高压氧对阿尔茨海默病模型小鼠认知功能的影响
2016-12-17吕裕霞闫赋琴
吕裕霞,李 卉,闫赋琴,冉 敏,李 严
高压氧对阿尔茨海默病模型小鼠认知功能的影响
吕裕霞1,李 卉2,闫赋琴1,冉 敏3,李 严4
目的 探讨应用高压氧对阿尔茨海默病模型小鼠认知功能的影响及相关机制,为治疗阿尔茨海默病提供参考。方法 将36只KM雄性小鼠随机分成正常对照组、阿尔茨海默病模型组和造模后高压氧处理组。用D-半乳糖(120 mg/kg)和亚硝酸钠(90 mg/kg)制作阿尔茨海默病小鼠模型,利用Morris水迷宫试验进行认知功能检测,并检测小鼠海马中的SOD、GSH-Px活性及 MDA含量。结果 与正常对照组小鼠相比较,阿尔茨海默病模型组小鼠逃避潜伏期明显延长、跨越平台次数明显减少(P< 0.01);与高压氧处理前组相比,高压氧处理后组小鼠的逃避潜伏期缩短、跨越平台次数增多,均存在着统计学差异(P<0.01)。与正常对照组小鼠相比较,阿尔茨海默病模型组小鼠海马中SOD和GSH-Px活性显著降低,MDA含量显著升高(P<0.01);与高压氧处理前相比,高压氧处理后,阿尔茨海默病模型小鼠海马SOD和GSH-Px活性显著升高,MDA含量显著降低,差异均有统计学意义(P<0.01)。结论 高压氧治疗可以改善阿尔茨海默病小鼠认知功能,其机制可能与高压氧治疗可以显著提高机体抗自由基损伤能力有关。
高压氧; 阿尔茨海默病; 认知功能; 氧化应激
阿尔茨海默病(Alzheimer disease, AD)是一种进展性的神经系统退行性疾病[1],主要表现为失语、失用、失认,以及人格和行为改变等[2]。该病起病缓慢或隐匿,多见于65岁以上老人[3]。据统计,2011年我国AD患者数为800万,已成为继心脏病、肿瘤、脑卒中后第四位引起成人死亡的原因[4]。随着社会老龄化的发展,老年人口占比越来越大,预计2040年我国阿尔茨海默病患者将达到2200万,到时阿尔茨海默病必将成为一个不容忽视的公共卫生和社会问题[5]。现代医学认为,淀粉样肽假说是AD发病机制的最主要的学说[6]。此外,越来越多的证据表明,氧化应激和自由基损害与AD发病极其密切[7]。因此,本研究拟通过在建立AD小鼠模型基础上,应用高压氧干预,探讨高压氧对AD小鼠的疗效,并深入讨论缺氧在AD发病机制中的作用,为AD的治疗提供临床参考。
1 材料与方法
1.1 试剂和仪器 D-半乳糖(由国药集团化学试剂有限公司提供,批号:F20090420);超氧化物歧化酶(Superoxide Dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase , GSH-Px)、丙二醛(Malondialdehyde, MDA)试剂盒(由南京建成生物工程有限公司提供)。实验动物高压氧舱(烟台宏远G2-Y900-002型),Morris水迷宫系统、U-2800紫外分光光度计、酶标仪、9Thermo离心机、电子天平、恒温水浴箱、低温冰箱。
1.2 实验动物和分组 日龄60~90 d雄性KM鼠36只,由本单位实验动物中心提供,体质量30~36 g。适应性饲养1周后,按随机数字表法随机分为:正常对照组、阿尔茨海默病模型组和造模后高压氧处理组,每组12只。
1.3 建立动物模型 36只小鼠自由饮水,控制喂食量[4~5 g/(d·只)],随机分为3组,即正常对照组不给以任何药物,正常饲养。阿尔茨海默病模型组和造模后高压氧处理组共24只,参照罗焕敏方法[8],按120 mg/kg D-半乳糖和90 mg/kg亚硝酸腹腔注射建立痴呆模型组,1次/d,持续注射60 d。造模40 d后,所有小鼠进行水迷宫及跳台实验,造模小鼠成绩与正常对照组相比若有明显差异,则判定为造模成功,最终24只小鼠全部造模成功。
1.4 高压氧治疗 把AD模型小鼠每日早上9:00放入动物高压氧实验舱,先用纯氧逐渐加压到0.18 MPa(1.8 ATA),再慢慢减压,用纯氧洗舱3次后,再加压到0.25 MPa(2.5 ATA),吸氧60 min,经20 min匀速减压出舱;1次/d,10次为一个疗程,中间间隔5 d,再进行第2个疗程[9]。
1.5 指标的检测
1.5.1 认知功能测试 采用Morris水迷宫进行定位航行实验和空间探索实验,检测3组小鼠的认知能力,记录逃避潜伏期和120 s内小鼠通过虚拟平台的次数[10]。
1.5.2 检测SOD、GSH-Px活性及MDA含量 所有行为学测试完成后,处死小鼠,取出小鼠脑组织,分离海马组织,按照试剂盒说明书测定SOD、GSH-Px活性及MDA含量。
1.6 统计学处理 所有数据均采用SPSS 17.0软件进行处理,各组之间的差异选用单因素方差分析法,P<0.05为差异有统计学意义。
2 结 果
2.1 Morris水迷宫测试结果 与正常对照组小鼠相比较,阿尔茨海默病模型组小鼠逃避潜伏期显著延长、跨越平台次数显著减少(P<0.01);与高压氧处理前相比,高压氧处理后,小鼠的逃避潜伏期缩短、跨越平台次数增多,均存在着统计学差异(P<0.01,表1)。

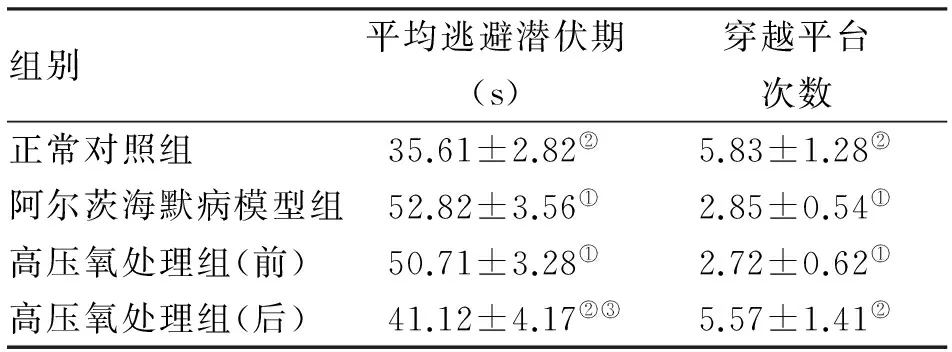
组别平均逃避潜伏期(s)穿越平台次数正常对照组35.61±2.82②5.83±1.28②阿尔茨海默病模型组52.82±3.56①2.85±0.54①高压氧处理组(前)50.71±3.28①2.72±0.62①高压氧处理组(后)41.12±4.17②③5.57±1.41②
注: 与正常对照组比较,①P<0.01; 与高压氧处理前比较,②P<0.01;与阿尔茨海默病模型组比较,③P<0.01
2.2 SOD、GSH-Px活性以及MDA含量的检测 如表2 所示,与正常对照组小鼠相比较,阿尔茨海默病模型组小鼠海马中SOD、GSH-Px活性明显降低,MDA含量明显升高(P<0.01);与处理前相比,高压氧处理后,阿尔茨海默病模型组小鼠海马SOD、GSH-Px活性明显升高,MDA含量明显下降,差异均有统计学意义(P<0.01,表2)。
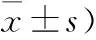
表2 各组小鼠SOD、GSH-Px活性和MDA含量变化比较 (n=12;
注:与正常对照组比较,①P<0.01; 与高压氧处理前比较,②P<0.01;与阿尔茨海默病模型组比较, ③P<0.01
3 讨 论
老年人由于机体组织再生性细胞减少和体内自由基增加等原因造成机体各组织、器官发生退行性病变,医学上把这一过程称为衰老。AD是老年人群中的一种常见病和多发病。有资料表明,5%~15%的老年人有不同程度的阿尔茨海默病症状[11]。到目前为止,AD的发病机制尚不完全清楚,但氧化应激作为研究AD发病机制的一个靶点已成为研究的热点[7]。由于AD发病因素涉及很多方面,单纯的药物治疗很难取得很好的效果。由于AD患者脑血流量及耗氧量明显低于正常同龄人,国外有研究证实,试用高压氧吸入疗法,取得了较好效果[12]。
本研究利用D-半乳糖(120 mg/kg)和亚硝酸钠(90 mg/k)联合制作AD小鼠模型。D-半乳糖可造成亚急性衰老模型,并会引起神经元发生一系列退行性改变,包括神经元数目减少,脑组织中SOD和GSH-Px活性下降,MDA水平升高,学习记忆能力下降等。随后,笔者给阿尔茨海默病模型小鼠吸入0.25 MPa(2.5 ATA)高压氧,1/d,每次60 min,10次为一个疗程,中间间隔5 d,再进行第2个疗程,治疗前后进行认知能力测验[9]。结果显示,与正常对照组小鼠相比较,阿尔茨海默病模型组小鼠逃避潜伏期明显延长、跨越平台次数明显减少(P<0.01);与高压氧处理前相比,高压氧处理后组小鼠的逃避潜伏期缩短、跨越平台次数增多,均存在着统计学差异(P<0.01)。有文献[13]报道,高压氧可以提高脑组织内含氧量,抑制由于乳酸堆积引起的细胞毒性及细胞部位的炎症反应,同时促进脑组织内自由基的清除,从而起到抑制脑细胞凋亡的作用。因此,用高压氧治疗,可使AD模型小鼠在适度的扩血管同时,高倍地提高血氧浓度,增加血液与组织间氧分压差,使外周血液中能量物质充分氧化,提供足够能量,脑组织含氧量大大提高,明显改善脑细胞功能状态,改善AD患者认知能力[14]。
本研究显示,对AD型小鼠采用高压氧治疗一段时间后,小鼠学习认知能力能得到改善的同时,AD小鼠模型内SOD和GSH-Px活性增高,以及MDA含量下降。AD的发生与脑组织中SOD和GSH-Px活性下降,MDA水平升高以及脑组织的持续缺氧相关,AD模型小鼠体内产生的过量自由基加剧了脑组织脂质过氧化,产生过量的MDA,使脑中MDA水平增加,细胞的合成能力降低,使SOD和GSH-Px活性显著下降。这一结果提示高压氧可以改善AD小鼠认知功能,其作用机制很可能是影响脑组织中的SOD和GSH-Px活性及MDA的含量,从而起到抑制氧自由基的生成、保护脑细胞的作用。早期研究证实,SOD、GSH-Px和MDA是衡量机体抗氧化能力三种主要指标[15]。SOD是参与自由基清除的重要酶,主要作用是参与催化产生超氧自由基,清除并阻断自由基的产生[16]。GSH-Px清除氧自由基则是通过歧化作用,从而保护细胞免受氧化损伤[17]。MDA是氧自由基破坏细胞后的产物,它的存在可以使生物膜坏死,同时抑制SOD的活性,造成自由基的大量产生,从而加重了氧化应激[18]。目前为止,脑组织SOD和GSH-Px活性和MDA含量影响AD模型小鼠认知功能及相关发病机制还未完全阐明,很多研究认为与脑内乙酰胆碱脂酶活性降低有关,此外某些炎性反应、缺血、缺氧等因素加速了AD模型小鼠的神经元变性与死亡,使脑细胞及血管内有异常淀粉样蛋白沉淀,最终导致脑功能发生障碍。
综上所述,本研究结果证实,经过高压氧处理的AD模型小鼠认知功能得到明显改善,提高了AD模型小鼠海马中SOD和GSH-Px活性,降低了海马MDA水平,表明高压氧可能通过清除AD模型鼠体内自由基发挥改善认知功能作用。但由于AD的发病机制复杂,AD动物模型建立不一定能完全模拟AD患者发病的病理生理过程和临床表现;此外,如何把握高压氧的最佳治疗时机、高压氧剂量的选择,以及需要配合的辅助治疗等因素都值得考虑。因此,如何利用高压氧治疗临床AD患者以及治疗后的疗效评价仍需进一步研究。
[1] Katzman R. Alzheimer’s disease[J]. NEJM, 1986, 314(15):522-525.
[2] 朱宝霞. 老年痴呆患者发生院内感染的因素及相应对策[J]. 中国实用神经疾病杂志, 2014,14(17):89-90.
[3] 贾伟华,马 颖, 陈若陵,等. 中国部分城乡社区老年痴呆症患病率及其影响因素研究[J]. 安徽医科大学学报, 2012, 47(8):944-947.
[4] 田金洲,时 晶.阿尔茨海默病:一个全新的临床病理单元[J].中国老年学杂志, 2008, 10(28):1974-1976.
[5] Ferri C P, Prince M, Brayne C,etal. Global prevalence of dementia: a Delphi consensus study[J]. Lancet, 2005, 366(9):2112-2117.[6] Monteiro M J. Neuronal Signal Transduction and Alzheimer’s Disease, C. O’Neill and B. Anderton, eds[J]. J Alzheimers Dis Jad, 2001, 3(6):603-605.
[7] 苗建亭,李柱一,林 宏,等. β-淀粉样肽对AD大鼠脑NO、NOS和氧自由基的影响研究[J]. 第四军医大学学报, 2002, 9(1):9-12.
[8] 罗焕敏, 陈子晟.一种新的老年痴呆动物模型[J]. 中国老年学杂志, 2003, 23(3):179-182.
[9] 周宏图. 高压氧对老年痴呆模型小鼠抗衰老作用的基础研究[D]. 南京:江苏大学, 2012.
[10] 王俊亚. Morris水迷宫实验的测试方法介绍及注意事项[J]. 现代医药卫生, 2012,21(28):3289-3290.
[11] 张越颖. 六味地黄丸对阿尔茨海默病细胞凋亡的影响[J]. 中国实用医药, 2015, 10(1):236-237.
[12] Soares J C, Gershon S. Advances in the pharmacotherapy of Alzheimer’s disease[J]. Eur Arch Psy Clin N,1994,244(5):261-271.
[13] Rockswold S B, Rockswold G L, Defillo A. Hyperbaric oxygen in traumatic brain injury[J]. Neurol Res,2007,29(2):162-172.
[14] Vantelon C, Gastou B, Rolland Y. Current status of Ginkgo biloba in Alzheimer’s disease: From treatment to prevention[J]. Res-Ract Alzhei Dis,2006,11:402-407.
[15] Jiang L F, Liao H L, Huang H M,etal. Potential Prevention and Treatment of Maifanite for Alzheimer’s Disease Based on Behavior Test, Oxidative Stress Assay, and Trace Element Analysis in Hippocampus of Aβ (25-35) -Induced AD Rats[J]. Biol Trace Elem Res,2013,152(1):50-56.
[16] Beckman J S, Carson M, Smith C D,etal. ALS, SOD and peroxynitrite[J].Nature,1993,364(364):584-584.
[17] Lei X G, Cheng W H, Mcclung J P. Metabolic regulation and function of glutathione peroxidase-1[J]. Annu Rev Nutri, 2007, 27(1):41-61.
[18] Marnett L J. Lipid peroxidation-DNA damage by malondialdehyde[J]. Mutat Res-Fund Mol M,1999,424(1-2):83-95.
(2016-07-15收稿 2016-10-20修回)
(责任编辑 梁秋野)
Effects of hyperbaric oxygen on cognitive function in mice with Alzheimer’s
LV Yuxia1,LI Hui2,YAN Fuqin1,RAN Min3,and LI Yan4.1.Procurement Center Office,2.Department of Nutriology,3.Department of Neurology,4.Department of Hyperbaric Oxygenation,General Hospital of Chinese People’s Armed Police Force,Beijing 100039,China
Objective To investigate the effect of hyperbaric oxygen on cognitive functions of mice with Alzheimer’s and related mechanisms in order to contribute to the treatment of Alzheimer’s disease.Methods 36 KM mice were randomly divided into three groups: normal control group, dementia model group, and hyperbaric oxygen treatment group. D-galactose(120 mg/kg)and sodium nitrite (90 mg/kg)were used to establish a mouse model of Alzheimer’s. The cognitive functions of mice were determined by Morris water maze, the mice’s hippocampus SOD and GSH-Px activity. The MDA level was also determined.Results Compared with the normal control group, the escape latency of the dementia model mice were prolonged, but the times of spanning the platform were significantly reduced (P<0.01). After hyperbaric oxygen treatment, escape latency was shortened while the times of spanning the platform increased. The difference was of statistical significance (P<0.01). Compared with the control group, the hippocampus SOD and GSH-Px activity in dementia model group were significantly reduced, but the MDA level was significantly increased (P<0.01). Afterhyperbaric oxygen treatment, the hippocampus SOD and GSH-Px activity of dementia model mice were significantly increased while the MDA level was significantly reduced. There were significant differences (P<0.01).Conclusions Hyperbaric oxygen therapy can improve cognitive functions in mice with Alzheimer’s, which is possibly because hyperbaric oxygen can significantly improve the body’s ability to combat free radical damage.
hyperbaric oxygen; Alzheimer disease; cognitive function; oxidative stress
吕裕霞,硕士,主治医师。
100039 北京,武警总医院:1.采购中心,2.营养科,3.脊髓空洞科护士站,4.高压氧治疗科
李 严,E-mail:lvyuxia7118@163.com
R459.6
