鲍曼不动杆菌的分布及对抗菌药物的耐药性
2016-12-17王凤林吕娟丽
刘 洋,刘 华,王凤林,吕娟丽
鲍曼不动杆菌的分布及对抗菌药物的耐药性
刘 洋,刘 华,王凤林,吕娟丽
目的 研究鲍曼不动杆菌的分布及对抗生素的耐药性,为临床合理选择抗菌药物提供依据。方法 回顾性分析2014-03至2014-12我院临床送检各类标本中分离的鲍曼不动杆菌的分布及对抗菌药物的耐药性,用全自动微生物分析仪和其配套的药敏卡对菌株进行鉴定,采用K-B法进行药敏试验。 结果 从6462份临床送检标本中共培养分离出120株鲍曼不动杆菌,分离率为1.86%,其中从呼吸道标本分离出68株,构成比为56.67%,来自泌尿道、血液,以及伤口分泌物中的构成比分别为20.00%、15.00%和8.33%。鲍曼不动杆菌对临床常用的抗菌药物的耐药率均大于70%,对头孢唑啉和氨苄西林的耐药率为100%,而对替加环素的耐药率最低为5.0%。与其他抗菌药物相比,鲍曼不动杆菌对替加环素的敏感性最高,差异有统计学意义(P<0.05)。 结论 鲍曼不动杆菌对多数抗菌药物产生较高的耐药性,应加强其耐药性监测,规范抗菌药物的合理使用,防止耐药菌的爆发与流行。
鲍曼不动杆菌;抗菌药物;替加环素;耐药性
鲍曼不动杆菌(A.baumannii,AB)属于非发酵菌,是自然界广泛存在的一种革兰阴性杆菌[1]。该菌是医院感染的重要的条件致病菌,特别是重症患者,临床常见的院内发生的呼吸道感染,泌尿系感染、继发性脑膜炎、手术部位感染、呼吸机相关性肺炎及菌血症等,常为鲍曼不动杆菌或与其他阴性菌的混合感染引起。近年来,随着临床广谱抗生素和免疫抑制药的使用越来越多,各种侵入性操作的不断使用,相关研究报道显示,鲍曼不动杆菌对抗菌药物的耐药性明显升高,给临床治疗带来严峻考验,引起了临床和微生物专家的高度关注[2,3]。为了解临床分离的鲍曼不动杆菌的分布及对临床常用抗菌药物的耐药性,为临床抗感染的治疗及合理使用抗菌药物提供数据支持。本研究选取8种抗菌药物,探究鲍曼不动杆菌常用抗菌药物和对替加环素的敏感性。
1 资料与方法
1.1 资料 我院2014-03至2014-12的共计21 423例住院患者,各类送检标本共计6462份,培养分离出120株鲍曼不动杆菌,分离率1.86%。其主要来源包括呼吸道、泌尿道、血液,以及伤口分泌物等。
1.2 菌株的分离和药敏试验 将采集的标本常规进行分离培养,然后行纯培养,对分离的菌株进行革兰染色及氧化酶试验初次筛选,然后采用全自动微生物分析仪及配套药敏卡对菌株进行鉴定和药敏分析。具体步骤如下:取约0.5麦氏单位的菌液,以K-B法的标准将菌液涂在平板上,放置在室温下10~15 min,表面风干后,将纸片贴在琼脂培养液上,在37 ℃下孵育18~20 h,最后用游标卡尺(精密度为1 mm)对抑菌圈的直径进行测量[3]。其中,采取K-B法对替加环素、头孢哌酮/舒巴坦行药敏试验,所有的操作均严格按照操作说明书进行。
1.3 观察指标 观察鲍曼不动杆菌的分布情况及鲍曼不动杆菌对抗菌药物的敏感情况,分析研究鲍曼不动杆菌对替加环素的敏感性。
1.4 评价标准 以美国FDA对替加环素药敏判断结果为诊断依据:(1)敏感,抑菌圈的直径不小于16 mm;(2)中介,抑菌圈的直径为13~15 mm;(3)耐药,抑菌圈的直径不超过12 mm[3]。
1.5 统计学处理 采用SPSS17.0软件统计分析本次试验数据,计数资料以百分率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 鲍曼不动杆菌分布 120株鲍曼不动杆菌主要来自我院ICU病区、呼吸内科、神经内科、肿瘤科等科室的住院患者,标本来源主要包括呼吸道、泌尿道、血液及伤口等,鲍曼不动杆菌的标本分离率以伤口分泌物为最高(3.48%),其次为呼吸道、泌尿道,血液分离率最低。来自呼吸道的分离菌株构成比最高为56.67%,其次为伤口分泌物、泌尿道和血液(表1)。
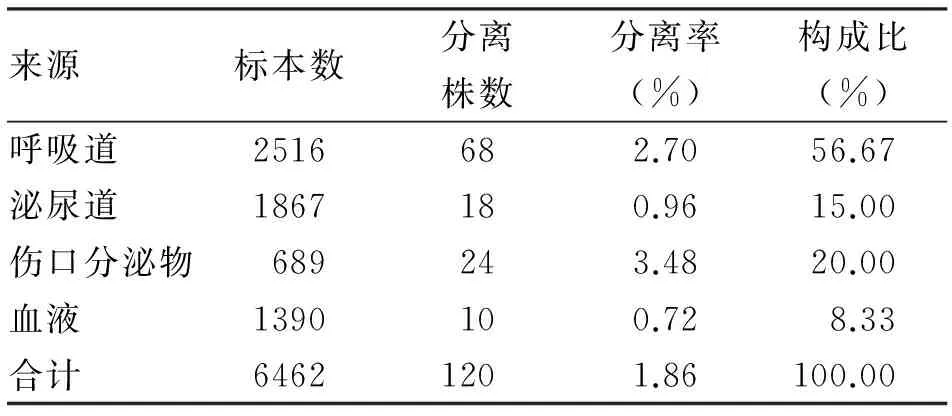
表1 鲍曼不动杆菌来源分布情况
2.2 对抗菌药物的耐药性 除替加环素和头孢哌酮/舒巴坦外,AB菌对几种抗菌药物的耐药率均高于70%,对氨苄西林、头孢唑啉的耐药率100%,对阿米卡星、庆大霉素的耐药率分别为83.3%和90.8%。对左氧氟沙星的耐药率也达到了76.0%,头孢哌酮/舒巴坦的耐药率也达到了21.7%。与其他抗菌药物比较,AB菌对替加环素的敏感性最高,对头孢曲松、头孢唑啉、氨苄西林的敏感性最低,差异有统计学意义(P<0.05,表2)。
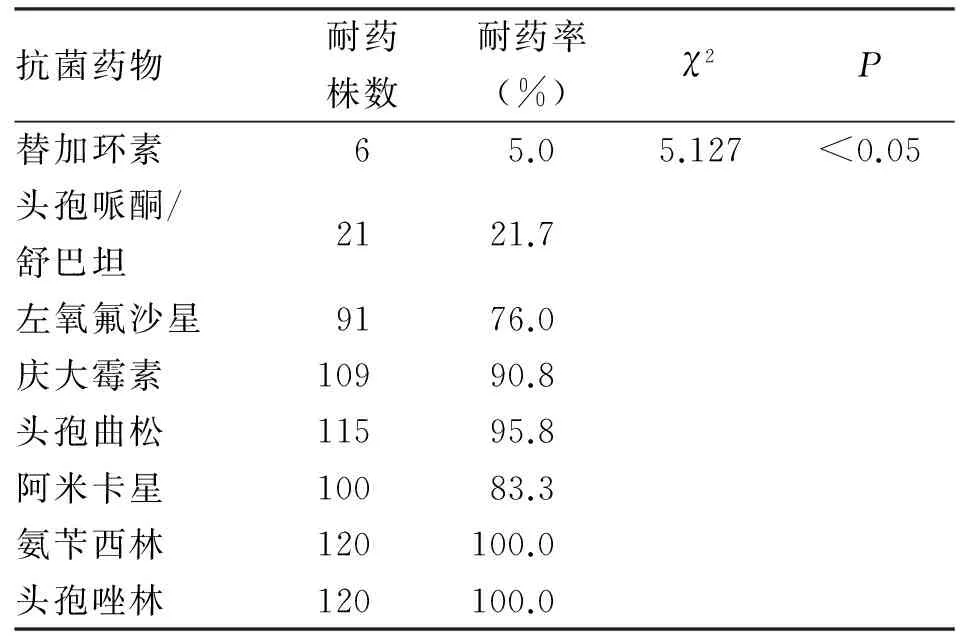
表2 120株鲍曼不动杆菌对抗菌药物的耐药性比较
3 讨 论
本研究120株AB菌主要来自我院ICU病区、呼吸内科、神经内科、肿瘤科等科室的住院患者,由于这些科室里重症患者较多,基础免疫功能差,住院时间比较长,所以患者住院期间更易发生AB菌株的感染,标本来源主要包括呼吸道分泌物、泌尿道、血液以及患者的伤口分泌物等,AB菌的分离率以伤口分泌物最高为3.48%,其次为呼吸道分泌物为2.70%,因AB菌属于医院定植菌,在患者皮肤、伤口也有定植,所以伤口分泌物中的AB菌的高分离率可能与定植菌株有关。来自呼吸道的分离菌株构成比最高为56.67%,由于医院送检标本中呼吸道分泌物如痰液在医院送检标本中占比最多,因为临床科室更倾向于痰培养,这与其他学者的研究报道一致[4]。来自血液的分离率和构成比均为最低,这与血液样本送检量少有关,同时血液样本不易被污染,所以受定植菌干扰比较小。
AB菌对抗菌药物的耐药性分析结果显示:AB菌对氨苄西林、头孢唑啉100%耐药,对头孢曲松耐药率达95.8%,与这类药物能够诱导细菌产生β-内酰胺酶,使其水解灭活有关。而头孢哌酮/舒巴坦由于含有酶抑制药,阻断了抗菌药物被水解灭活,因此耐药率相对较低为21.7%,可以作为AB菌感染的临床备选药物。氨基糖苷类抗菌药物阿米卡星、庆大霉素由于对革兰阴性杆菌有较好的抗菌谱,临床应用广泛,本研究中对AB菌的耐药率分别高达83.3%和90.8%,这可能与临床的使用率高有关。左氧氟沙星为喹诺酮类的抗菌药物,由于其具有良好的体外抗菌活性,且组织渗透性好,临床常选为抗AB菌的有效药物,本实验中该药对AB菌的耐药率为76.0%,这与临床广泛使用喹诺酮类药物,造成了AB菌对喹诺酮类的获得性耐药增加有关,AB菌对喹诺酮类抗菌药物的耐药机制主要与编码拓扑异构酶的基因突变有关[5]。
国内数据表明,临床分离的不动杆菌中70%以上为AB菌。而且AB菌对目前临床上常用的抗菌药物的耐药率均高于60%,如对三、四代头孢菌素的耐药率已达63.0%~89.9%,对阿米卡星、庆大素、奈替米星、妥布霉素和环丙沙星的耐药率均高达96.3%[6]。这与本研究的结果相一致。替加环素与上述抗菌药物相比,对AB菌的耐药率最低,替加环素是一种静脉注射用的新型抗菌药物,它克服了对很多抗菌药物产生主要耐药的外排泵和核糖体保护机制,对多种耐药菌株有活性,是一种广谱抗菌药物。相关报道发现,替加环素是米诺环素的衍生物,在甘氨酰环素类抗生素中替加环素是第一个应用于临床试验的抗生素[7]。替加环素被批准的适应证有皮肤软组织感染、获得性细菌肺炎等。相关研究报道显示,在众多抗菌药物中,AB菌对替加环素的敏感性最强,约为90%[8,9],本次研究报道与该报道结果相近。医院感染不动杆菌菌株耐药性高,易于传播和扩散,长期应用抗生素使耐药菌株明显增加,给临床的治疗形成严重的影响。
[1] 徐娇君,吕火祥,胡庆丰,等.替加环素对鲍曼不动杆菌的体外抗菌活性[J].实验与检验医学,2010,10(4):355-356.
[2] 曲俊彦,吕晓菊.不动杆菌对替加环素及多黏菌素耐药机制研究进展[J].中国抗生素杂志,2013,20(7):492-497.
[3] 梁 慧,彭国钧,张 薇,等.米诺环素、替加环素对多重耐药菌的体外抗菌活性比较[J].中国感染与化疗杂志,2012,16(5):390-392.
[4] 童金英,耿文娟,王圆圆,等.2011-013年某院鲍曼不动杆菌临床分布与耐药性分析[J].中国感染控制杂志,2015,14(4):240-244.
[5] 王 敏,覃章顺,李先平,等. 鲍曼不动杆菌喹诺酮类耐药基因突变分析[J].中国病原生物学杂志,2010,5(2):86-90 .
[6] Wormald P J. The agger nasi cell: the key to understanding the anatomy of the frontal recess[J].Otolaryngol Head Neck Surg,2011,129:497-507.
[7] Choi B I, Lee H J, Han J K,etal. Detection of hypervascular nodular hepatocellur carcinomas: value of triphasic helical CT compared with iodized oil CT[J]. AJR, 2010,157(2):219-224.
[8] Khan M A, Com B S, Brunt E M,etal. Positron emission tomography scanning in the evaluation of hepatocellular carcinoma[J]. Ann Nucl Med,2009,14(2):121-126.
[9] Tabit C E, Chung W B,Hamburg N M,etal. Endothelial dysfunction in diabetes mellitus:molecular mechanisms and clinical implications[J]. Rev Endocr Metab Disord, 2010,11(1):61-74.
(2016-02-20收稿 2016-06-15修回)
(责任编辑 岳建华)
Clinical distribution of acinetobacter baumannii and sensitivity to antimicrobial agents
LIU Yang,LIU Hua, WANG Fenglin, and LV Juanli.Pharmacy Department, General Hospital of Chinese People’s Armed Police Force, Beijing 100039, China
Objective To study the clinical distribution of acinetobacter baumannii and its sensitivity to antimicrobial agents so as to guide clinical treatment. Methods The distribution of acinetobacter baumannii isolated between March 2014 and December 2014 and its resistance to eight antimicrobial drugs were retrospectively analyzed. The strains were identified with an automatic microbial analyzer and the K-B method was used to test the sensitivity of drugs. Results 120 strains of acinetobacter baumannii were isolated from 6462 clinical samples, and the isolation rate was 1.86%. 68 of these strains were isolated from respiratory specimens, accounting for 56.67% of the total. The percentage of strains isolated from the urinary tract, blood, and wounds was 20.00%, 15.00% and 8.33%, respectively. The resistance rate of acinetobacter baumannii to most of the commonly-used antimicrobials was above 70%, and the resistance rate to cefazolin and ampicillin was 100%, while tigecycline had the lowest resistant rate of 5.0%. Acinetobacter baumannii was more sensitive to tigecycline than other antibacterial drugs.The difference was statistically significant(P<0.05).Conclusions Acinetobacter baumannii was highly resistant to many antimicrobial drugs so that surveillance of drug resistance should be strengthened while the rational use of antimicrobial agents should be regulated in order to prevent the outbreak and prevalence of resistant bacteria.
acinetobacter baumannii ;antimicrobial agents; tigecycline; sensitivity
刘 洋,本科学历,副主任药师。
100039 北京, 武警总医院药剂科
吕娟丽,E-mail:lv-juanli@163.com
R978.1
