SA、MeJA和ACC处理对甘蓝型油菜叶角质层蜡质组分、结构及渗透性的影响
2016-12-16赵秋棱李加纳
李 帅 赵秋棱 彭 阳 徐 熠 李加纳 倪 郁
西南大学农学与生物科技学院, 重庆 400715
SA、MeJA和ACC处理对甘蓝型油菜叶角质层蜡质组分、结构及渗透性的影响
李 帅 赵秋棱 彭 阳 徐 熠 李加纳 倪 郁*
西南大学农学与生物科技学院, 重庆 400715
角质层蜡质与植物适应逆境胁迫有关。本研究以甘蓝型油菜中双11为试材, 在五叶期分别对其进行200 μmol L-1水杨酸(SA)溶液、1-氨基环丙烷-1-羧酸(ACC)溶液以及100 μmol L-1茉莉酸甲酯(MeJA)溶液浇灌处理, 分析油菜叶角质层蜡质组分含量、结构以及角质层渗透性的变化。结果表明, MeJA处理7 d后, 烷类、二级醇类、酮类、醛类含量以及蜡质总量与对照相比均显著增加, 而处理14 d后, 所有蜡质组分含量及蜡质总量与对照相比均显著减少; SA与ACC处理早期对叶片蜡质沉积无显著影响(SA处理14 d后, 一级醇类、醛类及未知组分含量显著减少)。SA、MeJA和ACC处理21 d后均显著诱导油菜叶片角质层蜡质的沉积, 蜡质组分中烷类、酮类、醛类显著增加, 其中C29烷、C29酮、C30醛是被SA、MeJA和ACC诱导的主要蜡质组分, 暗示烷类、酮类、醛类可能与这些信号分子介导的抗(耐)性反应密切相关。扫描电镜结果显示, SA处理减少叶表皮蜡质杆状结构, 且部分区域熔融; MeJA与ACC处理增加油菜叶表皮蜡质的晶体结构密度。角质层蜡质的沉积与结构变化降低角质层渗透性, 减缓叶片的水分散失, 其中 C29烷的特异性增加可能是造成叶片失水率降低的主要原因。
甘蓝型油菜; 角质层蜡质; 水杨酸(SA); 茉莉酸甲酯(MeJA); 乙烯(ETH)
植物在发育过程中经常会遭受各种生物和非生物胁迫, 对于抵抗和适应这些逆境胁迫, 植物进化中形成了一套复杂的防御网络。植物激素在这个防御网络中起到了十分重要的作用, 当遇到逆境胁迫时, 植物体内的激素水平会发生变化以启动和调节某些与逆境适应相关的生理生化过程来诱导抗(耐)逆性的形成。植物角质层是植物与外界环境的第一接触面, 是植物应对生物和非生物逆境的重要屏障,其中的角质层蜡质是由堆积在角质层最外面有独特三维结构的表皮蜡质和填充于角质中的内部蜡质组成, 具有多种生理和生态学功能。环境因素如水分胁迫、NaCl、紫外线辐射、低温、病害胁迫等会导致植物蜡质含量和结构的改变[1-4]。角质层蜡质的沉积也受植物激素的调控。例如, 乙烯(ETH)能够诱导柑桔表皮蜡质含量的增加及结构变化, 阻止Penicillium digitatum入侵[5]。ETH合成受抑制时, 延迟了苹果表皮中特定蜡质组分的合成[6]。脱落酸(ABA)诱导了独行菜叶片中大于 C26的脂肪族物质含量的增加, 其耐旱性随之增强[7]。水分胁迫下, ABA通过上调转录因子MYB96的表达而促进拟南芥几个蜡质合成基因的表达, 最终促进了蜡质的积累[8]。这些结果表明, 植物激素作为信号分子可能通过介导角质层蜡质的沉积而影响植物对逆境胁迫的响应。
ETH是一种重要的植物激素, 在植物对生物胁迫和非生物胁迫的耐受性和抗性中发挥重要作用。水杨酸(SA)与茉莉酸类物质(JAs)是广泛存在于高等植物体内的一种新型植物生长调节物质, 在调节植物生长发育、光合特性、抗逆反应中起着重要的作用。本研究分析了SA、茉莉酸甲酯(MeJA)和乙烯合成促进剂 1-氨基环丙烷-1-羧酸(ACC)处理对油菜叶角质层蜡质组分含量、结构以及角质层渗透性的影响, 初步揭示了这些信号分子与植物角质层蜡质沉积的关系。
1 材料与方法
1.1 试验材料
甘蓝型油菜中双11, 由西南大学油菜工程中心提供。采用盆栽, 每盆(7 cm × 8 cm)装土0.2 kg [草炭土与弱酸性黄壤1∶1 (w/w)], 移栽1株幼苗, 于网室种植, 常规管理, 保证土壤相对含水量不低于60%。待幼苗长出5片真叶时进行激素处理。
1.2 激素处理
用1%的MS溶液分别配制浓度为200 μmol L-1的SA溶液、ACC溶液以及100 μmol L-1的MeJA溶液。当幼苗长至 5片真叶时, 分别取上述溶液浇灌于土壤中, 每2 d一次, 每次浇灌20 mL。对照用1%的MS溶液浇灌。在激素处理的7、14和21 d后分别取其叶片分析蜡质组分含量; 在处理21 d后取叶片以扫描电镜观察蜡质结构及检测角质层渗透性。
1.3 叶角质层蜡质的提取与组分分析
采集植株自上而下第 2片展开叶片, 置含 30 mL氯仿的培养皿浸提30 s, 氯仿中预先加入已知浓度的 C16烷作为内标。用氮吹仪蒸干浸提液, 再于80℃下用100 μL的BSTFA衍生1 h, 将BSTFA在氮吹仪中蒸干后, 将产物溶于100 μL正己烷中。用气相色谱仪(福立 9790II, 浙江)分析测定蜡质组分及含量。具体程序及参数设置参考倪郁等[2]方法。根据FID的峰面积对蜡质定量, 同时利用GC-MS (岛津 GC2010MS, 日本)鉴定蜡质组分, 参考内标正十六烷计算各蜡质组分的实际含量。用单位叶面积的微克数(μg cm-2)表示蜡质含量。利用数字化扫描仪(EPSON V750)和WinFOLIA叶片专业图像分析软件(Regent Instrument Inc., Canada)测定并记录叶面积。每处理4个重复。
1.4 叶角质层蜡质结构的扫描电镜观察
采集植株自上而下第 3片展开叶片, 干燥后从距中间叶脉0.1 cm处剪取样品, 用碳导电胶布固定在载物台上, 再将样品放入金属离子溅射仪(E1010, Hitachi)内喷镀导电膜, 材料镀金后于扫描电子显微镜(S3000-N, Hitachi)下观察形态。每处理4个重复。
1.5 角质层水分损失的测定
参考 Kosma等[1]方法, 将各处理材料于黑暗环境中培养6 h, 以使气孔关闭, 采集植株叶片于蒸馏水中黑暗处理1 h, 称其重量, 作为叶片饱和重量。然后将叶片放入20℃的培养箱(黑暗), 每15 min取出叶片称重一次。150 min后将叶片取出放在70℃的烘箱中干燥24 h, 称其干重。水分损失率 = (饱和重量 - 每个时间点的重量)/叶片含水量, 叶片含水量 = 饱和重量 - 干重。每处理8个重复。
2 结果与分析
2.1 甘蓝型油菜叶角质层蜡质含量
表1表明, SA处理7 d后, 角质层各蜡质组分含量与蜡质总量均与对照无显著差异; 处理 14 d后,一级醇类、醛类及未知组分含量显著减少, 其中蜡质优势组分C24酸、C28醛、C30醛含量显著降低,但蜡质总量无显著变化; 处理21 d后, 烷类、酮类、醛类含量以及蜡质总量均比对照显著增加, 其中蜡质优势组分C29烷、C29酮、C24酸、C28醛、C30醛含量增加显著(图1)。
MeJA处理7 d后, 烷类、二级醇类、酮类、醛类含量以及蜡质总量均比对照显著增加, 其中蜡质优势组分C29烷、C31烷、C29二级醇、C29酮、C28醛、C30醛含量增加显著(表 1和图 1); MeJA处理14 d后, 所有蜡质组分含量及蜡质总量均比对照显著减少; 而在处理 21 d后, 烷类、酮类、酸类、醛类含量以及蜡质总量显著增加, 其中蜡质优势组分C29烷、C29酮、C20酸、C30醛含量增加显著。
ACC处理7 d、14 d后, 角质层各蜡质组分与蜡质总量与对照相比均无显著变化(表1和图1); 处理21 d后, 烷类、酮类、醛类以及蜡质总量均比对照显著增加, 其中蜡质优势组分C29烷、C29酮、C24酸、C28醛、C30醛增加显著。
2.2 油菜叶表皮蜡质结构
甘蓝型油菜中双11叶表皮蜡质结构类型以杆状、颗粒状(小型片状)为主(图2)。SA处理(21 d)后,叶片表皮蜡质杆状结构减少, 部分区域熔融, 晶体结构边界不清晰。MeJA与ACC处理(21 d)后, 叶表皮蜡质的晶体结构密度增加, ACC处理后杆状结构长度增加(图2)。
2.3 油菜叶角质层渗透性
SA、MeJA和ACC处理21 d后, 取油菜叶片测定其角质层水分损失率。如图3所示, 与对照相比, 3种处理均使叶片水分损失速率降低, 在150 min时, SA、MeJA和ACC处理失水率与对照相比分别减少了33%、30%和35%, 表明3种处理均减缓了甘蓝型油菜叶片的水分散失, 角质层渗透性降低。
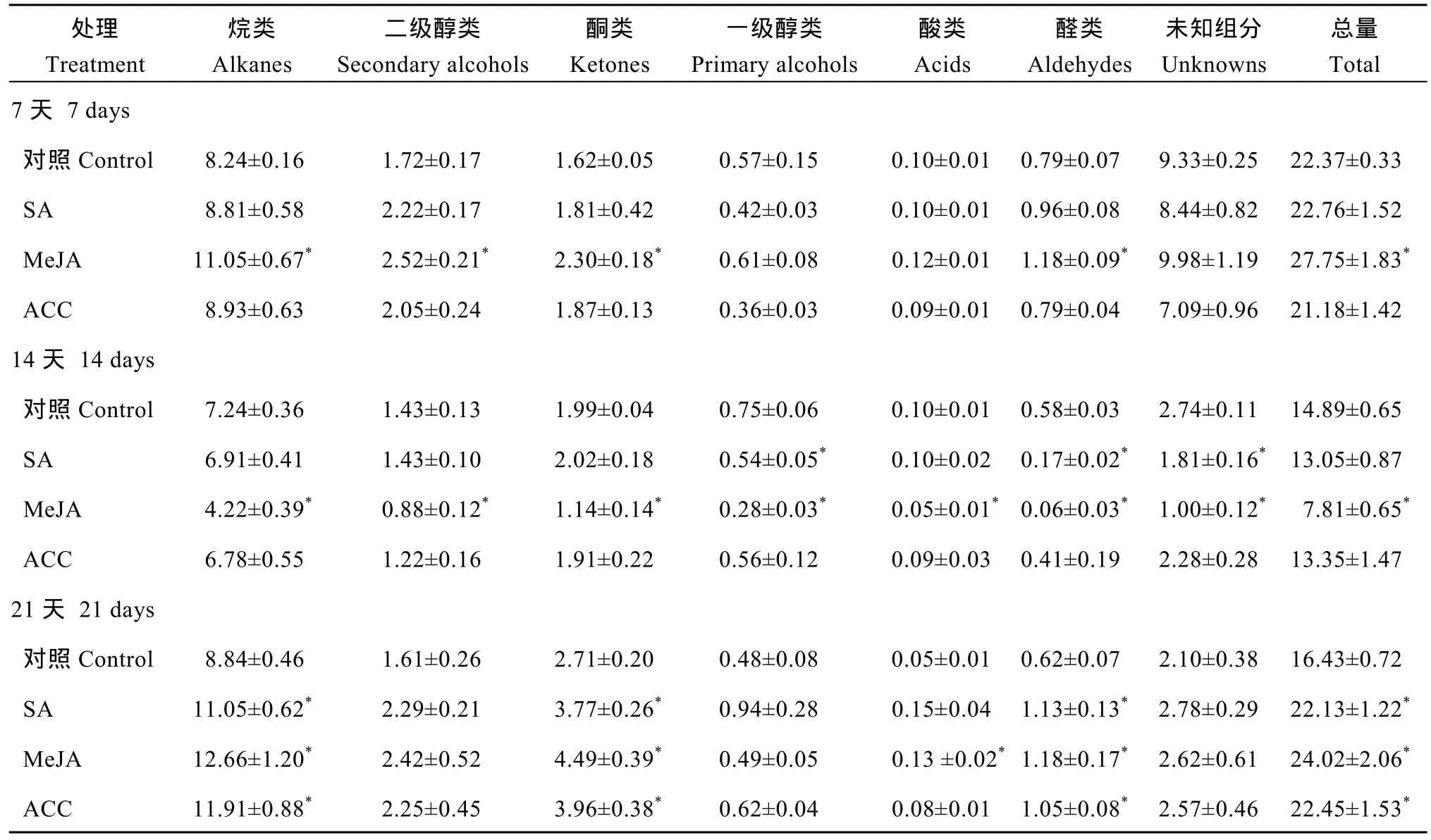
表1 SA、MeJA和ACC对油菜叶角质层蜡质含量的影响Table 1 Effects of SA, MeJA, and ACC treatment on amounts of leaf cuticular wax in Brassica napus (μg cm-2)
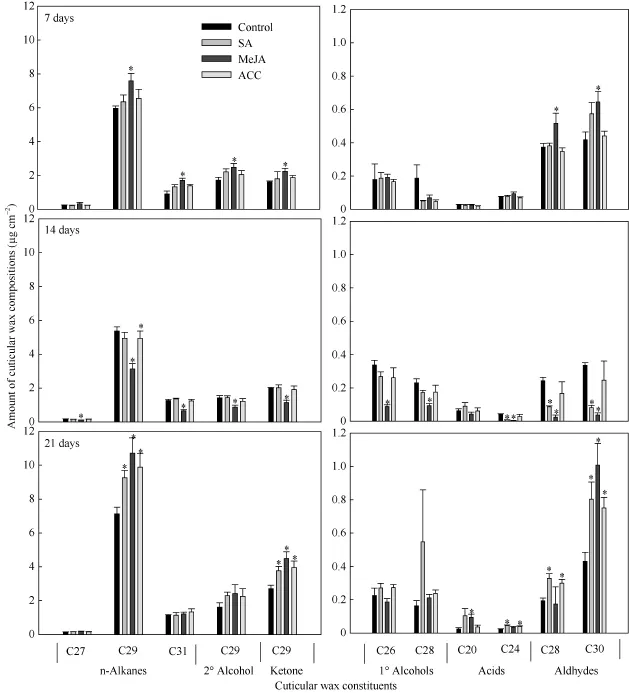
图1 SA、MeJA和ACC处理对油菜叶角质层蜡质主要组分含量的影响Fig. 1 Effects of SA, MeJA, and ACC treatments on contents of major individual leaf cuticular wax constituents in B. napus数据柱上*表示在P < 0.05水平上差异显著。Bars with asterisks are significantly different at P < 0.05 according to Student’s t-test.
3 讨论
3.1 甘蓝型油菜叶角质层蜡质的组成
甘蓝型油菜叶角质层蜡质主要由长链脂肪酸(C>18)和由长链脂肪酸衍生而来的醛、一级醇、二级醇、烷、酮、酯等组成, 其中由蜡质脱羰途径生成的C29烷、C29酮与C29二级醇是主要的蜡质组分。这与十字花科拟南芥(A. thaliana)、甘蓝(B. oleracea)等角质层蜡质组成相似[9]。植物角质层蜡质的组分、含量等会随着植物组织器官及发育时期的变化而改变。例如, 瑞士石松(Pinus cembra)的蜡质沉积随着叶片的发育而减少[10]。本研究中, 虽然蜡质总量随着叶片发育而减少, 但烷类、二级醇类、酮类、醛类等在蜡质总量中所占的比重随叶片的发育而呈增加趋势。
3.2 外源SA、MeJA和ACC诱导的蜡质组分变化提高了植株的抗(耐)逆性
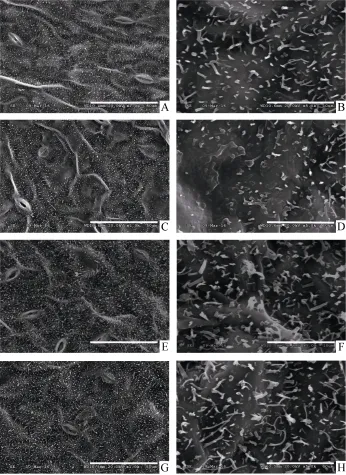
图2 SA、MeJA和ACC处理对油菜叶表皮蜡质晶体结构的影响Fig. 2 Effects of SA, MeJA, and ACC treatment on the crystalloid structures of leaf cuticular wax in B. napusA~B: 对照; C~D: SA处理; E~F: MeJA处理; G~H: ACC处理; A、C、E、G: 标尺=100 μm; B、D、F、H: 标尺=10 μm。A-B: control; C-D: SA; E-F: MeJA; G-H: ACC; A, C, E, and G:bar=100 μm; B, D, F, and H: bar=10 μm.
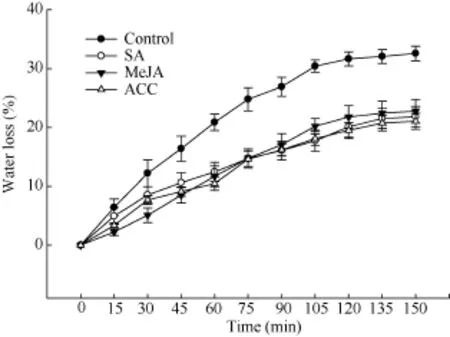
图3 SA、MeJA和ACC处理对油菜叶角质层水分损失的影响Fig. 3 Water loss rates of isolated leaves from B. napus treated by SA, MeJA, and ACC
植物激素作为植物体内的痕量信号分子, 调节着植物体对环境的应答。近年来发现SA、JAs和ETH广泛参与调控植物防御反应与植株形态发育相关的多种生物学过程, 从而影响着植物应对不良环境的能力[11-13]。本研究结果表明, 外源SA、MeJA和ACC处理能够诱导油菜叶片角质层蜡质的沉积, 降低角质层渗透性, 而蜡质组分的变化可能是造成其水分散失减缓的主要原因。SA、MeJA、ACC处理21 d时, 油菜叶角质层中烷类、酮类、醛类显著增加, 其中C29烷、C29酮、C30醛是被SA、MeJA、ACC诱导增加的主要蜡质组分, 暗示烷类、酮类、醛类可能与这些信号分子介导的抗(耐)性反应密切相关。Seo等[8]研究发现, 拟南芥角质层蜡质中烷类和醛类物质的增加提高了植株的抗旱能力。番茄ps突变体果实表皮蜡质中几乎不含烷类和醛类, 而果实表面失水率比野生型快5~8倍[14]。乙烯信号的转导最后以乙烯响应因子激活或抑制相关基因的表达, 参与防卫反应的诱导[15]。拟南芥乙烯响应类型的转录因子 WIN1/SHN1在转基因植株中超表达时诱导蜡质脱羰基途径产物(烷类、二级醇类、酮类)的特异性增加, 增强植株的耐旱性[16-17]。SA、MeJA和ACC诱导的油菜叶片角质层中烷类、醛类的增加也可能与生物胁迫抗性有关。菌核病菌侵染甘蓝型油菜时,油菜叶表皮蜡质中醛类含量显著增加[18]。Kosma等[19]研究认为 C21~C27烷类、醛类、C22和 C24脂肪酸及伯醇是小麦抗黑森瘿蚊侵扰的重要成分。拟南芥表皮蜡质缺失突变体cer6和cer2中, SA信号途径标志基因——病程相关蛋白 PR基因的表达显著降低[20], 暗示植物抗性基因的转录水平与蜡质组分密切相关。
本研究中, 油菜叶片蜡质含量在 MeJA处理 7 d、21 d时均显著增加, 而在处理中期(14 d)显著减少,这可能与 MeJA对植物生长发育的复杂调控有关。茉莉酸类能够调节植物生长发育的很多方面, 包括抑制幼苗叶片与主根的生长[21]、促进侧根和根毛的产生[22]、诱导表皮毛的形成等[23]。叶片蜡质的沉积变化应该是一个受茉莉酸类调控的综合效应, 可能与MeJA处理时间、浓度、植物发育阶段等有关。
3.3 C29烷积累对植株抗(耐)旱性的贡献
C29烷是甘蓝型油菜含量最高的蜡质组分[24]。本研究中, SA、MeJA和ACC处理21 d后, C29烷含量与对照相比分别增加30%、50%和39%, 而叶片失水率在150 min时与对照相比分别减少33%、30%和35%, 说明C29烷的积累在SA、MeJA和ETH介导的植株抗旱性中可能承担着重要作用。Weng等[25]发现, C29烷严重缺失的拟南芥lacs1、lacs2双缺失突变体与野生型相比, 角质层渗透性高, 失水率快,对干旱更为敏感。负责烷类物质合成的 CER1在拟南芥中超表达促进了 C29烷的积累, 角质层渗透性降低, 增强了植株对干旱的耐受力[26]。蒺藜苜蓿乙烯响应类型转录因子 WXP1在拟南芥中超表达时,促进C29、C31和C33烷类的合成, WXP转基因植株表现出耐旱性增强[27]。
3.4 角质层蜡质结构
Oliveira等[28]认为角质层结构和蜡质组成是决定植物抗逆性的关键因素。ETH诱导的柑桔表皮蜡质结构的变化, 阻止了Penicillium digitatum入侵[5]。本研究扫描电镜结果显示, 甘蓝型油菜中双11叶表皮蜡质结构类型以杆状、颗粒状(小型片状)为主。SA、MeJA和ACC处理不同程度地改变了油菜叶表皮蜡质结构。MeJA与ACC处理使油菜叶表皮蜡质的晶体结构密度增加, 这与蜡质含量分析的结果相一致。表皮蜡质层厚度的增加可降低植株失水率,提高其对干旱的耐受力[29]。SA处理后, 叶表皮蜡质杆状结构减少, 且部分区域熔融(图2)。植物角质层蜡质包含角质层内部蜡质与表皮蜡质, SA所诱导的叶片蜡质含量的增加可能主要是来自角质层内部蜡质的沉积。在对番茄蜡质研究中发现, 蜡质组成特别是内表皮蜡质起着主要的蒸腾屏障作用[30]。SA与MeJA、ACC所诱导的表皮蜡质结构的差异也可能与它们介导的不同抗逆信号途径有关。一般而言, 在抗病反应中, 依赖于 SA的防卫反应主要针对活体营养型病原菌, 依赖于JA和ETH的防卫反应主要针对腐生营养型病原菌[31-32]。
4 结论
外源SA、MeJA及ACC处理能够诱导甘蓝型油菜中双11叶片角质层蜡质的沉积, 降低角质层渗透性, 减缓叶片的水分散失, 其中 C29烷的特异性增加是造成叶片失水率降低的主要原因。蜡质组分中烷类、酮类以及醛类可能与SA、JA和ETH所介导的抗(耐)性反应密切相关。
[1] Kosma D K, Bourdenx B, Bernard A, Parsons E P, Lü S, Joubès J, Jenks M A. The impact of water deficiency on leaf cuticle lipids of Arabidopsis. Plant Physiol, 2009, 151: 1918-1929
[2] Ni Y, Xia R E, Li J N. Changes of epicuticular wax induced by enhanced UV-B radiation impact on gas exchange in Brassica napus. Acta Physiol Plant, 2014, 36: 2481-2490
[3] 倪郁, 宋超, 王小清. 低温胁迫下拟南芥表皮蜡质的响应机制.中国农业科学, 2014, 47: 252-261
Ni Y, Song C, Wang X Q. Investigation on response mechanism of epicuticular wax on Arabidopsis thaliana under cold stress. Sci Agric Sin, 2014, 47: 252-261 (in Chinese with English abstract)
[4] 倪郁, 宋超, 王小清. 核盘菌侵染对拟南芥表皮蜡质结构及化学组成的影响. 生态学报, 2014, 34: 4160-4166
Ni Y, Song C, Wang X Q. Effects of Sclerotinia sclerotiorum on the morphology and chemical constituents of epicuticular wax in Arabidopsis thaliana stems. Acta Ecol Sin, 2014, 34: 4160-4166 (in Chinese with English abstract)
[5] Cajustea J F, González-Candelasa L, Veyrat A, García-Breijo F J, Reig-Arminana J, Lafuente M T. Epicuticular wax content and morphology as related to ethylene and storage performance of‘Navelate’ orange fruit. Postharvest Biol Tec, 2010, 55: 29-35
[6] Curry E. Effects of 1-MCP applied postharvest on epicuticular wax of apples (Malus domestica Borkh.) during storage. J Sci Food Agric, 2008, 88: 996-1006
[7] Macková J, Vašková M, Macek P, Hronková M, Schreiber L, Šantrůček J. Plant response to drought stress simulated by ABA application: changes in chemical composition of cuticular waxes. Environ Exp Bot, 2013, 86: 70-75
[8] Seo P J, Lee S B, Suh M C, Park M J, Go Y S, Park C M. The MYB96 transcription factor regulates cuticular wax biosynthesis under drought conditions in Arabidopsis. Plant Cell, 2011, 23:1138-1152
[9] Baker E A. The influence of environment on leaf wax development in Brassica oleracea var. gemmifera. New Phytol, 1974, 73:955-966
[10] Grant R H, Heisler G M, Gao W, Jenks M. Ultraviolet leaf reflectance of common urban trees and the prediction of reflectance from leaf surface characteristics. Agric For Meteorol, 2003, 120:127-139
[11] Khan M I, Fatma M, Per T S. Salicylic acid-induced abiotic stress tolerance and underlying mechanisms in plants. Front Plant Sci, 2015, 6: 462-478
[12] Cheong J J, Yang D C. Methyl jasmonate as a vital substance in plants. Trends Genet, 2003, 19: 409-413
[13] Morgan P W, Drew M C. Ethylene and plant responses to stress. Physiol Plant, 1997, 100: 620-630
[14] Leide J, Hildebrandt U, Vogg G, Riederer M. The positional sterile (ps) mutation affects cuticular transpiration and wax biosynthesis of tomato fruits. J Plant Physiol, 2011, 168: 871-877
[15] Singh K, Foley R C, Onate-Sanchez L. Transcription factors in plant defense and stress responses. Curr Opins Plant Biol, 2002, 5: 430-436
[16] Broun P, Poindexter P, Osborne E, Jiang C Z, Riechmann J L. WIN1, a transcriptional activator of epidermal wax accumulation in Arabidopsis. Proc Natl Acad Sci USA, 2004, 101: 4706-4711
[17] Aharoni A, Dixit S, Jetter R, Thoenes E, van Arkel G, Pereira A. The SHINE clade of AP2 domain transcription factors activates wax biosynthesis, alters cuticle properties, and confers drought tolerance when overexpressed in Arabidopsis. Plant Cell, 2004, 16: 2463-2480
[18] Ni Y, Guo Y J, Wang J, Xia R E, Wang X Q, Ash G, Li J N. Responses of physiological indexes and leaf epicuticular waxes of Brassica napus to Sclerotinia sclerotiorum infection. Plant Pathol, 2014, 63: 174-184
[19] Kosma D K, Nemacheck J A, Jenks M A, Williams C E. Changes in properties of wheat leaf cuticle during interactions with Hessian fly. Plant J, 2010, 63: 31-43
[20] Garbay B, Tautu M T, Costaglioli P. Low level of pathogene-sis-related protein 1 mRNA expression in 15-day-old Arabidopsis cer6-2 and cer2 eceriferum mutants. Plant Sci, 2007, 172:299-305
[21] Staswick P E, Su W, Howell S H. Methyl jasmonate inhibition of root growth and induction of a leaf protein are decreased in an Arabidopsis thaliana mutant. Proc Natl Acad Sci USA, 1992, 89:6837-6840
[22] 李延安, 祁林林, 孙加强, 刘宏宇, 李传友. 茉莉酸诱导侧根形成缺陷突变体asa1-1抑制子(soa)的鉴定与遗传分析. 遗传, 2011, 33: 1003-1010
Li Y A, Qi L L, Sun J Q, Liu H Y, Li C Y. Genetic screening and analysis of suppressors of asa1-1 (soa) defective in jasmonate-mediated lateral root formation in Arabidopsis. Hereditas, 2011, 33: 1003-1010 (in Chinese with English abstract)
[23] Boughton A J, Hoover K, Felton G W. Methyl jasmonate application induces increased densities of glandular trichomes on tomato, Lycopersicon esculentum. J Chem Ecol, 2005, 31: 2211-2216
[24] Holloway P J, Brown G A, Baker E A, Macey M J K. Chemical composition and ultrastructure of the epicuticular wax in three lines of Brassica napus (L). Chem Phys Lipids, 1977, 19: 114-127
[25] Weng H, Molina I, Shockey J, Browse J. Organ fusion and defective cuticle function in a lacs1 lacs2 double mutant of Arabidopsis. Planta, 2010, 231: 1089-1100
[26] Bourdenx B, Bernard A, Domergue F, Pascal S, Leger A, Roby D, Pervent M, Vile D, Haslam R P, Napier J A, Lessire R, Joubes J. Overexpression of Arabidopsis ECERIFERUM1 promotes wax very-long-chain alkane biosynthesis and influences plant response to biotic and abiotic stresses. Plant Physiol, 2011, 156: 29-45
[27] Zhang J Y, Broeckling C D, Sumner L W, Wang Z Y. Heterologous expression of two Medicago truncatula putative ERF transcription factor genes, WXP1 and WXP2, in Arabidopsis led to increased leaf wax accumulation and improved drought tolerance, but differential response in freezing tolerance. Plant Mol Biol, 2007, 64: 265-278
[28] Oliveira A F M, Meirelles S T, Salatino A. Epicuticular waxes from caatinga and cerrado species and their efficiency against water loss. An Acad Bras Cienc, 2003, 75: 431-439
[29] Yang M, Yang Q Y, Fu T D, Zhou Y M. Overexpression of the Brassica napus BnLAS gene in Arabidopsis affects plant development and increases drought tolerance. Plant Cell Rep, 2011, 30: 373-388
[30] Vogg G, Fischer S, Leide J, Emmanuel E, Jetter R, Levy A A, Riederer M. Tomato fruit cuticular waxes and their effects on transpiration barrier properties: functional characterization of a mutant deficient in a very-long-chain fatty acid beta-ketoacyl-CoA synthase. J Exp Bot, 2004, 55: 1401-1410
[31] Glazebrook J. Contrasting mechanisms of defense against biotrophic and necrotrophic pathogens. Annu Rev Phytopathol, 2005, 43: 205-227
[32] Thomma B P H J, Eggermont K, Penninckx I A M A, Mauch-Mani B, Vogelsang R, Cammue B P A, Broeckaert W. Separate jasmonate-dependent and salicylate-dependent defense-response pathways in Arabidopsis are essential for resistance to distinct microbial pathogens. Proc Natl Acad Sci USA, 1998, 95: 15107-15111
Effects of SA, MeJA, and ACC on Leaf Cuticular Wax Constituents, Structure and Permeability in Brassica napus
LI Shuai, ZHAO Qiu-Ling, PENG Yang, XU Yi, LI Jia-Na, and NI Yu*
College of Agronomy and Biotechnology, Southwest University, Chongqing 400715, China
Cuticular waxes are related to plant adaptation to environment stress. In the current study, Brassica napus cv. Zhongshuang 11 grown in the soil treated with adding solutions of SA (200 μmol L-1), MeJA (100 μmol L-1), and ACC (200 μmol L-1) wax, were sampled at the five-leaf stage to clarify the effects of SA, MeJA and ETH on adjusting plant cuticular wax deposition. The leaves were used to analyze the amounts of total cuticular wax and wax constituents, wax crystal structure, and cuticular permeability. The amounts of n-alkanes, secondary alcohols, ketones, aldehydes and total cuticular waxes increased significantly when compared with the control at seven days after MeJA treatment, whereas the amounts of all wax constituents and total cuticular waxes significantly decreased at 14 days after MeJA treatment. The application of SA and ACC had no significant influence on cuticular wax deposition at 7 and 14 days after treatments, except for an amount reduction of primary alcohol, aldehyde and unknown constituents for SA treatment at 14 days after treatment. At 21 days after SA, MeJA, and ACC application, the amounts of total cuticular wax, n-alkanes, ketones and aldehyde significantly increased. C29 n-alkane, C29 ketone, and C30 aldehyde were the main cuticular wax constituents induced by SA, MeJA, and ACC application, implying that n-alkane, ketone and aldehyde might be related to the resistance to stresses induced by these signal molecules. Scan electric microscope analysis indicted that the rod-shape structure of cuticular wax in leaf surface reduced and some rods melted under SA treatment. MeJA and ACC application increased the distribution density of wax crystalloids. The cuticular wax deposition and crystal structure altera-tion reduced the cuticular permeability and delayed the leaf water loss. The specific increase of C29 n-alkane might be the main reason for reducing leaf water loss in B. napus.
Brassica napus L; Cuticular wax; Salicylic acid; Methyl jasmonic acid; Ethylene
10.3724/SP.J.1006.2016.01827
本研究由中央高校基本科研业务费专项(XDJK2014B037), 重庆市基础与前沿研究计划项目(cstc2016jcyjA0170)和国家自然科学基金项目(31000122)资助。
This study was supported by the Fundamental Research Funds for the Central Universities (XDJK2014B037), the Chongqing Basic and Advanced Research Project (cstc2016jcyjA0170), and the National Natural Science Foundation of China (31000122).
*通讯作者(Corresponding author): 倪郁, E-mail: nmniyu@126.com
联系方式: E-mail: 1099908163@qq.com
稿日期): 2016-03-29; Accepted(接受日期): 2016-07-11; Published online(
日期): 2016-08-01.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20160801.1037.004.html
