热处理对全脂大豆蛋白质分子结构特征、溶解度和体外消化率的影响
2016-12-16白明昧孙泽威龙国徽姜海龙何玉华秦贵信
白明昧,孙泽威,龙国徽,王 涛,姜海龙,潘 丽,何玉华,秦贵信
(吉林农业大学 a 动物生产及产品质量安全教育部重点实验室,b 动物科学技术学院,c 生命科学学院,吉林 长春130118)
热处理对全脂大豆蛋白质分子结构特征、溶解度和体外消化率的影响
白明昧a,孙泽威b,龙国徽c,王 涛b,姜海龙b,潘 丽a,何玉华a,秦贵信b
(吉林农业大学 a 动物生产及产品质量安全教育部重点实验室,b 动物科学技术学院,c 生命科学学院,吉林 长春130118)
【目的】 研究热处理对全脂大豆蛋白质分子结构特征、溶解度和体外消化率的影响及三者之间的相关性。【方法】 以全脂大豆为样本,对其进行湿热法(120 ℃高压(0.1 MPa)灭菌锅加热7.5 min)和干热法(120 ℃烘箱干燥15 min)处理,同时设膨化全脂大豆粉不作加热处理。使用傅立叶红外光谱(FTIR)技术,定量计算蛋白质分子结构特征(酰胺Ⅰ带、酰胺Ⅱ带、酰胺Ⅰ带/酰胺Ⅱ带、蛋白质二级结构中α-螺旋、β-折叠及α-螺旋与β-折叠的比值),并采用体积分数0.2%KOH溶液定氮法和胃蛋白酶-胰酶制剂两步酶解法,分别对大豆样品蛋白质溶解度和粗蛋白体外消化率进行分析,用Pearson方法分析各指标间的相关性。【结果】 不同热处理条件显著影响了3种大豆样品蛋白质的分子结构特征、溶解度和体外消化率,且以对膨化全脂大豆的影响最大。蛋白质酰胺Ⅰ带、酰胺Ⅱ带的峰高和峰面积与其溶解度和体外消化率呈显著正相关关系(P<0.05);而蛋白质酰胺Ⅰ带与酰胺Ⅱ带峰高比值与其溶解度和体外消化率呈显著负相关关系(P<0.05),蛋白质酰胺Ⅰ带与酰胺Ⅱ带的峰面积比值与其溶解度和体外消化率也呈显著负相关关系(P<0.05);α螺旋含量、α螺旋/β折叠值与蛋白质溶解度和体外消化率呈极显著正相关关系(P<0.001);无规则卷曲含量与蛋白质溶解度和体外消化率呈显著正相关关系(P<0.05);而β-折叠含量与蛋白质溶解度和体外消化率呈极显著负相关关系(P=0.002);并且蛋白质溶解度与体外消化率呈极显著正相关关系(P<0.001)。【结论】 得到了一组新的蛋白质分子结构特征数据,而且蛋白质的分子结构特征、溶解度和体外消化率三者之间存在密切的相关性关系。
热处理;傅立叶红外光谱技术;分子结构特征;溶解度;体外消化
JIANG Hailongb,PAN Lia,HE Yuhuaa,QIN Guixinb
饲料的营养价值及利用率不仅与其化学成分组成有关,而且与其蛋白质分子结构相关。饲料营养价值的传统测定方法是在利用强酸、强碱、机械研磨等方式破坏饲料成分空间结构的基础上,采用化学方法测定饲料中营养成分的组成,但这种方法不能从分子结构方面揭示营养价值和其在家畜消化道中的降解规律。目前傅立叶红外光谱技术已发展成为一种快速、先进且无破坏性的生物分析技术,其在科研、饲料生产和营养学等各个领域的应用十分广泛,采用此技术可以对饲料原料蛋白质的光谱学特征和功能团空间分布等指标进行分析,以区分不同饲料原料内在化学结构信息的差异,可为建立饲料原料内在化学结构信息与饲料品质、养分利用率和消化特性等方面的数量关系提供依据[1]。
近年来有研究指出,高温加热可以使饲料原料蛋白质的分子结构特征、溶解度和养分降解特性在一定程度上发生改变[2-3];而且蛋白质分子结构特征(酰胺Ⅰ带、酰胺Ⅱ带和二级结构等)对蛋白质品质、营养价值、可利用性和消化行为也有影响[4-5]。国内外学者还发现,饲料中蛋白质(氨基酸)等养分的溶解度与其消化率的高低也密切相关[6-8]。因此,建立不同饲料蛋白质分子的光谱特性和溶解性与其可消化性之间的关系,有助于人们对蛋白质营养价值的深入理解和开拓新兴的科研领域。目前,有关探究蛋白质饲料分子结构特征、溶解度与单胃动物粗蛋白质体外消化率之间关系的研究尚未见报道。
为此,本研究在分析加热对蛋白质分子结构特征、溶解度和体外消化率影响的基础上,揭示蛋白质饲料分子结构特征、溶解度与其体外消化率之间的关系,以期为完善饲料营养价值评价体系、提高饲料蛋白质资源利用效率以及减少养殖业对环境的污染提供依据。
1 材料与方法
1.1 材料及处理
全脂大豆和膨化全脂大豆粉,购于德惠市万浩生物饲料公司。全部样品粉碎过孔径1 mm分析筛用于实验室分析,以全脂大豆作为蛋白质原料进行湿热法(120 ℃高压(0.1 MPa)灭菌锅加热7.5 min)和干热法(120 ℃烘箱干燥15 min)处理,然后于室温下冷却,4 ℃备用。
1.2 试剂及仪器
胃蛋白酶(P7000-25 G)、胰酶(P7545-100 G)、KBr(光谱纯),购自SIGMA公司;氯霉素、磺基水杨酸,购自北京康为世纪生物科技有限公司。
LXJ-64-01型离心机,北京医疗器械厂;GLP 22型pH计,上海仁器仪器仪表有限公司;78-Ⅰ型磁力搅拌器,江苏金坛市中大仪器厂;FTIR-8400s傅立叶变换红外光谱仪,日本岛津公司;FW-3红外压片机,天津天光光学仪器有限公司;HZS-H型恒温水浴振荡器,哈尔滨东联电子技术开发有限公司。
1.3 试验方法
1.3.1 蛋白质溶解度的测定 按Dale[9]的方法,称取3种大豆样品(膨化全脂大豆粉、湿热处理的全脂大豆粉和干热处理的全脂大豆粉)各1.5 g于250 mL烧杯中,分别加入75 mL体积分数 0.2%氢氧化钾溶液,在磁力搅拌器上搅拌20 min后,取50 mL液体转移至离心管,2 700 r/min离心10 min。吸取15 mL上清液,用凯氏定氮法测定其中的蛋白质含量,其量相当于0.3 g样品(15/75=x/1.5 g,x=0.3 g)中的蛋白质含量。蛋白溶解度=15 mL上清液中的蛋白质含量/原样中的蛋白质含量×100%。
1.3.2 蛋白质分子结构的测定 根据龙国徽等[10]的方法,称取3种大豆样品(膨化全脂大豆粉、湿热处理的全脂大豆粉和干热处理的全脂大豆粉)各2.0 mg,分别加入200 mg KBr,在真空干燥器中干燥24 h,研磨混合均匀,然后用红外压片机进行压片,再用傅立叶变换红外光谱仪进行红外光谱扫描,分辨率4 cm-1,扫描次数64次,波数范围4 000~400 cm-1。图谱处理采用OMNIC 8.0数据处理软件,原谱进行基线校正,所有蛋白样品的红外光谱与不含蛋白质样品的KBr图谱做差谱,参照去卷积参数,通过控制半峰宽和增强因子分别为30.0,3.0,得到去卷积图谱。确定子峰峰位,结合去卷积图谱利用Origin 7.5软件对酰胺Ⅰ带(1 700~1 600 cm-1)进行高斯曲线拟合,求出各子峰相对峰面积,分析二级结构各组分与各子峰的对应关系。
1.3.3 粗蛋白质体外消化率的测定 参照Boisen等[11]的体外模拟消化方法测定粗蛋白质体外消化率,其操作程序如下:称取3种大豆样品(膨化全脂大豆粉、湿热处理的全脂大豆粉和干热处理的全脂大豆粉)各1.0 g(精确到0.001 g),分别放入100 mL锥形瓶中,再加入10 mL 1 mg/mL新鲜猪胃蛋白酶溶液(pH为2.0),同时加入0.5 mL氯霉素溶液防止微生物生长,封口后在恒温水浴摇床上37 ℃孵育4 h;胃消化期结束后,用0.2 mol/L NaOH中和,加入10 mL磷酸盐缓冲液(0.2 mol/L,pH值6.8),用1 mol/L HCl或1 mol/L NaOH将pH值调至6.8;然后加入1 mL 50 mg/mL猪胰酶溶液,封口,放入39 ℃恒温水浴振荡器中继续消化18 h;小肠消化期结束后,加入5 mL体积分数20%磺基水杨酸,15 000 r/min离心15 min,弃上清液,沉淀物置于80 ℃烘箱中过夜,待测。粗蛋白质消化率=(原样中粗蛋白质含量-沉淀物中粗蛋白质含量)/原样中粗蛋白质含量×100%。
1.4 数据处理
所有数据均用Microsoft Office Excel 2003进行初步整理,采用Duncan氏法对各组数据进行多重比较,数值表示为“平均值+标准误”,结果以α=0.05 水平来标注差异显著性;相关性分析采用SPSS 19.0进行,得到Pearson相关系数的置信区间和P值。
2 结果与分析
2.1 热处理对大豆样品蛋白质溶解度的影响
如表1所示,3种大豆样品中蛋白质溶解度受热处理的影响均不相同。其中,干热处理组大豆样品的蛋白质溶解度显著高于其他2组(P<0.05),为86.14%;湿热处理组和膨化全脂大豆组分别为82.65%, 76.91%,差异显著(P<0.05)。

表 1 热处理对3种大豆样品蛋白质溶解度的影响
注:同列数据后标不同字母表示差异显著(n=3,P<0.05)。下表同。
Note:Different small letters in the same column indicate significant difference (n=3,P<0.05).Same as below.
2.2 热处理对大豆样品蛋白质分子结构特征的影响
2.2.1 对蛋白质谱带强度特征的影响 由图1可以看出,傅立叶红外光谱分析中蛋白质酰胺Ⅰ带和酰胺Ⅱ带采用共同的基线(1 722~1 482 cm-1),酰胺Ⅰ带峰高所对应的波数大约在1 652 cm-1, 酰胺Ⅱ带峰高所对应的波数大约在1 544 cm-1;酰胺Ⅰ带峰面积所对应的波数在1 722~1 585 cm-1, 酰胺Ⅱ带峰面积所对应的波数在1 585~1 482 cm-1。
由表2可知,3组大豆样品蛋白质的谱带特征值两两比较均差异显著(P<0.05)。湿热处理组大豆酰胺Ⅰ带峰高度、峰面积分别为0.31,0.60,均显著高于其他2组(P<0.05),膨化全脂大豆组蛋白质酰胺Ⅱ带峰高度、峰面积分别为0.04,0.07,均显著低于其他2组(P<0.05);而酰胺Ⅰ带与Ⅱ带的峰高度和峰面积比值均以膨化全脂大豆组最高,均为3.39,显著高于其他2组(P<0.05),其他2组酰胺Ⅰ带与Ⅱ带的峰高、峰面积比值之间差异也显著(P<0.05)。
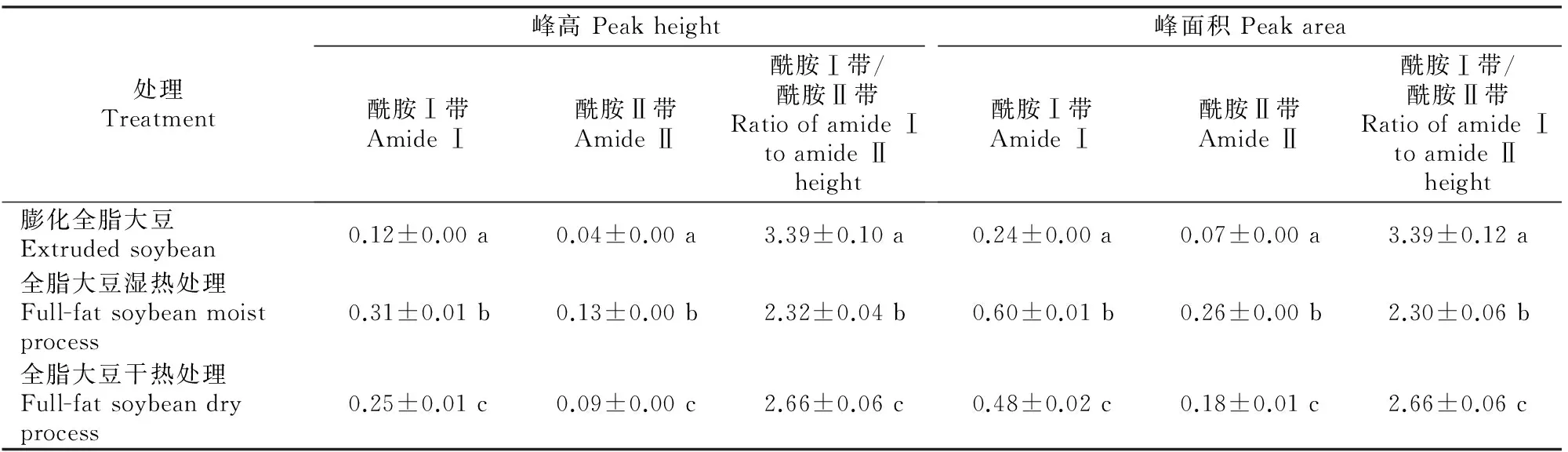
表 2 热处理对3种大豆样品蛋白质谱带强度的影响
2.2.2 对蛋白质二级结构各组分的影响 3种大豆样品酰胺Ⅰ带的拟合结果如图2所示,拟合度R2=0.999 99,据此计算得出的蛋白质二级结构各组分含量见表3。由图2可以看出,红外光谱酰胺Ⅰ带特征峰1 619,1 626,1 634 cm-1归为β-折叠;1 641,1 649 cm-1归为无规则卷曲;1 656 cm-1归为α-螺旋;1 665,1 674,1 687,1 697 cm-1归为β-转角。
由表3可知,3种大豆样品中干热处理组α-螺旋含量最高,为12.81%,显著高于其他2组(P<0.05);膨化全脂大豆组的β-折叠含量最高,为30.99%,显著高于其他2组(P<0.05);3种大豆样品中β-转角含量差异均不显著(P>0.05);干热处理组大豆样品的无规则卷曲含量也最高,但仅与膨化大豆组相比差异显著(P<0.05);膨化全脂大豆组的α-螺旋与β-折叠比值显著低于其他2组(P<0.05),为36.97%。
2.3 热处理对大豆样品粗蛋白质体外消化率的影响
由图3可知,3种大豆样品粗蛋白质经胃蛋白酶-胰酶连续消化后,粗蛋白质体外消化率随时间延长呈逐渐递增的趋势,且在不同时间点上,3种大豆样品粗蛋白质体外消化率均不相同。12~16 h,粗蛋白质降解速率以干热处理组最大,其次是湿热处理组,膨化全脂大豆组最小;且干热处理组大豆样品粗蛋白质终消化率显著高于其他2组(P<0.05),为75.85%,湿热处理组和膨化全脂大豆组相比差异也显著(P<0.05),分别为71.83%,64.22%。

图 2 热处理条件下3种大豆样品蛋白质酰胺Ⅰ带(波数在1 700~1 600 cm-1)的曲线拟合谱图
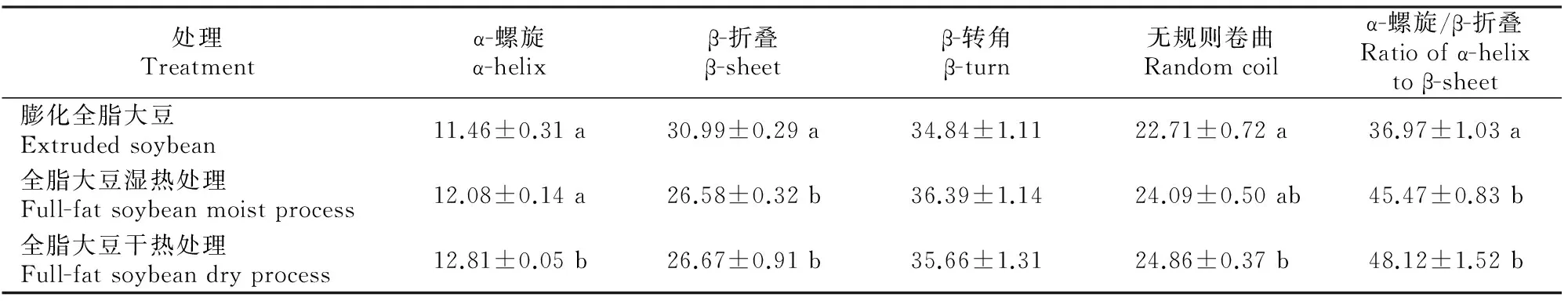
表 3 热处理条件下3种大豆样品蛋白质二级结构各组分的定量计算
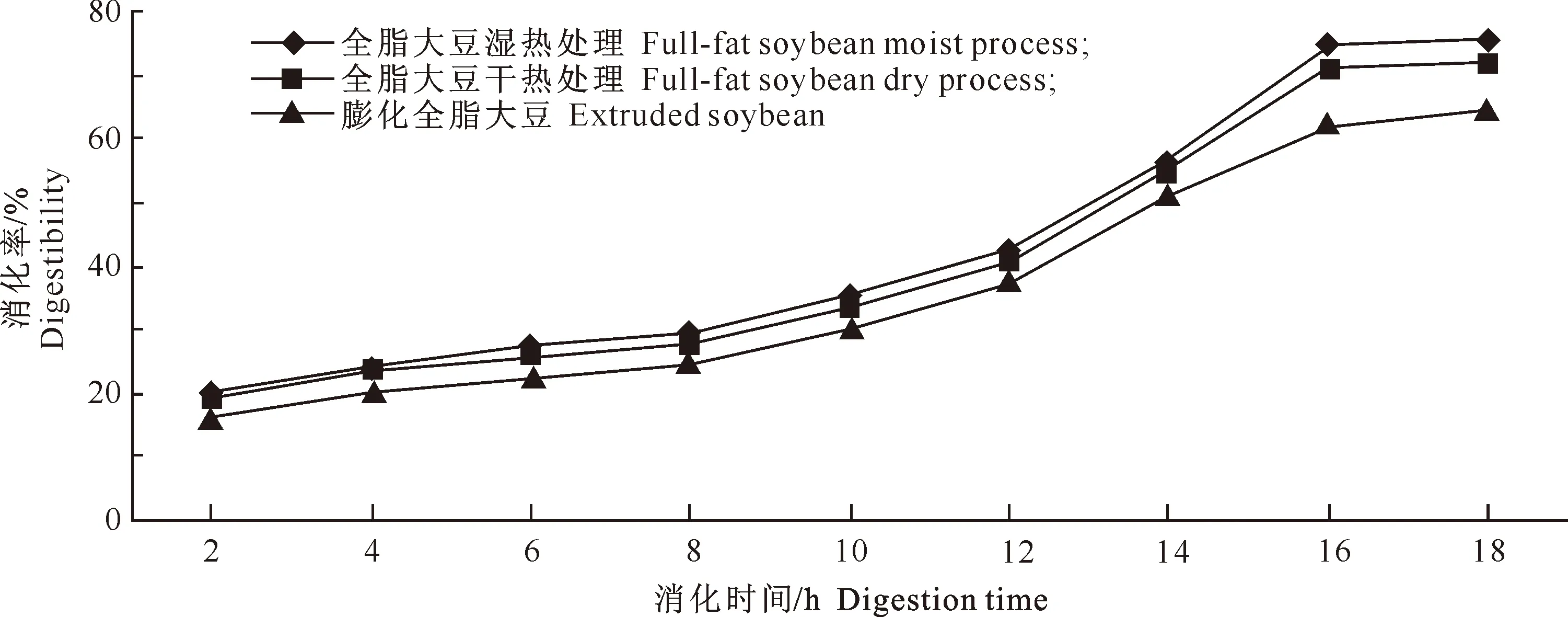
图 3 热处理对3种大豆样品粗蛋白质体外消化率的影响
2.4 蛋白质分子结构特征与其溶解度和体外消化率的关系
2.4.1 蛋白质谱带强度特征与其溶解度和体外消化率的关系 由表4可知,蛋白质酰胺Ⅰ带、酰胺Ⅱ带峰高和峰面积均与其溶解度和粗蛋白质消化率呈显著正相关关系(P<0.05);而蛋白质酰胺Ⅰ带与酰胺Ⅱ带峰高比值与其溶解度和粗蛋白质消化率呈显著负相关关系(P<0.05),蛋白质酰胺Ⅰ带与酰胺Ⅱ带峰面积比值与其溶解度和粗蛋白质消化率也呈显著负相关关系(P<0.05)。
2.4.2 蛋白质二级结构各组分与其溶解度和体外消化率的关系 由表5可知,蛋白质二级结构中α-螺旋含量与其溶解度和体外消化率呈极显著正相关关系(P=0.001);β-折叠含量与蛋白质溶解度和体外消化率呈极显著负相关关系(P=0.002);无规则卷曲含量与蛋白质溶解度和体外消化率呈显著正相关关系(P<0.05);α-螺旋/β-折叠与蛋白质溶解度和体外消化率也呈极显著正相关关系(P<0.001)。同时,研究发现蛋白质溶解度与其体外消化率呈极显著正相关关系(r=0.998,P<0.001)。
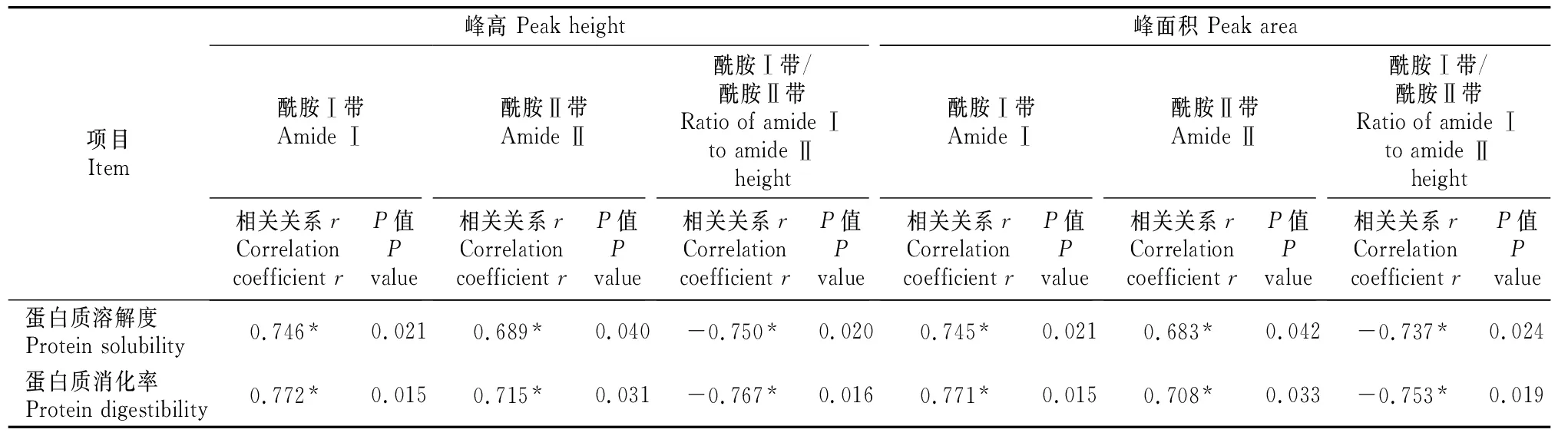
表 4 蛋白质谱带强度特征与其溶解度和体外消化率的相关分析
注:*. 表示在P=0.05水平上差异显著,**. 表示在P=0.01水平上差异显著。采用Pearson方法获得相关系数。下表同。
Note:*.shows significant difference at the level ofP=0.05,**.shows the significant difference at the level ofP=0.01.Correlation coefficients were obtained using the Pearson method.The same below.
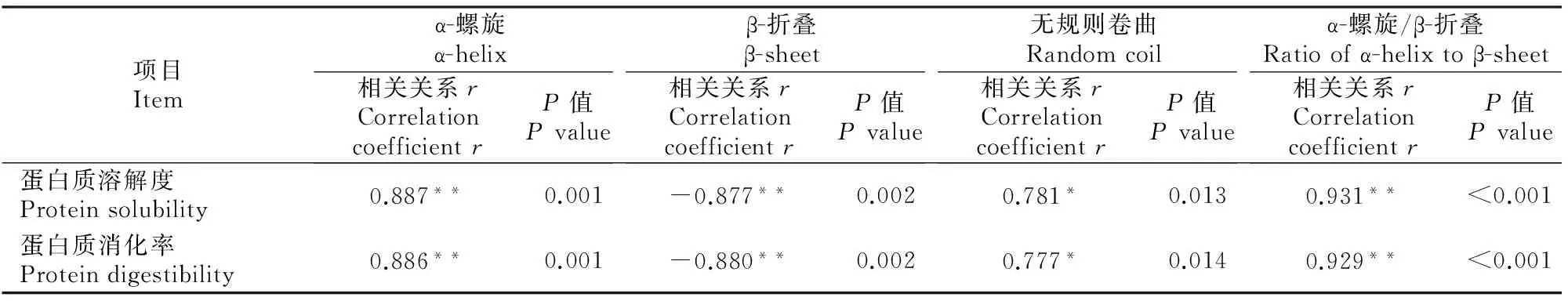
表 5 蛋白质二级结构各组分与其溶解度和体外消化率的相关分析
3 讨 论
3.1 热处理对蛋白质溶解度的影响
许多研究认为,蛋白质溶解度是评价全脂大豆加工或营养品质的一个重要指标[12]。本研究结果表明,膨化全脂大豆组的蛋白质溶解度受高温加热影响最大,此结果与豆洪启[13]的研究结果一致;但蛋白质溶解度达76.91%,高于李素芬等[14]的研究结果,这可能是因为饲料产地、品种和贮存方式等不同造成的;其次影响较大的是湿热处理组,可能是由于湿热法具有穿透力强和作用快等特点,从而使湿热处理组的蛋白质溶解度受加热影响较大,这与Qin[15]的研究结果相一致。
另外本试验还发现,在同一粒度下,饲料原料的蛋白质溶解度与其体外消化率呈极显著正相关关系,这与王卫国等[16]的研究结果相一致。蛋白质溶解度之所以能够影响肠道内的养分利用率,可能是因为动物消化道内蛋白饲料首先要溶解于消化液中,然后才能被消化酶有效地加以水解所致。
3.2 热处理对大豆样品粗蛋白质体外消化率的影响
由于实体动物消化实验耗时、费力,很难在短时间内对大量的饲料样品进行评价分析,而单胃动物体外消化模拟技术具有简单、快捷、重演性好等特点,因此在饲料营养价值评定方面具有重大应用潜力,其中胃蛋白酶-胰酶制剂两步酶解法是目前较为适宜的体外消化测定技术之一[17]。
然而,由于动物体胃肠道是一个极其复杂的生物系统,力图完全真实模拟胃肠道的消化过程几乎是不可能实现的,而且在胃和小肠消化的不同阶段,消化产物的不断积累会抑制酶促反应的发生,因此本试验中的粗蛋白质体外消化率可能会低于实际理论值。Doiron等[18]研究表明,湿热法较干热法能更有效地改善饲料的蛋白质品质和营养价值。这与本研究结果不同,可能是由于湿热处理组加热时间较短,致使大豆中部分抗营养因子未能完全去除,进而影响了主要蛋白酶类的消化作用,所以本研究中湿热处理组的粗蛋白质体外消化率稍低于干热处理组。
3.3 热处理对蛋白质谱带强度特征的影响
蛋白质红外光谱具有两个主要功能波段,即酰胺Ⅰ带(1 700~1 600 cm-1)和酰胺Ⅱ带(1 600~1 500 cm-1),这是由蛋白质主链特定弯曲和伸缩振动产生的。酰胺Ⅰ带主要为80%的C=O伸缩振动,酰胺Ⅱ带为60%的N-H弯曲振动和40%的C-N 伸缩振动,二者都可以用于评估蛋白质构象[19]。
本研究结果表明,热处理可以显著改变蛋白质酰胺Ⅰ带和酰胺Ⅱ带特征值,其中湿热处理组酰胺Ⅰ带、Ⅱ带峰高、峰面积最大,其次是干热处理组,但都低于Samadi等[20]的研究结果;而酰胺Ⅰ带与酰胺Ⅱ带峰高和峰面积比值以湿热处理组最低,其次是干热处理组,却都高于Samadi等[20]的研究结果,这可能与原料来源、加工处理方法和加热时间等不同有关。本研究还发现,蛋白质酰胺区特征与其溶解度呈显著相关,这与Yu和Nuez-Ortín等[21]的研究结果相一致。
另外本试验还发现,粗蛋白质含量相同的3种大豆样品,当加热导致蛋白质酰胺区特征发生变化时,不同样品在动物消化道内的粗蛋白质消化率也不同,这与Theodoridou等[22]的研究结果相一致。蛋白质酰胺区特征之所以与其溶解度和体外消化率存在密切的相关性,可能是因为酰胺Ⅰ带和Ⅱ带峰高、峰面积的大小代表着蛋白质分子结构中主要化学键(C=O、C-N和N-H键等)数量的多少,而化学键的种类和数量可以间接反映消化道内主要蛋白酶与底物相互作用时肽链的降解程度。
3.4 热处理对蛋白质二级结构各组分的影响
由于典型的蛋白质二级结构中α-螺旋和β-折叠结构的形成与氢键特性有关,酰胺Ⅰ带的振动频率对与肽键有关的氢键又非常敏感,所以红外光谱酰胺Ⅰ带对蛋白质二级结构特别敏感[23-24]。虽然酰胺Ⅱ带也能用于评估蛋白质构象,但它是由多官能团复杂式振动产生的;酰胺Ⅰ带具有较高的光谱强度,是预测蛋白质结构、评估蛋白质构象的首选[25-26]。因此本研究通过定量计算酰胺Ⅰ带组分来预测蛋白质二级结构。
本研究结果表明,热处理能够诱导蛋白质二级结构发生改变,其中湿热处理组的α-螺旋、β-折叠含量和α-螺旋/β-折叠值均较干热处理组低,这与Yu等[27]的研究结果相似;另外本研究发现,蛋白质二级结构中α-螺旋、β-折叠含量和α-螺旋与β-折叠比值均不同程度地影响着蛋白质的品质和可消化性,这与Yu[28]的研究结果相一致。饲料原料的蛋白质二级结构在一定程度上决定饲料的营养价值,可能是因为不同饲料蛋白质分子结构特征间的差异,导致其在消化过程中与消化酶接触的机会和作用位点不同,从而释放出不同种类、数量的寡肽和游离氨基酸,进而导致蛋白质营养价值也不同[29]。
4 结 论
本研究结果表明,不同热处理条件严重影响了全脂大豆蛋白质的分子结构特征、溶解度和体外消化率,且以膨化全脂大豆组受高温加热影响最大,蛋白质分子结构特征、蛋白质溶解度和粗蛋白质体外消化率三者之间存在密切的相关关系。说明高温加热既可以提高或改善蛋白质品质,也可以降低蛋白质质量和养分利用率,饲料原料和加工处理方法是影响饲料营养价值的重要因素。
[1] 俞培强.同步辐射傅立叶变换红外显微光谱技术在饲料学中应用前景广阔 [J].中国家禽,2007,29(24):48.
Yu P Q.Wide application prospects of synchrotron radiation fourier transform infrared microscopy spectroscopy in feed science [J].China Poultry,2007,29(24):48.
[2] Peng Q,Khan N A,Wang Z,et al.Moist and dry heating-induced changes in protein molecular structure,protein subfractions,and nutrient profiles in camelina seeds [J].J Dairy Sci,2013,97:446-457.
[3] Samadi,Theodoridou K,Yu P.Detect the sensitivity and response of protein molecular structure of canola seed (yellow and brown) to different heat processing and relation to protein utlization and availability using ATR-FT/IR molecular spectroscopy with chemo metrics [J].Spectrochimica Acta Part A-Molecular and Biomolecular Spectroscopy (UK),2013,105:304-313.
[4] Peng Q H,Khan N A,Wang Z S,et al.Relationship of feeds protein structural makeup in common prairie feeds with protein solubility,in situ ruminal degradation and intestinal digestibility [J].Anim Feed Sci & Tech,2014,194:58-70.
[5] Zhang X,Yu P.Molecular basis of protein structure in combined feeds (hulless barley with bioethanol coproduct of wheat dried distillers grains with solubles) in relation to protein rumen degradation kinetics and intestinal availability in dairy cattle [J].J Dairy Sci,2012,95:3363-3379.
[6] 夏继桥,钟荣珍,秦贵信,等.不同蛋白源对断奶仔猪粗蛋白消化吸收的影响研究 [D].长春:吉林农业大学,2014.
Xia J Q,Zhong R Z,Qin G X,et al Effect of different protein source diets on digestion and absorption of crude protein in weaned piglets [D].Changchun: Jilin Agricultural University,2014.
[7] Liu B,McKinnon J J,Thacker P,et al.In-depth study of the protein molecular structures of different types of dried distillers grains with solubles and their relationship to digestive characteristics [J].Sci Food Agric,2013,93(6):1438-1448.
[8] Xin H,Falk K,Yu P.Studies onBrassicacarinataseed:1.protein molecular structure in relation to protein nutritive values and metabolic characteristics [J].J Agric Food Chem,2013b,61:10118-10126.
[9] Dale N M. Protein solubility as an indicator of optimum processing of soybean meal [J].Georgia Nutrition Conference for the Feed Industry, Atlanta Georgia,1987(18/19/20):88-95.
[10] 龙国徽,纪 媛,秦贵信,等.大豆球蛋白的红外和拉曼光谱分析 [J].吉林大学学报(理学版),2014,52(4):840-846.
Long G H,Ji Y,Qin G X,et al.Analysis of soy glycinin by FTIR and Raman spectroscopy [J].Jilin University(Science Edition),2014,52(4):840-846.
[11] Boisen S,Fernandez J A.Prediction of the apparent ileal digestibility of protein and amino acids in feedstuffs and feed mixtures for pigs by in vitro analyses [J].Anim Feed Sci & Tech,1995,51:29-43.
[12] 曹志华,赵先铭,郭晓霞.干热处理对大豆粉品质的影响 [J].湖北农业科学,2004(3):92-94.
Cao Z H,Zhao X M,Guo X X. Effects of dry heat treatment on the quality of soybean powder [J].Hubei Agr Sci,2004(3):92-94.
[13] 豆洪启.挤压膨化大豆工艺及其品质的研究 [D].郑州:河南工业大学,2013.
Dou H Q.Study of parameters and qualities of full-fat soybean extruded by extruder [D].Zhengzhou:Henan University of Technology,2013.
[14] 李素芬,杨丽杰,霍贵成.膨化处理对全脂大豆抗营养因子及营养价值的影响 [J].畜牧兽医学报,2001,32(3):193-201.
Li S F,Yang L J,Huo G C.Effects of extrusion on residual anti-nutrient contents and nutritional value of full-fat soybean [J].Acta Veterinaria et Zootechnica Sinica,2001,32(3):193-201.
[15] Qin G X.Thermal-processing of whole soyabeans:studies on the inactivation of antinutritional factors and effects on ileal digestibility in piglets [J].Anim Feed Sci & Tech,1996,57:313-324.
[16] 王卫国,李石强,张 磊,等.六种饲料原料粉碎粒度与蛋白质溶解度关系研究 [J].饲料工业,2002,23(5):6-8.
Wang W G,Li S Q,Zhang L,et al.Study on the relationship between particle size of six kinds of feed ingredients and protein [J].Feed Industury,2002,23(5):6-8.
[17] Boisen S,Moughan P J.Different expressions of dietary protein and amino acid digestibility in pig feeds and their application in protein evaluation:a theoretical approach [J].Acta Agricultural Scandinavica,1996b,46:165-172.
[18] Doiron K,Yu P,McKinnon J J,et al.Heat-induced protein st-ructure and subfractions in relation to protein degradation kinetics and intestinal availability in dairy cattle [J].Dairy Sci,2009a,92:3319-3330.
[19] Lisa M,Dumas P.From structure to cellular mechanism with infrared micro-spectroscopy [J].Curr Opin Struc Biol,2010,20:649-956.
[20] Samadi,Yu P.Determine heat-induced changes of protein molecular structure,protein subfraction and nutrient profiles in soybean seeds affected dry and moisture heat processing [J].Dairy Sci,2011,94:6092-6102.
[21] Yu P,Nuez-Ortín W G.Relationship of protein molecular str-ucture to metabolisable proteins in different types of dried distillers grains with solubles:a novel approach [J].Br J Nutr,2010,104:1429-1437.
[22] Theodoridou K,Yu P Q.Application potential of ATR-FT/IR molecular spectroscopy in animal nutrition:reveal protein molecular structures of canola meal and presscake,as affected by heat processing methods,in relationship with their protein digestive behavior and utilization for dairy cattle [J].J Agr Food Chem,2013,61:5449-5458.
[23] Miller L M.The impact of infrared synchrotron radiation on biology: past, present, and future [J].Synchrotron Radiation News,2000,13:31-37.
[24] Marinkovic N S,Huang R,Bromberg P,et al.Center for Synchrotron Biosciences’ U2B beamline:an international resource for biological infrared spectroscopy [J].Synchrotron Radiation,2002,9:189-197.
[25] Yu P.Synchrotron IR microspectroscopy for protein structure analysis:potential and questions [J].Spectroscopy,2006,20:229-251.
[26] Yu P.Application of advanced synchrotron radiation based Fo-urier transform infrared (SR-FTIR)micro-spectroscopy to animal nutrition and feed science: a novel approach [J].Br J Nutr,2004a,92:869-885.
[27] Yu P,McKinnon J J,Soita H W,et al.Use of synchrotron-based FTIR micro-spectroscopy to determine protein secondary structures of raw and heat-treated brown and golden flaxseeds:A novel approach [J].Can J Anim Sci,2005,85:437-448.
[28] Yu P.Protein sedondary structures (α-helix and β-sheet) at a cellular level and protein fractions in relation to rumen degardation behaviours of protein:a new approach [J].Br J Nutr,2005b,94(5):655-665.
[29] Yu P,Mckinnon J J,Christensen C R,et al.Using synchrotron-based FTIR micro-spectroscopy to reveal chemical features of feather protein secondary structure:comparison with other feed protein sources [J].J Agr Food Chem,2004,52:7353-7361.
Effect of heat-treatment on molecular structure characteristics,solubility andinvitrodigestibility of full-fat soybean protein
BAI Mingmeia,SUN Zeweib,LONG Guohuic,WANG Taob,
(aAnimalProduction&ProductQualityandSecurityKeyLab,MinistryofEducation,bCollegeofAnimalScienceandTechnology,cCollegeofLifeScience,JilinAgriculturalUniversity,Changchun,Jilin130118,China)
【Objective】 This study investigated the effect of heat-treatment on molecular structure characteristics,solubility,invitrodigestibility as well as their relationships of full-fat soybean protein.【Method】 In this study,full-fat soybean was treated with moist process (autoclaved (0.1 MPa) at 120 ℃ for 7.5 min) and dry process (heated at 120 ℃ for 15 min).A group of fat-full soybean was also extruded without heat treatment.The protein molecular structures (including amide Ⅰ,amide Ⅱ,amide Ⅰ/amide Ⅱ,and ratios of α-helix and β-sheet and α-helix/β-sheet in secondary structure) were quantified using Fourier transform infrared molecular spectroscopy (FTIR).The protein solubility andinvitrodigestibility were analyzed by (0.2%)KOH solution kjeldahl and pepsin-pancreatin two-step enzymatic methods,respectively.Pearson method was used to calculate correlation coefficients.【Result】 Different heat treatments had significant effect on protein molecular structure characteristics,solubility andinvitrodigestibility,with the greatest impact on the extruded soybean.Heights and areas of amid Ⅰ and amide Ⅱ had significantly positive correlation with protein solubility andinvitrodigestibility (P<0.05).The height ratio of amide Ⅰ to amide Ⅱ was significantly negatively related to solubility andinvitrodigestibility (P<0.05),and the area ratio of amide Ⅰ to amide Ⅱ was significantly negatively related to solubility andinvitrodigestibility (P<0.05).The contents of α-helix and ratio of α-helix to β-sheet had very significantly positive correlation with solubility andinvitrodigestibility (P<0.001).The contents of random coil had significantly positive correlation with solubility andinvitrodigestibility (P<0.05).The contents of β-sheet had significantly negative correlation with protein solubility andinvitrodigestibility (P=0.002),and significantly positive correlation was found between protein solubility andinvitrodigestibility (P<0.001).【Conclusion】 Novel molecular structural data was obtained and close correlations were found between molecular structure characteristics,solubility and extracorporeal digestibility.
heat treatment;Fourier transform infrared molecular spectroscopy;molecular structure;protein solubility;hydrolysisinvitro
时间:2016-10-09 10:08
10.13207/j.cnki.jnwafu.2016.11.005
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20161009.1008.010.html
2015-05-22
国家重点基础研究发展计划“973计划”项目(2013CB127306)
白明昧(1990-),女,内蒙古扎赉特旗人,硕士,主要从事动物营养与饲料科学研究。 E-mail:mingmeidexiatian@163.com
秦贵信(1956-),男,山东高密人,教授,博士,主要从事比较动物营养学和饲料抗营养因子研究。 E-mail:qgx@jlau.edu.cn
S816.42
A
1671-9387(2016)11-0031-08
