饲料中添加抗菌肽对红姑鱼幼鱼生长性能及血清激素水平的影响
2016-12-16郑宗林赵永志SergioCastillo
郑宗林,赵永志,Sergio Castillo
(1 西南大学荣昌校区,水产动物繁育和健康养殖研究中心,重庆 402460;2 Department of Wildlife and Fisheries Sciences,Texas A&M University,College Station,Texas,77843-2258 USA;3 苏州海特科生物科技有限公司,江苏 苏州 215100)
饲料中添加抗菌肽对红姑鱼幼鱼生长性能及血清激素水平的影响
郑宗林1,2,赵永志3,Sergio Castillo2
(1 西南大学荣昌校区,水产动物繁育和健康养殖研究中心,重庆 402460;2 Department of Wildlife and Fisheries Sciences,Texas A&M University,College Station,Texas,77843-2258 USA;3 苏州海特科生物科技有限公司,江苏 苏州 215100)
【目的】 评价抗菌肽(Antimicrobial peptides,AMPs)对红姑鱼(Sciaenopsocellatus)幼鱼生长性能和血清激素水平的影响。【方法】 在基础饲料中添加不同剂量的抗菌肽(0,0.1,0.3和0.5 g/kg)作为试验饲料(即A0,A100,A300和A500组),饲喂平均体质量为(1.57±0.17) g/尾的红姑鱼8周,测定各组红姑鱼生长性能、血清激素(GH、T3、T4和IGF-I)水平,A0和A300组红姑鱼停饲后不同时间点的血清激素水平及肌肉和肝脏中IGF-I mRNA表达丰度。【结果】 A300和A500组红姑鱼增重率、饲料效率和蛋白效率都显著高于A0组 (P<0.05),A100、A300和A500组的蛋白沉积率和成活率显著高于A0组(P<0.05)。A300和A500组含肉率和鱼体粗蛋白含量显著高于A0组(P<0.05),对形体指标和体组成的其他指标均无显著影响(P>0.05)。养殖4,6,8周抗菌肽对血清中GH水平无显著影响(P>0.05);A300和A500组血清T3、T4和IGF-I含量显著高于A0组(P<0.05)。停饲后72 h内持续取样发现,A300组的血清IGF-I在停饲后2 h时达峰值,且在2和4 h时血清IGF-I含量显著高于A0组(P<0.05)。A300组的IGF-I mRNA在肝脏和肌肉中的表达量在4 h时达峰值(P<0.05)。【结论】 饲料中添加抗菌肽0.3 g/kg可促进红姑鱼的生长,提高饲料效率,增加含肉率。抗菌肽与血清GH的分泌无显著相关性,但可提高血清IGF-I水平及IGF-I mRNA在肌肉和肝脏中的表达量。
红姑鱼;抗菌肽;生长性能;血清激素;IGF-I mRNA
红姑鱼(Sciaenopsocellatus)属鲈形目,石首鱼科,拟石首鱼属,是我国海水网箱养殖的主要品种之一。目前对红姑鱼生物学特性[1]、人工育苗[1]、营养素需求[2]、养殖模式和环境[3-4],及饲料功能性物质[5]等方面已有较充分的研究。
抗菌肽(AMPs)是一类具有抗菌活性的天然小分子蛋白。自1975年瑞典科学家Boman等从蚕蛹中分离得到第一个抗菌肽天蚕素(Cecropin)以来,在昆虫、两栖类、水产动物以及包括人在内的哺乳动物,甚至植物及细菌等广泛的生物谱中发现了1 700余种抗菌肽[6]。抗菌肽几乎是所有生命物种都有的重要免疫分子,它具有广谱抗菌、抗病毒、抗真菌、抗寄生虫及抗肿瘤等生物活性[7]。目前,抗菌肽在凡纳滨对虾(Litopenaeusvannamei)[7-9]、锦鲤(Cyprinuscarpiokoi)[10]、花鲈(Lateolabraxjaponicus)[11]和湘云鲫(Triploidcruciancarp)[12]等中均表现出良好的促生长效果,并可增强非特异性免疫性能,但未涉及到对内分泌机能,如血清激素水平影响的研究。本试验研究了抗菌肽对红姑鱼生长性能和血清激素水平的影响,通过观察红姑鱼血清激素水平的变化,从内分泌角度探讨抗菌肽对红姑鱼生理机能的影响。
1 材料与方法
1.1 试验设计
试验采用单因素设计。在基础饲料中添加不同剂量(0,0.1,0.3和0.5 g/kg)的AMPs(柞蚕代谢物抗菌肽,活性单位20 000 U/g,由苏州海特科生物科技有限公司提供),即A0、A100、A300和A500组,每组设3个重复。所有饲料组分经过V型混合机混合20 min后,加定量鱼油和约20%蒸馏水混合搅拌、制粒(3 mm),在25 ℃阴干约24 h。饲料基本组分按AOAC(1995)[13]的方法进行,饲料配方见表1。
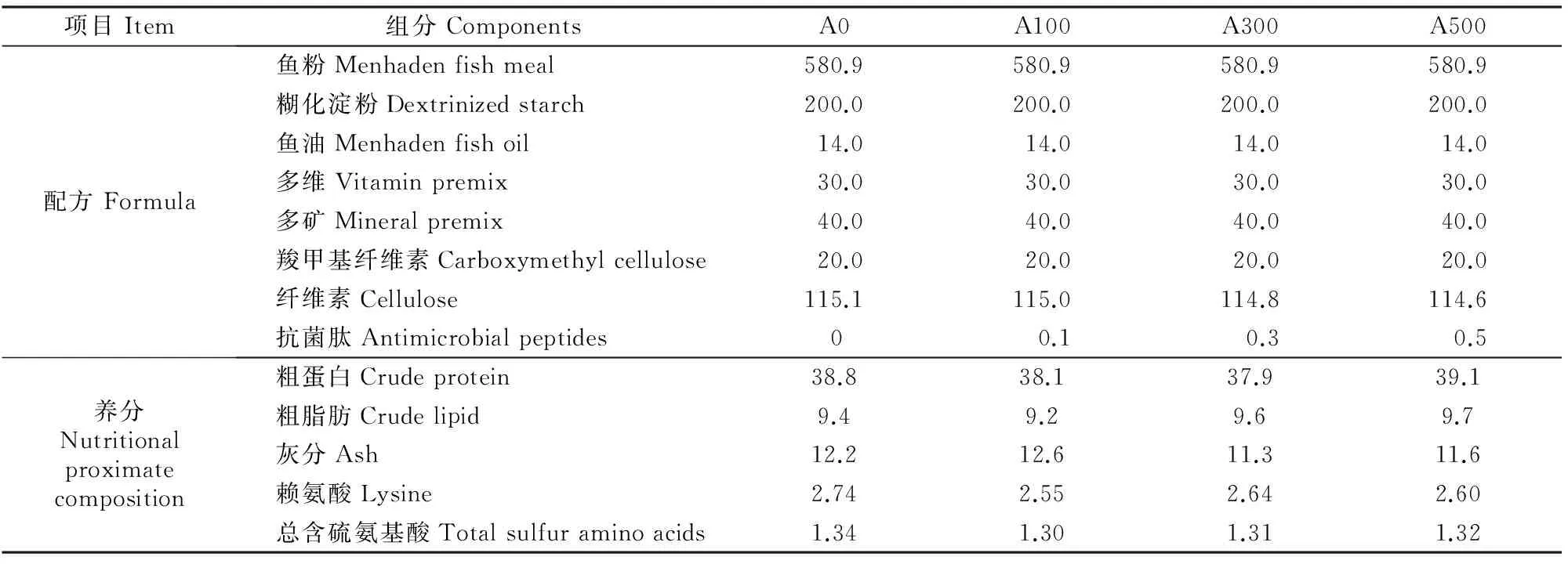
表 1 试验饲料配方及营养分析(风干物质)
1.2 试验方法
试验在美国德州农工大学水产养殖研究中心(Texas A&M Aquacultural Research and Teaching Facility,USA)进行。红姑鱼幼鱼购于德州海洋水产研究中心(the Sea Center Texas Marine Aquarium),先在室内暂养2周以适应环境。暂养和试验期间,每天早上10:00和下午16:00投喂A0组饲料至饱食。
试验用水族缸水容积38 L,养殖水经过沉淀、曝气、生物过滤、紫外消毒后再进入养殖系统,水体盐度保持在5~7 g/L。每缸中的水流速为1 L/min,溶氧饱和度为90%左右,水温控制在(26±1.0) ℃。光照时间为12 h。每个水族缸放20尾鱼,体质量(1.57±0.17) g/尾。每天投喂相应试验饲料至表观饱食,持续8周。每周称整缸鱼的体质量,调整投饵率,以保证饲料不浪费。
1.3 生长性能及内分泌指标测定
养殖试验结束后,每缸鱼整体称体质量。每缸随机取3尾鱼,用MS222麻醉后,解剖鱼体,分离肌肉、肝脏、内脏脂肪等组织,测量鱼形体指标和脏体质量。试验鱼体干物质、粗蛋白、粗脂肪、灰分采用AOAC(1995)[13]的方法测定,水分于105 ℃烘干至恒质量测定。
成活率=各组剩余鱼(尾)/各组试验鱼(尾)×100%;增重率(Weight gain,WG)=(末均体质量(g)-初均体质量(g))/初均体质量(g)×100%;饵料系数(Feed conversion ratio,FCR)=摄食量(g)/(末均体质量(g)-初均体质量(g));蛋白贮积率(Protein retentionefficiency,PRE)=鱼体积累蛋白(g)/蛋白摄食量(g)×100%;肥满度(Condition factor,CF)=体质量(g)/鱼体全长(cm)3×100%;含肉率(Muscle retention,MR)=肌肉质量(g)/体质量(g)×100%;内脏脂肪比(Intraperitoneal fat,IPF)=内脏脂肪质量(g)/体质量(g)×100%;肝胰指数(Hepatopancreas index,HSI)=肝胰脏质量(g)/体质量(g)×100%。
1.4 血清及基因表达分析
养殖试验第4,6和8周末投喂结束后4 h,每缸取2尾鱼,从尾静脉取血,6 000g离心12 min后,取上清液,-80 ℃保存至备用。养殖试验结束后,发现A300组红姑鱼的生长性能等指标表现最佳,为进一步探讨抗菌肽可能的作用机理,对停饲后不同时间点(0,1,2,4,6,8,12,16,24,36,48,60和72 h)的A0和A300组的红姑鱼尾静脉取血,并分离肝脏和肌肉,测定内分泌激素水平和组织mRNA丰度。
血清甲状腺激素三碘甲腺原氨酸(T3)和甲状腺素(T4)含量采用放射免疫技术进行测定,根据Loter等[14]和Cohn等[15]的方法进行。实际检测限为0.1 ng/mL;T3和T4含量组内变异系数<6.0%;组间变异系数<10.0%(T3)和<17.0%(T4)。
血清生长激素(GH)采用酶联免疫法(ELISA)测定[16]。免疫板在碳酸盐缓冲液中用配位体包被,4 ℃孵育过夜,加入山羊血清(NGS,Sigma)继续孵育过夜。血清样品用缓冲液按1∶4(体积比)稀释,与NGS和一抗(兔抗红姑鱼GH)混合。检测限为0.2 ng/mL;组内和组间变异系数分别为<7.0%和<10.0%。
血清类胰岛素样生长因子I(IGF-I)采用竞争性时间分辨免疫荧光法[17]测定,用羊抗兔包被的96孔板(Reacti-BindTM)进行检测(Pierce,Rockford, IL,USA),其检测限及变异系数与GH相同。IGF-I在血清中的回收率>90%。
肌肉和肝组织中IGF-I mRNA表达量的测定按Peterson等[18]的方法进行。使用iCycleriQ RT-PCR检测系统进行定量实时多聚酶联反应(qPCR),定量IGF-I和核糖体18S mRNA亚基。
1.5 统计分析
用统计软件SPSS 17.0进行统计分析。试验结果经过一元方差分析(one-way ANOVA)后,进行Duncan’s多重比较各试验组间差异的显著性,P<0.05表示差异显著。
2 结果与分析
2.1 抗菌肽对红姑鱼生长性能的影响
由表2可知,饲料中添加AMPs对红姑鱼增重率、饵料系数、蛋白贮积率和成活率都有显著影响。A300和A500组红姑鱼WG和PRE都显著高于A0组,FCR则显著低于A0组(P<0.05),A100、A300和A500组的红姑鱼成活率显著高于A0组(P<0.05)。
2.2 抗菌肽对红姑鱼形体指标和体组成的影响
由表3可知,AMPs对红姑鱼CF、HSI和IPF无显著影响(P>0.05),A300和A500组红姑鱼MR显著高于A0组(P<0.05)。AMPs对红姑鱼全鱼Moi、EE和Ash无显著影响(P>0.05);A300和A500组的鱼体CP含量显著高于A0及A100组(P<0.05)。
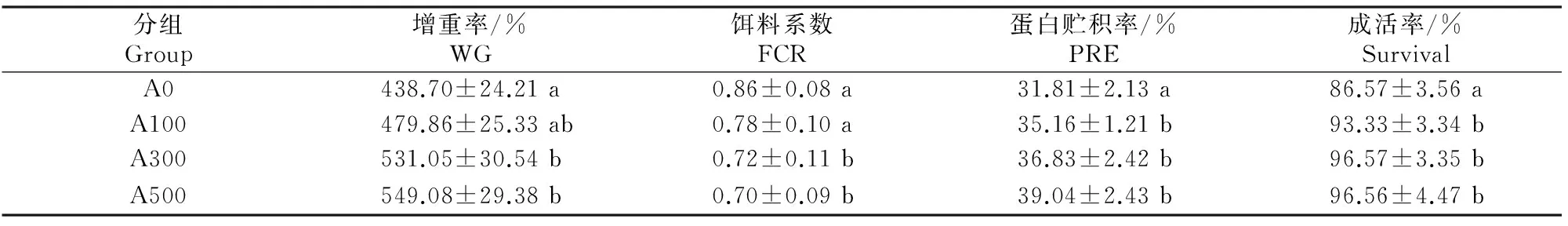
表 2 抗菌肽对红姑鱼生长性能、饲料利用和成活率的影响
注:表中数据为3个体质量重复样本的平均值;同列数据后标不同小写字母表示差异显著(P<0.05)。下同。
Note:Values represent means of 3 replicate samples;Different lowercase letters within each column indicate significant difference (P<0.05).The same below.
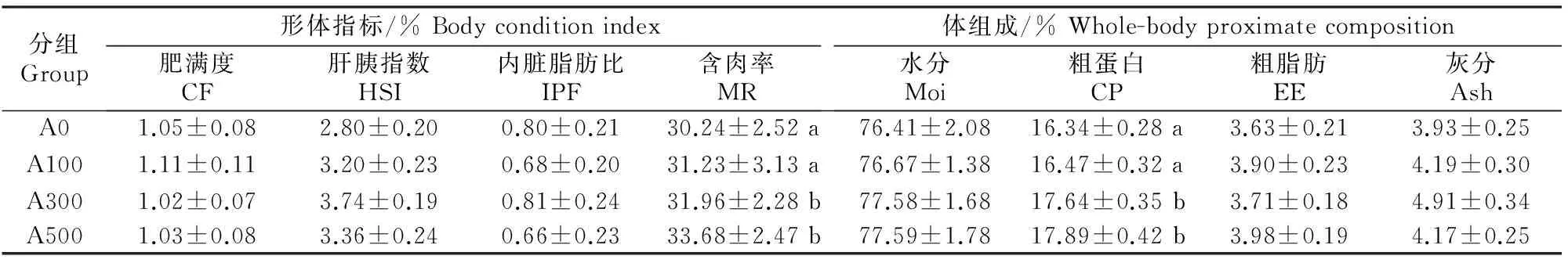
表 3 抗菌肽对红姑鱼形体指标和体组成的影响
2.3 抗菌肽对红姑鱼血清激素水平的影响
2.3.1 养殖期间 由表4可以看出,养殖试验第4,6和8周末,AMPs对红姑鱼血清生长激素(GH)水平无显著影响(P>0.05);除第4周A300组T4含量与A0组无显著差异(P>0.05)外,A300和A500组血清T3、T4和IGF-I水平显著高于A0组(P<0.05)。
2.3.2 停饲后不同时间 停饲后不同时间抗菌肽对红姑鱼血清激素水平的影响见图1~4。

表 4 抗菌肽对红姑鱼血清激素水平的影响
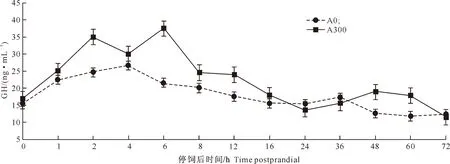
图 1 抗菌肽对红姑鱼血清中生长激素变化的影响
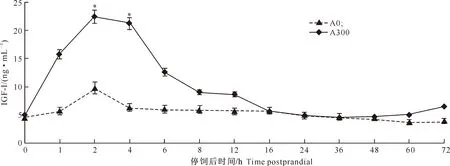
*表示该时间点有显著性差异(P<0.05)。下图同
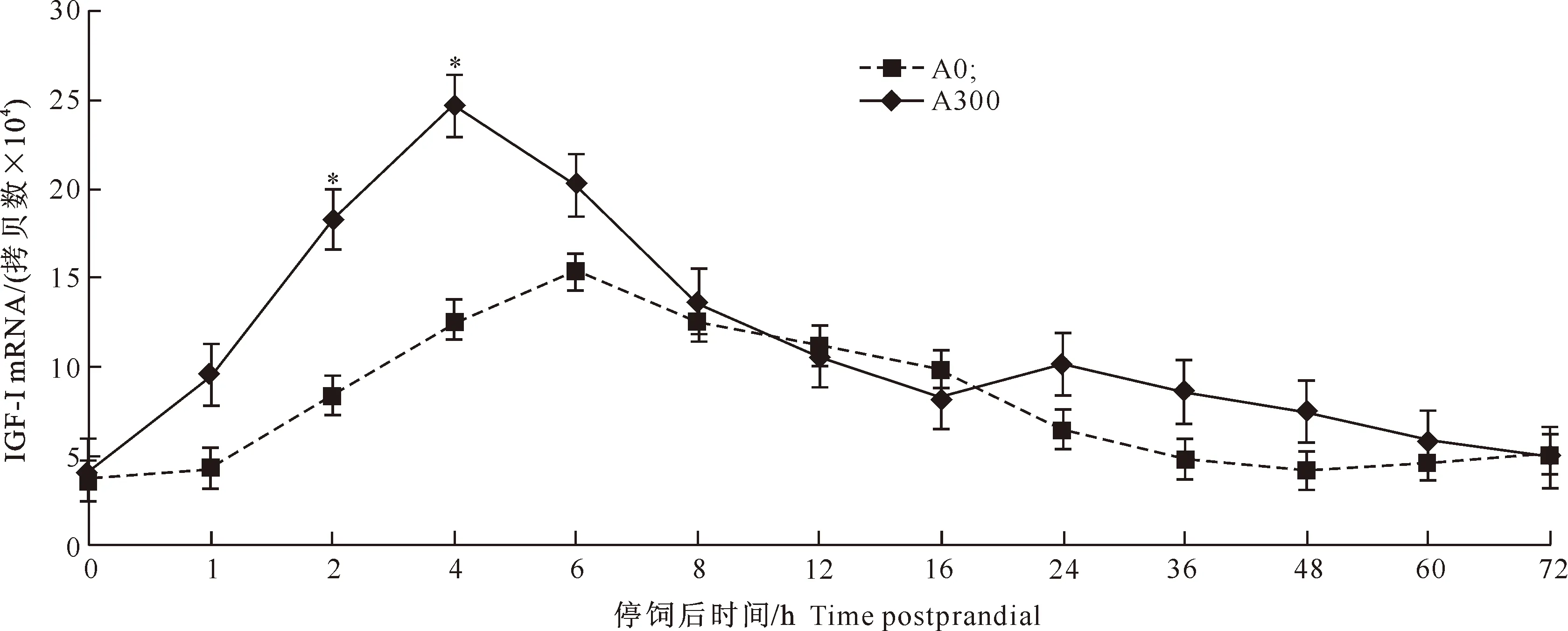
图 3 抗菌肽对红姑鱼肝脏中IGF-I mRNA丰度变化的影响
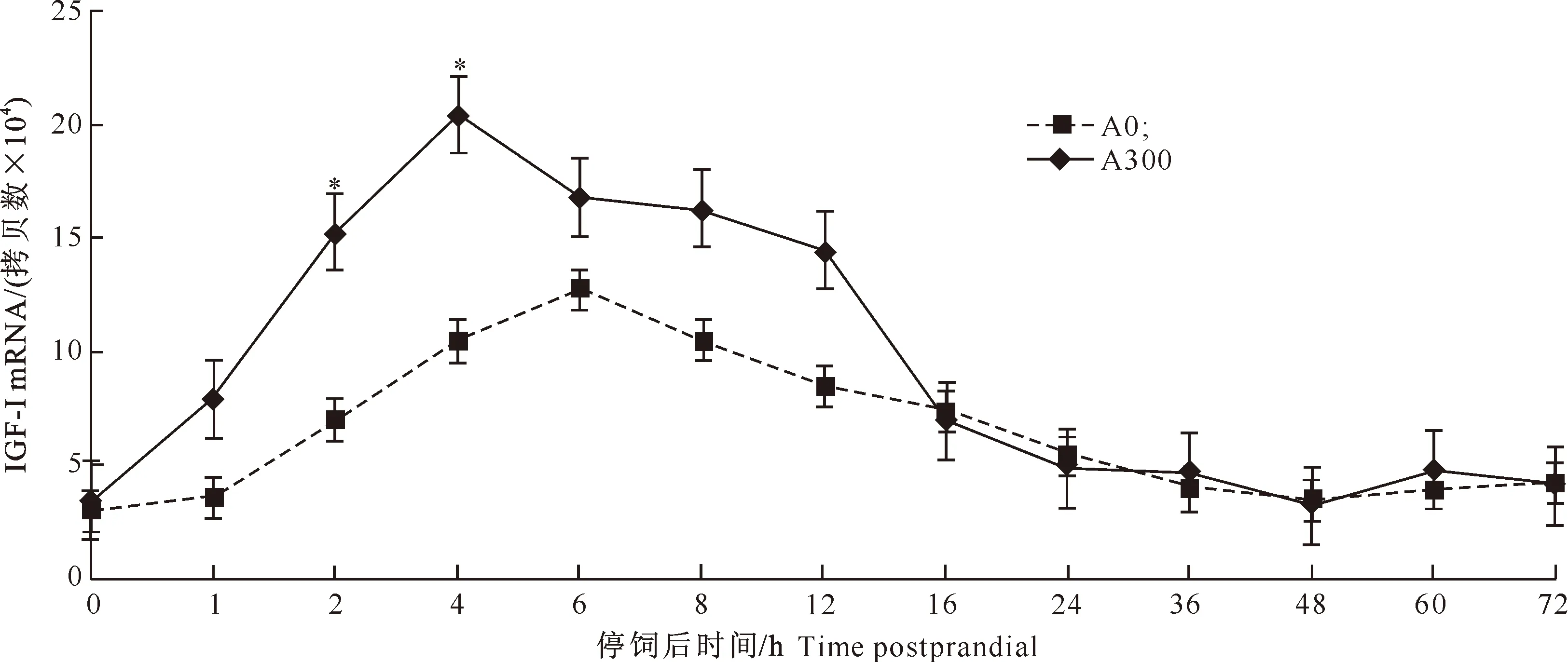
图 4 抗菌肽对红姑鱼肌肉中IGF-I mRNA丰度变化的影响
由图1~4可以看出,在红姑鱼停饲后72 h内的各时间点,A300组的血清GH含量与A0组均无显著差异(P>0.05),但停饲后16 h内,A300组血清GH含量均高于A0组,并在6 h时达峰值,随后缓慢下降。A300组的血清IGF-I含量在停饲后16 h内均高于A0组,并在2 h达峰值,且2 h和4 h时的血清IGF-I含量显著高于A0组(P<0.05)。A300组的肝脏和肌肉IGF-I mRNA的表达量在停饲后4 h达峰值,且2 h和4 h时表达量显著高于A0组(P<0.05)。
3 讨 论
抗菌肽的相对分子质量一般为 2 000~7 000 U,由20~60个氨基酸残基组成[19-21];这类活性多肽多数具有强碱性、热稳定性及广谱抗菌等特点,对正常的真核细胞几乎无作用,仅作用于原核细胞和发生病变的真核细胞,并且与传统抗生素阻断细菌大分子生物合成的作用机制完全不同,病原菌不易对其产生耐药性,具有独特的研究和应用价值[6]。宋理平等[8]在凡纳滨对虾饲料中添加10 g/kg抗菌肽后,发现对虾的增重率和成活率都有显著提高。林鑫等[10]在饲料中添加0.15 g/kg的抗菌肽后,锦鲤的末体质量和特定生长率显著提高。王自蕊等[12]在饲料中添加2.5 g/kg的天蚕素抗菌肽,湘云鲫增重率、特定生长率及肥满度都显著高于对照组。姜珊等[22]研究发现,饲料中添加0.005~0.01 g/kg抗菌肽可以显著提高罗非鱼的增重率、红细胞总数以及过氧化氢酶活性;当添加量为0.05 g/kg时,特定生长率最高,肝脏的超氧化物歧化酶与血清中溶菌酶活性较对照组显著降低。但夏耘等[11]在饲料中添加0.3 g/kg的抗菌肽,发现其对花鲈生长和饲料利用都无显著影响。本试验发现,饲料中添加0.3~0.5 g/kg抗菌肽后,红姑鱼增重率、饲料效率、蛋白贮积率和成活率等指标均显著提高。
柴仙琦等[9]在凡纳滨对虾饲料中添加0.3 g/kg的抗菌肽后,虾体增重率、成活率、饲料利用率和肌肉粗脂肪含量均显著提高。但本试验发现,添加抗菌肽并未显著影响红姑鱼的肥满度、肝胰指数及鱼体脂肪含量。这可能是抗菌肽对甲壳动物与脊椎动物的作用机理不同所致。
调节生长性能的内分泌激素主要有生长激素(GH)、类胰岛素样生长因子I(IGF-I)和甲状腺素(T3和T4)等[23]。鱼类内分泌系统对营养摄入的变化非常敏感,营养因素在调控鱼类激素的合成与分泌中发挥着重要作用[24]。硬骨鱼的能量代谢与生长是通过一个复杂的内分泌系统来调节的,内分泌系统中包括各种激素,其中血清GH与IGF-I发挥着重要作用。对哺乳动物的研究发现,使用垂体可以引起GH分泌量增加,水产动物上也观察到类似情况[23,25]。GH与IGF-I具有代谢调节和生长促进功能,GH可以刺激肝脏中IGF-I分泌,而IGF-I水平又转而调节GH的合成与释放[26]。本试验采集了第4,6和8周停饲后红姑鱼血清,测定了单一时间点GH和IGF-I的变化,但这可能不能全面反映抗菌肽对血清激素分泌的影响。因此,试验结束后采集了72 h内多个时间点的血清样本,结果发现,血清GH水平与红姑鱼生长性能和饲料利用率等无显著相关性。强俊等[27]在研究温度与饲料蛋白对罗非鱼血清GH的影响时也发现同一现象,而王桂芹等[28]发现翘嘴鲌(E.ilishaeformis)血清GH水平与生长性能呈负相关。由此推测,GH对翘嘴鲌生长调节作用尚不能确证。邓利等[29]也认为,血清GH并非直接调控生长,其促生长作用还取决于循环GH的清除率、GH靶组织上GH受体数量和亲和力的变化以及与IGF-I的相互作用等。
GH可以调控IGF-I的含量,而IGF-I则通过调控转录模板DNA含量、转录效率和翻译水平等影响蛋白质合成,从而实现对鱼体蛋白质的调控[30]。血清IGF-I水平通常与生长呈正相关。本试验发现,抗菌肽对红姑鱼血清IGF-I水平具有显著影响,血清IGF-I水平随抗菌肽添加量的增加而提高。
甲状腺激素是鱼类生长、发育和繁殖的重要调控因子,其分泌受到内分泌和营养、环境等因素的影响和调控。甲状腺激素是以T3、T4形式释放入血。甲状腺主要分泌T4进入血清到肝脏,通过肝脏5′D单脱碘酶脱碘转化为T3。甲状腺激素中T3较容易进入细胞,并与核受体结合,且在体内的更新较T4快。故T3更能代表甲状腺的功能,是体内发挥效能的主要甲状腺激素。本试验发现,添加0.3 g/kg抗菌肽对红姑鱼血清T3、T4含量有显著提高,这可能是其影响红姑鱼生长的机制之一。
Brown等[31]发现,随着T3水平的提高,细胞内mRNA和RNA聚合酶含量、蛋白质的合成代谢提高,分解代谢降低,氨基酸的吸收增加,从而促进鱼体生长。T3可提高罗非鱼肝脏IGF-I mRNA的表达,进而促进其生长[32]。本研究发现,抗菌肽对红姑鱼肝脏和肌肉中IGF-I mRNA的表达丰度有显著提高。但目前关于抗菌肽对生长激素和甲状腺激素分泌及其基因表达影响的研究尚未见报道,而激素类物质的分泌与调控对生长的影响非常复杂,可能还有其他因素参与,需要进一步研究确认。本试验发现,抗菌肽的添加使红姑鱼肝脏和肌肉中IGF-I mRNA表达丰度在停饲后快速提高。这提示在水产动物中IGF-I的表达、分泌机制可能独立于GH的调控,在以往的研究中较少进行连续取样测定,可能错过这样的结果判断[33-34]。
4 结 论
(1)饲料中添加抗菌肽(0.3~0.5 g/kg)可促进红姑鱼的生长,提高饲料效率和鱼体含肉率,以0.3 g/kg为宜。
(2)抗菌肽与内源生长激素(GH)的分泌无正相关性。
(3)抗菌肽可迅速提高红姑鱼组织中IGF-I mRNA的表达丰度,促进IGF-I的快速分泌,从而促进对蛋白质的合成代谢能力,进而提高动物的生长性能。
[1] 陆彤霞.美国红鱼的生物学特性、人工育苗及病害防治技术 [J].海洋渔业,2003,25(1):34-36.
Lu T X.Biological characteristics,artificial breeding and diseases control ofSciaenopsocellatus[J].Marine Fisheries,2003,25(1):34-36.
[2] 周立斌,王安利,马细兰,等.饲料中铁对美国红鱼(Sciaenopsocellatus)生长和免疫的影响 [J].海洋与湖沼,2009,40(5):663-668.
Zhou L B,Wang A L,Ma X L,et al.Effects of dietary iron on growth and immune response of red drumSciaenopsocellatus[J].Oceanologia et Limnologia Sinica,2009,40(5):663-668.
[3] 周飘苹,金 敏,吴文俊,等.不同养殖模式、投喂不同饵料及不同品系大黄鱼营养成分比较 [J].动物营养学报,2014,26(4):969-980.
Zhou P P,Jin M,Wu W J,et al.Comparison of nutrient components of large yellow croaker (Pseudosciaenacrocearichardson) cultured in different modes,fed different feeds and from different strains [J].Chinese Journal of Animal Nutrition,2014,26(4):969-980.
[4] 陈国伟,许曹鲁,叶海滨,等.温度和pH对美国红鱼蛋白酶和淀粉酶活力的影响 [J].现代渔业信息,2011(2):13-16.
Chen G W,Xu C L,Ye H B,et al.Effects of temperature and pH value on activities of protease and amylase inSciaenopsocellatus[J].Modern Fisheries Information,2011(2):13-16.
[5] 马爱敏,闫茂仓,常维山,等.5种中草药对美国红鱼生长和免疫机能的影响 [J].海洋科学,2009(12):96-102.
Ma A M,Yan M C,Chang W S,et al.Effects of Chinese herbs on the growth and immune function inSciaenopsocellatus[J].Marine Science,2009(12):96-102.
[6] 庹晓晔,柴家科.抗菌肽的基因工程研究进展 [J].生物技术通讯,2007,18(2):298-300.
Tuo X Y,Chai J K.Research progress in gene engineering of antimicrobial peptides [J].Letters in Biotechnology,2007,18(2):298-300.
[7] 柴仙琦,冷向军.抗菌肽在凡纳滨对虾饲料中的应用研究 [J].养殖与饲料,2012(9):99-100.
Chai X Q,Leng X J.Research and application of antibacterial peptide inLitopenaeusvannamei[J].Culture and Feed,2012(9):99-100.
[8] 宋理平,胡 斌,王爱英,等.抗菌肽对凡纳滨对虾生长和机体免疫的影响 [J].广东海洋大学学报,2010,30(3):28-32.
Song L P,Hu B,Wang A Y,et al.Effects of antibacterial peptide on growth and immunity ofPenaeusvannamei[J].Journal of Guangdong Ocean University,2010,30(3):28-32.
[9] 柴仙琦,冷向军,李小勤,等.抗菌肽对凡纳滨对虾生长和血清非特异性免疫指标的影响 [J].淡水渔业,2012,42(4):59-62.
Chai X Q,Leng X J,Li X Q,et al.Effect of antibacterial peptide on growth and serum non-specific immunity ofLitopenaeusvannamei[J].Freshwater Fisheries,2012,42(4):59-62.
[10] 林 鑫,毛述宏,杨 阳,等.饲料中添加抗菌肽对锦鲤生长、非特异性免疫力和抗病力的影响 [J].动物营养学报,2013,25(8):1860-1865.
Lin X,Mao S H,Yang Y,et al.Effects of antimicrobial peptides supplementation on growth,non-specific immunity and disease resistance of koi(Cyprinuscarpiokoi) [J].Chinese Journal of Animal Nutrition,2013,25(8):1860-1865.
[11] 夏 耘,余德光,郁二蒙,等.饲料中添加抗菌肽和枯草芽孢杆菌对花鲈生长和非特异性免疫功能的影响 [J].淡水渔业,2012,42(1):52-57.
Xia Y,Yu D G,Yu E M,et al.Effects of dietary antimicrobial peptide andBacillussubtilison growth performance and non-specific immunity ofLateolabraxjaponicus[J].Freshwater Fisheries,2012,42(1):52-57.
[12] 王自蕊,谯仕彦,李 波,等.饲料中添加天蚕素抗菌肽对湘云鲫生长性能、非特异性免疫功能及抗病力的影响 [J].动物营养学报,2014,26(7):1856-1863.
Wang Z R,Qiao S Y,Li B,et al.Effects on growth performance,no-specific immunity and disease resistance ofTriploidcruciancarp [J].Chinese Journal of Animal Nutrition,2014,26(7):1856-1863.
[13] Basiron Y,Industrial E B.Official methods of analysis of the association of official analytical chemists [M].Washington:AOAC,1995.
[14] Loter T C,MacKenzie D S,McLeese J,et al.Seasonal changes in channel catfish thyroid hormones reflect increased magnitude of daily thyroid hormone cycles [J].Aquaculture,2007,262(2):451-460.
[15] Cohn W B,Jones R A,Valverde R A,et al. Molecular cloning and regulation of mRNA expression of the thyrotropin β and glycoprotein hormone α subunits in red drum,Sciaenopsocellatus[J].Fish Physiology and Biochemistry,2010,36(4):1277-1290.
[16] Drennon K,Moriyama S,Kawauchi H,et al.Development of an enzyme-linked immunosorbent assay for the measurement of plasma growth hormone (GH) levels in channel catfish (Ictaluruspunctatus):assessment of environmental salinity and GH secretogogues on plasma GH levels [J].General and Comparative Endocrinology,2003,133(3):314-322.
[17] Small B C,Peterson B C.Establishment of a time-resolved fluoroimmunoassay for measuring plasma insulin-like growth factor I (IGF-I) in fish:effect of fasting on plasma concentrations and tissue mRNA expression of IGF-I and growth hormone (GH) in channel catfish (Ictaluruspunctatus) [J].Domestic Animal Endocrinology,2005,28(2):202-215.
[18] Peterson B,Bilodeau-Bourgeois A,Small B.Response of the so-matotropic axis to alterations in feed intake of channel catfish (Ictaluruspunctatus) [J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2009,153(4):457-463.
[19] Moon H Y,Gatlin D M.Total sulfur amino acid requirement of juvenile red drum,Sciaenopsocellatus[J].Aquaculture,1991,95(1):97-106.
[20] Gazit E,Miller I R,Biggin P C,et al.Structure and orientation of the mammalian antibacterial peptide cecropin P1 within phospholipid membranes [J].Journal of Molecular Biology,1996,258(5):860-870.
[21] Ganz T,Lehrer R I.Antibiotic peptides from higher eukaryo-tes:biology and applications [J].Molecular Medicine Today, 1999,5(7):292-297.
[22] 姜 珊,王宝杰,刘 梅,等.饲料中添加体质量组抗菌肽对吉富罗非鱼生长性能及免疫力的影响 [J].中国水产科学,2011,18(6):1308-1314.
Jiang S,Wang B J,Liu M,et al.Effects of recombinant antimicrobial peptides on growth and immunity in tilapia(GIFT) [J].Journal of Fishery Sciences of China,2011,18(6):1308-1314.
[23] Zhang W M,Lin H R,Peter R.Episodic growth hormone secretion in the grass carp,Ctenopharyngodonidellus(C.&V.) [J].General and Comparative Endocrinology,1994,95(3):337-341.
[24] 聂国兴,王俊丽,周洪琪.饲料中添加木聚糖酶对尼罗罗非鱼生长及血清激素水平的影响 [J].中国水产科学,2007,14(2):249-256.
Nie G X,Wang J L,Zhou H Q.Effects of xylanase on growth and levels of serum hormones ofTilapianilotica[J].Journal of Fishery Sciences of China,2007,14(2):249-256.
[25] Benedet S,Andersson E,Mittelholzer C,et al.Pituitary and pl-asma growth hormone dynamics during sexual maturation of femaleAtlanticsalmon[J].General and Comparative Endocrinology,2010,167(1):77-85.
[26] Planas J V,Méndez E,Banos N,et al.Insulin and IGF-I receptors in trout adipose tissue are physiologically regulated by circulating hormone levels [J].Journal of Experimental Biology,2000,203(7):1153-1159.
[27] 强 俊,杨 弘,王 辉,等.温度与饲料蛋白质水平对吉富品系尼罗罗非鱼 (Oreochromisnilotica) 幼鱼生长和血清生长激素水平的影响 [J].动物营养学报,2012,24(8):1589-1601.
Qiang J,Yang H,Wang H,et al.Temperature and dietary protein level affect growth and serum growth hormone level in GIFT NILE tilapia juvenile(Oreochromisnilotica) [J].Chinese Journal of Animal Nutrition,2012,24(8):1589-1601.
[28] 王桂芹,周洪琪,陈建明,等.饲料蛋白对翘嘴鲌生长和内分泌激素的影响 [J].水生生物学报,2008,32(4):544-550.
Wang G Q,Zhou H Q,Chen J M,et al.Effect of dietary protein on growth and hormone of culter alburnus juveniles [J].Acta Hydrobiologica Sinica,2008,32(4):544-550.
[29] 邓 利,郑汉其.黑鲷生长激素及其受体的季节变化 [J].水产学报,2001,25(3):203-208.
Deng L,Zheng H Q.Seasonal variations of serumgrowth hormone receptors growth hormone levels andin sparus macrocephalus [J].Journal of Fisheriks of China,2001,25(3):203-208.
[30] 冯仁勇,周小秋,林 燕.类胰岛素样生长因子I对鱼类氮代谢的影响 [J].动物营养学报,2006,18(S1):372-377.
Feng R Y,Zhou X Q,Lin Y.Effects of insulin-like growth factor I on nitrogen metabolism of fish [J].Chinese Journal of Animal Nutrition,2006,18(S1):372-377.
[31] Brown J G,Bates P C,Holliday M A,et al.Thyroid hormones and muscle protein turnover:the effect of thyroid-hormone deficiency and replacement in thryoidectomized and hypophysectomized rats [J].Biochem J,1981,194:771-782.
[32] Schmid A C,Lutz I,Kloas W,et al.Thyroid hormone stimulates hepatic IGF-I mRNA expression in a bony fish,the tilapiaOreochromismossambicus,invitroandinvivo[J].General and Comparative Endocrinology,2003,130(2):129-134.
[33] Gómez-Requeni P,Mingarro M,Calduch-Giner J,et al.Protein growth performance,amino acid utilisation and somatotropic axis responsiveness to fish meal replacement by plant protein sources in gilthead sea bream (Sparusaurata) [J].Aquaculture,2004,232(1):493-510.
[34] Pierce A L,Beckman B R,Shearer K D,et al.Effects of ration on somatotropic hormones and growth in coho salmon [J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2001,128(2):255-264.
Effects of antimicrobial peptide on growth and serum hormone levels of red drum juvenile
ZHENG Zonglin1,2,ZHAO Yongzhi3,SERGIO Castillo2
(1FisheriesBreedingandHealthyCultivationResearchCentre,SouthwestUniversity,Chongqing402460,China; 2DepartmentofWildlifeandFisheriesSciences,TexasA&MUniversity,CollegeStation,Texas,77843-2258USA;3SuzhouHitechBio-techCo.Ltd.,Suzhou,Jiangsu215100,China)
【Objective】 This study investigated the effects of AMPs supplement to diet on growth performance and serum hormones of juvenile red drum,Sciaenopsocellatus.【Method】 Tested diets were mixed with different levels of antimicrobial peptide (AMPs,0,0.1,0.3 and 0.5 g/kg) as treatments of A0,A100,A300 and A500.S.ocellatuswith initial body weight of (1.57±0.17) g were fed for 8 weeks,and the growth,serum hormones (GH,T3,T4,and IGF-I) and serum hormone levels and IGF-I mRNA expression in muscle and liver at different days after stopping feeding were determined. 【Result】 A300 and A500 diets promoted the relative weight gain (RWG),feed efficiency ratio (FCR) and protein efficiency ratio (PER) significantly (P<0.05),and protein retention (PR) and survival rate of A100,A300 and A500 diets were significantly higher than A0 diet (P<0.05).Muscle retention (MR) and whole-body crude protein (CP) of A300 and A500 diets were increased significantly compared to A0 diet (P<0.05).AMPs had no significant effect on serum GH level (P>0.05).AMPs enhanced serum T3and T4and IGF-I concentration of A300 and A500 diets significantly compared to A0 (P<0.05).After postprandial,serum was sampled in 72 h continuously,IGF-I of 2 h samples reached the peak in A300 diet,and IGF-I of the samples in the 2 h and 4 h period were significantly higher than A0 diet (P<0.05).Expressions of IGF-I mRNA in liver and muscle of A300 reached the peak in 4 h,and significantly (P<0.05) higher than A0 diet.【Conclusion】 The inclusion of 0.3 g/kg AMPs in diet could enhance the growth performance,feed efficiency and muscle ratio.AMPs had no positive correlation with serum GH concentration but it increased serum IGF-I concentration and expression of IGF-I mRNA in muscle and liver.
red drum (Sciaenopsocellatus);antimicrobial peptide;growth performance;plasma hormone;IGF-I mRNA
时间:2016-10-09 10:08
10.13207/j.cnki.jnwafu.2016.11.004
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20161009.1008.008.html
2015-06-18
中央高校基本科研业务费项目(XDJK2014C056);西南大学博士基金项目(SWU114025)
郑宗林(1978-),男,重庆荣昌人,副教授,博士,硕士生导师,主要从事水产动物疾病控制与营养研究。 E-mail:zhengzonglin@126.com
S965.337.3
A
1671-9387(2016)11-0023-08
