乙肝相关肝癌患者肝组织硬脂酰-辅酶A脱氢酶的表达与预后的相关性
2016-12-16林晓平汪珍光孙金海
林晓平, 汪珍光, 孙金海
1.第二军医大学卫生勤务学系军队健康管理学教研室,上海 200433
2.第二军医大学基础医学部,上海 200433
3.第二军医大学东方肝胆外科医院胆道三科,上海 200433
·论 著·
乙肝相关肝癌患者肝组织硬脂酰-辅酶A脱氢酶的表达与预后的相关性
林晓平1,2, 汪珍光3, 孙金海1*
1.第二军医大学卫生勤务学系军队健康管理学教研室,上海 200433
2.第二军医大学基础医学部,上海 200433
3.第二军医大学东方肝胆外科医院胆道三科,上海 200433
目的: 探讨乙肝相关肝癌组织中硬脂酰-辅酶A脱氢酶(stearoyl-CoA desaturase, SCD)的表达水平及临床意义。方法: 构建176例距离肝癌边界3 cm以上肝组织的组织芯片,应用免疫组化技术检测SCD的表达水平,并分析其与临床病理学特征之间的关系。结果: SCD在乙肝相关肝癌患者肝组织中的阳性率为85.80%(151/176)。且肝组织中SCD表达量与肿瘤数目、微血管侵犯、肝硬化等相关(P<0.05),SCD高水平表达组患者无瘤生存时间和总体生存时间均短于SCD低水平表达组。结论: SCD在乙肝相关肝癌患者肝组织中的表达量与临床病理及不良预后之间存在一定联系,提示肝癌患者肝组织中SCD的表达量可以作为不良预后的标志物。
肝癌;SCD;组织芯片;免疫组化
根据2014年世界卫生组织报告,我国肝癌新增病例数和死亡病例数均居世界首位。最近的研究表明与肥胖相关的非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)不仅可导致肝癌,且肥胖相关的肝癌与丙肝病毒感染导致的肝癌相比预后更差[1]。与肥胖相关的非酒精性脂肪肝组织中,由于脂肪沉积,肝脏星状细胞被激活。一方面,活化的星状细胞会激活肝脏组织中的巨噬细胞,促进炎症;另一方面,激活的星状细胞会直接调控肝细胞,促进其发生表皮间质样转化,从而加速肝癌的发生、发展过程[2]。可见,肝细胞的脂肪代谢的异常与肝癌的发生、发展有着密切的关系。肝癌患者手术后残存肝组织中的肝细胞肩负着分裂增殖、恢复肝脏重量及功能的重任,肝细胞脂肪代谢的紊乱无疑会影响这一过程。此外,手术后残存的肝组织也提供了肝癌复发的微环境,是“种子肿瘤细胞”生根发芽的“土壤”,紊乱的肝细胞脂肪代谢会参与其“微环境”的构建。因此,肝癌病人手术后残存肝组织中肝细胞脂肪代谢的关键调控基因的表达变化可能会对患者手术后的预后产生较大的影响。
硬脂酰-辅酶A脱氢酶(stearoyl-CoA desaturase, SCD)是催化饱和脂酰辅酶A生成单不饱和脂酰辅酶A的关键酶[3-4]。高热量饮食[5]、运动、激素等因素均影响SCD的表达水平。调控SCD蛋白表达水平或者是蛋白活性会导致细胞内饱和与单不饱和脂肪酸比例的调整,从而进一步影响整个机体的脂质代谢。有研究结果显示,肥胖以及肝细胞中脂肪累积与肝细胞中SCD的表达水平呈正相关[6-7]。SCD作为脂肪酸合成的关键调控基因,与肿瘤的发生、发展关系密切,参与肿瘤发展的多个方面,包括细胞增殖、细胞周期、凋亡、炎症反应等[8-10]。肿瘤细胞中降低SCD的表达能够诱导凋亡,抑制多种不同类型肿瘤生长[11-12]。尽管近期有研究表明与癌旁组织比较,SCD在肝癌组织中表达量增高,且其表达量与肝癌患者的预后相关[13],但肝癌患者手术后残存肝组织中SCD的表达量是否影响患者预后仍没有定论。
本研究将探讨肝癌患者手术后残存肝组织中肝细胞SCD的表达对肝癌患者根治性切除术后肿瘤复发和患者生存时间的影响,明确肝癌患者肝组织中SCD高表达是否为肝癌切除术后复发和死亡的危险因素,为肝癌患者肝癌切除术后健康管理措施的制定提供理论依据。
1 材料与方法
1.1 标本来源及随访 收集在上海东方肝胆外科医院进行肝切除的176例乙肝相关肝癌患者的资料,包括手术时身高、体质量、年龄、性别、肝硬化及肝炎史、甲胎蛋白(alpha fetoprotein, AFP)的大小及数目、癌栓、肿瘤分期等资料。术后1个月复查肝功能、AFP、乙肝病毒的脱氧核糖核酸(HBV-DNA)、肝脏增强磁共振,以后每3个月复查肝功能、AFP、HBV-DNA、B超,每6个月复查核磁共振、胸片。
1.2 组织芯片的构建 选取远离肝癌边界的(>3 cm)肝组织作为实验样品。组织芯片由上海芯超生物科技有限公司协助制作,具体步骤包括:将组织阵列仪设计重提的组织阵列块放置于52℃烤箱中加热融合,采用全自动组织切片机以4 μm/rad进行切片,切片裱附在防脱载玻片上,并置于60℃恒温烤箱中16 h,最后于4℃冰箱中保存。
1.3 免疫组织化学术检测SCD的表达 免疫组织化学染色按照链霉菌抗生物素蛋白-过氧化物酶连结法(SP法)标准操作步骤进行。抗SCD单克隆抗体(HPA012107, Sigma-Aldrich)及二抗均购自sigma公司。结果判断由3位病理科医生完成,按目标蛋白染色程度分为无(切片上的染色为无色,-)、轻度(切片上的染色为浅黄色,+)、中度(切片上的染色为棕黄色,)和重度染色(切片上的染色为深棕色,)。
1.4 测量方法 测量身高、体质量:入院时,患者着轻便衣服接受身高、体质量的测量,身高以m为单位,记小数点后2位,体质量以kg为单位,精确到0.5 kg。根据身体质量指数(body mass index, BMI)=体质量(kg)/身高2(m2),计算出患者的身体质量指数值。
1.5 统计学处理 统计数据采用SPSS 17.0软件处理,分层变量比较采用χ2检验。生存检验采用Kaplan-Meirer和Log-rank检验。检验水准(α)为0.05。
2 结 果
2.1 SCD在肝癌患者肝组织中的表达 乙肝相关肝癌癌旁组织中SCD蛋白的阳性信号主要集中在细胞质中(图1),偶尔也可见部分细胞核中阳性表达。176例组织中检测出SCD的阳性表达率为85.80%(151/176)。

图1 SCD在原发性肝癌癌旁肝组织中的表达(SP法)
2.2 肝癌患者肝组织中SCD表达与临床病理特征的关系 根据176例乙肝相关肝癌癌旁组织中SCD的阳性表达水平,将患者分成SCD高水平组(染色程度为中度和重度染色,n=75)和低水平组(染色程度为无和轻度,n=101),比较两组患者之间性别、年龄、肿瘤大小、肿瘤数量、分化程度、微血管癌栓的差异情况,发现两组患者肝硬化、微血管癌栓、肿瘤数目有显著差异(表1)。肿瘤数目为多个(≥2)的比例,SCD高水平组(18/75=24.00%)高于SCD低水平组(12/101=11.88%);有微血管侵犯的比例,SCD高水平组(20/75=26.67%)高于SCD低水平组(13/101=12.87%);而发生肝硬化的比例则是,SCD高水平组(16/75=21.33%)低于SCD低水平组(41/101=40.59%),说明癌旁组织中SCD高水平表达与肿瘤数目多、发生微血管侵犯呈正相关,而与肝硬化的发生呈负相关。
2.3 肝癌患者肝组织中SCD表达与患者手术后预后的关系 在预后方面,肝组织中SCD高水平组病人的无瘤生存时间和总体生存时间均短于SCD低水平组,见图2。
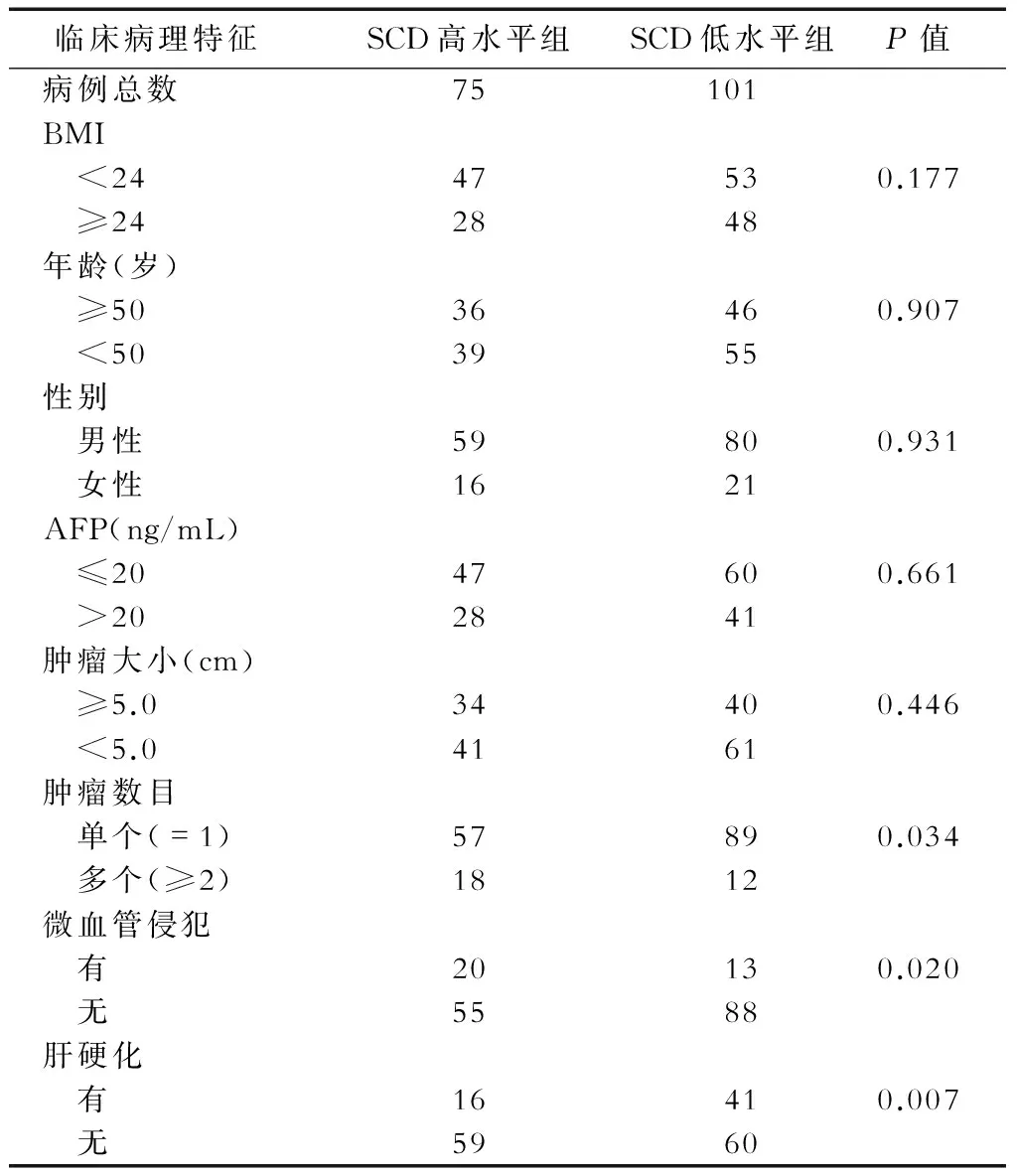
表1 肝癌患者肝组织中SCD表达水平与临床病理特征间的关系
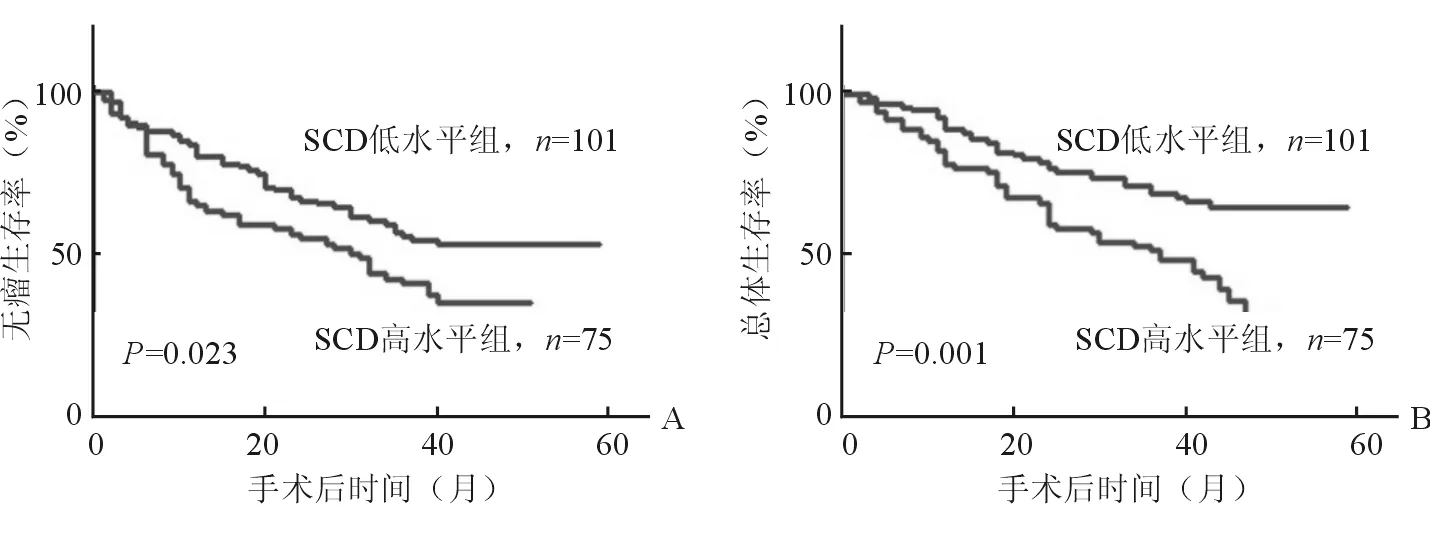
图2 在预后方面,SCD蛋白表达高水平组的无瘤生存时间(A)和总体生存时间(B)均要短于SCD蛋白表达低水平组
3 讨 论
我国肝癌患者大部分来自于慢性乙肝患者,应该重视慢性乙肝-肝硬化-肝癌的全过程、全方位的健康管理,肝癌复发率很高,对经过治疗的患者的健康管理同样重要。目前我国肝癌患者的健康管理水平与肝癌发病大国的状况是不相适应的,在肝癌患者临床治疗期间的健康管理工作中还有很多问题需要深入研究。特别是肝癌患者手术切除后的健康管理和健康指导,需要整合基础科研的肝癌分子分型研究、临床循证医学研究和流行病学调查等方面的成果。
乙型肝炎病毒(hepatitis b virus, HBV)的慢性感染是导致肝细胞癌变最重要的原因。近年来的相关研究结果表明,HBV可通过多种途径对人肝细胞的功能产生诸多影响。对HBV转基因鼠肝脏组织的蛋白质组学以及代谢组学的研究结果表明,HBV抗原的表达会导致肝细胞脂肪酸代谢紊乱[14]。伴随着感染肝细胞组装并分泌完整HBV病毒颗粒,肝细胞膜的丢失非常明显,从而需要肝细胞大量合成新的细胞膜。众所周知,细胞膜的主要结构是脂质双分子层,因此细胞膜的更新会在一定程度上促进脂肪酸合成与代谢的活跃。此外,随着肥胖、高脂血症和糖尿病等代谢性疾病的全球化流行,NAFLD已成为目前对人类健康损害最严重的问题之一。据保守估计,全世界约有10亿人口患有NAFLD,在生活水平相对较高的西方发达国家,该疾病的流行更是明显,约有1/3的人口罹患该病[15]。Ascha等研究者近3年的随访数据表明,非酒精性脂肪性肝炎导致的肝硬化患者中约有12.8%的患者会进展为肝癌[16]。可见,在肝癌的发生、发展过程中,肝细胞脂肪代谢紊乱起到重要作用[17]。而通过控制饮食、增加有氧运动等可行健康管理措施调整慢性乙型肝炎患者及肝癌患者肝细胞的脂肪代谢程度,可能会延缓疾病的进展,改善其预后。本研究之所以选择肝癌手术病人远离癌边界(距离边界3 cm以上)的肝组织(接近于手术后的残存肝组织)进行研究,是基于肝癌的复发主要有两种可能:一种是可能残存的肝细胞重新“癌化”生成了一个“新的”肝癌,此时,残存肝组织中的肝细胞基因表达的异常及功能改变实际上提供了其向癌细胞转变的基础;另一种可能是隐藏于残存肝组织中的“少量癌细胞”增殖成为“肝内转移性”肝癌,在这种情况下,残存肝组织中的肝细胞参与构建的“微环境”对其增殖等变化有重要影响。因此,肝癌病人手术后残存肝组织中肝细胞是影响其复发的重要因素。本研究主要是在肝癌手术病人远离(距离边界3 cm以上)癌边界的肝组织中检测脂肪代谢关键酶SCD的表达,发现其在残存肝组织中的表达量越低,病人手术后的无瘤生存时间和整体生存时间就越长,预后越好。综上所述,肝脏细胞脂肪代谢关键酶SCD在肝癌患者手术后残存肝组织的表达与肝癌的临床病理学特征之间存在相关性,提示其在肝癌复发中起一定作用。因此,研究及检测SCD在肝癌患者手术后残存肝组织的表达,对肝癌的治疗以及判断预后具有一定的临床意义,可将SCD作为肝癌发展、转移及预后的评估指标。
[ 1 ] Piscaglia F, Svegliati-Baroni G, Barchetti A, et al. Clinical patterns of hepatocellular carcinoma in nonalcoholic fatty liver disease: A multicenter prospective study[J]. Hepatology, 2016,63(3):827-838.
[ 2 ] Benbow JH, Thompson KJ, Cope HL, et al. Diet-Induced Obesity Enhances Progression of Hepatocellular Carcinoma through Tenascin-C/Toll-Like Receptor 4 Signaling[J]. Am J Pathol, 2016,186(1):145-158.
[ 3 ] Flowers MT, Ntambi JM. Stearoyl-CoA desaturase and its relation to high-carbohydrate diets and obesity[J]. Biochim Biophys Acta, 2009,1791(2):85-91.
[ 4 ] Smith SB, Kawachi H, Choi CB, et al. Cellular regulation of bovine intramuscular adipose tissue development and composition[J]. J Anim Sci, 2009,87(14 Suppl):E72-E82.
[ 5 ] Schwenk RW, Jonas W, Ernst SB, et al. Diet-dependent alterations of hepatic SCD expression are accompanied by differences in promoter methylation[J]. Horm Metab Res,2013,45(11):786-794.
[ 6 ] Kotronen A, Seppänen-Laakso T, Westerbacka J, et al. Hepatic stearoyl-CoA desaturase (SCD)-1 activity and diacylglycerol but not ceramide concentrations are increased in the nonalcoholic human fatty liver[J]. Diabetes, 2009,58(1):203-208.
[ 7 ] García-Serrano S, Moreno-Santos I, Garrido-Sánchez L, et al. Stearoyl-CoA desaturase-1 is associated with insulin resistance in morbidly obese subjects[J]. Mol Med, 2011,17(3-4):273-280.
[ 8 ] Huang GM, Jiang QH, Cai C, et al. SCD negatively regulates autophagy-induced cell death in human hepatocellular carcinoma through inactivation of the AMPK signaling pathway[J]. Cancer Lett, 2015,358(2):180-190.
[ 9 ] Igal RA. Stearoyl-CoA desaturase-1: a novel key player in the mechanisms of cell proliferation, programmed cell death and transformation to cancer[J]. Carcinogenesis, 2010,31(9):1509-1515.
[10] von Roemeling CA, Marlow LA, Pinkerton AB, et al. Aberrant lipid metabolism in anaplastic thyroid carcinoma reveals stearoyl CoA desaturase 1 as a novel therapeutic target[J]. J Clin Endocrinol Metab, 2015,100(5):E697-E709.
[11] Powell DA. An overview of patented small molecule stearoyl coenzyme-A desaturase inhibitors (2009 - 2013)[J]. Expert Opin Ther Pat, 2014,24(2):155-175.
[12] Zhang Z, Dales NA, Winther MD. Opportunities and challenges in developing stearoyl-coenzyme A desaturase-1 inhibitors as novel therapeutics for human disease[J]. J Med Chem, 2014,57(12):5039-5056.
[13] Budhu A, Roessler S, Zhao X, et al. Integrated metabolite and gene expression profiles identify lipid biomarkers associated with progression of hepatocellular carcinoma and patient outcomes[J]. Gastroenterology, 2013,144(5):1066-1075.
[14] Yang F, Yan S, He Y, et al. Expression of hepatitis B virus proteins in transgenic mice alters lipid metabolism and induces oxidative stress in the liver[J]. J Hepatol, 2008,48(1):12-19.
[15] Ahmed M. Non-alcoholic fatty liver disease in 2015[J].World J Hepatol, 2015,7(11):1450-1459.
[16] Ascha MS, Hanouneh IA, Lopez R, et al. The incidence and risk factors of hepatocellular carcinoma in patients with nonalcoholic steatohepatitis[J]. Hepatology, 2010,51(6):1972-1978.
[17] Saran U, Humar B, Kolly P, et al. Hepatocellular carcinoma and lifestyles[J]. J Hepatol,2016,64(1):203-214.
[本文编辑] 廖晓瑜, 贾泽军
The relationship between the expression of stearoyl-CoA desaturase in liver tissue and the prognosis of HBV-related hepatocellular carcinoma patients
LIN Xiao-ping1,2, WANG Zhen-guang3, SUN Jin-hai1*
1. Department of Health Management, Faculty of Health Service, Second Military Medical University, Shanghai 200433, China2. College of Basic Medical Sciences, Second Military Medical University, Shanghai 200433, China3. Third Department of Biliary Tract, Shanghai Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200433, China
Objective: To investigate the expression level and clinical significance of stearoyl-CoA desaturase (SCD) in liver tissues of HBV-related hepatocellular carcinoma (HCC) patients. Methods: We constructed the tissue microarray of liver tissue 3 cm beyond the HCC boundary (n=176), detected the expression level of SCD by immunohistochemistry, and analyzed the relationship between the expression level and clinical pathological features. Results: The positive rate of SCD in liver tissues of patients with HBV-related HCC patients was 85.80% (151/176). The SCD expression level was associated with tumor number, microvascular invasion, liver cirrhosis (P< 0.05). The tumor free survival time and overall survival time of SCD high level expression group were both shorter than those of SCD low level expression group. Conclusions: The SCD expression level in the liver tissues of HBV-related HCC patients is related to clinical pathology and prognosis, which suggests that the expression of SCD in the liver tissues of HCC patients can be used as a marker of poor prognosis.
hepatocellular carcinoma; stearoyl-CoA desaturase; tissue microarray; immunohistochemistry
2016-07-05 [接受日期] 2016-08-11
林晓平,硕士生,实验师. E-mail: xiaolin714714@126.com
*通信作者(Corresponding author). Tel: 021-81870913, E-mail: sunjinhai2003@sina.com
10.12025/j.issn.1008-6358.2016.20160026
R 735.7
A
