外施海藻糖对高温胁迫下小麦幼苗膜脂过氧化的影响
2016-12-15高亚敏赵燕燕邹春静
王 迪,罗 音,高亚敏,赵燕燕,邹春静
(华东师范大学生命科学学院,上海 200241)
外施海藻糖对高温胁迫下小麦幼苗膜脂过氧化的影响
王 迪,罗 音,高亚敏,赵燕燕,邹春静
(华东师范大学生命科学学院,上海 200241)
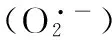
冬小麦;高温胁迫;活性氧;海藻糖;抗氧化系统
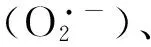
海藻糖(Trehalose)是由两个葡萄糖分子通过α,α-1,1糖苷键结合而成的可溶性非还原性糖,在许多生物体中广泛存在。海藻糖对热、pH 等不敏感,在高温、干旱、寒冷、高盐碱等逆境条件下可保护生物膜、蛋白质等免受伤害[4,8]。植物中的海藻糖还参与代谢调控和基因表达调控,对植物的生长发育及响应外界环境变化有重要影响[9]。许多微生物、低等动、植物在遭受不良生活环境时,通过体内调节合成海藻糖以抵御逆境胁迫。外源添加海藻糖也能较好保护细胞、生物体和生物大分子。研究表明,在高温、干旱、高盐等胁迫条件下,外源海藻糖可以维持作物相对正常的生长[10-12]。叶施海藻糖可提高植物酶促机制中POD和CAT活性及非酶抗氧化剂AsA的含量,减轻干旱胁迫条件下的氧化损伤[10]。用根施海藻糖的方法提高小麦的海藻糖含量,发现高温胁迫下,外源海藻糖可以影响膜脂组成,从而稳定类囊体膜[11]。但高温胁迫及室温恢复期的小麦幼苗中,外源海藻糖是否通过影响抗氧化系统来提高膜脂的稳定性未见报道。本研究以冬小麦为实验材料,在苗期进行海藻糖和40 ℃高温胁迫处理,探究在高温胁迫条件下,外源海藻糖减轻小麦幼苗氧化胁迫损伤的机理,以期为作物大田生产应对高温胁迫提供理论依据。
1 材料与方法
1.1 植物材料的培养
挑选完整饱满的小麦(TriticumaestivumL.)籽粒(品系宁-13),用0.01 %(m/v) HgCl2溶液浸泡12 h后,再用清水清洗2~3遍,加入适量清水后放在培养箱中催芽24 h,挑选发芽状况基本一致的小麦种子均匀排在特制带有漏网的塑料培养盘中,加入适量清水,放在室温下管理,待小麦幼苗长至一叶一心时期开始浇灌Hoagland营养液,培养期间每天更换清水或者Hoagland营养液。
1.2 高温胁迫处理
当小麦幼苗的第三片叶子开始伸展时,用1.5 mmol·L-1的海藻糖营养液培养3 d(TRE),并以不加海藻糖的Hoagland营养液培养小麦幼苗为对照(CK),然后放入光照培养箱高温(40 ℃;光强 120 μmol·m-2·s-1;湿度38%)处理24 h(昼13 h,夜11 h)。高温处理结束后将小麦幼苗移至室温条件下继续常规培养72 h。取小麦第二片伸展叶进行指标的测定。
1.3 丙二醛(MDA)含量的测定
MDA含量的测定采用硫代巴比妥酸法,分别测定532 nm、600 nm和450 nm波长下的吸光度[13]。
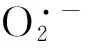

1.5 抗氧化酶的提取和活性测定
取新鲜小麦幼苗第二片伸展叶0.5 g,置于预冷后的研钵中,然后加入已经预冷的0.05 mol·L-1Na2HPO4/NaH2PO4(pH 7.8)缓冲液5 mL,充分研磨至匀浆。过滤后在4 ℃,12 000 r·min-1的条件下离心20 min。SOD和APX活性的测定参考Cakmak等的方法[16];CAT活性的测定参考Durner等的方法[17];POD活性的测定参考Andres等的方法[18]。
1.6 非酶促抗氧化物质含量的测定
取新鲜小麦幼苗第二片伸展叶0.5 g,置于预冷后的研钵中,然后加入已经预冷的6%偏磷酸缓冲液3 mL(含有1 mmol·L-1EDTA,pH 2.8)和少量的石英砂,充分研磨至匀浆。在4 ℃、10 000 r·min-1的条件下离心20 min,取上清液测定。参考Anderson等的方法测定还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)的含量[18]。还原型抗坏血酸(AsA)的提取测定参考Law等[19]的方法:取新鲜小麦幼苗第二片伸展叶0.5 g,置于预冷后的研钵中,然后加入已经预冷的5%(w/v)的磺基水杨酸2.5 mL和少量的石英砂,充分研磨至匀浆4 000 r·min-1离心10 min,取上清液测定。
1.7 抗氧化酶Mn-SOD、Cu/Zn-SOD、CAT、POD和APX基因RNA提取和RT-Q-PCR检测
根据制造商的说明,使用RNAiso Plus(Takara, Japan)提取RNA。500 ng RNA作为模板与Sso Advanced TM SYBR○RGreen Super-mix(Bio-Rad)共同用于SuperScript One-step RT-PCR,在实时定量PCR仪(CFX96, Bio-Rad, USA)上进行反应。RT-PCR反应步骤:cDNA的构建体在25 ℃下5 min,然后在42 ℃下, 85 ℃下5 min;随后qRT-PCR的扩增谱在95 ℃下3 s,然后在95 ℃ 15 s,56 ℃ 20 s,72 ℃ 5 s进行39个循环。转录水平以18S rRNA(TTAGTTGGT GGAGCGATTT,AACCAGCGACCTACAACG)为内参基因。
1.8 数据分析方法
所用指标测定均有3次或3次以上的重复,实验结果是3次或3次以上平均值±SD。统计分析利用DPS软件(浙江大学,中国),按照采用单因素或双因素进行方差分析。利用Excel 2003软件作图。
2 结果与分析
2.1 外源海藻糖对高温胁迫下小麦幼苗叶片丙二醛(MDA)含量的影响
经过高温胁迫后,海藻糖处理和CK的MDA含量均显著升高(图1),说明高温胁迫对脂膜造成了损伤。室温恢复过程中海藻糖处理的MDA含量与CK变化趋势基本相同,均表现为先升后降。由于高温胁迫导致ROS过量产生,从而引起MDA的积累,而抗氧化系统不能完全清除ROS,因而室温恢复前期MDA含量继续上升,随着室温恢复时间的延长及抗氧化系统的诱导, ROS的清除能力增强,使室温恢复后期MDA含量降低。在高温胁迫及室温恢复过程中,海藻糖处理的MDA含量均显著低于CK,说明外源海藻糖降低了ROS产生引起的脂膜过氧化,保护了膜结构的稳定性。
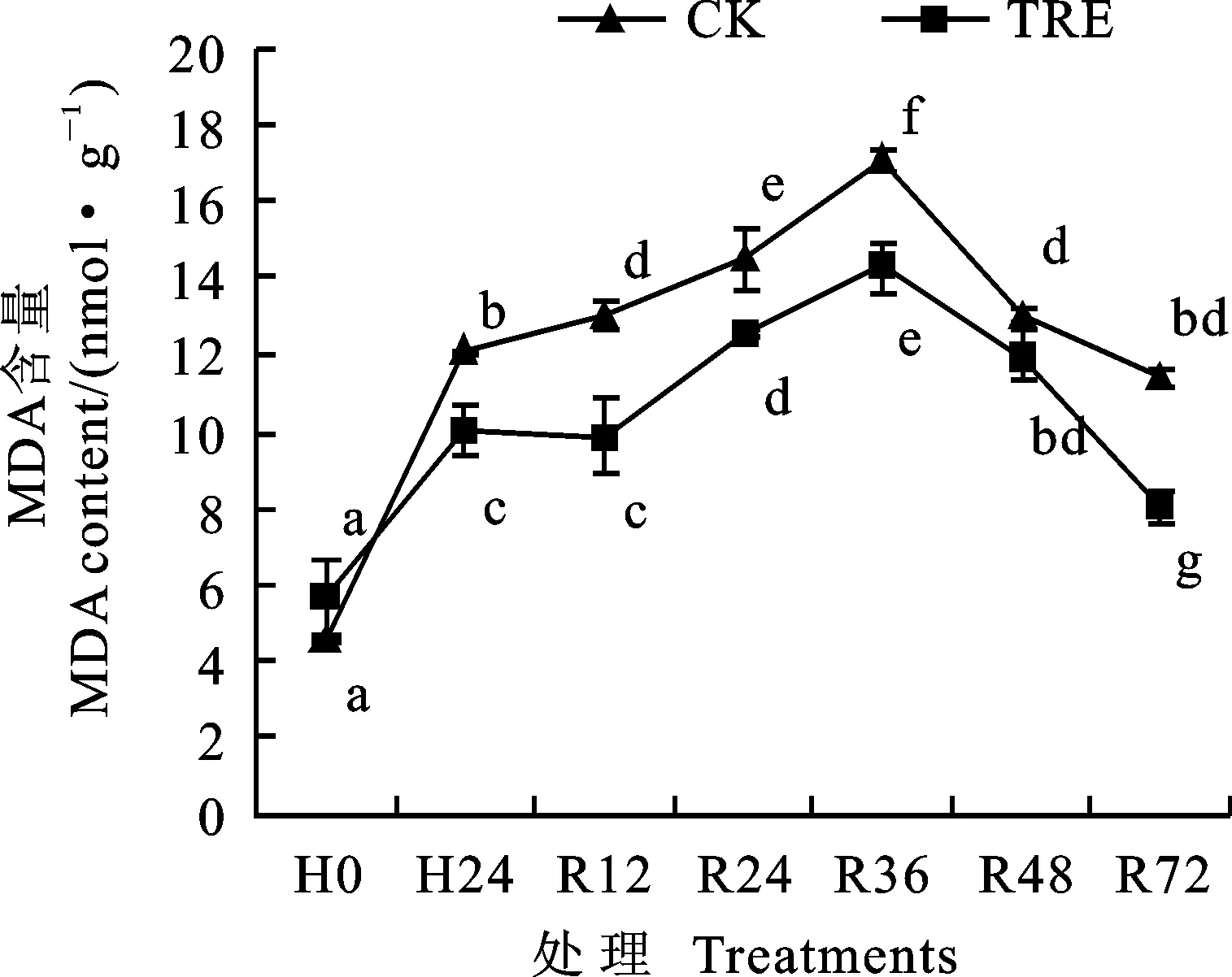
TRE:海藻糖处理;H0:高温处理前;H24:高温胁迫24 h;R12、R24、R36、R48、R72分别代表高温处理后室温恢复了12 h、24 h、36 h、48 h和72 h。不同字母表示差异显著(P<0.05)。下图同。
TRE:Trehalose pretreatment; H0:Without high temperature treatment; H24:High temperature treatment for 24 h; R12,R24,R36,R48 and R72 represent different treatments recovered 12 h, 24 h, 36 h, 48 h and 72 h from high temperature treatment, respectively. Different letters show significant differences(P<0.05). The same as in the other figures.
图1 外源海藻糖对高温胁迫下小麦幼苗叶片丙二醛(MDA)含量的影响
Fig.1 Influences of exogenous trehalose on MDA content of wheat seedling leaves under heat stress
2.3 外源海藻糖对高温胁迫下小麦幼苗叶片抗氧化酶活性的影响
在经过24 h高温胁迫和室温恢复后,海藻糖处理和CK的SOD活性均呈先降后升的趋势,且室温恢复24 h后海藻糖处理的SOD活性持续低于CK(图3A)。
在经过24 h高温胁迫后,CK的CAT活性无显著性变化,而海藻糖处理的CAT活性上升53.85%,显著高于CK(P<0.05)(图3B),说明海藻糖在高温胁迫条件下增加了CAT活性。室温恢复12 h后,海藻糖处理的CAT活性降低,而CK的CAT活性显著上升,但经过更长时间的室温恢复后,海藻糖处理的CAT活性与CK均无显著性差异。
在正常生长条件、高温胁迫条件及室温恢复至24 h期间,海藻糖处理的POD活性与CK无显著性差异(图3C)。而室温恢复36 h、48 h、72 h后,海藻糖处理的POD活性分别上升40.87%、67.00%、70.74%,均显著高于CK(P<0.05)。表明海藻糖可能在高温胁迫后的室温恢复后期阶段增强了POD的活性。
在经过24 h高温胁迫及随后的常温室温恢复12 h、24 h、36 h后,海藻糖处理的APX活性显著高于CK(图3D,P<0.05),表明海藻糖在高温胁迫条件下提高了APX活性。而经过较长时间的48 h、72 h室温恢复后,海藻糖处理的APX活性与CK无显著性差异。
由上述结果可知,与CK相比,在高温胁迫后和室温恢复前期(12 h)外源海藻糖增强了APX活性,引起CAT活性急剧上升后降低,室温恢复中后期(24 h、36 h、48 h、72 h)主要提高了POD和APX活性,抑制了SOD活性。说明海藻糖可能通过调控这些抗氧化酶在高温及室温恢复阶段的活性以响应高温胁迫。
2.4 外源海藻糖对高温胁迫下小麦幼苗叶片非酶促系统AsA含量和GSH/GSSG比值的影响
在高温胁迫及室温恢复过程中,虽然CK和海藻糖处理的还原型与氧化型谷胱甘肽的比值(GSH/GSSG)没有显著差异(图4A),但高温胁迫及室温恢复中后期(36 h、48 h、72 h),海藻糖处理的AsA含量明显高于CK(图4B)。
2.5 外源海藻糖对高温胁迫下小麦幼苗叶片抗氧化酶基因表达的影响
常温下外源海藻糖显著上调了所有抗氧化酶基因的表达量(图5)。在高温胁迫下,CK的Mn-SOD和CAT基因的相对表达量没有显著变化,而Cu/Zn-SOD、POD、APX基因均显著上调表达;与CK相比,外源海藻糖处理的小麦幼苗中,CAT基因相对表达量没有显著变化,Mn-SOD、Cu/Zn-SOD、 POD、APX的基因相对表达量均显著上调,表达量分别是CK的4.37、1.90、2.38和 1.39倍。室温恢复了24 h后,外源海藻糖处理的Mn-SOD、Cu/Zn-SOD、CAT、POD和APX的基因相对表达量均显著高于CK,分别是CK的4.37、2.12、1.69、10.19和2.14倍。这些结果表明在高温胁迫下(CAT基因除外)和室温恢复条件下,海藻糖使小麦幼苗Mn-SOD、Cu/Zn-SOD、CAT、POD和APX的基因发生明显上调表达。
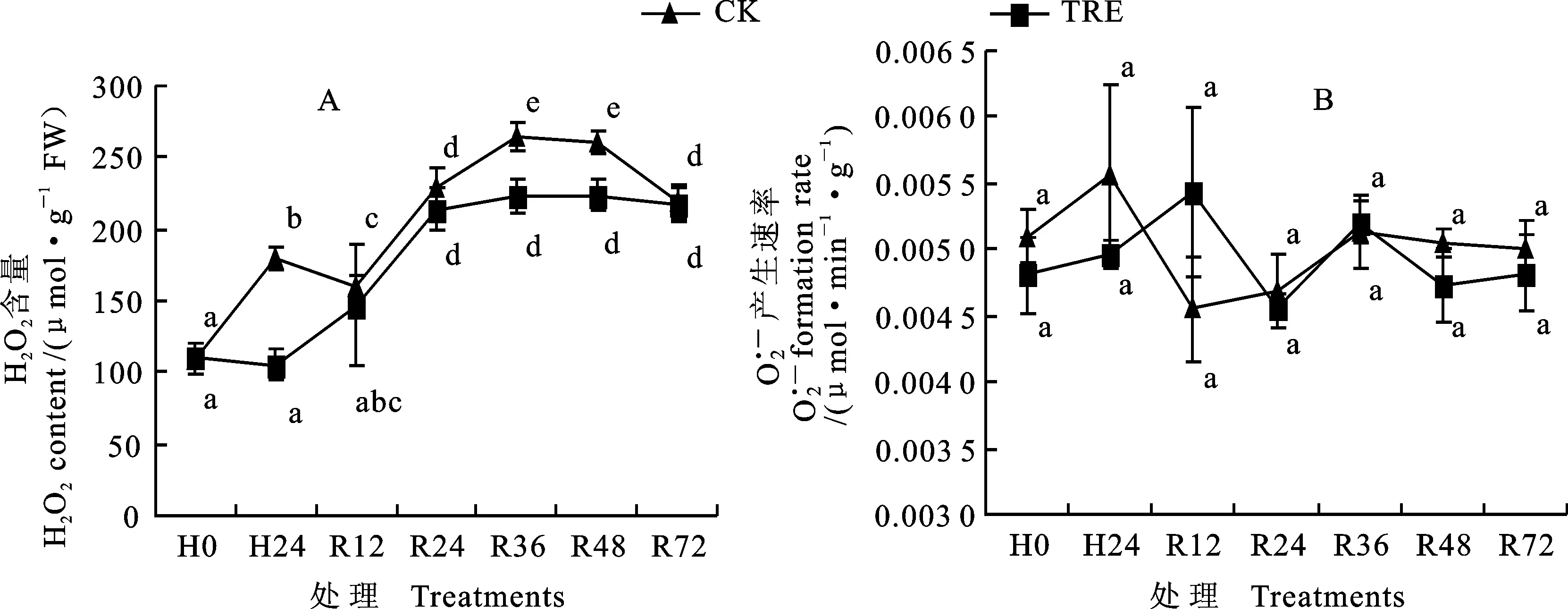
图2 外源海藻糖对高温胁迫下小麦幼苗叶片产生速率和H2O2含量的影响
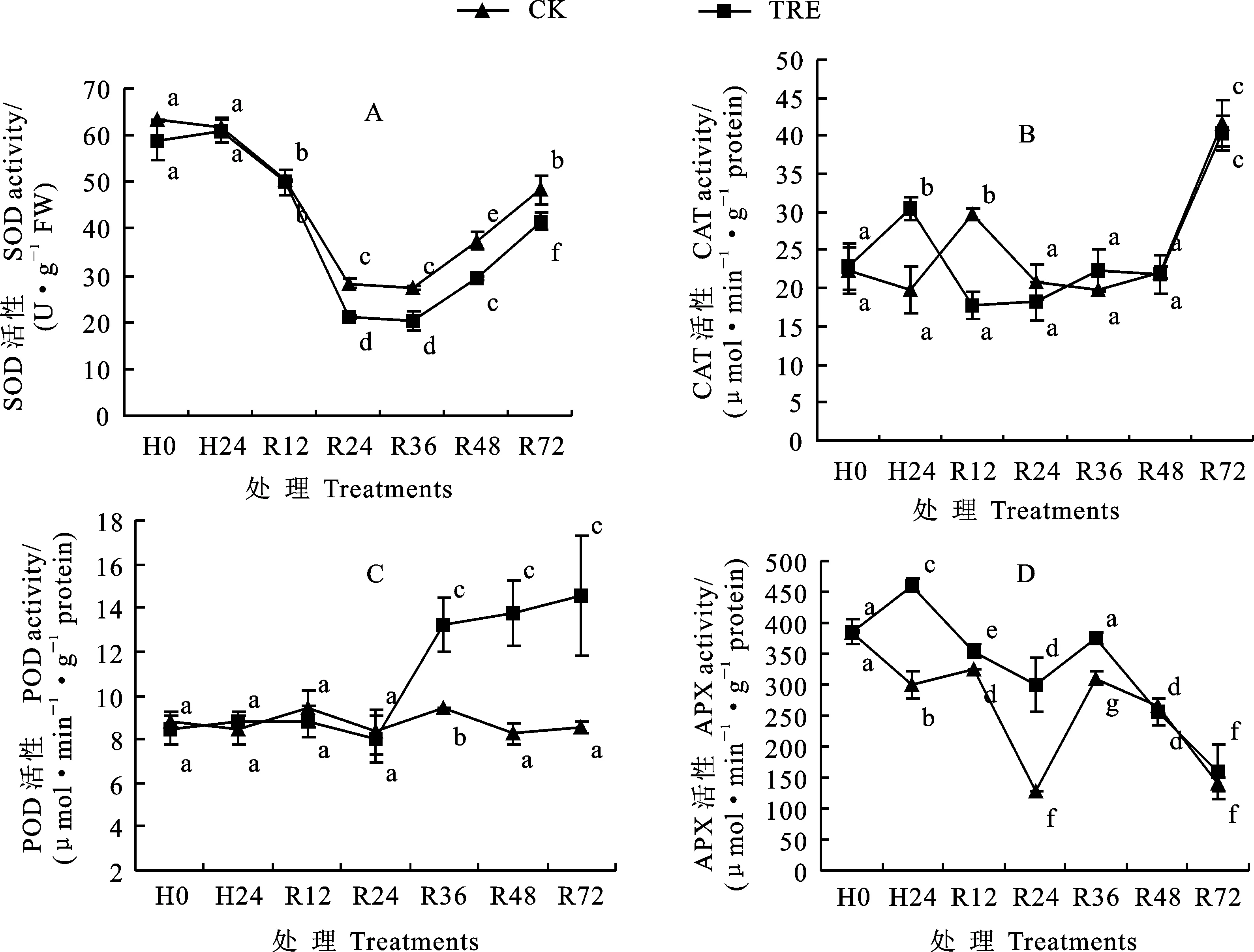
图3 外源海藻糖对高温胁迫下幼苗期小麦叶片中抗氧化酶SOD(A)、CAT(B)、POD(C)、APX(D)活性的影响
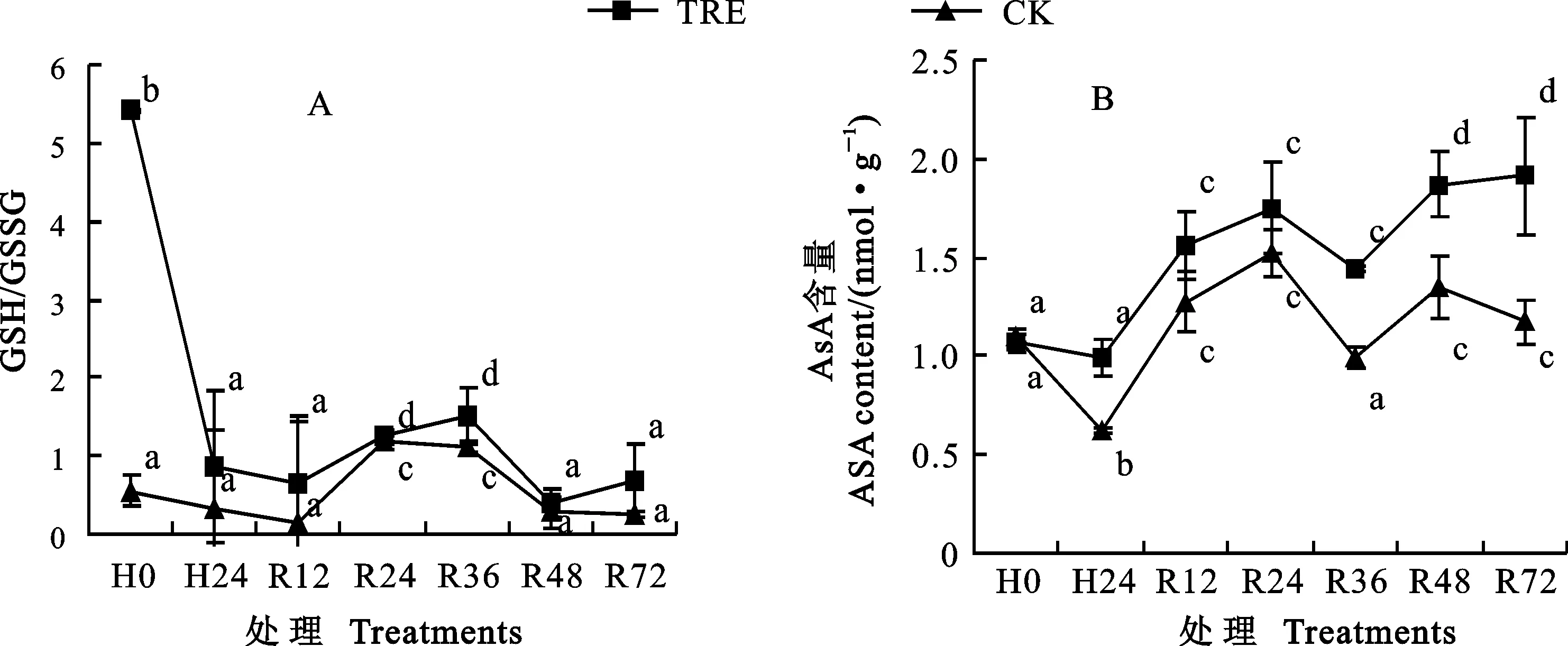
图4 外源海藻糖对高温胁迫下小麦幼苗叶片非酶促系统GSH/GSSG比值(A)和AsA含量(B)的影响
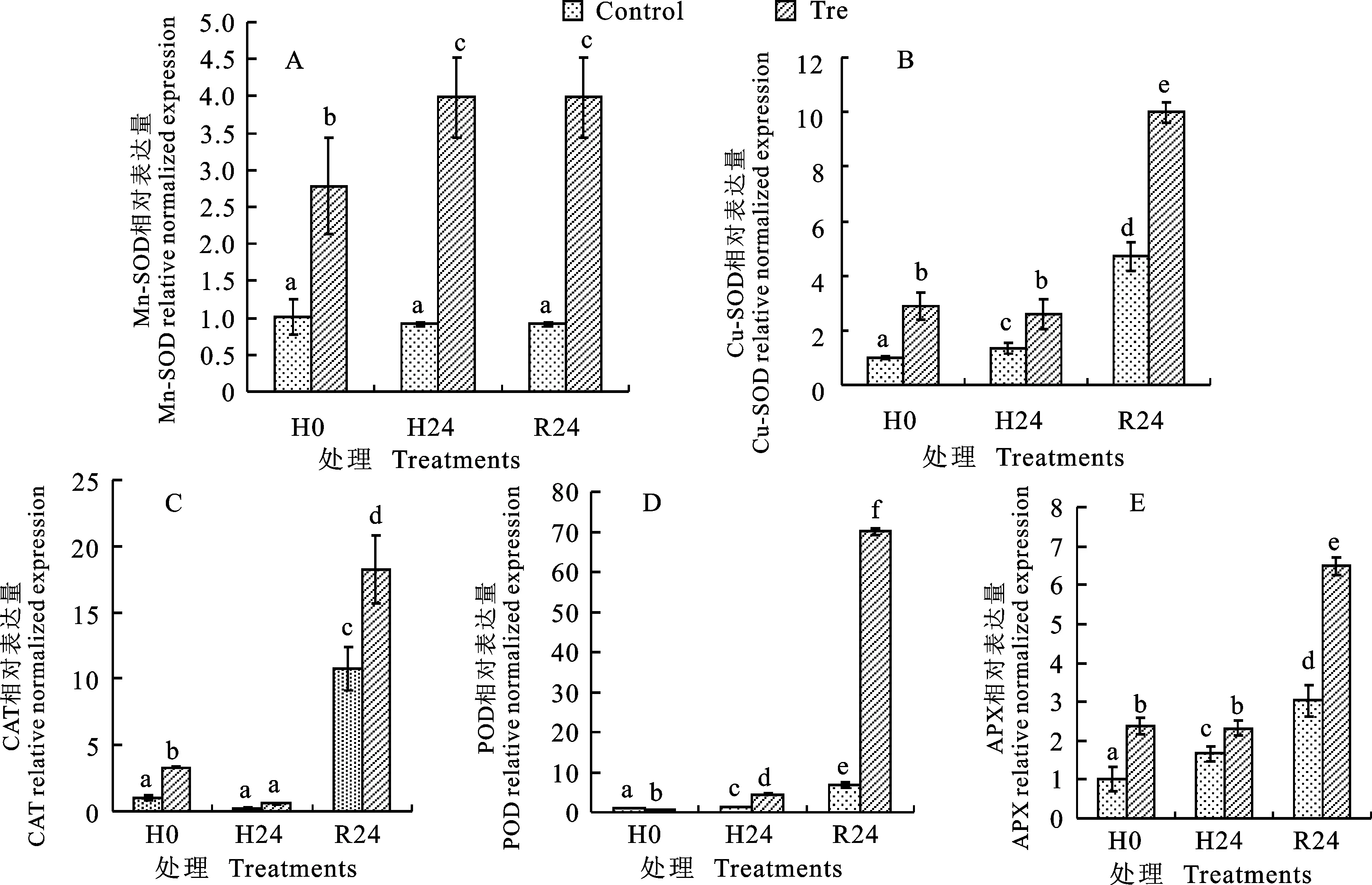
图5 外源海藻糖对高温胁迫下小麦幼苗叶片抗氧化酶基因Mn-SOD(A)、Cu/Zn-SOD(B)、CAT(C)、POD(D)和APX(E)基因相对表达量的影响
3 讨 论
高温胁迫会导致植物体中ROS过量产生。ROS可以破坏膜的结构、组成和功能,导致膜渗漏和选择透过性受损[2],使膜脂过氧化,产生毒害更大的氧化产物MDA,因此常用MDA的累积表示膜脂过氧化程度。本研究结果表明,高温胁迫及随后的室温恢复过程,海藻糖处理的小麦幼苗MDA含量均显著低于CK(图1),说明海藻糖处理降低了高温胁迫造成的脂质过氧化程度,维持膜的稳定性,能够对高温胁迫下小麦幼苗叶片的细胞膜起到保护作用。
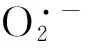
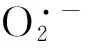
在常温条件、高温胁迫和室温恢复条件下,海藻糖处理的Mn-SOD、Cu/Zn-SOD、CAT、POD和APX基因的相对表达量均显著高于CK,表明海藻糖处理提高了Mn-SOD、Cu/Zn-SOD、CAT、POD和APX这些抗氧化酶的含量,从而提高抗氧化系统的活性,促进小麦幼苗清除有害的ROS,维持相对正常的生理机能。海藻糖处理后的Mn-SOD、Cu/Zn-SOD相对表达量上调(图5A),而SOD活性没有显著变化甚至在室温恢复后期降低(图3A),与之前的报道相似[24],可能是因为高温胁迫下Mn-SOD和Cu/Zn-SOD的翻译水平较低所致。
AsA-GSH循环在清除H2O2的抗氧化代谢起着重要作用。在AsA-GSH循环中,首先,APX利用AsA将H2O2还原成H2O的同时也形成单脱氢抗坏血(MDHA),MDHA很不稳定,其中一部分被单脱氢抗坏血酸还原酶(MDAR)还原为AsA,另一部分被进一步氧化后生成脱氢抗坏血酸(DHA)。DHA以还原型谷胱甘肽(GSH)为底物,在脱氢抗坏血酸还原酶(DHAR)的作用下生成 AsA。此反应产生的氧化型谷胱甘肽(GSSG)又可在谷胱甘肽还原酶(GR)的催化下被还原成GSH。在叶绿体中清除活性氧的关键抗氧化物质是AsA[25],它是植物和大多数动物体内一种重要的抗氧化剂。AsA和GSH通过维持植物细胞和组织中的氧化还原状态,直接清除ROS以保护植物。GSH/GSSG比值是一种氧化胁迫状态的动态指标,可反映对逆境的抵抗能力[26]。高温胁迫下GSH/GSSG比值没有显著变化,但外源海藻糖处理维持了较高的AsA含量,表明外源海藻糖处理提高了AsA含量,增强对H2O2的清除并降低其含量,缓解了氧化胁迫造成的损伤,从而提高了小麦幼苗对高温的耐受性。
总之,外源海藻糖能够提高Mn-SOD、Cu/Zn-SOD、CAT、POD和APX等抗氧化酶的基因的相对表达量,增加高温胁迫下小麦幼苗叶片抗氧化酶CAT和APX活性以及室温恢复期的POD和APX活性和抗氧化物质AsA的含量,增强清除ROS的能力,从而减少MDA累积,增强高温胁迫条件下膜脂稳定性,提高小麦幼苗对高温胁迫的抗性。
[1]DE COSTA W.A review of the possible impacts of climate change on forests in the humid tropics [J].JournalofTheNationalScienceFoundationofSriLanka,2011,39(4):281-302.
[2]WAHID A,GELANI S,ASHRAF M,etal.Heat tolerance in plants:an overview [J].EnvironmentalandExperimentalBotany,2007,61(3):199-223.
[3]MADAN S.Trehalose mitigates heat stress-induced damages in wheat seedlings [J].JournalofWheatResearch,2015,7(1):74-78.
[4]GILL S S,TUTEJA N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants [J].PlantPhysiologyandBiochemistry,2010,48(12):909-930.
[5]LARKINDALE J,HUANG B.Thermotolerance and antioxidant systems inAgrostisstolonifera:involvement of salicylic acid,abscisic acid,calcium,hydrogen peroxide,and ethylene [J].JournalofPlantPhysiology,2004,161(4):405-413.
[6]HE Y,HUANG B.Differential responses to heat stress in activities and isozymes of four antioxidant enzymes for two cultivars ofKentuckybluegrasscontrasting in heat tolerance [J].JournaloftheAmericanSocietyforHorticulturalScience,2010,135(2):116-124.
[7]WANG G P,TIAN F X,ZHANG M,etal.The overaccumulation of glycinebetaine alleviated damages to PS II of wheat flag leaves under drought and high temperature stress combination [J].ActaPhysiologiaePlantarum,2014,36(10):2743-2753.
[8]DRENNAN P M,SMITH M T,GOLDSWORTHY D,etal.The occurrence of trehalose in the leaves of the desiccation-tolerant angiospermMyrothamnusflabellifoliusWelw [J].JournalofPlantPhysiology,1993,142(4):493-496.
[9]VAN DIJKEN A J H,SCHLUEPMANN H,SMEEKENS S C M.Arabidopsistrehalose-6-phosphate synthase 1 is essential for normal vegetative growth and transition to flowering [J].PlantPhysiology,2004,135(2):969-977.
[10]ALI Q,ASHRAF M.Induction of drought tolerance in maize(ZeamaysL.) due to exogenous application of trehalose:growth,photosynthesis,water relations and oxidative defence mechanism [J].JournalofAgronomyandCropScience,2011,197(4):258-271.
[11]LUO Y,LI F,WANG G P,etal.Exogenously-supplied trehalose protects thylakoid membranes of winter wheat from heat-induced damage [J].BiologiaPlantarum,2010,54(3):495-501.
[12]YANG L,ZHAO X,ZHU H,etal.Exogenous trehalose largely alleviates ionic unbalance,ROS burst,and PCD occurrence induced by high salinity inArabidopsisseedlings [J].FrontiersinPlantScience,2014,5.
[13]HODGES D M,DELONG J M,FORNEY C F,etal.Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds [J].Planta,1999,207(4):604-611.
[14]LUO Y,LI W M,WANG W.Trehalose:protector of antioxidant enzymes or reactive oxygen species scavenger under heat stress? [J].EnvironmentalandExperimentalBotany,2008,63(1):378-384.
[15]ELSTNER E F,HEUPEL A.Inhibition of nitrite formation from hydroxylammoniumchloride:a simple assay for superoxide dismutase [J].AnalyticalBiochemistry,1976,70(2):616-620.
[16]CAKMAK I,MARSCHNER H.Magnesium deficiency and high light intensity enhance activities of superoxide dismutase,ascorbate peroxidase,and glutathione reductase in bean leaves [J].PlantPhysiology,1992,98(4):1222-1227.
[17]DURNER J,KLESSIG D F.Salicylic acid is a modulator of tobacco and mammalian catalases [J].JournalofBiologicalChemistry,1996,271(45):28492-28501.
[18]ANDERSON J V,CHEVONE B I,HESS J L.Seasonal variation in the antioxidant system of eastern white pine needles evidence for thermal dependence [J].PlantPhysiology,1992,98(2):501-508.
[19]LAW M Y,CHARLES S A,HALLIWELL B.Glutathione and ascorbic acid in spinach(Spinaciaoleracea) chloroplasts.The effect of hydrogen peroxide and of paraquat [J].BiochemistryJournal,1983,210:899-903.
[20]HONGBO S,ZONGSUO L,MINGAN S.Changes of anti-oxidative enzymes and MDA content under soil water deficits among 10 wheat(TriticumaestivumL.) genotypes at maturation stage [J].ColloidsandSurfacesB:Biointerfaces,2005,45(1):7-13.
[21]MA C,WANG Z,KONG B,etal.Exogenous trehalose differentially modulate antioxidant defense system in wheat callus during water deficit and subsequent recovery [J].PlantGrowthRegulation,2013,70(3):275-285.
[22]LU F,CHEN Q,CHEN Z,etal.Effects of heat stress on development,reproduction and activities of protective enzymes in Mononychellus mcgregori [J].ExperimentalandAppliedAcarology,2014,63(2):267-284.
[23]LINS R D,PEREIRA C S,H?NENBERGER P H.Trehalose-protein interaction in aqueous solution [J].Proteins:Structure,Function,andBioinformatics,2004,55(1):177-186.
[24]ZHANG J,LI D M,SUN W J,etal.Exogenous p-hydroxybenzoic acid regulates antioxidant enzyme activity and mitigates heat stress of cucumber leaves [J].ScientiaHorticulturae,2012,148:235-245.
[25]SMIRNOFF N,WHEELER G L.Ascorbic acid in plants:biosynthesis and function [J].CriticalReviewsinBiochemistryandMolecularBiology,2000,35(4):291-314.
[26]KOCSY G,LAURIE R,SZALAI G,etal.Genetic manipulation of proline levels affects antioxidants in soybean subjected to simultaneous drought and heat stresses [J].PhysiologiaPlantarum,2005,124(2):227-235.
Effects of Exogenous Trehalose on the Membrane Lipid Peroxidation in Wheat Seedlings under Heat Stress
WANG Di,LUO Yin,GAO Yamin,ZHAO Yanyan,ZOU Chunjing
(East China Normal University, School of Life Science, Shanghai 200241,China)

Winter wheat; Heat stress; Reactive oxygen species; Trehalose; Antioxidant system
时间:2016-07-07
2015-12-26
2016-01-24
国家自然科学基金项目(31200301)
E-mail:wdlsyg@163.com
邹春静(E-mail:cjzou@bio.ecnu.edu.cn)
S512.1;S311
A
1009-1041(2016)07-0925-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160707.1531.028.html
