小麦BNS雄性不育中国春恢复基因的连锁群检测和QTL初步定位
2016-12-15孙慧慧付庆云曹银萍茹振钢李友勇
孙慧慧,杨 靖,2,卫 笑,付庆云,曹银萍,茹振钢,李友勇
(1.河南科技学院/河南省高等学校作物分子育种重点学科开放实验室/现代生物育种河南省协同创新中心,河南新乡 453003; 2.四川农业大学农学院,四川成都 611130)
小麦BNS雄性不育中国春恢复基因的连锁群检测和QTL初步定位
孙慧慧1,杨 靖1,2,卫 笑1,付庆云1,曹银萍1,茹振钢1,李友勇1
(1.河南科技学院/河南省高等学校作物分子育种重点学科开放实验室/现代生物育种河南省协同创新中心,河南新乡 453003; 2.四川农业大学农学院,四川成都 611130)
BNS是一个新发现的温敏小麦雄性不育系,有良好的不育性和自身转换性,在杂交小麦利用和不育资源研究中有重要价值。为定位BNS的恢复基因,首先以BNS的高恢复系中国春为材料,创建BNS×中国春F2作图群体,建立自交结实率和花粉可育率两个表型BSA池;然后用中国春缺体-四体系检测恢复相关连锁群;最后用这些连锁群上的SSR分子标记筛选BSA池,用检测的连锁标记筛选F2作图群体,进一步定位恢复基因的QTL位点。结果表明,用BNS与中国春缺四体杂交,根据F1不育性检测到4个相关连锁群,分别是1A、1B、2B和7B;利用4个相关连锁群和4个非相关连锁群共8个染色体上的222对SSR分子标记筛选2对共4个BSA池,结果在3个相关连锁群上检测到8对连锁标记;用这8对连锁标记筛选F2群体210个个体植株,检测到5个QTL位点,位于1A、1B和2B染色体上。这些位点中,1个与自交结实率相关,2个与两个表型均相关,是主效QTL位点,另2个与花粉可育率相关,是微效QTL位点。这些结果为BNS恢复基因分子标记选择和精细定位奠定了基础。
小麦;BNS雄性不育;恢复基因;SSR分子标记;QTL位点
BNS是一个新发现的小麦雄性不育系。多年观察发现,当该不育系小孢子发育处于较低温度时,花粉发育败育,当小孢子发育时温度升高,花粉发育逐步恢复,因此,BNS是一个对温度敏感的二型雄性不育系[1-3]。观察还发现,BNS在生产上不育度高,不育期长,且年度间稳定,一些特殊品种可对BNS有完全恢复性[3-7]。因此,BNS既是一个可应用于杂交小麦的优良材料,也是一个有重要研究价值的小麦雄性不育种质资源。
近些年来,围绕BNS的生物学特性和遗传机理,人们在不育性和自身转换性方面做了大量的研究,并取得了重要进展[1-7],但在不育和恢复的遗传机理以及基因定位方面报道较少。该方面的进展缓慢,主要原因是BNS的不育也是多基因遗传[1,8-9],恢复规律不明确,加上小麦基础研究薄弱,基因组测序未进入应用阶段,因此全基因组测序定位缺乏参考基因组。关于BNS的遗传机理,目前报道的有两种推测模式,一种是隐性核不育模式,认为有1~3个隐性核不育基因控制BNS的雄性不育[1,8],另一种是显性核不育和非等位恢复模式,认为BNS的不育有显性特征,因为多数品种不能恢复BNS的育性,因此F1的恢复应是不育基因的非等位基因的作用[10]。关于BNS雄性不育和恢复相关基因的定位,Xing等[11]2003年曾将BNS的早期材料BNY-S的不育隐性核基因定位在2B染色体上,王茂婷[12]以BNS×山农055525组合的F2群体为材料,采用QTL方法检测到与BNS恢复性相关的14个QTL位点,分布在5个染色体上。这些研究在BNS的不育和恢复基因定位方面做了开拓性工作,但他们均认为BNS的不育是隐性核不育,因此恢复基因是不育基因的显性等位基因。
本实验室通过大量的观察认为BNS的恢复应是非等位恢复机制,并检测到中国春是一个高恢复系[10]。中国春是一个小麦研究的经典材料,有一套完整的缺体-四体系,能在形态水平检验基因所属连锁群,并且目前报道的SSR分子标记工具也多是在中国春组合中开发的,因此,本研究在BNS非等位恢复模式下,选用中国春为恢复亲本,用中国春及缺体-四体系检测中国春中BNS恢复基因的所属连锁群,然后用SSR分子标记方法筛选与恢复基因连锁的分子标记,最后用这些连锁标记在BNS×中国春的F2作图群体中检测QTL位点,旨在初步检测中国春恢复BNS育性的基因位点和特性。
1 材料与方法
1.1 材 料
BNS不育系是本实验室保存材料。恢复系中国春(Chinase Spring,CS)以及中国春缺四体由中国农业大学刘志勇教授惠赠,这些缺四体均经SSR分子标记鉴定,部分重要材料经SSR荧光原位标记鉴定。
1.2 材料种植和表型调查
试验材料在河南辉县小麦育种基地种植。自2008年以来BNS于历年10月1日开始播种,8 d一个播期。本试验中中国春、中国春缺四体、BNS×中国春缺四体的F1和BNS×中国春的F1及F2均在2013-2014年10月9日播种,该播种期在研究地区是小麦正季播种期,也是BNS的不育播期[1-3]。田间种植方式为:行长2 m,行宽0.23 m,种植2行隔1空行。BNS、中国春及其缺四体和F1种植株距12~15 cm,F2株距18~20 cm。
抽穗后取主茎和高位分蘖穗套羊皮纸带,每行植株依次套袋,每株套2穗,单穗套,父本每品种套袋20株以上,F1每个组合套袋30株以上,BNS不育系各播期套袋50株以上,F2全部套袋。成熟后收取套袋穗,统计每穗小穗数和结实粒数,每株取2穗的平均数。采用第1、第2小花结实粒数计算法[1-3,6-9](国内法)计算自交结实率,即自交结实率=第1、第2小花结实粒数/(2×总小穗数)×100%。
开花当天取单株的主茎穗上、中、下3个部位小穗各1个,随即固定,后在室内取每个小穗第一小花的3枚花药,挤出花粉粒,I2-KI染色,参照水稻和小麦的计数方法[3,13]统计完全黑色的可育花粉粒数和花粉粒总数,每个片子取3个视野,共9个观察值,得出平均数,然后计算花粉可育率。花粉可育率=可育花粉粒数目/花粉粒总数×100%。
不育度和恢复度是杂交组合后代的套袋不育率或可育率与亲本套袋的不育率或可育率的比率。
1.3 基因组DNA的提取及不育、可育池建立
田间依次标记BNS×CS的F2单株240个,于雌雄蕊分化期取各单株幼穗,采用CTAB法提取基因组DNA[10-11,14],1%琼脂糖凝胶电泳和紫外分光光度计检测DNA纯度和浓度。群体集团分离法(Bulked segregant analysis,BSA)池[15]的建立用2个表型性状,即自交结实率和花粉可育率,方法是在F2群体中取表型最低株系和最高株系各10株,各自DNA等量混合,形成自交结实率不育池(A1)和可育池(B1),花粉可育率不育池(A2)和可育池(B2)。
1.4 SSR引物的选择及合成
SSR分子标记在Daryl的SSR图谱上选择[16-17],从染色体的短臂端开始,按顺序每3~5 cM选1个标记位点,首先选单扩增产物标记,若长距离无单扩增产物标记,选二产物扩增标记。在总数222对引物中,其中184对是单扩增产物标记,38对是二产物扩增标记。引物序列在小麦网站(http://wheat.pw.usda.gov/cgi-bin/graingenes/browse.cgi?class=marker/)上获得,由上海生工生物技术有限公司合成。
1.5 引物的多态性检测
以P1(BNS)、P2(中国春)、F1及由F2建立的两套不育和可育池DNA(见1.3)为模板,参考Somers等[11,17-18]的方法进行PCR扩增。反应体系(25 μL):ddH2O 18.2 μL,10×Buffer(Mg2+)2.5 μL,dNTP Mix(2.5 mmol·L-1)2 μL,TaqDNA Polymerase(5 U· μL-1)0.3 μL,模板DNA(50 ng· μL-1)1 μL,引物(10 μmol·L-1)1 μL。引物Xgwm、Xwmc和Xbarc的反应程序:94 ℃预变性3 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,45个循环;72 ℃延伸10 min;12 ℃保存。引物Cfd的反应程序:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s;72 ℃延伸30 s,30个循环;72 ℃延伸10 min,12 ℃保存。扩增产物用2.5%的琼脂糖凝胶电泳检测,恒压100 V,电泳50 min。电泳结束后,UVItec-FireReader凝胶成像分析仪观察并记录图像。
1.6 遗传图谱的构建
以F2作图群体各单株总DNA为模板,利用BSA池筛选得到的多态性引物进行PCR扩增,方法同1.5。用Mapmaker/Exp 3.0b[19]软件处理标记的F2群体中的基因型,计算标记遗传距离;用WinQTLCart 2.5[20]软件检测QTL位点;用Mapdraw绘制连锁标记和QTL位点合并连锁图[21]。
2 结果与分析
2.1 BNS和中国春的自交结实率
从表1可以看出,中国春自交结实为59.33%~78.09%,BNS的套袋自交结实率为0.7%~3.54%,该结果也用作同年同期播种的F1、F2代不育和可育的划分界限。
2.2 BNS与中国春缺四体杂交F1的自交结实率和恢复基因所属连锁群
2013年和2014年共做32个BNS与中国春缺四体杂交组合,包含小麦21个连锁群,2015年是部分相关连锁群的重复验证,3年调查的BNS与中国春及其缺四体杂交F1的自交结实率见表2。从表2可以看出,2013年和2014年BNS×中国春F1套袋自交结实率分别为48.24%和60.68%,而中国春本身套袋自交结实率分别为59.33%和70.43%,与父本相比较,F1可恢复的程度达81.31%和86.16%,但32个BNS与中国春缺四体杂交组合的F1自交结实率均下降,部分组合下降显著,甚至达到BNS的高不育程度,如N1B-T1A和N2B-T2D与中国春缺四体杂交组合的F1,这应是缺失了恢复基因的缘故。根据F1自交结实率及其连续3年不育性的稳定性,可知N1A-T1D、N1B-T1A、N1B-T1D、N2B-T2D、N7B-T7A和N7B-T7D为BNS与中国春缺四体杂交高不育组合的父本,说明BNS恢复基因位于1A、1B、2B和7B染色体上。以2A缺四体为父本的组合有两个,但两个组合表现不同,即以N2A-T2D为父本的F1表现不育,以N2A-T2B为父本的F1表现可育,虽然3年结果一致,但不能确定是恢复相关连锁群。还有一些组合,也有高不育现象出现,但年份间表现不稳定,因此也不认为是恢复相关连锁群。
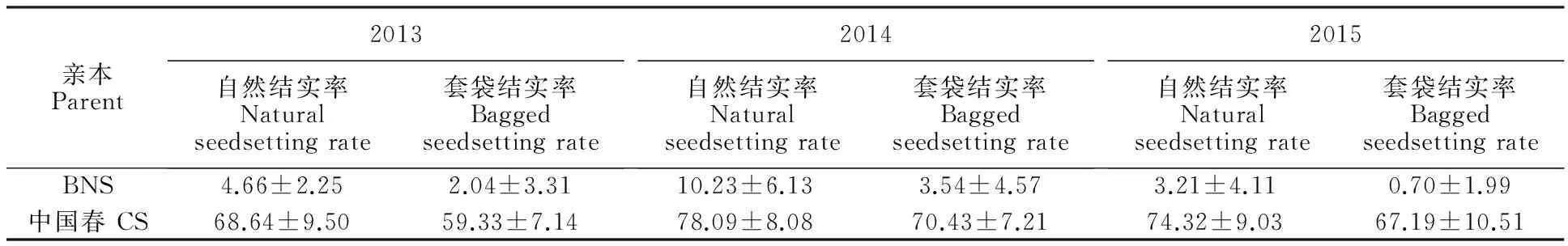
表1 不育期(10月9日)播种的BNS和中国春套袋与自然结实率
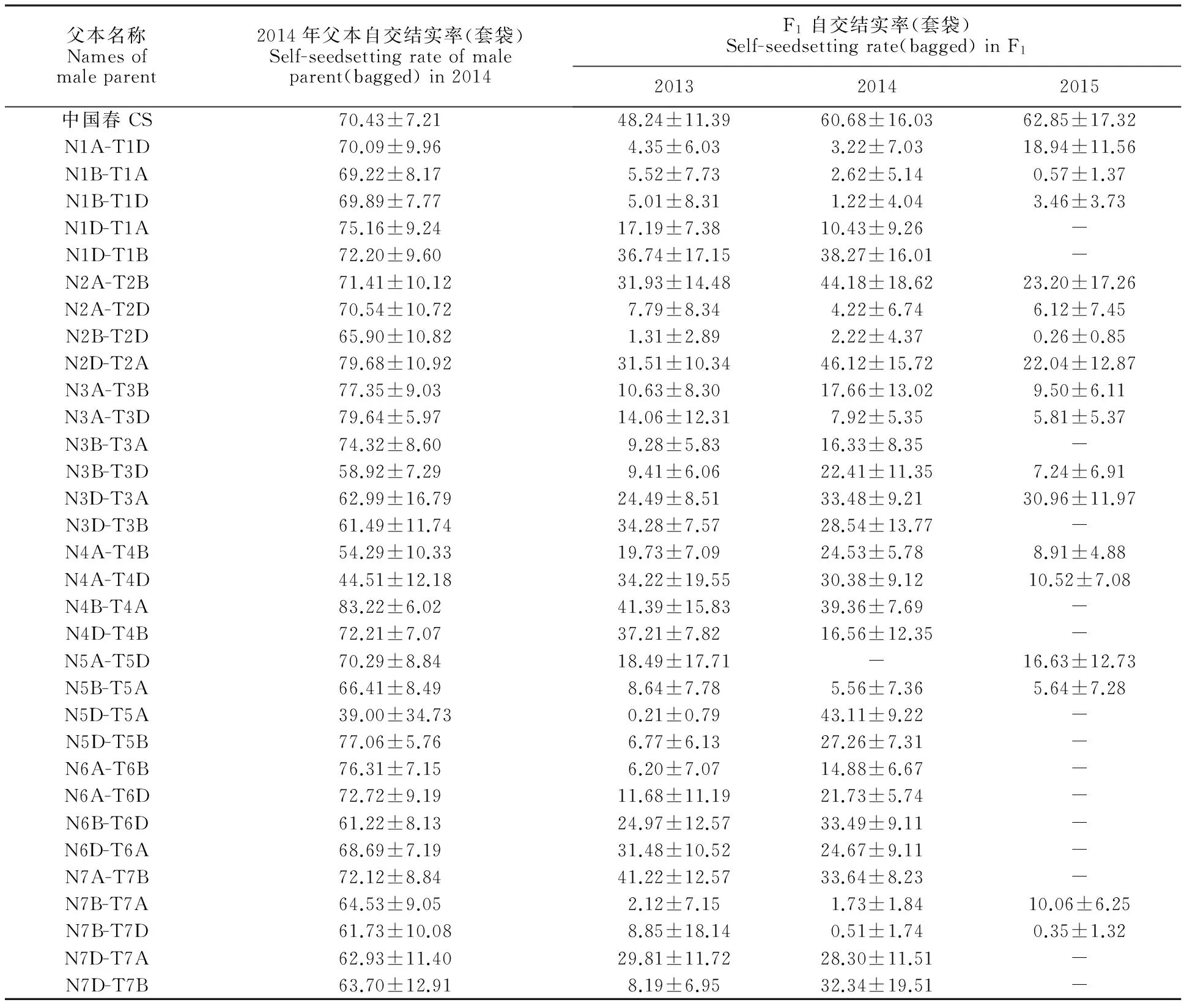
表2 BNS与中国春缺四体杂交F1及其父本缺四体的自交结实率
“-”代表无调查数据。
“-” represents missing data.
2.3 BNS×中国春F2作图群体特征、BSA池建立和基因对数估计
为了检测恢复基因位点,本研究构建了F2作图群体。田间标记和取样样本数240,到分子标记筛选后数据完整的有效样本数210,该210个样本的表型(花粉可育率和自交结实率)分布见表3。表3的第一和第二区间设为0~3.54%和3.55%~9.89%,其中,3.54%和9.89%分别是BNS不育系10月9日播期的自交结实率和花粉可育率。从表3可以看出,自交结实率在不育性水平3.54%及以下是一个多数组,3.54%到99.99%呈连续分布,平均数为52.34%,众数在50%~80%区间;从花粉可育率表型看,完全不育株较少,但高花粉可育率个体较多,平均数为59.29%,众数在60%~90%区间。这些结果说明,一是花粉可育率大于自交结实率,二是两个表型分布区间0~95%,适宜作定位群体。利用两个表型的极端个体建BSA池,样品均为10株,育性分组中3.54%和9.89%是指与F2同年同期播种的BNS的自交结实率和花粉可育率。
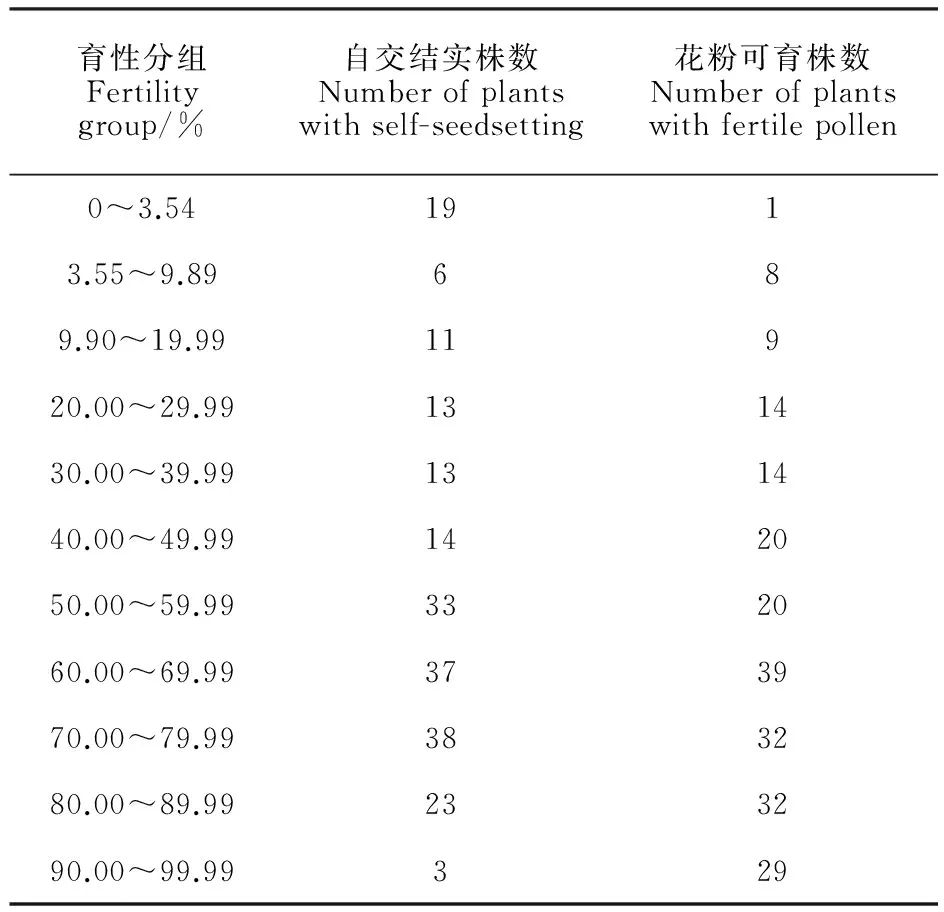
表3 BNS×中国春F2代自交结实率和花粉可育率分布(2014年)
Both 3.54% and 9.89% in fertility group represent the self-seedsetting rate and fertile pollen rate of BNS that were sown at the same time as F2.
自交结实率不育池结实率为0,可育池结实率为84.89%~92.9%;花粉可育率不育池可育率平均数<10%,且3个小花中有2个<2%,可育池花粉可育率>88%。
从F2群体分布可以看出,两个表型的遗传方式均是多基因遗传。以同年BNS不育系表型值为临界值,2014年自交结实率为3.54%,花粉可育率为9.89%,F2群体中自交结实率和花粉可育率不育个体数分别是19个和9个,分别占F2群体的1/11.05和1/23.3,该比值的数量遗传学含义是,从自交结实率角度,恢复不育性有2个主效基因,从花粉可育率角度,涉及到3个基因。
2.4 BSA池筛选出8对多态性SSR分子标记
中国春缺四体检测到恢复基因与4个染色体相关,因此,理论上在相关染色体上筛选连锁标记即可。但为了提高可靠性,除了用1B、2B、1A和7B染色体外,还增加了4个对照染色体,其中,2个是F1组合育性表现不稳定的染色体2A和5D,另2个是随机选取的非相关染色体3A和7D。沿着该8个染色体,在Somers的SSR图谱上[17]顺序选取SSR位点222个,引物在P1、P2、F1、自交结实率BSA池和花粉可育率BSA池总DNA中做多态性检测,最后扩增的有效引物218对,筛选出亲本间有明显差异的引物58对,在该58对引物中,同时在不育池和可育池之间也存在相同多态性的引物8对,该8对引物的编号及所在染色体信息见表4。从表4可看出,检测到的多态性SSR标记所在的染色体正是缺四体方法检测的连锁群,用作对照的非连锁染色体,没有检测到连锁标记,5D染色体也没有筛选到连锁标记,2A染色体上在花粉可育率池中检测到1对连锁标记。还有一个例外是7B染色体,缺四体检测是连锁染色体,但该染色体上用33对引物扩增,结果没有检测到连锁标记。
8对多态性标记的扩增带型清晰,区分明显(图1),扩增产物分子量在100~300 bp之间,其中序号1~7号(表4)标记是共显性标记,8号是显父显性标记。这些多态性标记中,Xwmc619是在自交结实率BSA池中检测到的,Xgwm311在两个表型池中均检测出多态性,其余6对均是在花粉可育率BSA池中检测到的。
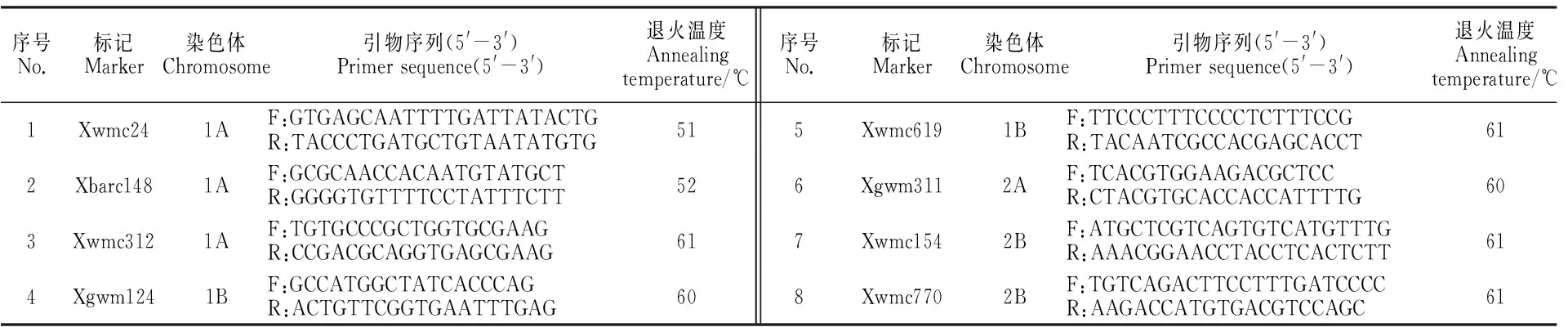
表4 亲本和BSA池DNA中检测的共分离SSR分子标记
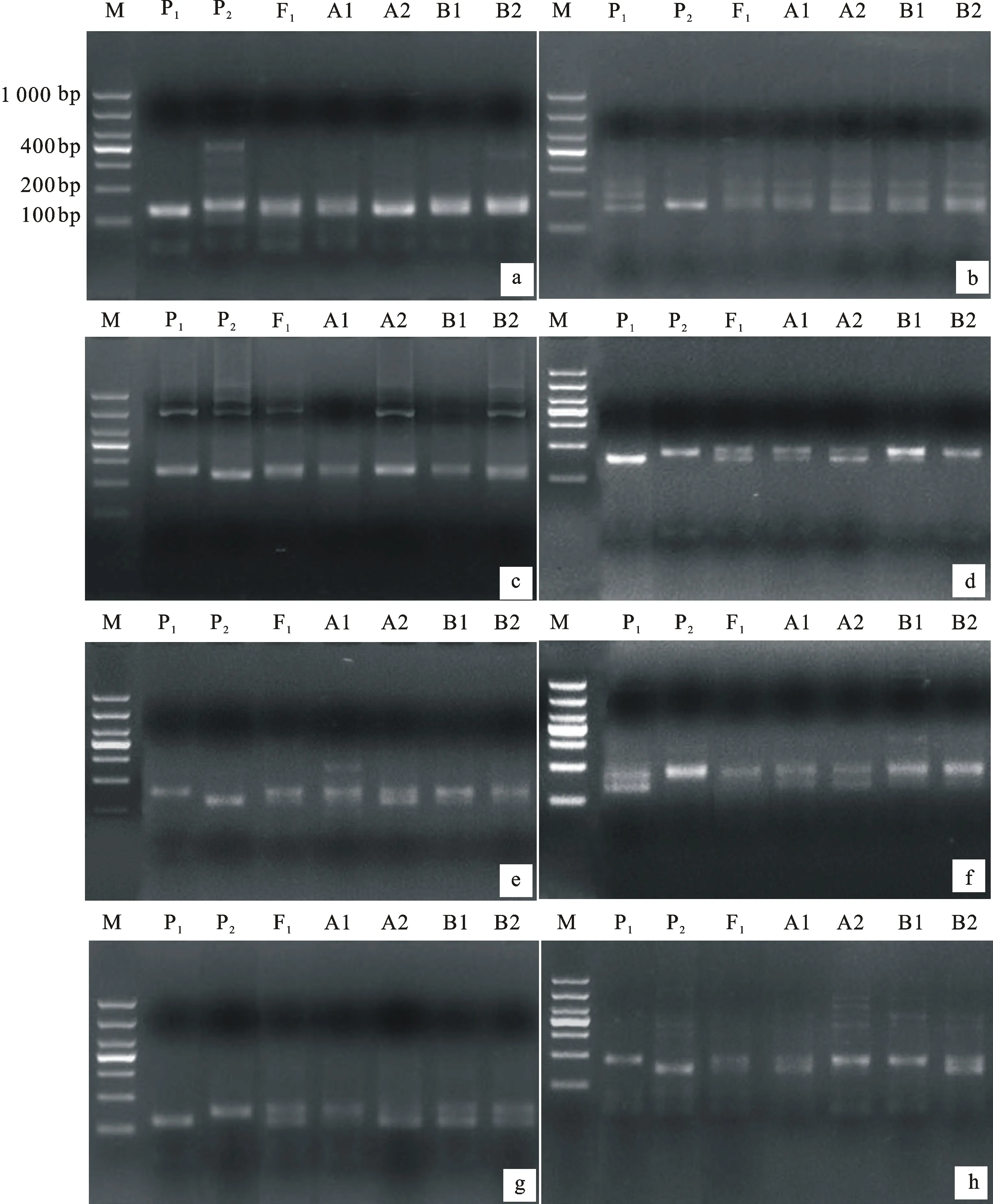
a~h分别表示分子标记引物Xwmc24、Xbarc14、Xwmc312、Xgwm124、Xwmc619、Xgwm311、Xwmc154和Xwmc770的扩增结果;M:DL1000;P1:BNS;P2:中国春;F1:BNS与中国春杂交F1代;A1:自交结实率不育池;B1:自交结实率可育池;A2:花粉可育率不育池;B2:花粉可育率可育池。
a-h indicate the amplication results of molecular marker Xwmc24,Xbarc14,Xwmc312,Xgwm124,Xwmc619,Xgwm311,Xwmc154 and Xwmc770,respectively;M:DL1000; P1:BNS; P2:Chinese Spring; F1:F1generation of BNS×CS; A1:Sterile pool of self seedsetting rate; B1:Fertile pool of self seedsetting rate; A2:Sterile pool of pollen fertility rate; B2:Fertile pool of pollen fertility rate.
图1 8对多态性SSR标记引物在亲本与BSA池中扩增的琼脂糖凝胶电泳图
Fig.1 Eight agarose gel electrophoresis of screening SSR molecular marker among BNS,Chinese Spring and BSA pools
2.5 恢复基因QTL检测和初步定位
用具有多态性的8对SSR标记对F2群体总DNA扩增,结果显示,标记的带型保持清晰,产物分子量与BSA池筛选时保持一致,部分带型图谱见图2。从图谱上读出的多态性标记基因型在Mapmaker/Exp 3.0b软件上运行,结果是,1A染色体上Xwmc24和Xwmc312连锁,2B染色体上Xwmc154和Xwmc770连锁,与Somers的SSR图谱连锁关系[17]一致,但Xbarc148未检测到与1A连锁,1B上两个标记Xgwm124和Xgwm311也未检测到连锁,这可能是标记间相距较远的缘故。按照Somers的SSR图谱连锁关系,将Xbarc148添加到1A染色体上,Xgwm124与Xgwm311添加在1B染色体上,计算出相互间的遗传距离,结果见表5。然后用WinQTLChart 2.5软件处理表5遗传距离数据,采用区间分析法检测QTL位点,结果共发现5个QTL位点,1A染色体上2个,标记为 QTL1和 QTL2;1B染色体上2个,标记为 QTL3和 QTL4;2B染色体上1个,标记为 QTL5,其中, QTL1仅与自交结实率相关, QTL2和 QTL3仅与花粉可育率相关, QTL4和 QTL5与两个表型性状均相关,说明 QTL1是与授粉相关的位点, QTL2和 QTL3是与花粉发育相关的位点, QTL4和 QTL5与花粉发育和授粉均相关。这些QTL位点的遗传特性参数见表6,从表6可看出,LOD值最小也为3.8, QTL1和 QTL4达10以上, QTL5是9.9,说明QTL的真实性很高。 QTL1、3、4、5均是加性和显性效应,与张宝雷[8]测定的效应一致。根据这些位点的LOD值和遗传效应,分析认为, QTL1、 QTL4和 QTL5应是主效QTL, QTL2和 QTL3是微效QTL。5个QTL位点和8个连锁标记的连锁图见图3。2A染色体上的连锁标记Xgwm311没有检测到QTL位点。
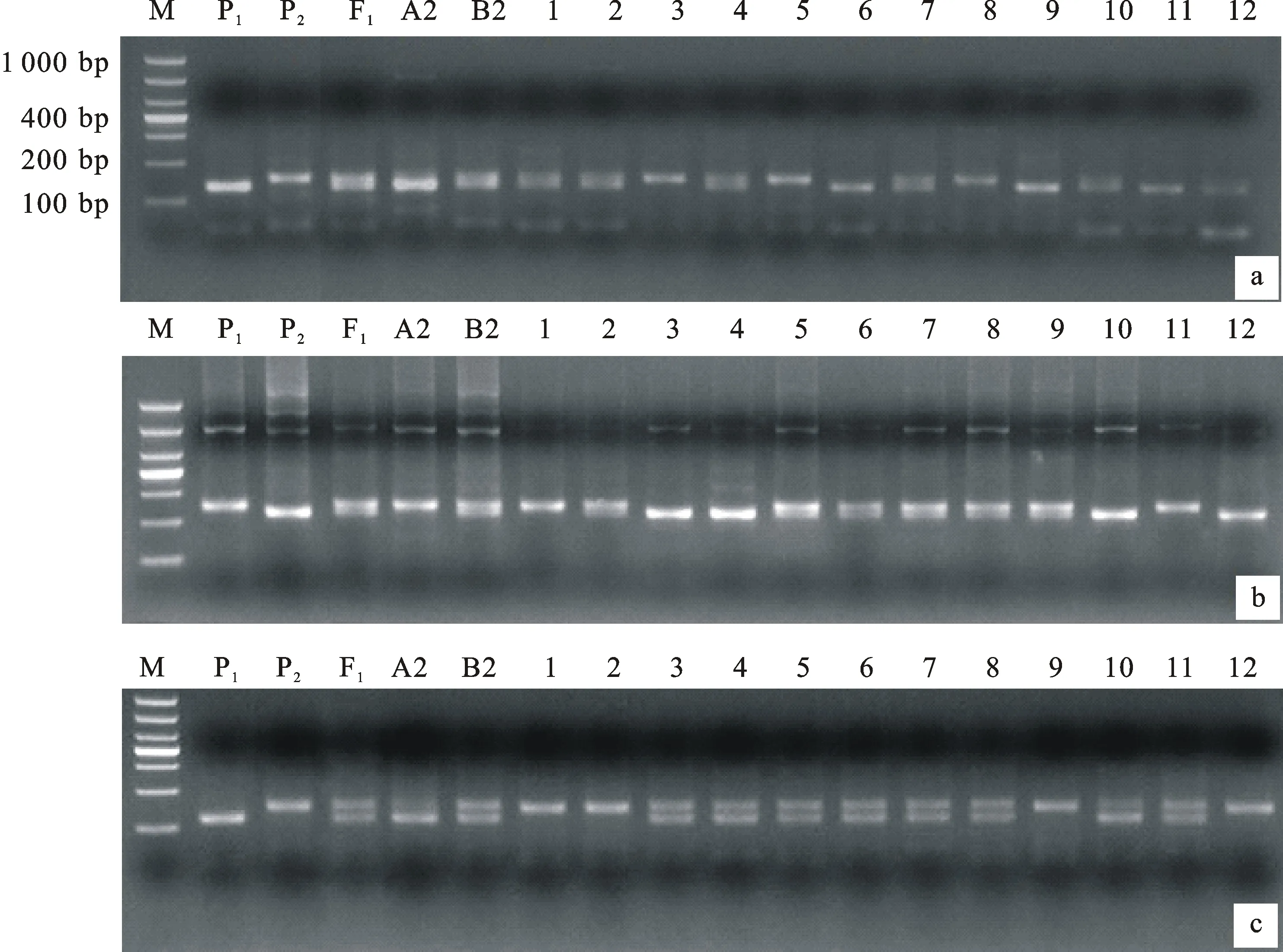
a~c分别表示标记Xwmc24、Xwmc312和Xwmc154的扩增结果; M:DL1000;P1:BNS;P2:中国春;F1:BNS与中国春杂交F1代;A1:自交结实率不育池;B1:自交结实率可育池;A2:花粉可育率不育池;B2:花粉可育率可育池;1~12:F2群体部分单株。
a-c indicate the amplication results of molecular marker Xwmc24,Xwmc312 and Xwmc154,respectively; M:DL1000; P1:BNS; P2:Chinese Spring; F1:F1generation of BNS×CS; A1:Sterile pool of self seedsetting rate; B1:Fertile pool of self seedsetting rate; A2:Sterile pool of pollen fertility rate; B2:Fertile pool of pollen fertility rate; 1-12:Part plants in F2population.
图2 部分多态性标记在部分F2群体中的扩增结果
Fig.2 Amplication results of part polymorphic markers in part F2population

表5 8个连锁标记的Mapmaker/EXP 3.0b连锁图距
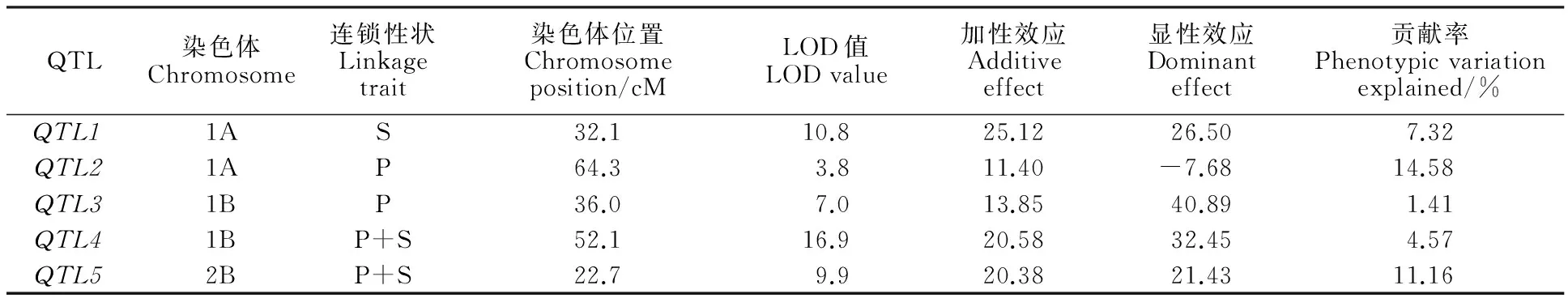
表6 WinQTLCart 2.5检测的5个QTL及遗传特性参数
连锁性状列中,P指花粉可育率,S指自交结实率。
In the column of linkage character,P refers to the pollen fertility rate,and S refers to the self seedsetting rate.

图3 中国春恢复BNS育性基因的QTL位点和连锁标记位点遗传图谱
3 讨 论
3.1 关于在中国春缺四体检测到的4个与恢复相关的连锁群
关于BNS的不育和恢复机制,如果看作是隐性核不育,那么恢复基因应是不育的等位基因,但大多数可育的小麦品种不能恢复BNS的育性,因此非等位恢复的推断更加合理[10]。中国春是BNS的高恢复系,应具有恢复BNS育性的主效基因,因此中国春的缺四体能够检测出恢复基因所在的染色体。从本研究结果可以看出,中国春的缺四体本身自交结实率,除N5D-T5A、N4A-T4B和N4A-T4D较低,分别为39.00%、54.29%和44.51%外,其余缺四体均在60.00%以上,但F1的组合自交结实率显著下降,一些如以N1B-T1A、N2B-T2D为父本的组合,不育性达到BNS的水平,显然结实率的下降是由于缺失染色体引起的,因此可以推测,缺失的染色体上携带有恢复的相关基因。根据结果,从该途径检测的4个染色体1B、2B、1A和7B缺四体与BNS杂交F1自交结实率低,3年表现稳定,因此认为这些染色体上载荷有BNS的恢复基因或重要相关基因。
3.2 关于BSA池筛选出的8对连锁分子标记
为了进一步定位恢复基因,检测和发现连锁标记是有效途径。用该4个相关连锁群染色体,加上育性不稳定的2个连锁群染色体,以及2个对照染色体共8个染色体,222对SSR引物,在2对共4个BSA池筛选,结果在3个相关的连锁群上筛选到8对连锁标记,这些标记,既是进一步检测QTL的连锁标记位点,也是恢复性选择时可利用的连锁标记。
筛选到的8对连锁标记,其中7对位于3个相关连锁群上,1对位于育性不稳定的2A染色体上,其余染色体,包括育性不稳定的5D染色体和非相关染色体,均未筛选到连锁标记,这一方面说明缺四体检测的可信性,另一方面也说明表型不稳定的材料也有遗传基础,但该遗传基础是否是真正的恢复基因,需要F2群体分离来证实。另外,缺四体检测的相关染色体7B上没有检测到连锁标记,该现象的出现有些意外,该现象是由于检测的SSR分子标记密度不够,还是缺四体检测环节出现假阳性,需后续进一步研究。
在筛选连锁标记时,建立了两种类型BSA池,这是因为在表型调查时,发现群体中部分个体自交结实率和花粉可育率两个表型不一致。自交结实率和花粉可育率不是同一概念[22],但都是雄性不育的重要指标。从结果也可看出,在两种类型BSA池中分别筛选到不同连锁标记,在自交结实率池中检测到Xwmc619/1B和Xgwm311/2A 2对连锁标记,在花粉可育率池中,除Xwmc619/1B标记外,7对标记均被检测出来,这说明花粉可育率池灵敏度更高,但也有重大缺陷,它没有检测出重要的Xwmc619/1B标记,因此,对恢复基因分子标记的筛选来说,两种类型BSA池都是必需的。
3.3 关于F2作图群体检测到的5个QTL位点
8对连锁SSR标记在F2群体中检测到5个QTL位点,其中, QTL1、 QTL4和 QTL5与自交结实率相关,认为是主效恢复基因位点,4个与花粉可育率相关的位点,除2个与自交结实率重叠,是主效位点外,另2个 QTL2和 QTL3属微效位点。需要指出的是,这些位点的重要性是根据LOD值确定的,但它们连锁的基因的确切作用需要进一步检测之后才能确定。在QTL的数目上,由于中国春是BNS的高恢复系,F1相对中国春恢复度在85.0%左右,因此,理论上,具有多数位点,但不具备全部位点,因此BNS的完全恢复,除上述位点外,还应有一些微效恢复位点存在。王茂婷[12]用BNS×山农555025的F2为作图群体,检测到14个QTL,分布在1A、1B、4A、4B和7B染色体上,而中国春中并没有检测到4A、4B染色体上有恢复位点,而检测到2B染色体上的恢复位点。2B染色体缺四体组合F1不育性很低,3年结果一致,因此,2B染色体是恢复的一个主效位点染色体。这些相同和不同,还需今后更多的检测来证实。
另外,检测的QTL数目的结果和作图群体估计的基因数目基本一致。结果中显示利用F2分离数据估计恢复基因数目,与自交结实率相关是2个主效基因,与花粉可育率相关是3个基因,检测的QTL位点,分别是3个和4个。由于表型是基因综合作用的结果,因此,基因数目估计值一般偏小。
检测的恢复多位点还有一个重要意义,就是可解释BNS的完全恢复系较少的原因。目前报道的正常可育的小麦品种,能完全恢复BNS的育性的品种较少[5,9-10]。分析认为这是由于对BNS不育性的完全恢复,上述位点以及未检测到的位点都必须是显性状态,或者说对恢复的有效状态才能实现,因此在此之前没有进行过恢复性选择的小麦品种中,恢复位点全部是显性状态的基因型,理论概率比较小,各种恢复性能力品种的比率应是恢复位点数的随机组合概率。
根据以上讨论,本研究从连锁群检测,到SSR连锁标记筛选,到QTL定位,3个环节相互联系,相互支撑,得到的结果相互印证,与数量遗传的基因对数估计的结果也吻合,因此认为检测的连锁群和定位的QTL有较高可靠性。但还有一些问题需深入研究和回答,如中国春是高恢复系,但不是完全恢复系,因此定位的位点不是全部位点,今后需用恢复度更高的恢复系与BNS杂交建立作图群体,整合定位位点;7B染色体是否是恢复相关连锁群需进一步检测;还有如BNS与中国春F1中的一些组合,缺少1对染色体即几乎完全不育,表现出重叠基因的性质;检测的QTLs与分子标记之间的距离还较大等,这些现象,可能存在实验假阳性或假隐性,也可能存在恢复基因靶基因的干扰,这些疑问需通过优化实验方案和技术路线等方法来解决,如选用透气性更好的纸袋减少套袋对授粉的影响,提高SSR分子标记筛选密度来提高QTLs与分子标记之间的连锁强度等,准确检测和定位BNS的恢复基因及位点。
[1]李罗江,茹振刚,高庆荣,等.BNS小麦的雄性不育性及其温光特性 [J].中国农业科学,2009,42(9):3019-3027.
LI L J,RU Z G,GAO Q R,etal.Male sterility and thermo-photo sensitivity charaterisitics of BNS in wheat [J].ScientiaAgriculturaSinica,2009,42(9):3019-3027.
[2]张自阳,胡铁柱,冯素伟,等.温敏核雄性不育小麦BNS的育性转换规律初探 [J].河南农业科学,2010(7):5-9.
ZHANG Z Y,HU T Z,FENG S W,etal.A preliminary study on fertility alteration of thermo-sensitive genic male sterile wheat line BNS [J].HenanAgriculturalSciences,2010(7):5-9.
[3]周美兰,茹振钢,骆叶青,等.两系小麦不育系BNS雄性育性的转换 [J].核农学报,2010,24(5):887-894.
ZHOU M L,RU Z G,LUO Y Q,etal.Male fertility transformation of two-line wheat sterile lines BNS [J].JournalofNuclearAgriculturalSciences,2010,24(5):887-894.
[4]李罗江,茹振钢,高庆荣,等.小麦雄性不育系BNS及其杂种F1的育性分析 [J].麦类作物学报,2009,29(4):583-587.
LI L J,RU Z G,GAO Q R,etal.Analysis the fertility of male-sterile line BNS and its F1hybrids in wheat [J].JournalofTriticeaeCrops,2009,29(4):583-587.
[5]宁江权,茹振钢,郑炜君,等.BNS小麦雄性不育性及其恢复性的研究 [J].麦类作物学报,2011,31(4):642-647.
NING J Q,RU Z G,ZHENG W J,etal.Male sterility and restoration of thermo-photo-sensitive male sterile line BNS of common wheat [J].JournalofTriticeaeCrops,2011,31(4):642-647.
[6]范晓静,马小飞,王 震,等.小麦温敏雄性不育系BNS的遗传稳定性及恢复性 [J].西北农林科技大学学报(自然科学版),2015,43(4):53-58.
FAN X J,MA X F,WANG Z,etal.Hereditary stability and restoration of thermo-photo-sensitive male sterile line BNS of wheat(TriticumaestivumL.) [J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2015,43(4):53-58.
[7]秦志英,杨 靖,马亚朝,等.BNS小麦雄性不育系育性的稳定性和波动性 [J].西北农业学报,2013,22(4):39-43.
QIN Z Y,YANG J,MA Y C,etal.Stability and variability of male infertility of wheat BNS line [J].ActaAgriculturaeBoreali-occidentalisSinica,2013,22(4):39-43.
[8]张保雷,张卫东,高庆荣,等.温光敏雄性不育小麦BNS育性的遗传效应分析 [J].中国农业科学,2013,46(8):1533-1542.
ZHANG B L,ZHANG W D,GAO Q R,etal.Genetic analysis on male sterility of thermo-photo-sensitive male sterile line BNS in wheat [J].ScientiaAgriculturaSinica,2013,46(8):1533-1542.
[9]马小飞,王 震,李雪垠,等.小麦温光敏雄性不育系BNS育性恢复性测定及杂种优势 [J].西北农业学报,2013,22(7):90-94. MA X F,WANG Z,LI X Y,etal.Restoring ability test and heterosis analysis of wheat thermo-photo-sensitive genic male sterile line BNS [J].ActaAgriculturaeBoteali-occidentalisSinica,2013,22(7):90-94.
[10]曹银萍,杨 靖,茹振钢,等.小麦温敏雄性不育BNS的显性不育和非等位显性恢复特性观察[R/OL].中国科技论文在线(http://www.paper.edu.cn/releasepaper/content/),2015:3-15. CAO Y P,YANG J,RU Z G,etal.Observation of the characteristics of dominant infertility and non-allelic dominant recovery on male sterile wheat BNS [R/OL].Sciencepaper Online(http://www.paper.edu.cn/releasepaper/content/),2015:3-15.
[11]XING Q H,RU Z G,ZHOU C J,etal.Molecular tagging and mapping of the thermo-sensitive genic male-sterile gene( wtms1) in wheat [J].TheoreticalandAppliedGenetics,2003,107(8):1500-1504.
[12]王茂婷.BNS小麦雄性不育性恢复基因遗传特性和QTL初步定位 [D].山东:山东农业大学,2011:41.
WANG M T.Genetic analysis and QTL priliminary mapping for fertility of BNS [D].Shandong:Shandong Agricultural University,2011:41.
[13]王风平,梅明华,徐才国,等.光敏核不育水稻农垦58S与正常品种“农垦58”在 pms1区段无育性基因分离 [J].植物学报,1997,39(10):922-925.
WANG F P,MEI M H,XU C G,etal. Pms1 is not the locus relevant to fertility difference between the photoperiod-sensitive male sterile rice Nongken 58S and normal rice “Nongken 58” [J].ChineseBulletinofBotany,1997,39(10):922-925.
[14]CHEN D H,RONALD P C.A rapid DNA minipreparation method suitable for AFLP and other PCR applications [J].PlantMolecularBiologyReporter,1999,17(1):53-57.
[15]MICHELMORE R W,PARAN I,KESSELI R V.Identification of markers linked to disease-resistance genes by bulked segregant analysis:a rapid method to detect markers in specific genomic regions by using segregating populations [J].ProceedingsoftheNationalAcademyofSciences,1991,88(21):9828-9832.
[16]RöDER M S,KORZUN V,WENDEHAKE K,etal.A microsatellite map of wheat [J].GeneticsSocietyofAmerica,1998,149(14):2007-2023.
[17]SOMERS D J,ISAAC P,EDWARDS K.A high-density microsatellite consensus map for bread wheat(TriticumaestivumL.) [J].TheoreticalandAppliedGenetics,2004,109(16):1105-1114.
[18]何蓓如,董普辉,宋喜悦,等.小麦温度敏感不育系A3314温敏特性研究 [J].麦类作物学报,2003,23(1):1-6.
HE B R,DONG P H,SONG X Y,etal.Study on the thermo-sensitivity male sterile wheat line A3314 [J].JournalofTriticeaeCrops,2003,23(1):1-6.
[19]王竹林,杨 睿,杨兴圣,等.Mapmaker 3.0和作图软件使用 [J].实验室研究与探索,2012,31(11):62-65.
WANG Z L,YANG R,YANG X S,etal.The use of mapmaker 3.0 and mapping software [J].ResearchandExplorationinLaborator,2012,31(11):62-65.
[20]WANG S,BASTEN C J,ZENG Z B.Windows QTL Cartographer 2.5 [EB/OL].Department of Statistics,North Carolina State University,Raleigh,NC.[2015-10-16]http://statgen.ncsu.edu/qtlcart/WQTLCart.htm.
[21]刘仁虎,孟金陵.MapDraw,在Excel中绘制遗传连锁图的宏 [J].遗传,2003,25(3):317-321.
LIU R H,MENG J L.MapDraw:a microsoft excel macro for drawing genetic linkage maps based on given genetic linkage data [J].Hereditas,2003,25(3):317-321.
[22]姚克敏,刘 梅,袁潜华.水稻不育系育性观察指标套袋自交结实率和花粉可育度的比较分析 [J].杂交水稻,1998,13(4):23-25.
YAO K M,LIU M,YUAN Q H.Comparison of bagged seed set with pollen fertility in observing the fertility of male sterile rice [J].HybridRice,1998,13(4):23-25.
Detection of Linkage Groups and Location of QTLs in Chinese Spring for Restorer Wheat BNS Male Sterility SUN Huihui1,YANG Jing1,2,WEI Xiao1,FU Qingyun1,
CAO Yinping1,RU Zhengang1,LI Youyong1
(1.Henan Institute of Science and Technology/Key Discipline Opening Laboratory of Crop Molecular Breeding of Henan Province/Collaborative Innovation Center of Modern Biological Breeding,Xinxiang,Henan 453003,China; 2.College of Agronomy,Sichuan Agricultural University,Chengdu,Sichuan 611130,China)
BNS is a new type of thermo-sensitive wheat male-sterile line,and has excellent sterility and convertibility by itself. It is of important value for the utilization of hybrid wheat and the research of genetic resources. In order to locate the restorer gene of BNS,wheat Chinese Spring(CS),a high restorer line for BNS,was selected as parent material to reform an F2population by crossing over BNS. In the detection,two bulked segregant analysis(BSA) pools of phenotypes,the self-seedsetting rate and pollen fertility rate were established. First,the linkage groups related to restorer gene(s) were detected by Chinese Spring nulli-tetrasomes. Then,SSR molecular markers on these linkage groups were used to screen two BSA pools,and the linked markers obtained in screening were used to screen F2population to detect QTL loci of restorer gene(s). The results showed that when CS nulli-tetrasomes was crossed over BNS,there were four recombinations in F1to be pulled into low self-seedsetting rate,meaning that the four linkage groups on chromosomes 1B,2B,1A and 7B were relative to the recovery of BNS. When 222 pairs of SSR primers from 8 chromosomes were used to screen two phenotypes BSA pools,it was found that there were eight SSR markers on three linkage groups on chromosomes 1B,2B and 1A,which are linked with the restoration of BNS. These eight linkage markers then were used for screening 210 individual plants of F2population,and five QTL loci were found. Of them,one QTL was relative to self seedsetting rate only,and two major QTLs were relative to two phenotypes,and two minor QTLs were relative to fertile pollen rate only,which were located on chromosomes 1A,1B and 2B,respectively. These results laid a value foundation for MAS(marker-assisted selection) and fine mapping of BNS restorer genes.
Wheat; BNS male sterility; Restorer gene; SSR molecular marker; QTL locus
时间:2016-07-07
2015-12-03
2016-03-30
河南省基础与前沿计划重点项目(122300410011,162300410136)
E-mail:vip.sunhui@qq.com(孙慧慧);yangjing228@foxmail.com(杨 靖,与第一作者同等贡献)
李友勇(E-mail:liyouyong@163.com)
S512.1;S330
A
1009-1041(2016)07-0856-10
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160707.1530.010.html
