转cry1Ab/Gc基因玉米的不同转化事件Bt蛋白表达和抗虫性分析*
2016-12-15刘相国赵方方韩四平尹悦佳
刘 洋,柳 青,李 楠,刘相国,张 航,赵方方,贾 伟,韩四平,尹悦佳**
(1.吉林省农业科学院; 2.吉林省农业生物技术重点实验室; 3.哈尔滨师范大学;4.吉林农业大学)
转cry1Ab/Gc基因玉米的不同转化事件Bt蛋白表达和抗虫性分析*
刘 洋1,2,柳 青1,2,李 楠1,2,刘相国1,2,张 航3,赵方方3,贾 伟4,韩四平1,2,尹悦佳1,2**
(1.吉林省农业科学院; 2.吉林省农业生物技术重点实验室; 3.哈尔滨师范大学;4.吉林农业大学)
分析不同转化体Bt蛋白表达量和评估其抗虫性,进而筛选优异转化事件是转基因玉米新品种培育研究中的重要环节.为分析转cry1Ab/Gc基因玉米中Bt蛋白表达特性与抗虫性的关系,筛选优秀转化事件,研究以三个转化事件HG-1、 HG-2、HG-3为试验材料,利用ELISA检测、玉米螟生测等技术,在室内和田间详细分析心叶期和抽丝期玉米抗虫蛋白表达量,并评估抗虫性.研究结果表明,同一转化事件不同组织或器官Cry1Ab/Gc蛋白含量存在显著差异,均表现为叶>茎>根;不同时期叶片Cry1Ab/Gc蛋白含量存在显著差异,表现为抽丝期>心叶期;不同转化事件间,心叶期转化事件HG-1的叶片、抽丝期转化事件HG-1和HG-2的茎中Cry1Ab/Gc蛋白的含量明显高于其他材料.室内和田间亚洲玉米螟生测试验结果表明:不同转化事件抗虫性差异显著,转化事件HG-1在心叶期和抽丝期亚洲玉米螟抗性显著高于其他两个玉米转化事件,与该时期Cry1Ab/Gc蛋白高表达的试验结果一致.本研究结果证实不同玉米转化事件Bt蛋白表达量显著差异,心叶期和抽丝期Bt蛋白表达量与亚洲玉米螟抗性呈正相关,可以作为抗虫转基因玉米优秀转化体初步筛选的重要技术指标,具有可操作性强、技术稳定性好、节省时间等优势,为抗虫转基因玉米新品种培育研发提供数据参考.
Cry1Ab/Gc蛋白;转化事件;抗虫性
0 引言
亚洲玉米螟是我国玉米的重要害虫,一般发生年份可使玉米减产10%左右,大发生年份可造成玉米产量损失30%以上,严重时甚至绝收[1].转Bt基因玉米是通过生物技术将外源抗虫基因插入到玉米基因组中,使其成为具备抗虫性状的玉米品系,为控制玉米螟危害提供了新的途径[2].目前,已有26个国家批准40余种转Bt基因玉米事件开展商业化种植或饲料食品加工[3],其中包括孟山都公司和先正达公司分别推出的MON810 与 Bt11、Bt176 抗虫玉米杂交种[4].
进入商业化种植的转基因材料初期通常产生成百至上千个不同事件,并不断筛选事件中具有商业用途所需的转基因表达水平和模式的单个事件.岳同卿[5]等从12个转cry1Ah基因玉米事件植株中,筛选出高抗转基因事件2个,分别为B1-1 和 B1-7.孙越等[6]从以玉米自交系9801为背景的42个转化事件,筛选出高抗草甘膦、高抗玉米螟转化事件3个,从以玉米自交系齐319为背景的12个转化事件中筛选出高抗草甘膦、高抗玉米螟转化事件3个,并发现抗虫基因cry1AcM表达量的高低与玉米抗虫性强弱成正比.
一般来说,表达量越高,抗虫效果就越好.早期的转抗虫基因植物的杀虫蛋白在植株上的表达量很低(占全部可溶性蛋白的 0.001%以下),抗虫效果不理想[7].从已有的研究结果来看,通过对cry基因的修饰、改造和密码子优化,不但可以有效解决昆虫产生抗性问题[8],同时转基因植物中Bt蛋白表达量也逐步提高,获得了多种有应用价值的转基因植物.Bohorova等[9]将融合基因crylB-crylAb转入玉米中来防治多种农业害虫.国内很多通过密码子优化,改造合成新的基因,获得高表达抗虫蛋白的转基因植物,有效提高了转基因玉米的杀虫活性[10-12].但对于在不同生育期玉米不同组织部位杀虫蛋白表达量和抗虫效果的详细解析还未见报道.
该实验室前期通过结构域交换等合理化分子改造方法获得新型抗虫基因cry1Ab/Gc,将其构建到植物表达载体pTF101-ubi中,通过农杆菌介导法进行玉米遗传转化,共获得216个转化事件.经过高压力虫试初步筛选,获得农艺性状优异的玉米转化事件3个,分别为HG-1、 HG-2、 HG-3.本研究通过对三个转化事件T4代材料心叶期和抽丝期抗虫蛋白表达量测定和抗虫性分析,解析在玉米不同生育期两者关系,筛选出高抗玉米螟的转基因玉米转化事件,为抗虫转基因玉米新品种培育研发提供数据参考.
1 材料与方法
1.1 试验材料 转cry1Ab/Gc基因玉米转化事件HG-1、HG-2、HG-3,是将抗虫基因cry1Ab/Gc构建到适用于单子叶植物高效表达的植物表达载体pTF101-ubi中,通过农杆菌介导法进行玉米遗传转化,并对216个转基因玉米事件的T2、T3代抗虫筛选后获得的三个性状优良的转化事件,由吉林省农业科学院农业生物技术研究所创制;pTF101-ubi-cry1Ab/Gc质粒为用于转化到玉米中的含cry1Ab/Gc的植物表达载体质粒,抗虫基因cry1Ab/Gc由玉米泛素化启动子ubi启动,nos终止子终止.试验中所需亚洲玉米螟虫由吉林省农业科学院农业生物技术研究所提供.
1.2 试验方法
1.2.1 PCR
选取HG-1、HG-2、HG-3玉米T4代植株各三株,用CTAB法(参照 GB/T 19495.3—2004《转基因产品检测核酸提取纯化方法》中的 CTAB-1 法)分别提取的叶片DNA,浓度稀释为1μg/μL作为模板.pTF101.1-ubi-cry1Ab/Gc质粒为阳性对照,非转基因玉米HiII为阴性对照,水为空白对照.根据载体上目的基因cry1Ab/Gc序列,利用Primer Premier 5软件设计引物,引物序列如下:cry1Ab/Gc R: CGCCTTATTGGCAACTAC; cry1Ab/Gc F: CCTGCTACTACTGGACGAAA.使用2×EasyTaq PCR SuperMix进行PCR反应.反应条件为:95℃,5 min;95℃,30 sec、58℃,45sec、72℃,90 sec,共30 cycles;72℃ 10 min.PCR反应产物经1%琼脂糖凝胶电泳检测
1.2.2 ELISA
分别在心叶期、抽丝期选取三个转化事件HG-1、HG-2、 HG-3和非转基因玉米HiII植株各三株,3次重复,剪取根、茎和叶片,按照Bt-Cry1Ab/1Ac ELISA Kit 试剂盒方法,测定在心叶期和抽丝期的根、茎、叶中cry1Ab/Gc基因的蛋白表达量,使用 Bio-Rad 酶标仪测定其 OD655 值.根据标准品蛋白的浓度和其 OD655值,绘制出标准曲线,根据标准曲线计算出待测样品中 Bt 蛋白浓度.计算公式为:蛋白含量鲜重测试样品浓度(μg/g)=测试样品浓度(ng/ml)×稀释倍数×抽提液(mL)/组织鲜重(g)×1000(ng/μg)
1.2.3 心叶期抗虫性
在心叶期,将已经黑头的、即将孵化的玉米螟卵块接于转基因玉米HG-1、 HG-2、 HG-3、非转基因玉米HiII心叶中.每种材料接虫96株,每株接 2-3个中等大小的卵块,于接虫14天-21天后,调查食叶级别.参照国家行业标准(NY/T 1248.5-2006)分级标准,评价各转化事件抗虫性.

表1 玉米螟对心叶为害程度的分级标准

表2 玉米抗玉米螟的抗性评价标准
1.2.4 抽丝期抗虫性
抽丝期将已经黑头的、即将孵化的玉米螟卵块接于HG-1、 HG-2、 HG-3、非转基因玉米HiII.每株接2~3个中等大小的卵块,接虫14~21 d后调查植株被取食情况.参照国标(农业部953公告-10.1-2007)分级标准,调查玉米蛀孔数量、蛀孔隧道长度以及存活幼虫数量,采用SPSS统计软件进行分析,采用单因素方差分析方法进行差异显著性分析,采用Tukey法和Duncan法进行材料间指标的多重比较.
抽丝期取转基因玉米和非转基因玉米新鲜花丝在实验室测定抗虫能力.称取玉米花丝1g,放置于铺有润湿的三层滤纸的培养皿中,将初孵玉米螟5只接于花丝上,注意保持湿度和温度,观察5天玉米螟取食花丝情况.
2 结果
2.1 PCR
为鉴定抗虫基因cry1Ab/Gc已整合到三个转化事件HG-1、HG-2、HG-3中,对三个转化事件玉米进行PCR鉴定.以pTF101-ubi-cry1Ab/Gc质粒为阳性对照,水为阴性对照.根据孟德尔遗传分离规律,自交授粉后代表现3:1分离规律,随着自交代数的增加,获得纯合体的概率越来越高,本研究选取的是T4代转基因材料,纯合度达93%以上.因此随机选择3株进行检测,由图可以看出,质粒和三个转化事件玉米植株扩增出981bp条带,阴性对照和空白对照未扩增出目的条带,可见抗虫基因cry1Ab/Gc在三个转化事件HG-1、HG-2、HG-3中稳定遗传.

图1 转基因玉米PCR鉴定 M:DL2000 marker; 1:质粒(阳性对照);2:HiII(阴性对照);3: 水(空白对照);4-6:转基因玉米HG-1;8-10:转基因玉米HG-2;12-14:转基因玉米HG-3
2.2 ELISA
对心叶期和抽丝期三个转化事件进行ELISA检测,分析不同转化事件不同组织抗虫蛋白Cry1Ab/Gc表达量.根据标准曲线计算出待测样品中Cry1Ab/Gc蛋白占总蛋白的鲜重.
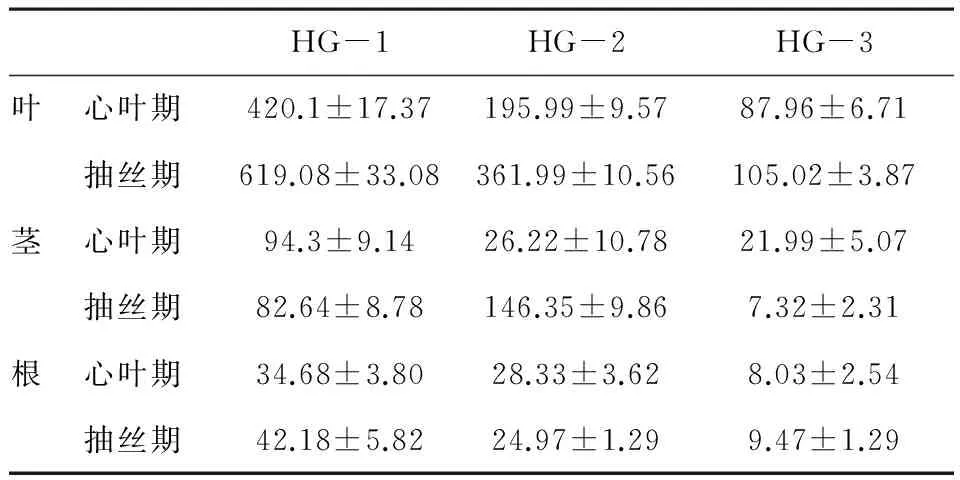
表3 不同时期不同转化事件不同部位Cry1Ab/Gc蛋白鲜重
结果表明:在同一时期,不同转化事件中Cry1Ab/Gc蛋白表达量的一致趋势为,叶片中含量最高,茎次之,根中最低.在心叶期,转化事件HG-1不同部位Cry1Ab/Gc蛋白表达量均高于HG-2和HG-3;在抽丝期,转化事件HG-1的根、叶Cry1Ab/Gc蛋白表达量明显高于转化事件HG-2和HG-3,但转化事件HG-2的茎中Cry1Ab/Gc蛋白表达量高于转化事件HG-1和HG-3.
随着转基因玉米的生长,不同时期同一转化事件同一部位的Cry1Ab/Gc蛋白表达量有所变化.转化事件HG-1、HG-2、HG-2的叶和根、HG-2的茎中Cry1Ab/Gc含量升高.
2.3 心叶期抗虫性
为分析三个转化事件在Cry1Ab/Gc表达量不同的情况下的抗虫性情况.在心叶期对非转基因玉米和三个转化事件转基因玉米进行田间玉米螟抗虫性试验.接初孵幼虫14 d后,非转基因玉米叶片出现大量排孔、被玉米螟虫啃食严重;转化事件HG-1叶片较少排孔,未受影响;转化事件HG-2、 HG-3叶片出现一定的排孔,部分被玉米螟虫啃食.记录各材料玉米螟危害程度级别,计算玉米螟对各鉴定材料群体叶片食叶级别的平均数.
参照国家行业标准(NY/T 1248.5-2006)分级标准,HG-1虫害级别为1级,抗性为高抗(HR),HG-2和HG-3虫害级别为3,抗性为抗(R),HiII虫害级别为9,抗性为感(S).综上,田间心叶期抗虫性高低依次为HG-1> HG-2>HG-3.
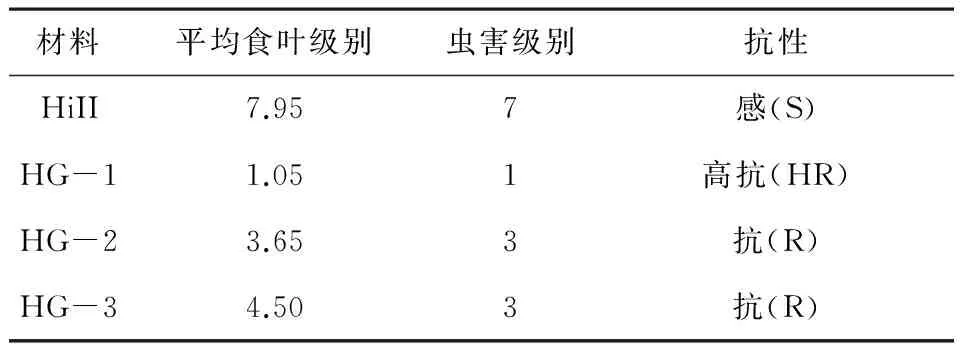
表4 心叶期转cry1Ab/Gc基因玉米抗虫性评价

图2 心叶期转基因玉米抗虫性鉴定 A:HiII; B:HG-1;C:HG-2;D: HG-3
2.4 抽丝期抗虫性
为进一步评价三个转化事件抗虫性,在抽丝期接虫后统计植株被害情况.参照国标(农业部953公告-10.1-2007)分级标准,调查玉米蛀孔数量、蛀孔隧道长度以及存活幼虫数量(表5),结果表明:抽丝期转基因玉米HG-1、HG-2抗虫性高于HG-3,且明显高于对照HiII,抗性级别依次为高抗、高抗、抗、感.

表5 抽丝 期转cry1Ab/Gc基因玉米抗虫性评价
表中不同小写字母间5%水平上差异显著,表中数值为Mean±SE.
同时,在转基因玉米和非转基因玉米抽丝期选择新鲜花丝在实验室测定抗虫能力,如图3所示.结果发现,对照组玉米螟前三天生长良好,第4、5天出现死亡,花丝已全部吃光,只剩深褐色的粪便和废屑;转基因玉米HG-1、HG-2抗性良好.它们的花丝被取食非常少,接虫3天以后玉米螟死亡率在80%以上,5天以后大部分转化系上玉米螟死亡率到达100%.HG-3被部分取食.因此,转化事件HG-1、HG-2室内花丝抗虫性级别较高.

图3 室内抗虫性测定A:空白对照;B:HiII;C:HG-1;D:HG-2;E:HG-3
3 讨论
培育转基因抗虫玉米是解决玉米虫害的有效方法.从已有的研究结果来看,通过对cry基因的修饰与改造,转Bt基因的作物可以获得较好的抗虫效果[13-14].该实验室在前期通过合理化定向分子改造出新型抗虫基因cry1Ab/Gc,通过遗传转化到玉米中获得216 个转化事件.经过高压力抗虫性初步筛选,获得目标性状优异的玉米转化体3个,分别为HG-1、HG-2、 HG-3.
为分析不同转化体Bt蛋白表达量和评估抗虫性.首先对转化事件HG-1、HG-2、HG-3的T4代的玉米进行PCR鉴定,确定阳性植株.采用ELISA方法分别对三个转化事件阳性转基因玉米心叶期和抽丝期的根、茎、叶中Cry1Ab/Gc蛋白表达量进行了测定,研究表明(1)在同一时期,不同转化事件中Cry1Ab/Gc蛋白表达量的一致趋势为,叶片中含量最高,茎次之,根中最低;这种现象与李葱葱等[15]对先正达公司转cry1Ab玉米中Cry1Ab蛋白、杨丽丽[16]对抗虫转基因玉米Bt799中mCry1A蛋白在各组织部位表达量趋势一致;(2)不同时期叶片Cry1Ab/Gc蛋白含量存在显著差异,表现为抽丝期>心叶期,与刘金洋等[17]对抗虫玉米的Bt蛋白表达特征分析趋势一致;(3)不同转化体间,心叶期转化事件HG-1的叶片、抽丝期转化事件HG-1和HG-2的茎中Cry1Ab/Gc蛋白的含量明显高于其他材料.以上趋势可能由于外源基因cry1Ab/Gc插入玉米中不同的位点、目的基因拷贝数等因素不同所致;也可能当外源基因整合到生长发育相关的基因附近,生长发育基因的调控序列也会影响外源基因的表达.外界环境因子、植株不同组织中碳水化合物和总蛋白含量不同等因素也能引起外源基因表达量的差异,其机理有待深入研究.
玉米螟初孵幼虫取食偏好嫩叶、抽穗后的秸秆,破坏植物组织,阻碍玉米养分的输送,进而造成减产,因此心叶期和抽丝期是玉米螟危害的主要时期.本研究参照国家行业标准分级标准,对心叶期、抽丝期三个转化事件进行抗虫性评价.在心叶期,转化事件HG-1抗虫性级别为高抗,转化事件HG-2和HG-3抗虫性级别为抗;抽丝期的田间和室内抗虫性试验结果表明抽丝期 HG-1和HG-2抗虫性级别为高抗,HG-3抗性级别为抗.这与心叶期转化事件HG-1叶中、抽丝期转化事件HG-1叶中、HG-2叶和茎中Cry1Ab/Gc蛋白表达量相对较高的趋势一致.说明转基因玉米对亚洲玉米螟的毒性强弱与其所表达的毒蛋白含量高低相吻合[6].根据杀虫晶体蛋白的作用机制,Bt蛋白被昆虫摄入并活化后,与昆虫中肠上皮细胞的受体结合,造成离子通道或形成孔洞,引起渗透压失衡,最终导致昆虫死亡[18].转基因作物的抗虫性是杀虫蛋白与特异性受体结合的过程.ELISA技术的基础就在于抗原抗体之间的特异结合反应,具有高效、灵敏、特异、稳定、可靠等特点.Wang等[19]已利用此技术筛选出高抗二化螟虫的转基因水稻T1C-19b.本研究通过ELISA方法测定心叶期和抽丝期不同转化体的根、茎、叶中抗虫蛋白Cry1Ab/Gc表达量,并对转基因玉米抗虫性进行评价,明确了心叶期和抽丝期Bt蛋白表达量与亚洲玉米螟抗性呈正相关,选育出高表达抗虫蛋白高抗亚洲玉米螟的转基因玉米HG-1.因此对转基因作物中外源基因的表达水平进行个案分析,可作为优秀抗虫转化体初步筛选和评估的重要技术指标,为抗虫转基因玉米新品种培育研发提供数据参考.
[1] 王振营, 鲁新, 何康来, 等. 中国亚洲玉米螟的研究历史、现状和展望[J]. 沈阳农业大学学报,2000, 31(5): 402 -412.
[2] Hilbeck A, Baumgartner M, Fried PM, et al. Effects of transgenic Bacillus thuringiensis corn-fed prey on mortality and development time of immature Chrysoperla carnea (Neuroptera: Chrysopidae) [J].EnvironmentalEntomology, 1998, 27: 480-487.
[3] 吕霞, 王慧, 曾兴, 等. 转基因抗虫玉米研究及应用[J]. 作物杂志, 2013, 2:7-12.
[4] 刘桂玲, 陈举林, 李平海. 转基因玉米的研究进展与展望[J]. 农业生物技术科学, 2004, 20 (4): 36-38
[5] 岳同卿, 郎志宏, 王延锋, 等. 转Bt cry1Ah 基因抗虫玉米的获得及其遗传稳定性分析[J]. 农业生物技术学报, 2010, 18(4):638-644.
[6] 孙越, 刘秀霞, 李丽莉, 等. 兼抗虫除草剂干旱转基因玉米的获得和鉴定[J]. 中国农业科学, 2015,48(2):215-228.
[7] 乔光明. 抗虫基因Bt的研究进展[J]. 西南科技大学学报, 2005,20(2): 75-78.
[8] 李晨, 刘博林. 转 Bt 基因抗虫作物培育现状及 Bt 蛋白的改造和聚合策略的利用[J]. 生物工程学报, 2015, 31(1): 53-64.
[9] Bohorova N, Frutos R, Royer M, et al. Novel synthetic Bacillus thuringiensis CryIB gene and the CrylB-CrylAb translational fusion confer resistance to southwestern corn borer,sugarcane borer and fall armyworm in transgenic tropical maize[J].TheoreticalandAppliedGenetics, 2001, 103: 817-826.
[10] 赖锦盛, 董永彬, 宋伟彬, 等. 人工合成用于转基因抗虫植物的 Bt杀虫基因. 中国, 200910082840.6[P].2009-11-18.
[11] 李圣彦, 郎志宏, 朱莉, 等. 利用密码子优化提高Bt cry1Ah基因在转基因玉米(Zea maysL.)中的表达[J].中国农业科技导报, 2012, l3(6): 20-26.
[12] 李新海, 铁双贵, 岳润清, 等. 编码杀虫蛋白基因cry1Ab-Ma其表达载体及应用[P]. 中国,CN102094030A,2011-06-15.
[13] Walters FS, de Fontes CM, Hart H, et al. Lepidopteran-active variable-region sequence imparts coleopteran activity in eCry3.1Ab,an engineeredBacillusthuringiensishybrid insecticidal protein[J]. Appl Environ Microbiol,2010,76 (10) : 3082-3088.
[14] Naimov S, Dukiandjiev S, de Maagd RA. A hybridBacillusthuringiensisdelta-endotoxin gives resistance against a coleopteran and a lepidopteran pest in transgenic potato[J]. Plant Biotechnol J,2003, 1 (1) : 51-57.
[15] 李葱葱, 刘娜, 康岭生, 等. 转基因抗虫玉米Bt蛋白表达量的研究[J]. 玉米科学, 2006, 14(3): 40-41.
[16] 杨丽丽, 董姗姗, 刘燕, 等.mCry1Ac基因在抗虫转基因玉米 Bt799 中的表达特征[J]. 生态与农村环境学报, 2014, 30(5): 670-673.
[17]刘金洋, 姜海洋, 赵阳, 等. 转基因抗虫玉米转育株Bt蛋白的表达特征分析[J]. 安徽农业大学学报, 2014, 41(5):725-730.
[18] Schnepf E, Crickmore N, VanRie J, et al. Bacillus thuringiensis and its pesticidal crystal Proteins[J],JMicrobiolMolBiolRev, 1998, 62: 775-806.
[19] Wang YN, Ke KQ, Li YH, et al. Comparison of three transgenic Bt rice lines for insecticidal protein expression and resistance against a target pest, Chilo suppressalis (Lepidoptera: Crambidae).InsectScience, 2016, 23, 78-87.
(责任编辑:季春阳)
Analysis of Bt Protein Expression and Insect Resistance in Different Transgeniccry1Ab/GcMaize
Liu Yang1,2, Liu Qing1,2,Li Nan1,2;Liu Xiangguo1,2;Zhang Hang3, Zhao Fangfang3, Jia Wei4, Han Siping1,2,Yin Yuejia1,2
(1.Jilin Academy of Agricultural Sciences; 2. Key Laboratory of Agricultural Biotechnology of Jilin Province; 3. Harbin Normal University; 4. Jilin Agricultural University)
It’s an important key to analysis of Bt protein expression and insect resistance in different transgenic maize for new variety breeding. To analysis of relationship between Bt protein expression and the insect resistance of transgeniccry1Ab/Gcmaize, three transformants, HG-1, HG-2, HG-3 as experimental materials are selected, and the expression of different transformants in different tissues at different periods are detected by using an enzyme-linked immunosorbent assay (ELISA) method, the insect resistance of transgenic maize at whorl stage and silking stage are evaluated. The results show that the order ofCry1Ab/Gcprotein expression in different tissues at the same period was leaf > stem > root with significant differences andCry1Ab/Gcprotein expression in transgenic leaf at different periods is silking stage > whorl stage;Cry1Ab/Gcprotein expression of HG-1 maize leaf in whorl stage and HG-1、HG-2 stem at silking stage is significantly higher than that of other materials. The laboratory and field test at whorl stage and silking stage show that the Asian corn borer resistant of HG-1 is significantly higher than that of the other transformants, in accord with the high expression ofCry1Ab/Gcprotein in leaf and stem of HG-1. The results of this study demonstrate that the expression of Bt protein is related to the Asian corn borer resistance at whorl stage and silking stage. The expression of Bt protein can be an important technical index as selecting excellent insect resistant transgenic maize, with operability, stability, saving time and other advantages.
Cry1Ab/Gcprotein expression; Transformants; nsect resistance
2016-05-22
*吉林省农业科技创新工程资助(吉财教[2012]1072);吉林省科技发展计划项目资助(20160520060JH)
Q78
A
1000-5617(2016)03-0087-06
**通讯作者:yyjqishi@163.com
