SMG-1在肾细胞癌中表达及其对预后的意义
2016-12-15雷光辉赵鹏靓
向 彬,种 铁,雷光辉,张 旭,赵鹏靓,崔 杰
(1.西安交通大学医学院第二附属医院泌尿外科,陕西西安 710004;2.西电集团医院泌尿外科,陕西西安 710077;3.安康市中心医院肿瘤科,陕西安康 725000)
·临床研究·
SMG-1在肾细胞癌中表达及其对预后的意义
向 彬1,2,种 铁1,雷光辉2,张 旭2,赵鹏靓2,崔 杰3
(1.西安交通大学医学院第二附属医院泌尿外科,陕西西安 710004;2.西电集团医院泌尿外科,陕西西安 710077;3.安康市中心医院肿瘤科,陕西安康 725000)
目的 检测生殖器形成抑制基因-1(SMG -1)在肾癌组织中的表达情况,研究SMG -1的表达与肾癌临床病理参数的关系及对预后的临床意义。方法 应用免疫组织化学方法检测SMG -1在58例肾癌组织及32例癌旁组织的表达情况。用SPSS18.0软件包进行统计处理,采用χ2检验SMG -1表达与临床病理因素的关系,Kaplan-Meier法及Cox回归模型用于肾癌的生存分析。结果 SMG -1在肾癌组织阳性表达低于癌旁组织(20/58vs. 23/32,P=0.001)。按照TNM分期及Fuhrman分级,在Ⅰ+Ⅱ期肾癌患者中SMG -1表达高于在Ⅲ+Ⅳ期(17/39vs. 3/19,P=0.036),在G1+G2肾癌患者中SMG -1表达高于G3+G4患者(18/41vs. 2/17,P=0.01)。SMG -1高表达的患者总生存期长于SMG -1低表达的患者(P=0.018)。SMG -1高表达是肾癌预后良好的独立因素[风险比(HR)=0.289, 95%CI=0.126~0.662,P=0.003]。结论 SMG -1异常表达可能参与肾癌的发生和进展。SMG -1的高表达可作为预测肾癌良好预后的独立指标。
肾癌;SMG-1;预后;免疫组织化学
肾癌是成人常见的泌尿系统恶性肿瘤,期中肾细胞癌(renal cell carcinoma, RCC)最为常见,约占90%~95%[1]。肾癌尤其是透明细胞癌临床表现及肾外表现不典型,很难做到早期诊断和早期治疗,即使行手术治疗后也将近有30%的患者发生局部复发或者远处转移[2];转移性肾癌的预后极差,平均生存时间仅仅月3个月左右,3年存活率低于5%[3]。目前临床上迫切需要研究出新的有诊断或预后价值的分子标志物,这对进一步研究分析肾透明细胞癌的发生发展机制以及预后监测具有十分重要的意义。近期研究逐渐揭示生殖器形成抑制基因-1(suppressor of morphogenesis in genitalia-1,SMG-1)是长期以来被忽略的重要抑癌基因,SMG-1的失活和表达缺失可能在多种肿瘤发生发展中发挥了重要作用[4-5]。本研究旨在研究SMG-1在肾细胞癌中表达及其对预后的意义。
1 资料与方法
1.1 病例资料 本研究共收集肾癌组织标本共58例,病理类型均为肾透明细胞癌,于2005~2013年在西电集团医院泌尿外科行根治性肾切除术中取得。排除多发肿瘤,术前行放疗、化疗及免疫治疗及术后随访资料不完整的患者。肾癌术后病理诊断由西安交通大学医学院第二附属医院病理科医生确认。使用2010年美国癌症委员会(American Joint Committee on Cancer,AJCC)的TNM分期系统对肿瘤分期,使用Fuhrman系统对肿瘤分级。病理特征见表1。患者年龄34~78岁,中位年龄54.5岁:≥55岁者30例,<55岁者28例;男性35例,女性23例。配对癌旁肾癌组织为32例,癌旁组织均取自距离肿瘤边缘2 cm 处的肾组织。原发肾癌分期为Ⅰ、Ⅱ、Ⅲ、Ⅳ期:Ⅰ+Ⅱ期39例,Ⅲ+Ⅳ期19例;按照Fuhrman分级G1+G2 患者41例,G3+G4 患者17例。远处转移4例。所有患者的手术标本,包括肾癌组织和癌旁组织,均经 10%甲醛溶液固定,石蜡包埋4 μm连续切片,分别进行免疫组织化学染色检测。
1.2 主要试剂与仪器 鼠抗人酶SMG-1抗体(稀释浓度1︰100)购自北京博奥森生物技术有限公司,通用型SABC检测试剂盒及浓缩型DAB检测试剂盒购买于北京中杉金桥生物技术有限公司。
1.3 免疫组织化学检测 采用免疫组织化学染色方法检测SMG-1在肾癌及癌旁组织中的表达。各步骤严格按照试剂盒操作说明书操作。石蜡切片置于65℃烤箱中1 h,在二甲苯乙醇梯度脱蜡水化后,采用高压锅法进行抗原修复,加入3% H2O2反应,生物素阻断剂阻断;分别加人一抗鼠抗人抗体SMG-1,工作稀释比例为1︰100,4℃过夜孵育,再加入二抗于37℃孵育30 min,DAB显色,脱水,透明,固定。PBS 代替一抗作为阴性对照。
1.4 染色结果判定 采用双盲法由两位病理科医生独立阅片,染色评判方法为根据组织细胞的染色强度结合染色比例综合判断。每张切片随机选取5个高倍视野(400倍),每个高倍视野计数100个癌细胞,观察阳性细胞染色强度,计数阳性细胞百分数并进行综合评分:阳性染色比例为0~39%为0分;阳性染色比例为40%~69%为1分;阳性染色比例≥70%为2分。根据染色强度计算分数:无染色颗粒为0分,着色为黄色颗粒为1分,着色为棕黄色颗粒为2分。最终结果取两者评分之和,0~1分为低表达,2~4分为高表达。
1.5 随访 对所有肾癌患者术后门诊或电话随访。总生存期(overall survival,OS)为手术之日算起,终止日期为死亡或末次随访日期,随访截止日期为2015年10月11日。随访时限为40~92月,中位随访时间为78月。
1.6 统计学方法 SMG-1蛋白的表达与肾癌临床病理因素的关系采用χ2检验,生存分析采用Kaplan-Meier法,生存曲线用Log-rank检验,Cox多因素回归模型分析各变量与肾癌患者预后的关系。所有数据采用SPSS18.0分析,P<0.05为差异有统计学意义。
2 结 果
2.1 SMG-1在肾癌组织及癌旁组织的表达 免疫组织化学结果显示SMG-1在肾癌及癌旁组织均有表达,主要表达在细胞质、细胞膜,细胞核有少量表达。其他位置未见明显着色(图1)。如表1所示,肾癌组织SMG-1蛋白高表达率为34.48%,癌旁组织中SMG-1高表达率为71.88%。SMG-1在肾癌组织表达低于在癌旁组织中表达,差异具有统计学意义(P=0.001)。
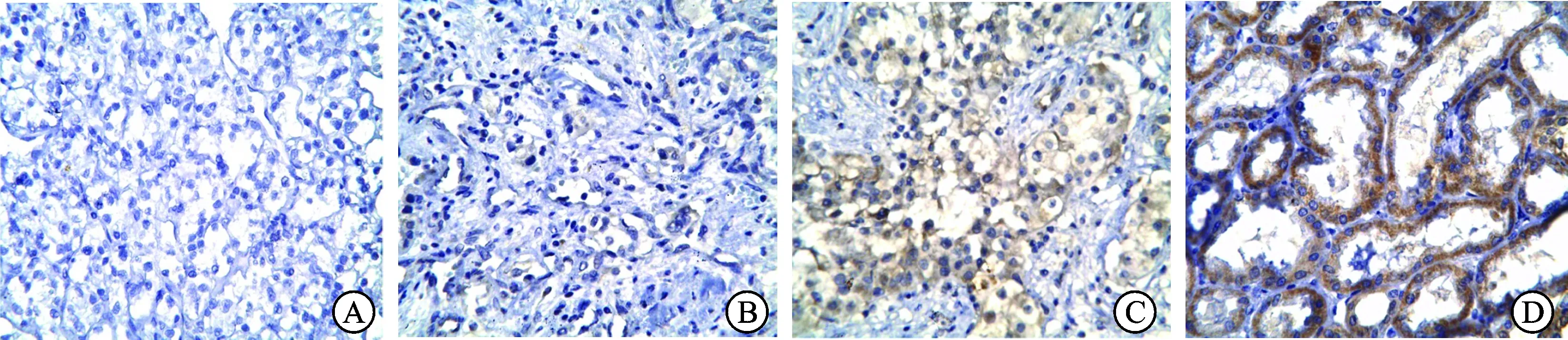
图1 免疫组织化学检测SMG-1在肾癌及癌旁组织的表达(×400)
A:阴性对照;B肾癌组织低表达;C:肾癌组织中高表达;D:癌旁组织中高表达
2.2 SMG-1蛋白表达与肾癌病理特征之间的关系 SMG-1蛋白表达与肾癌患者年龄、性别、转移不相关,但与肾癌分期和Fuhrman分级有关。在临床分期为Ⅰ、Ⅱ患者中SMG-1高表达率显著高于Ⅲ、Ⅳ患者(P=0.036)。通过Fuhrman分级,在G1和G2肾癌患者中SMG-1高表达率显著高于在G3和G4期患者中表达(P=0.010)。见表2。
表1 SMG-1蛋白在肾癌组织和癌旁组织的表达 [例(%)]

表2 SMG-1表达与肾癌组织临床病理特征关系 [例(%)]
2.3 肾癌组织SMG-1蛋白表达与患者总生存期的关系 肾透明细胞癌术后SMG-1蛋白高表达组的中位OS显著高于低表达组,两者之间有显著统计学差异(P=0.018,表3)。SMG-1不同表达的肾癌患者总生存曲线如图2所示。
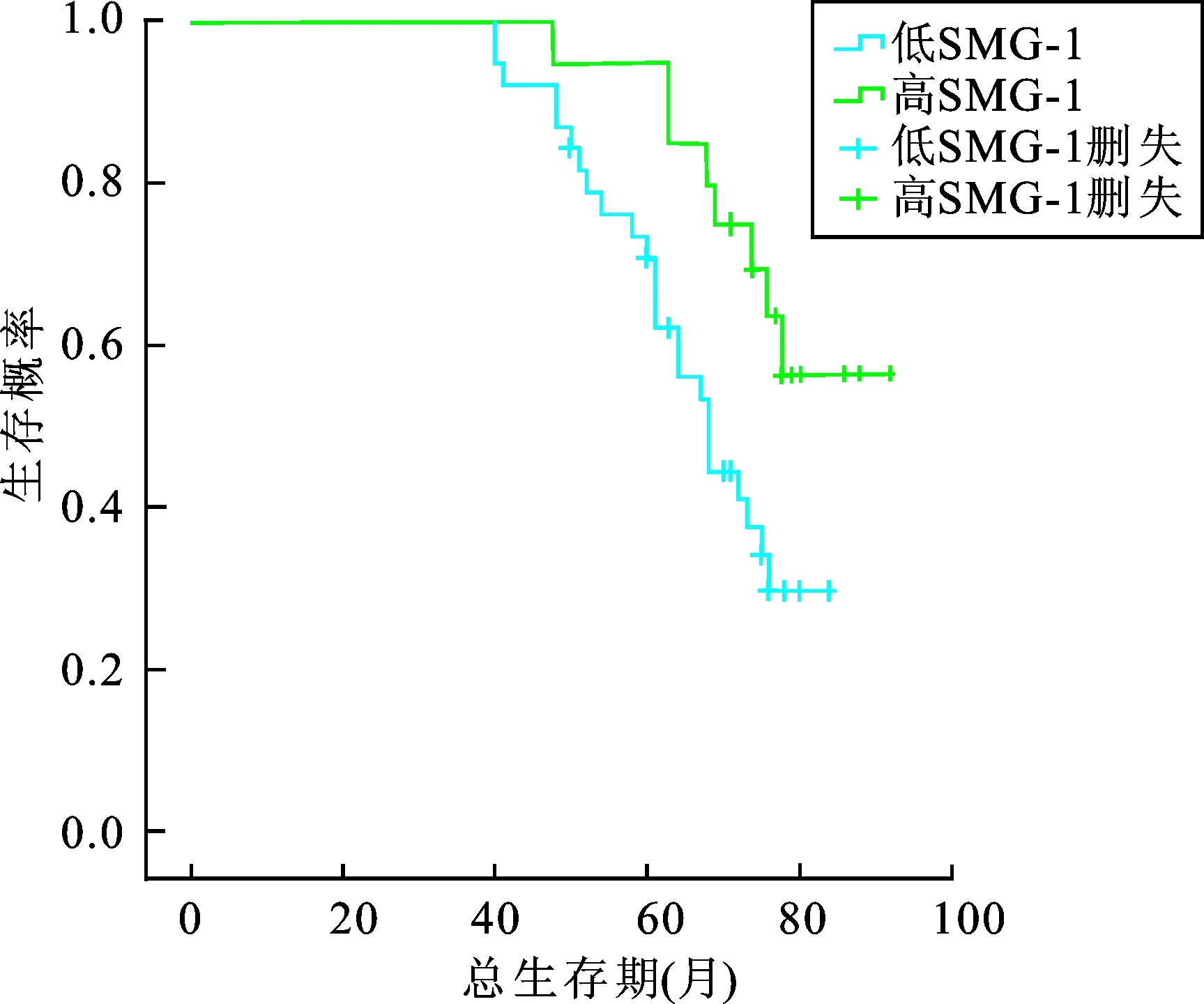
图2 SMG-1的表达与肾癌患者总生存期的生存曲线
表3 SMG-1不同表达水平肾癌患者中位总生存期比较

组 别例数中位OS(月)95%CIχ2值P值SMG-1高表达组2081(75.73~87.59)5.560.018SMG-1低表达组3868(62.70~71.95)
2.4 影响肾癌患者预后的因素 对58例肾癌患者生存资料进行预后分析,采用Cox多因素回归分析模型,应变量是的患者的总生存时间(OS),协变量为性别(男vs.女),年龄(≥55岁vs.<55岁),SMG-1(分高表达、低表达两组),肿瘤分期(Ⅰ+Ⅱvs.Ⅲ+Ⅳ),Fuhrman分级(G1+G2vs.G3+G4),采用向前逐步法筛选协变量,检验引入协变量的标准是:年龄、性别、SMG-1表达、肿瘤分期、分级。多因素回归模型显示肾癌分期、Fuhrman分级及SGM-1与肾癌预后有关。较早的肿瘤分期及分级,高表达SMG-1的患者预示着较好的预后。见表4。
表4 肾癌预后多因素分析

变 量风险比(HR)95%CIP值性别:女vs.男1.032(0.897~1.187)0.659年龄(岁):≥55vs.<550.796(0.393~1.611)0.526分期:Ⅰ+Ⅱvs.Ⅲ+Ⅳ0.216(0.103~0.452)0.001分级:G1+G2vs.G3+G40.436(0.203~0.936)0.036SMG-1:高vs.低0.289(0.126~0.662)0.003
3 讨 论
SMG-1是最近发现的一种抑癌基因,已经明确的是SMG-1可调控细胞生长、增殖及凋亡等多个生物进程。但是文献报道SMG-1在不同肿瘤组织中的表达对其预后有着不同作用。GUBANOVA等[6]在人类乳头瘤病毒阳性的头颈部鳞状细胞癌中发现,SMG-1因其启动子区高甲基化而导致其表达降低,提高了这些患者的生存期,该研究结果提示SMG-1发挥着“癌”基因的功能。而GUBANOVA等[7]也报道SMG-1通过调节P53和CDc25A信号通路抑制肿瘤的生长。最近报道SMG-1在肝癌组织及急性髓性白血病中发挥着抑癌基因的作用,低表达SMG-1预示着肝癌患者的不良预后。而周学军等[8]报道了,虽然在喉鳞癌组织中SMG-1表达低于癌旁组织,但SMG-1蛋白表达阴性组5年生存率却明显高于阳性组。这表明SMG-1在肿瘤预后中的作用具有多元性及复杂性,对此需要更加深入的研究。
本研究中,用免疫组织化学的方法检测了SMG-1在肾癌组织及匹配癌旁组织中的表达情况,我们发现在肾癌组织中SMG-1阳性表达率显著低于其在癌旁组织的阳性表达率。进一步分析SMG-1的表达与肾癌病理特征的关系,我们发现SMG-1的表达与分期和Fuhrman分级有关,较早分期和分级的肾癌患者中SMG-1的表达率更高。分析对患者的总生存期,发现SMG-1高表达的患者总生存期长于其低表达的患者。Cox多因素生存分析显示肿瘤分期、Fuhrman分级、SMG-1表达水平是影响肾癌患者预后的独立因素,说明SMG-1的表达可作为检测肾癌预后的指标。
需要指出的是本研究仍有一些不足。本研究属于回顾性研究,纳入肾癌的病例数相对偏少会导致患者代表性较差,可能会使试验结果带来一定偏倚。另外,虽然免疫组织化学方法检测蛋白在组织标本上的表达是一种经典的方法,但仍是一种半定量的评判手段,在操作过程中抗体的质量和浓度以及最后对染色结果的评判都会对最终结果产生影响。因此在应用上述结果时需考虑到这些不足。当然SMG-1真正作为一种有效的预后指标还需多中心更大的样本验证,并进一步研究SMG-1在肾癌发生发展过程中的具体机制。另外,考虑到肿瘤组织标本取材的不便,在实际临床应用中,肾癌组织中检测SMG-1蛋白的表达作为肾癌的预后标志物存在一定的局限性。因此我们在后期实验中,会同期收集肾癌患者血液样本,进行循环肿瘤细胞(circulating tumor cell,CTC)检测,同时标记SMG-1,深入研究其作为肾癌指标的应用价值。
总之,本研究发现SMG-1在肾癌组织中低表达,其表达水平与肾癌临床分期、Fuhrman分级有关,高表达SMG-1的患者预后较好,SMG-1可能成为监测肾癌尤其是肾透明细胞癌患者预后的理想指标。
[1] BEX A, JONASCH E, KIRKLI Z, et al. Integrating surgery with targeted therapies for renal cell carcinoma:current evidence and ongoing trials[J]. Eur Urol, 2010, 58 (6):819-828.
[2] KIM SP, CRISPEN PL, THOMPSON RH, et al. Assessment of the pathologic inclusion criteria from contemporary adjuvant clinical trials for predicting disease progression after nephrectomy for renal cell carcinoma[J]. Cancer, 2012, 118 (18):4412-4420.
[3] DESANTIS CE, LIN CC, MAROTTO AB, et al. Cancer treatment and survivorship statistics, 2014[J]. CA Cancer J Clin, 2014, 64 (4):252-271.
[4] DU Y, LU F, LI P, et al. SMG1 acts as a novel potential tumor suppressor with epigenetic inactivation in acute myeloid leukemia[J]. Int J Mol Sci, 2014,15(9):17065-17076.
[5] HAN LL, NAN HC, TIAN T, et al. Expression and significance of the novel tumor-suppressor gene SMG-1 in hepatocellular carcinoma[J]. Oncol Rep,2014, 31 (6):2569-2578.
[6] GUBANOVA E, BROWN B, IVANOV SV, et al. Downregulation of SMG-1 in HPV-positive head and neck squamous cell carcinoma due to promoter hypermethylation correlates with improved survival[J]. Clin Cancer Res, 2012,18(5):1257-1267.
[7] GUBANOVA E, ISSAEVA N, GOKTURK C, et al. SMG-1 suppresses CDK2 and tumor growth by regulating both the p53 and Cdc25A signaling pathways[J]. Cell Cycle, 2013, 12 (24):3770-3780.
[8] ZHOU X, WANG X, FENG Y, et al. [Expressions of SMG-1, ATM and P53 in laryngeal squamous cell carcinoma and their clinical significance][J]. Nan Fang Yi Ke Da Xue Xue Bao, 2016, 36 (1):50-55.
(编辑 何宏灵)
The expression and prognostic significance of SMG-1 in renal cell carcinoma
XIANG Bin1,2,CHONG Tie1,LEI Guang-hui2,ZHANG Xu2,ZHAO Peng-jing2,CUI Jie3
(1.Department of Urology, the Second Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710004; 2.Department of Urology, Xidian Group Hospital, Xi’an 710077;3.Department of Oncology Ankang Central Hospital,Ankang 725000 China)
Objective To investigate the expression of suppressor of morphogenesis in genitalia-1 (SMG-1) and to evaluate the association between SMG-1 expression and clinicopathological characteristics and prognosis of renal cell carcinoma (RCC). Methods The expression of SMG-1 was detected by immunohistochemistry in 58 RCC cases and 32 paired adjacent non-cancerous tissues. SPSS18.0 package was used for statistical analysis. The association between SMG-1 expression and clinicopathological characteristics of RCC was evaluated byχ2test.Kaplan-Meierplots and Cox’s proportional hazards regression model were used to analyze the survival data of RCC. Results The expression of SMG-1 in RCC was significantly lower than that in paired adjacent non-cancerous tissues (P<0.05). According to TNM stage and Fuhrman grading system, the expression of SMG-1 in RCC cases with the stage Ⅰ+Ⅱ or G1+G2 was higher than that in patients with Ⅲ+Ⅳ(17/39vs.3/19;P=0.036) or grade G3+G4. (18/41vs.2/17;P=0.01).The patients with high expression of SMG-1 had a better overall survival than patients with low expression of SMG-1 (P=0.018). High expression of SMG-1 was an independent predictive factor for favorable prognosis of RCC patients (HR=0.289, 95%CI=0.126-0.662,P=0.003). Conclusions Aberrant expression of SMG-1 may be involved in RCC progression. Increased SMG-1 expression can be used as a favorable prognostic factor for RCC.
renal cell carcinoma; SMG-1; prognosis; immunohistochemistry
2016-06-06
2016-10-12
崔杰,主治医师.E-mail:akcuijie@163.com
向彬(1979-),男(汉族),学士学位,主治医师,主要从事泌尿系肿瘤发病机制研究和临床诊疗工作.E-mail:13772466732@139.com
R737
A
10.3969/j.issn.1009-8291.2016.11.009
