树兰茎段丛生芽快繁体系的建立
2016-12-15易双双陆顺教冷青云杨光穗
易双双,陆顺教,冷青云,王 存,杨光穗
(中国热带农业科学院 热带作物品种资源研究所/农业部 华南作物基因资源与种质创制重点实验室/海南省热带观赏植物种质创新利用工程技术研究中心,海南 儋州 571737)
树兰茎段丛生芽快繁体系的建立
易双双,陆顺教,冷青云,王 存,杨光穗
(中国热带农业科学院 热带作物品种资源研究所/农业部 华南作物基因资源与种质创制重点实验室/海南省热带观赏植物种质创新利用工程技术研究中心,海南 儋州 571737)
【目的】 建立茎段诱导丛生芽途径的树兰快速繁殖技术体系,为树兰种苗生产及工厂化育苗奠定基础。【方法】 以树兰当年生分蘖苗的带芽茎段为外植体,以MS为基本培养基,研究不同质量浓度6-BA、NAA和IBA组合对树兰茎段丛生芽诱导、增殖及生根的影响。【结果】 不同质量浓度6-BA和NAA组合对树兰茎段丛生芽的诱导与增殖均有显著影响,树兰茎段丛生芽诱导最适宜培养基为MS+1.0 mg/L 6-BA+0.5 mg/L NAA,诱导率最高达到73.13%;增殖最适宜培养基为MS+3.0 mg/L 6-BA+1.0 mg/L NAA,增殖系数最高达到5.2。不同质量浓度NAA和IBA组合对树兰组培苗生根有显著影响,生根最适宜培养基为MS+1.0 mg/L NAA+1.5 mg/L IBA ,生根率可达100%,平均根数7.78条/株,株高7.44 cm,茎粗2.82 mm。【结论】 建立了树兰茎段诱导丛生芽的组织培养快繁体系,在该体系下丛生芽的诱导率和增殖率均较高,生根状况良好。
树兰;茎段;丛生芽;诱导与增殖;组织培养
树兰(Epidendrum)为兰科(Orchidaceae)树兰属热带气生兰,易生长,可周年开花,花期长,花色丰富艳丽,具有很高的观赏价值,可作为盆花、切花观赏,也可露地种植,应用于花坛、花镜等园林景观[1]。树兰属因其物种丰富且具有与生态群和地理分布显著相关的形态多样性,目前已作为一种重要的模式植物被用来研究生境选择、生殖生物学、授粉机制、物种形成和生殖隔离等生物进化相关问题[2]。现在我国部分地区已引进树兰并进行了初步的商业开发,但规模却一直无法进一步扩大,主要源于其传统的分株繁殖效率低,尽管也可通过无菌播种获得大量种苗,但在自然条件下,兰科植物因其花朵有效传粉率低,导致自然授粉结实率低[3-5],且种子繁育的后代会产生大量杂合体,无法保持亲本的优良性状以及种苗的整齐度。而利用外植体途径的组培快繁技术是种苗大量生产且保持亲本优良性状的有效方法。目前关于树兰利用根、叶、花梗等为外植体分别诱导原球茎的组织快繁已见相关报道,但其诱导率较低,得到的再生植株也较少[6-10]。而以茎段直接诱导丛生芽的途径不仅可以缩短繁育周期,且在一定程度上可降低种苗的变异率,但该方式在树兰组培快繁中目前尚未见报道。本试验以树兰当年生分蘖苗的带芽茎段为外植体,建立了树兰茎段诱导丛生芽的组织快繁技术体系,以期为树兰快速繁殖及工厂化育苗奠定基础。
1 材料与方法
1.1 材 料
供试树兰采自中国热带农业科学院热带作物品种资源研究所热带花卉种质资源圃。晴天上午,选取生长健壮、无病虫害的当年生树兰分蘖苗茎段,自顶端第4 片叶往下7~9 片叶处取材。
1.2 方 法
1.2.1 外植体消毒 将茎段的外包叶轻轻剥去,保留节上的芽点,剪成约3 cm 左右小段,先用流水冲洗30 min,然后用体积分数75%的乙醇浸泡30 s,无菌水冲洗1 次,再用质量分数0.1%的HgCl2浸泡10 min[11],最后用无菌水冲洗5~6 次。
1.2.2 6-BA和NAA对丛生芽诱导的影响 将消毒的茎段外植体切成1 cm 左右的带芽小段,分别接种于不同培养基中,培养基分别添加不同质量浓度的6-BA(1.0,2.0,3.0 mg/L)和NAA(0.1,0.5,1.0 mg/L),共9个处理组合。30 d天后统计诱导率,研究不同激素组合对丛生芽诱导的影响。丛生芽诱导率=(诱导的丛生芽植株数/接种的外植体数)×100%。
1.2.3 6-BA和NAA对丛生芽增殖的影响 将分化的丛生芽切成单株,分别接种到不同培养基中,培养基添加不同质量浓度的6-BA(1.0,2.0,3.0,4.0,5.0 mg/L)和NAA(0.1,0.5,1.0 mg/L),共15个处理组合。40 d后统计丛生芽的增殖情况,研究不同激素组合对丛生芽增殖的影响。增殖系数=诱导的芽数/接种芽数。
1.2.4 NAA和IBA对生根的影响 当增殖的丛生芽有3~4片叶,且高度达到2 cm左右时,从基部切下,将生长较好、长势一致的单株分别接种到生根培养基中,培养基添加不同质量浓度的NAA(0.5,1.0,1.5,2.0 mg/L)和IBA(0.5,1.0,1.5,2.0 mg/L),共16个处理组合。40 d后统计生根率、根数、根长、根粗、株高、叶片数、茎粗。
以上培养基均以MS为基本培养基,其中添加了30 g/L蔗糖,6.5 g/L琼脂,培养基pH值调至5.8~6.0,以上试验均采用双因素完全随机组合,每种组合接种20个外植体,试验重复3次。
1.3 数据处理与统计
对所得试验数据采用SAS 9.0 进行方差分析和多重比较(Duncan’s法)分析。
2 结果与分析
2.1 6-BA与NAA组合对树兰丛生芽诱导的影响
将消毒好的茎段接种于不同培养基中,培养12 d左右,发现树兰茎段的芽点开始萌动,随后形成小突起,并不断膨大,同时茎段逐渐枯黄萎缩,在培养30 d后,对丛生芽诱导情况进行统计。结果(表1)表明,不同激素组合处理对树兰丛生芽诱导差异较大,其中6-BA具有极显著影响,NAA具有显著影响,6-BA与NAA具有极显著交互作用。当6-BA质量浓度为1.0和3.0 mg/L时,丛生芽的诱导率随NAA质量浓度的增加先上升后下降;当6-BA质量浓度为2.0 mg/L时,随着NAA质量浓度增加,诱导率呈降低趋势。当NAA质量浓度为0.1 mg/L时,丛生芽的诱导率随6-BA质量浓度的增加逐渐下降;当NAA质量浓度分别为0.5,1.0 mg/L时,丛生芽的诱导率随6-BA质量浓度的增加则先下降后上升。当6-BA质量浓度为1.0 mg/L、NAA质量浓度为0.5 mg/L时,丛生芽的诱导率达到73.13%,显著高于其他处理组合。因此,丛生芽诱导的最适宜培养基为MS+1.0 mg/L 6-BA+0.5 mg/L NAA。
在培养30 d后,将膨大的带芽部位切下,接种于MS+1.0 mg/L 6-BA+0.5 mg/L NAA的诱导培养基中,45 d左右分化产生了丛生芽(图1-A)。
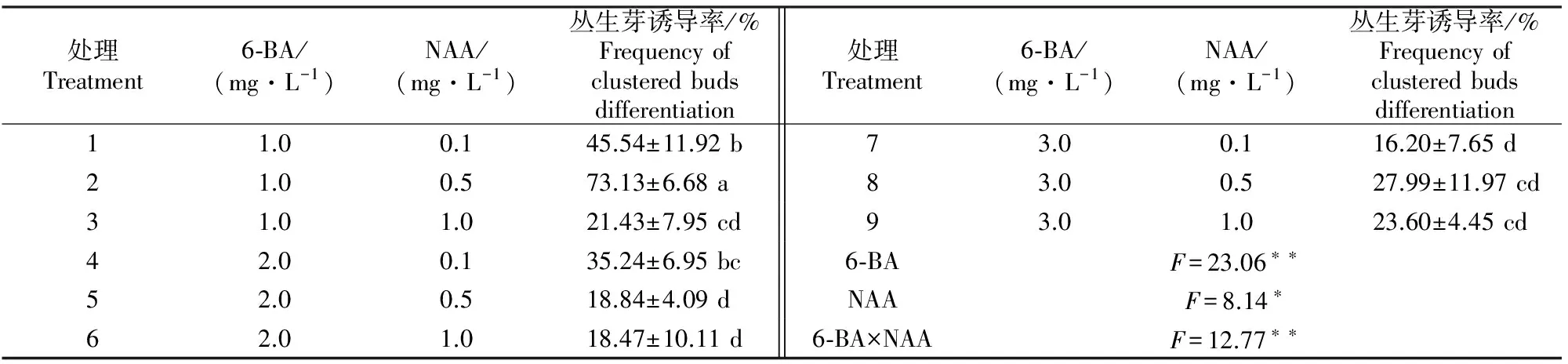
表 1 不同质量浓度6-BA 与NAA配比对树兰丛生芽诱导的影响
注:表中数据为“平均值±标准误”;同列数据后标不同小写字母表示差异显著(P<0.05);*表示F值检验差异显著(P<0.05),**表示F值检验差异极显著(P<0.01)。下表同。
Note:Values represent the means±SE.Means followed by different lowercase letters are significantly different atP=0.05;* indicates significant difference between 6-BA and NAA atP=0.05;** indicates significant difference between 6-BA and NAA atP=0.01.The same below.
2.2 6-BA与NAA组合对树兰丛生芽增殖的影响
表2显示,分别添加6-BA、NAA对树兰的丛生芽增殖均有显著和极显著影响,且6-BA与NAA之间存在极显著交互作用。当6-BA质量浓度分别为1.0,5.0 mg/L时,丛生芽的增殖系数随着NAA质量浓度的增加而逐渐上升;当6-BA质量浓度为4.0 mg/L时,丛生芽的增殖系数随着NAA质量浓度的增加而逐渐减少;当6-BA质量浓度为2.0,3.0 mg/L时,丛生芽的增殖系数随着NAA质量浓度的增加先下降后上升。当6-BA质量浓度为3.0 mg/L、NAA质量浓度为1.0 mg/L时,丛生芽的平均增殖系数为5.2,显著高于其他处理,在所有处理中效果最佳(图1-B)。因此,树兰丛生芽增殖最佳培养基为 MS+3.0 mg/L 6-BA+1.0 mg/L NAA。
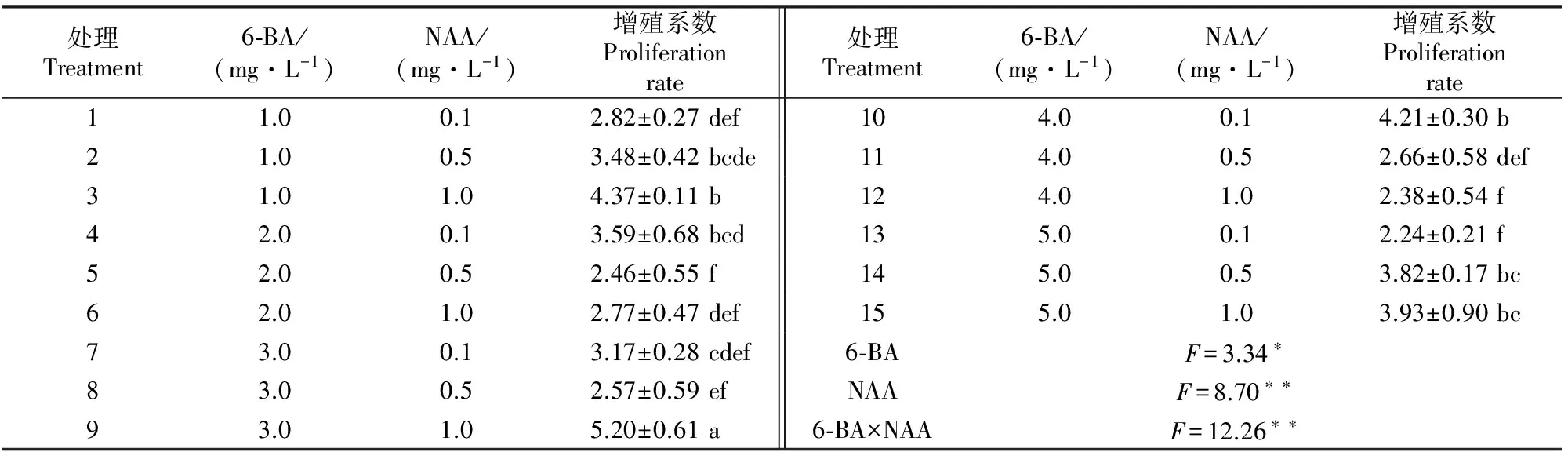
表 2 不同质量浓度6-BA 与NAA配比对树兰丛生芽增殖的影响
2.3 NAA与IBA组合对树兰生根的影响
40 d后统计生根情况,发现幼芽在16个不同处理的培养基上均能生根(图1-C),且生根率能达100% ,但不同生根培养基中,根的数量、长度、粗细及株高、叶片数、茎粗均有较大差异(表3、图1-D)。表3显示,在处理8中,平均生根数达到9.33条/株,显著高于其他处理,在处理3、4、7、11、13中,平均生根数也较高,均能达到7条/株以上。在处理1、4、9、10中,平均根长均能达到3 cm以上。在处理6、7中,平均根粗均高于1.7 mm,显著高于其他处理。
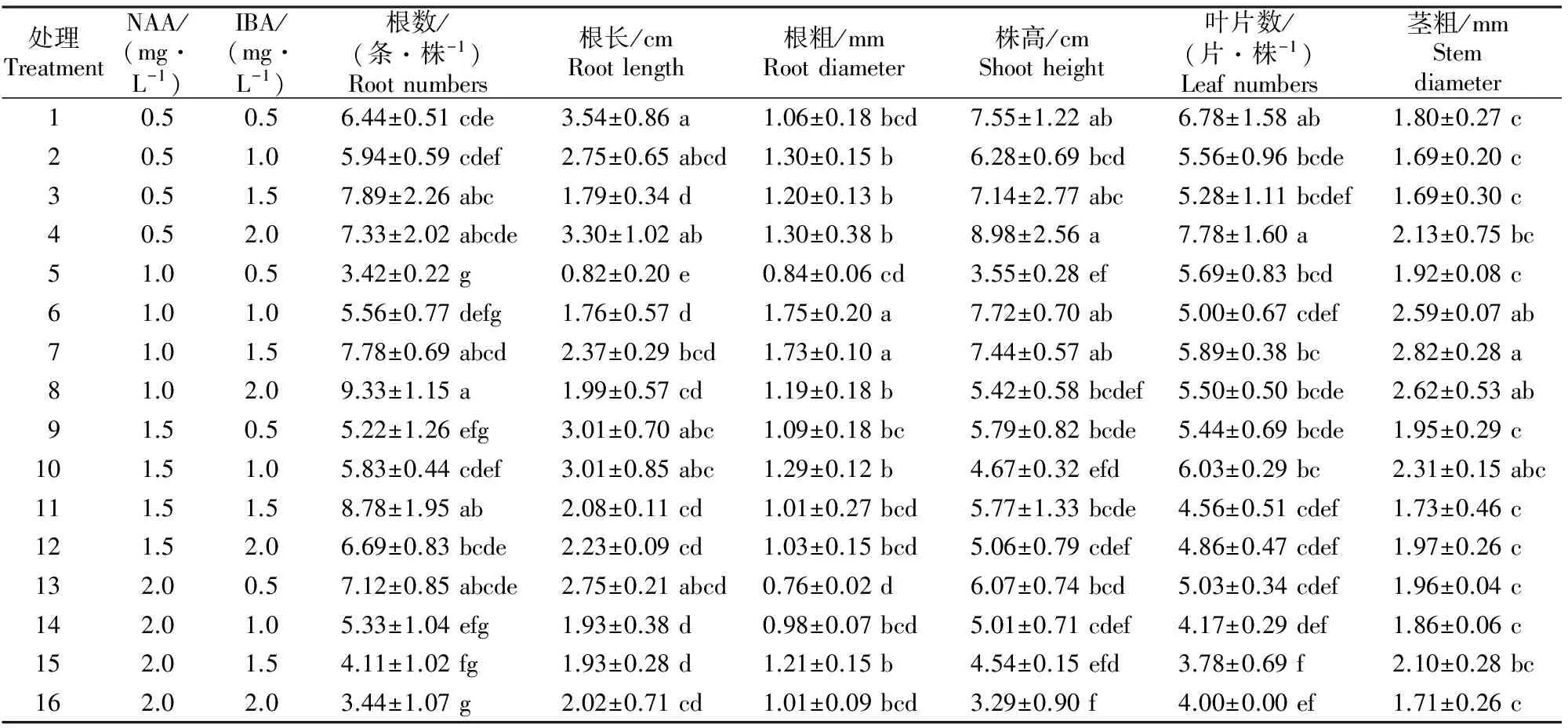
表 3 不同质量浓度NAA 与IBA配比对树兰生根的影响

A.丛生芽的诱导;B.丛生芽的增殖;C.生根诱导情况;D.植株的生长状况
图 1 树兰茎段直接诱导丛生芽与植株再生
Fig.1 Direct induction of clustered buds from stem and shoot regeneration ofEpidendrum
表3显示,在处理4中,平均株高能达到8.98 cm ,显著高于其他处理组合,而在处理1、3、6、7中,平均株高也能达到7 cm以上,且在处理1、7中,平均生长的叶片数也较高,能达到5.89片/株以上。在处理6、7、8中,平均茎粗均能达到2.5 mm以上。因此,综合根的数量、长度、粗细及株高、叶片数、茎粗,在所有组合中,处理4和处理7的效果均较好,其根数能达到7条/株以上,株高能达到7 cm以上,茎粗能够达到2 mm以上。但在处理7中,小苗12 d开始产生白色根尖,根粗壮,带有白色根毛;而在处理4中,小苗15 d才开始产生白色根尖,虽然根也较粗壮,但与处理7比较,其植株生长要相对细、长、瘦。因此,树兰生根的最适宜培养基为处理7,即MS+1.0 mg/L NAA+1.5 mg/L IBA。
3 讨 论
树兰常规的繁殖方式为分株繁殖,但繁殖效率不高,不利于种苗的规模化生产,组培快繁是迅速获得大量种苗的有效途径。目前关于树兰组培快繁技术的报道主要是通过诱导原球茎途径获得。如魏翠华[12]以树兰茎尖、侧芽为外植体,张建霞等[13]以树兰的幼芽为外植体,潘学峰等[14]以树兰未成熟种子为外植体,分别诱导了树兰的原球茎。但一般通过原球茎诱导分化形成的幼芽和根需要时间较长,其成苗速度慢,周期长,且在长时间的培养过程中,幼芽分化具有遗传变异性,导致随后的生长和形态发生变异[15]。种子间基因型也有差异,因此无菌播种萌发产生的幼苗个体也存在一定差异,不能很好地保持亲本的品种特性。相关研究表明,目前能保持亲本优良性状且较稳定的离体培养方式主要是通过对顶芽或腋芽的诱导,其体细胞的变异率低[16-18]。丛生芽生命力较强,增殖效率高,速度快,避免了原球茎途径中的分化成苗阶段,缩短了组培快繁的周期,且变异率相对较低,因此直接诱导丛生芽途径对树兰的快速繁殖具有重要的意义。
大量研究表明,外源植物生长调节剂对植物的组培快繁具有重要作用,不同阶段的培养效率与激素种类和浓度均具有较大关系。本研究结果表明,在用树兰茎段诱导丛生芽阶段,6-BA对丛生芽的诱导具有极显著作用,而NAA则具有显著作用,这与李媛等[19]在肿节石斛(Dendrobiumpendulum)、尖刀唇石斛(D.heterocarpum)和报春石斛(D.primulinum)3种石斛茎段诱导芽的研究结果一致。陆顺教等[20]研究表明,6-BA对秋石斛茎段芽诱导具有主导作用,也与本研究结果一致。但由于兰花种类间的差异,激素最佳诱导浓度存在一定差异。在芽增殖上,李媛等[19]研究表明,NAA对肿节石斛、尖刀唇石斛和报春石斛芽增殖起主要作用,王泽祺等[21]研究发现,与IBA和6-BA相比,NAA对树兰茎段芽增殖倍率的影响最大。本研究结果表明,NAA对树兰芽增殖具有极显著影响,与以上研究结果相似。此外,本研究发现,6-BA与NAA对树兰茎段诱导及芽的增殖效果具有极显著交互作用。魏翠华[12]研究发现,在树兰组培苗生根过程中,添加了0.5 mg/L NAA的1/2 MS培养基比未添加激素的1/2 MS培养基效果明显。王泽祺等[21]研究发现,树兰在添加1.0 mg/L NAA的1/2 MS培养基上生根较好。但以上研究均只单独添加NAA,本研究探讨了NAA和IBA组合对树兰生根的影响,结果表明MS+1.0 mg/L NAA+1.5 mg/L IBA对树兰生根效果显著,生根率能达到100%,其根数、根粗、株高以及茎粗等指标均较优。
本研究探讨了不同培养基对树兰丛生芽诱导、增殖和生根的影响,筛选出了最适宜的组织培养条件,为树兰种苗规模化生产和工厂化育苗提供了必要的技术支持,为树兰种质资源的保存及进一步的基因工程研究奠定了基础。
[1]Pansarin E R,Amaral M C E.Reproductive biology and pollination mechanisms ofEpidendrumsecundum(Orchidaceae). Floral variation:a consequence of natural hybridization? [J].Plant Biology,2008,10:211-219.
[2]Pinheiro F,Barros F D,Palma S,et al.Hybridization and introgression across different ploidy levels in the Neotropical orchidsEpidendrumfulgensandE.puniceoluteum(Orchidaceae) [J].Molec Ecol,2010,19:3981-3994.
[3]Montalvo A M,Ackerman J D.Limitations to fruit production inIonopsisutricularioides(Orchidaceae) [J].Biotropica,1987,19:24-31.
[4]Ackerman J D.Limitations to sexual reproduction inEncycliakrugii(Orchidaceae) [J].Systematic Botany,1989,14:101-109.
[5]Zimmerman J K,Aide M.Patterns of fruit production in a neotropical orchid:pollinator vs.resource limitation [J].American Journal of Botany,1989,76:67-73.
[6]Churchill M E,Ball E A,Arditti J.Tissue culture of orchids:Ⅱ.methods for root tips [J].Am Orchid Soc Bull,1972,41:726-730.
[7]Stewart J,Button J.Development of callus and plantlets fromEpidendrumroot tips culturedinvitro[J].Am Orchid Soc Bull,1978,47:607-613.
[8]Stewart J,Button J.Rapid vegetative multiplication ofEpidendrumO’brienianuminvitroand in the greenhouse [J].Am Orchid Soc Bull,1976,45:922-930.
[9]Kuhn L.The eric young micropropagation center [J].Am Orchid Soc Bull,1981,50:47-50.
[10]Chen L R,Chen J T,Chang W C.Efficient production of protocorm-like bodies and plant regeneration from flower stalk explants of the sympodial orchidEpidendrumradicans[J].InVitroCell Dev Biol-Plant,2002,38:441-445.
[11]易双双,陆顺教,尹俊梅,等.树兰组织培养外植体消毒方法初探 [J].基因组学与应用生物学,2014,33(4):897-901.
Yi S S,Lu S J,Yin J M,et al.The preliminary study in explants disinfection method ofEpidendrumin tissue culture [J].Genomics and Applied Biology,2014,33(4):897-901.
[12]魏翠华.树兰离体培养和植株再生(简报) [J].亚热带植物科学,2006,35(2):64-65.
Wei C H.Invitroculture and plantlet regeneration ofEpidendrumO′brienianum [J].Subtropical Plant Science,2006,35(2):64-65.
[13]张建霞,李洪林,付志惠,等. 胶水树兰的组织培养 [J].植物生理学通讯,2006,42(5):913.
Zhang J X,Li H L,Fu Z H,et al.Tissue culture ofEpidendrumciliareL. [J]. Plant Physiology Journal,2006,42(5):913.
[14]潘学峰,凌 梅,王安石. 树兰未成熟种子离体快繁技术 [J].热带生物学报,2010,1(2):158-164.
Pan X F,Ling M,Wang A S.Rapid propagation of immature seeds of Tree Orchid(Epidendrumschbomburgkii)invitro[J].Journal of Tropical Organisms,2010,1(2):158-164.
[15]Schmidt A J,Lee J M,An G.Media and environmental effects on phonolics production from tobacco cell culture [J].Biotechnology and Bioengineering,1989,33(11):1437-1444 .
[16]Martins M,Sarmento D,Oliveira M M.Genetic stability of mi-cropropagated almond plantlets,as assessed by RAPD and ISSR markers [J].Plant Cell Reports,2004,23(7):492-496.
[17]Renau-Morata B,Nebauer S G,Arrillaga I,et al.Assessments of somaclonal variation in micropropagated shoots of Cedrus:consequences of axillary bud breaking [J].Tree Genetics & Genomes,2005,1(1):3-10.
[18]Sharma S,Bryan G,Winfield M,et al.Stability of potato (SolanumtuberosumL.) plants regenerated via somatic embryos,axillary bud proliferated shoots,microtubers and true potato seeds:a comparative phenotypic,cytogenetic and molecular assessment [J].Planta,2007,226(6):1449-1458.
[19]李 媛,朱丹红,潘会堂,等.3种石斛兰以茎段为外植体的离体快繁技术 [J].东北林业大学学报,2013,41(8):77-81.
Li Y,Zhu D H,Pan H T,et al.Invitropropagation of threeDendrobiumspecies from stems [J].Journal of Northeast Forestry University,2013,41(8):77-81.
[20]陆顺教,易双双,任 羽,等. 秋石斛新生侧芽中部茎段组培快繁体系的建立 [J].南方农业学报,2015,46(8):1436-1441.
Lu S J,Yi S S,Ren Y,et al.Establishment of tissue culture and rapid propagation system for middle stem ofDendrobiumhybirdayong lateral bud [J].Journal of Southern Agriculture,2015,46(8):1436-1441.
[21]王泽祺,李聆睿,张佳燕,等.树兰的组织培养研究 [J].江苏农业科学,2014,42(8):45-48.
Wang Z Q,Li L R,Zhang J Y,et al.Tissue culture ofEpidendrum[J].Jiangsu Agricultural Sciences,2014,42(8):45-48.
Establishment of rapid propagation system for clustered buds ofEpidendrumstem
YI Shuangshuang,LU Shunjiao,LENG Qingyun,WANG cun,YANG Guangsui
(Tropical Crops Genetic Resources Institute,Chinese Academy of Tropical Agricultural Sciences/KeyLaboratoryofCropGeneResourcesandGermplasmEnhancementinSouthernChina,MinistryofAgriculture/HainanEngineeringTechnologyResearchCenterofTropicalOrnamentalPlantGermplasmInnovationandUtilization,Danzhou,Hainan571737,China)
【Objective】 A simple and efficient micro-propagation system was established for direct clustered buds induction fromEpidendrumstems to improve seedling production and industrialization.【Method】 The stem section with axillary bud of current-year tilleringEpidendrumwas used as explant and MS medium was used as basal culture medium to investigate the effects of 6-BA,NAA and IBA at different concentrations on induction,multiplication,and rooting of clustered buds.【Result】 Combinations of 6-BA and NAA at different concentrations had significantly influence on induction and proliferation of clustered buds ofEpidendrumstems.The optimal medium for clustered buds induction was MS+1.0 mg/L 6-BA+0.5 mg/L NAA with the highest induction rate of 73.13%.The optimal medium for proliferation was MS+3.0 mg/L 6-BA+1.0 mg/L NAA with the highest proliferation coefficient of 5.2.NAA and IBA combinations also had significantly influence on rooting ofEpidendrum.The optimal medium for shoot rooting was MS+1.0 mg/L NAA+1.5 mg/L IBA with the rooting rate of 100%,the average rooting number of 7.78,the shoot height of 7.44 cm,and the stem diameter of 2.82 mm.【Conclusion】 A rapid propagation system for clustered buds ofEpidendrumstem was established,which provided high induction rate and proliferation coefficient of clustered buds and good shoot rooting.
Epidendrum;stem;clustered buds;induction and proliferation;tissue culture
时间:2016-10-20 16:36
10.13207/j.cnki.jnwafu.2016.12.022
2015-12-09
农业部“引进国际先进农业科学技术计划(948计划)”项目(2011-G13)
易双双(1984-),女,湖北松滋人,硕士,研究实习员,主要从事热带花卉遗传育种研究。 E-mail:yishuang8410@163.com
杨光穗(1972-) ,女(苗族),贵州凯里人,硕士,副研究员,主要从事热带花卉营养生理研究。 E-mail:13976572870@163.com
S682.31
A
1671-9387(2016)12-0157-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20161020.1636.044.html
