腺苷酸活化蛋白激酶增强乳腺癌对多柔比星化疗敏感性的机制
2016-12-15崔文贤许柯青李元国陈桂金陆小群
崔文贤,许柯青,李元国,陈桂金,陆小群
常州市第七人民医院检验科,江苏 常州 213011
腺苷酸活化蛋白激酶增强乳腺癌对多柔比星化疗敏感性的机制
崔文贤,许柯青,李元国,陈桂金,陆小群
常州市第七人民医院检验科,江苏 常州 213011
背景与目的:腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)在调控细胞代谢和能量平衡方面起着重要作用,并与细胞增殖、生存和多种信号通路密切相关。近年来发现AMPK参与肿瘤的抑制和耐药。该研究旨在探讨AMPK对多柔比星抑制乳腺癌作用的影响及其机制。方法:采用四甲基偶氮唑蓝(methylthiazolyl tetrazolium,MTT)法检测多柔比星作用后对MCF-7/adr、MCF-7/adr-vector及MCF-7/adr-AMPKα细胞增殖的影响;Hoechst染色法观察各组细胞凋亡形态;流式细胞术(flow cytometry,FCM)检测各组细胞凋亡率;荧光酶标仪检测3组细胞多柔比星累积量;蛋白[质]印迹法(Western blot)检测各组细胞中耐药蛋白及凋亡相关蛋白的表达。结果:多柔比星对MCF-7/adr细胞增殖抑制作用呈剂量和时间依赖性,其作用24、48 h的IC50值分别为(36.8±2.1)和(28.8±1.3)µg/mL。过表达AMPKα可增加多柔比星对MCF-7/adr细胞的生长抑制作用,呈剂量和时间依赖性,其作用24、48 h的IC50值分别为(16.0±0.7)和(4.2±0.2)µg/mL。荧光形态分析发现多柔比星联合AMPKα能诱导MCF-7/adr细胞凋亡。1.0 µg/mL多柔比星作用48 h后,MCF-7/adr、MCF-7/adr-vector及MCF-7/adr-AMPKα细胞的凋亡率分别为(12.0±1.4)%、(12.7±1.6)%和(32.0±4.2)%,MCF-7/adr细胞中AMPKα过表达明显提高MCF-7/adr细胞对多柔比星的敏感性。荧光酶标仪检测显示,过表达AMPKα能明显提高细胞内多柔比星的累积量,具有浓度依赖性。Western blot实验结果显示,与MCF-7/adr和MCF-7/ adr-vector细胞比较,MCF-7/adr-AMPKα细胞中Bax、细胞色素c(Cyto c)的释放、caspase-3和多聚腺苷二磷酸-核糖聚合酶降解产物(cleaved PARP)蛋白表达明显增加,而细胞外排泵P-糖蛋白(P-gp)和Bcl-2蛋白表达降低。结论:AMPKα可通过抑制耐药细胞外排泵以及调控凋亡相关蛋白的表达,从而增强乳腺癌耐药细胞对多柔比星的化疗敏感性。
乳腺癌;耐药;腺苷酸活化蛋白激酶;凋亡;多柔比星
乳腺癌是女性最常见的恶性肿瘤,居女性各类恶性肿瘤死亡率的首位。近年来,由于早期发现和辅助治疗的改进,乳腺癌的治疗疗效已明显提升,其中多柔比星(doxorubicin)显示出对晚期乳腺癌独特的疗效,延长乳腺癌患者生存期[1]。
然而,如果多柔比星出现耐药或达到累积量,乳腺癌临床治疗就相对困难。因此,寻找可靠的靶点来提高乳腺癌对多柔比星敏感性可能是乳腺癌治疗上的突破点。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是丝氨酸、苏氨酸蛋白激酶,主要调控细胞内的代谢和能量平衡[2]。同时,大量研究证实,肿瘤细胞中存在能量异常的现象[3],在大部分乳腺癌患者中发现AMPK低表达[4]。在人肺癌、卵巢癌,肾细胞癌中均表明AMPK的活化能增强化疗敏感性[5-7]。因此AMPK的靶向治疗有望成为预防和治疗乳腺癌的新手段。本实验采用四甲基偶氮唑蓝(methylthiazolyl tetrazolium,MTT)法、蛋白[质]印迹法(Western blot)、Hoechst染色及流式细胞术(flow cytometry,FCM)检测等技术,研究AMPKα高表达在乳腺癌化疗中对多柔比星抗肿瘤作用的影响,并深入研究其相关机制。
1 材料和方法
1.1材料
耐多柔比星乳腺癌细胞株MCF-7/adr购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库。AMPKα、Bax、细胞色素c(Cyto c)、caspase-3、Bcl-2、cleaved-PARP和P-gp抗体购自美国Santa Cruz公司。MTT、AnnexinⅤ-FITC/PI双染试剂盒及Hochest染色试剂盒购自美国Sigma公司。AMPKα抑制剂(compound C)购自美国Sigma公司。4’,6-二脒基-2-苯基吲哚(DAPI)购自上海浩然生物技术有限公司。多柔比星购自深圳万乐药业有限公司。
1.2方法
1.2.1细胞培养
在耐多柔比星细胞株MCF-7/adr中构建过表达AMPKα的稳定株,以MCF-7/adr细胞感染表达全长AMPKα的慢病毒质粒,且以感染空白病毒质粒为对照细胞,命名为MCF-7/adr-vector。感染后3天观察绿色荧光表达情况。出现绿色荧光表达后加入含嘌呤霉素的完全培养基对阳性细胞进行筛选。筛选后采用Western blot进行鉴定,将稳定表达AMPKα的克隆命名为MCF-7/ adr-AMPKα。将上述细胞在含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI-1640完全培养液中,置于在37 ℃、CO2体积分数为5%的培养箱中培养及传代。
1.2.2细胞毒性测定
采用MTT法,将生长良好的MCF-7/adr、MCF-7/adr-vector及MCF-7/adr-AMPKα细胞分别接种于96孔板,每孔5×104个细胞,空白组加等量的培养液,于37 ℃、CO2体积分数为5%的培养箱中温育过夜后,弃去培养液,分别用0、0.1、1、5、10、20和40 µg/mL多柔比星处理细胞24和48 h,各取3个平行孔,再加入终浓度0.5 g/L的MTT,培养4 h,用每孔100 µL的DMSO溶解沉淀3 h后,用酶标仪进行吸光度(D)值测定。测定波长490 nm,参考波长630 nm,计算其抑制率及多柔比星对这3种细胞的半数抑制浓度IC50。细胞存活率=(D实验组平均值/D空白组平均值) ×100%。
1.2.3Hoechst 染色检测AMPKα过表达对MCF-7/adr细胞形态学的影响
将处于对数生长期细胞(2×105个/mL)接种于24孔板,加入1.0 µg/mL多柔比星,对照组加入等体积的培养液。作用48 h后离心,弃上清液,用PBS洗2次,离心去上清液(370×g,5 min)。加固定液(甲醇∶乙酸=3∶1),4 ℃固定10 min。采用Hoechst33258 (5 µL/mL) 染色5 min。356 nm紫外激发,荧光显微镜下观察并拍照。
1.2.4采用流式细胞术检测药物对细胞凋亡的影响
1.0 µg/mL多柔比星作用MCF-7/adr、MCF-7/adr-vector及MCF-7/adr-AMPKα细胞48 h后,重悬于Annexin Ⅴ-FITC结合液(1×)中,加入5 µL Annexin Ⅴ-FITC,轻轻混匀,室温避光温育10 min,1 000×g离心5 min,弃上清液,加入195 µL Annexin Ⅴ-FITC结合液(1×)轻轻重悬细胞,加入10 µL碘化丙啶染色液,轻轻混匀,冰浴中避光放置10 min;用FACS流式细胞仪检测样品,采用Cell Quest软件(Becton)及Modifit软件分析数据。
1.2.5细胞内多柔比星浓度测定
取对数生长期的各组细胞经培养液洗涤2次,将细胞终浓度调至1×104个/mL,培养3天后加入不同浓度多柔比星,放入温育箱中培养3 h,细胞用冷PBS洗2次,洗去培养基中的多柔比星。应用多功能酶标仪测定其荧光强度,检测波长530 nm,激发波长为485 nm。
1.2.6Western blot法检测
将对数生长期的各组细胞接种于6孔板中,然后用5和10 µg/mL多柔比星处理24 h后,细胞弃去培养基,冷PBS液冲洗2遍,采用细胞刮片收集细胞,用蛋白裂解液裂解细胞,冰浴30 min,12 000 r/min离心10 min,收集上清液,进行蛋白定量,制备好的蛋白样品置-80 ℃冰箱保存备用。每泳道以50 g蛋白上样,经SDSPAGE凝胶电泳,转至硝酸纤维膜。室温封闭3 h,加一抗,室温下温育2 h。再加辣根过氧化物酶标记二抗,室温下温育1 h,采用NBT/BCIP系统显色,记录结果并进行光密度值扫描分析,除以β-actin光密度值所得的比值,并进行统计学分析。
1.3统计学处理
采用SPSS 16.0软件进行统计分析,计量资料的比较采用方差分析(ANOVA)或独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1慢病毒感染MCF-7/adr细胞后AMPKα表达的情况
慢病毒感染成功后,用荧光显微镜检测目的基因的表达(图1)。构建的慢病毒基因组中均带有绿色荧光蛋白基因,MCF-7/adr-vector和MCF-7/adr-AMPKα均带有较强的绿色荧光,表明慢病毒基因组在宿主细胞中稳定表达。
2.2AMPKα过表达增强MCF-7/adr细胞对多柔比星的敏感性
Western blot检测发现转染AMPKα慢病毒质粒的MCF-7/adr细胞中AMPKα蛋白过表达(图2)。多柔比星作用乳腺癌MCF-7/adr细胞、MCF-7/adr-vector细胞及MCF-7/adr-AMPKα细胞24和48 h后,对这3种细胞均呈现浓度依赖性的生长抑制作用(图3和4)。多柔比星对MCF-7/adr和MCF-7/adr-vector细胞的细胞毒性作用相似,作用24 h的IC50值分别为(36.8±2.1)和(33.3±1.9)µg/mL,作用48 h的IC50值分别为(28.8±1.3)和(26.2±1.5)µg/mL。过表达AMPKα明显增强了乳腺癌细胞MCF-7/adr-AMPKα对多柔比星的敏感性,作用24 h的IC50值为(16.0±0.7)µg/mL,作用48 h的IC50值为(4.2±0.2)µg/mL。

图1 荧光显微镜观察MCF-7/adr细胞转染后AMPKα的表达Fig. 1 Expression of AMPKα in transfected-MCF-7/adr cells was observed by fluorescence microscope A, B: MCF-7/adr-vector; C, D: MCF-7/adr-AMPKα
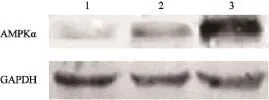
图2 Western blot法检测MCF-7/adr、MCF-7/adr-vector及MCF-7/adr-AMPKα细胞中腺苷酸活化蛋白激酶α(AMPKα)的表达情况Fig. 2 The expression of AMPKα in MCF-7/adr, MCF-7/adrvector and MCF-7/adr-AMPKα cells was detected by Western blot
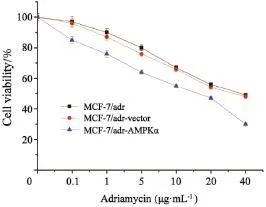
图3 多柔比星作用24 h后对MCF-7/adr、MCF-7/adr-vector及MCF-7/adr-AMPKα细胞的存活率影响Fig. 3 The effect of adriamycin on the viability of MCF-7/ adr, MCF-7/adr-vector and MCF-7/adr-AMPKα cells after 24 h treatment
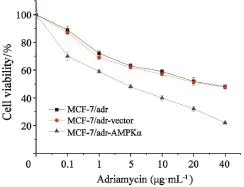
图 4 多柔比星作用48 h后对MCF-7/adr、MCF-7/adr-vector及MCF-7/adr-AMPKα细胞的存活率影响Fig. 4 The effect of adriamycin on the viability of MCF-7/ adr, MCF-7/adr-vector and MCF-7/adr-AMPKα cells after 48 h treatment
2.3过表达AMPKα联合多柔比星对MCF-7/ adr细胞形态学的影响
Hoechst实验结果显示,多柔比星作用前,3种细胞均无明显形态学变化,荧光较均匀。多柔比星作用后,与MCF-7/adr和MCF-7/adrvector细胞相比,过表达AMPKα的细胞呈现核染色质浓缩、核碎裂以及凋亡小体等细胞凋亡特征,表明多柔比星联合AMPKα能诱导细胞产生凋亡(图5)。
2.4过表达AMPKα增加多柔比星对细胞凋亡率的影响
采用Annexin Ⅴ-FITC/PI双染结合流式细胞术方法检测多柔比星对MCF-7/adr、MCF-7/adrvector和MCF-7/adr-AMPKα细胞凋亡率的影响。图6所示,1.0 µg/mL多柔比星作用细胞48 h,与MCF-7/adr-vector和MCF-7/adr细胞组相比,能明显提高MCF-7/adr-AMPKα细胞的凋亡率。MCF-7/adr和MCF-7/adr-vector细胞总凋亡率略高于对照组,分别为(12.0±1.4)%、(12.7±1.6)%和(5.2±0.4)%、(6.1±0.6)%,而过表达AMPKα的MCF-7/adr细胞总凋亡率明显高于对照组(32.0±4.2)%和(4.4±0.5)%。
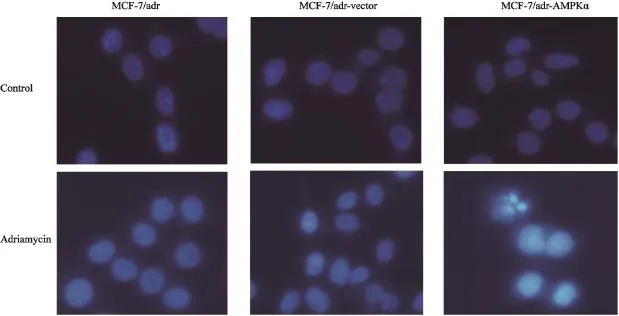
图5 Hoechst 33258荧光核染色对多柔比星作用前后MCF-7/adr、MCF-7/adr-vector及MCF-7/adr-AMPKα细胞凋亡形态的影响Fig. 5 Fluorescent staining of nuclei in adriamycin-treated or untreated MCF-7/adr, MCF-7/adr-vector and MCF-7/adr-AMPKα cells by Hoechst 33258

图6 多柔比星作用前后MCF-7/adr、MCF-7/adr-vector和MCF-7/adr-AMPKα细胞凋亡率的变化Fig. 6 Flow cytometry analysis of adriamycin induced apoptosis in MCF-7/adr, MCF-7/adr-vector and MCF-7/adr-AMPKα cells using Annexin Ⅴ-FITC/PI

表1 过表达AMPKα对细胞内多柔比星累积的影响Tab. 1 The effect of AMPKα overexpression on intracellular accumulation of adriamycin
2.5过表达AMPKα对细胞内多柔比星累积的影响
多柔比星具有荧光效应,可作为细胞内化疗药物累积的指示剂[8]。利用荧光酶标仪对3种细胞内多柔比星的积累量进行测定。过表达AMPKα能明显提高细胞内多柔比星的累积量,具有浓度依赖性。
2.6过表达AMPKα联合多柔比星对p-糖蛋白(P-gp)及凋亡相关通路的影响
多柔比星作用3种细胞后,与MCF-7/adr和MCF-7/adr-vector细胞相比,MCF-7/adr-AMPKα细胞中P-gp表达量明显降低,加入AMPKα抑制剂compound C后,MCF-7/adr-AMPKα细胞中P-gp表达量增加。此外,MCF-7/adr-AMPKα细胞中Bax、Cyt-c、cleaved PARP、caspase-3蛋白表达明显增加,Bcl-2蛋白表达减少。加入compound C后,Bax、Cyt-c、cleaved PARP、caspase-3蛋白表达有所减少,而Bcl-2蛋白表达有所增加,提示AMPKα过表达既能降低药物外排泵P-gp蛋白表达水平,增加多柔比星在细胞内药物浓度,又能激活内源性凋亡信号通路,增强多柔比星对乳腺癌细胞的抑制作用(图7)。

图7 多柔比星以及多柔比星联合AMPK抑制剂作用后,MCF-7/adr、MCF-7/adr-vector及MCF-7/adr-AMPKα 细胞中P-gp蛋白及凋亡相关蛋白的表达Fig. 7 The expression of P-gp and apoptosis related proteins in MCF-7/adr, MCF-7/adr-vector and MCF-7/adr-AMPK cells after adriamycin treatment or adriamycin combined with AMPK inhibitor
3 讨论
乳腺癌的发病率呈逐年上升趋势,其治疗和预后一直是人们关注的热点。传统的化疗药物在治疗中占有重要地位,多柔比星仍然是最为有效和常用的乳腺癌化疗药物。但是临床上患者在经历数次多柔比星化疗后产生耐药现象,严重影响化疗效果[9]。因此,提高多柔比星化疗敏感性在乳腺癌治疗中具有重要的作用。
研究表明,在不同实体肿瘤中均发现能量代谢异常,已被证实是肿瘤细胞的重要特征[10]。与正常细胞相比,在卵巢癌、宫颈癌、肺癌和乳腺癌等多种肿瘤中均检测到低表达的AMPK[11]。Pradelli等[12]发现,通过激活AMPK可增强Jurkat和白血病细胞的凋亡。AMPK还可控制某些蛋白如抑癌基因p53、p27的磷酸化,导致肿瘤细胞周期阻滞及生长抑制[13-14]。研究表明,肿瘤抑制因子LKB1和TSC2参与AMPK介导的抗肿瘤作用[15]。此外,AMPK被电离辐射(ionizing radiation, IR)激活后能增强肿瘤细胞对放疗的敏感性[16]。有研究发现,不同的AMPK亚型及表达差异与卵巢癌的分级和预后有密切关系[17]。但AMPK的过表达是否能增强乳腺癌耐药细胞对多柔比星的敏感性目前尚无报道。
本研究显示,多柔比星对乳腺癌耐药细胞有一定的生长抑制作用,但是多柔比星对过表达AMPKα的乳腺癌耐药细胞有明显的生长抑制作用,且呈剂量和时间依赖性,提示AMPKα高表达可显著提高MCF-7/adr耐药细胞对多柔比星的敏感性。细胞凋亡实验显示,多柔比星作用对照细胞和过表达AMPKα的细胞后,MCF-7/ adr-AMPKα细胞凋亡效果明显增加,表明AMPK具有增加多柔比星对MCF-7/adr细胞诱导凋亡敏感性的作用。为了进一步了解AMPK与多柔比星联合作用的机制,我们进行对照细胞和过表达AMPKα的细胞对多柔比星积累量的检测。结果显示,过表达AMPKα能明显提高细胞内多柔比星的累积量。这些结果表明AMPK过表达的细胞能够促进多柔比星进入乳腺癌耐药细胞发挥抗肿瘤效果,但具体机制需进一步研究。
研究报道,AMPK在抑制肿瘤增殖方面具有直接作用和间接作用,直接作用主要抑制mTOR、P-gp和COX-2等蛋白的活性或表达,此外,还可增加抑癌基因的活性。AMPK也通过间接机制发挥抗肿瘤活性,例如AMPK的表达能抑制胰岛素和IGF-1的分泌以及雌激素(E2)的合成和瘦素的分泌,进而抑制癌细胞的增殖以及影响能量的利用[18]。
为了阐明MCF-7/adr细胞中AMPK提高多柔比星在细胞中的积累并诱导细胞凋亡的作用机制,我们检测了耐药细胞中药物外排泵P-糖蛋白(P-gp)及凋亡通路中抑癌及促凋亡相关蛋白的表达。研究结果发现,多柔比星作用细胞后,过表达AMPKα的MCF-7/adr细胞中耐药蛋白P-gp、促凋亡蛋白Bax、Cyto c、caspase-3及其底物cleaved PARP的表达均明显上调,而凋亡抑制蛋白Bcl-2的表达明显下调。加入AMPK抑制剂compound C后,促凋亡蛋白及P-gp蛋白有所增加,凋亡抑制蛋白Bcl-2表达反而减少。这些结果表明,AMPKα过表达可以抑制耐药蛋白P-gp的表达促进多柔比星进入细胞,同时激活内源性凋亡信号通路,增强多柔比星对乳腺癌细胞的增殖抑制作用。
综上所述,AMPKα过表达在乳腺癌耐药细胞株MCF-7/adr中不仅影响了耐药表型,而且诱导细胞凋亡。这为解决乳腺癌耐药问题提供了新的思路和治疗靶点。AMPK与多柔比星联合方案有可能成为新的标准治疗方案,并在此基础上寻找更好的靶向药物,真正实现个体化靶向治疗,最终达到延长患者生存时间和提高生活质量的目的。
[1] 傅强, 王梅, 王雅杰. 紫杉醇联合顺铂治疗多柔比星耐药的晚期乳腺癌[J]. 癌症, 2002, 21(4): 438.
[2] MITCHELHILL K I, STAPLETON D, GAO G, et al. Mammalian AMP-activated protein kinase shares structural and functional homology with the catalytic domain of yeast Snf1 protein kinase[J]. J Biol Chem, 1994, 269(4): 2361-2364.
[3] BROWN K A, SAMARAJEEWA N U, SIMPSON E R. Endocrine-related cancers and the role of AMPK[J]. Mol Cell Endocrinol, 2013, 366(2): 170-179.
[4] HADAD S M, FLEMING S, THOMPSON A M. Targeting AMPK: A new therapeutic opportunity in breast cancer[J]. Crit Rev Oncol Hematol, 2008, 67 (1): 1-7.
[5] SANLI T, LIU C, RASHID A, et al. Lovastatin sensitizes lung cancer cells to ionizing radiation: modulation of molecular pathways of radioresistance and tumor suppression[J]. J Thorac Oncol, 2011, 6(3): 439-450.
[6] RATTAN R, GRAHAM R P, MAGUIRE J L, et al. Metformin suppresses ovarian cancer growth and metastasis with enhancement of cisplatin cytotoxicity in vivo[J]. Neoplasia, 2011, 13(5): 483-491.
[7] WOODARD J, JOSHI S, VIOLLET B, et al. AMPK as a therapeutic target in renal cell carcinoma[J]. Cancer Biol Ther, 2010, 10(11): 1168-1177.
[8] VAIMAN A V, STROMSKAYA T P, RYBALKINA E Y, et al. Intracellular localization and content of YB-1 protein in multidrug resistant tumor cells[J]. Biochemistry (Mosc), 2006, 71(2): 146-154.
[9] SMITH L, WATSON M B, O’KANE S L, et al. The analysis of doxorubicin resistance in human breast cancer cells using antibody microarrays[J]. Mol Cancer Ther, 2006, 5(8): 2115-2120.
[10] ZHANG X D, DESLANDES E, VILLEDIEU M, et al. Effect of 2-deoxy-D-glucose on various malignant cell lines in vitro[J]. Anticancer Res, 2006, 26(5A): 3561-3566.
[11] 郑杰. 肿瘤生长的能量代谢特点及其临床应用[J]. 中国细胞生物学学报, 2011, 33(10): 1158-1165.
[12] PRADELLI L A, BÉNÉTEAU M, CHAUVIN C, et al. Glycolysis inhibition sensitizes tumor cells to death receptorsinduced apoptosis by AMP kinase activation leading to Mcl-1 block in translation[J]. Oncogene, 2010, 29(11): 1641-1652.
[13] JONES R G, PLAS D R, KUBEK S, et al. AMP activated protein kinase induces a p53-dependent metabolic check point[J]. Mol Cell, 2005, 18(3): 283-293.
[14] LIANG J, SHAO S H, XU Z X, et al. The energy sensing LKB1-AMPK pathway regulates p27 (kip1) phosphorylation mediating the decision to enter autophagy or apoptosis[J]. Nat Cell Biol, 2007, 9(2): 218-224.
[15] HARDIE D G. AMP-activated protein kinase: An energy sensor that regulates all aspects of cell function[J]. Genes Dev, 2011, 25(18): 1895-1908.
[16] SANLI T, RASHID A, LIU C, et al. Ionizing radiation activates AMP-activated kinase (AMPK): A target for radiosensitization of human cancer cells[J]. Int J Radiat Oncol Biol Phys, 2010, 78(1): 221-229.
[17] LI C, LIU V W, CHIU P M, et al. Over-expressions of AMPK subunits in ovarian carcinomas with significant clinical implications[J]. BMC Cancer, 2012, 12: 357. doi: 10.1186/1471-2407-12-357.
[18] BROWN K A, SAMARAJEEWA N U, SIMPSON E R. Endocrine-related cancers and the role of AMPK[J]. Mol Cell Endocrinol, 2013, 366(2): 170-179.
Mechanism of AMPK-enhanced chemosensitivity of breast cancer MCF-7/adr cells to adriamycin
CUI Wenxian, XU Keqing, LI Yuanguo, CHEN Guijin, LU Xiaoqun
(Clinical Laboratory, Changzhou Seventh People’s Hospital, Changzhou 213011, Jiangsu Province, China)
Correspondence to: CUI Wenxian E-mail: swhx2015@163.com
Background and purpose: AMP-activated protein kinase (AMPK) plays an important role in the regulation of cell metabolism and energy balance and is associated with cell proliferation, survival and multiple signaling pathways. Recent reports found that AMPK is involved in tumor suppression and drug resistance. The aim of this study was to explore the effect of AMPK on the anti-tumor effect of adriamycin and underlying mechanism in breast cancer MCF-7/adr cells. Methods: The anti-proliferative effects of adriamycin was detected by methyl thiazolyl tetrazolium (MTT) assay in MCF-7/adr, MCF-7/adr-vector and MCF-7/adr-AMPKα cells. The cell morphology in each group was stained with the fluorescent dye Hoechst 33528, and the effects on apoptosis induction were examined by flow cytometry (FCM). The intracellular concentration of adriamycin was detected by fluorescence assay. The resistance- and apoptosis-related proteins were analyzed by Western blot. Results: The growth of breast cancer MCF-7/adr cells was inhibited by adriamycin in a dose- and time-dependent manner. The IC50values at 24 and 48 h were (36.8±2.1) and (28.8±1.3) µg/mL, respectively. AMPKα over-expression enhanced the cytotoxic effect of adriamycin in MCF-7/adr-AMPKα cells in a dose- and time-dependent manner. Its IC50values at 24 and 48 h were (16.0±0.7) and (4.2±0.2) µg/mL, respectively. Fluorescent morphological assay showed that AMPKα overexpression contributed to adriamycin induced apoptosis in MCF-7/adr-AMPKα cells. After treatment with 1.0 µg/mL adriamycin for 48 h, the apoptosis rates of MCF-7/adr, MCF-7/adr-vector and MCF-7/adr-AMPKα cells were (12.0±1.4)%, (12.7±1.6)% and (32.0±4.2)%, respectively, indicating that overexpression of AMPKα enhanced the adriamycin-induced apoptosis in MCF-7/adr cells. Fluorescence microplate assay showed that over expression of AMPKα significantly increased the intracellular accumulation of adriamycin, in a concentration dependent manner. Western blot analysis showed that, compared with MCF-7/adr and MCF-7/adr-vector cells, the expressions of Bax, caspase-3 and cleaved PARP proteins were increased. Meanwhile, Bcl-2 and P-gp protein expressions were decreased in MCF-7/adr-AMPKα cells. Furthermore, the release of cytochrome c from mitochondria into the cytosol was also observed in MCF-7/adr-AMPKα cells. Conclusion: AMPKα overexpression can enhance the chemosensitivity of breast cancer MCF-7/adr cells to adriamycin through inhibiting the drug efflux transporter and regulating the expression of apoptosis-related proteins.
Breast cancer;Drug resistance;AMP-activated protein kinase;Apoptosis;Adriamycin
10.19401/j.cnki.1007-3639.2016.11.005
R737.9
A
1007-3639(2016)11-0908-08
崔文贤E-mail:swhx2015@163.com
(2015-12-01
2016-03-08)
