Delta-catenin蛋白通过抑制JNK通路活性而减少肺癌细胞的凋亡
2016-12-15董彩凤孙丽红张朝军张俊毅
董彩凤,孙丽红,张 健,张朝军,张俊毅
1.赤峰学院附属医院呼吸内科,内蒙古 赤峰 024000;2.赤峰学院附属医院检验科,内蒙古 赤峰 024000;3.乌海市人民医院病理科,内蒙古 乌海 016000;4.赤峰学院附属医院病理科,内蒙古 赤峰 024000;
Delta-catenin蛋白通过抑制JNK通路活性而减少肺癌细胞的凋亡
董彩凤1,孙丽红2,张健3,张朝军1,张俊毅4
1.赤峰学院附属医院呼吸内科,内蒙古 赤峰 024000;2.赤峰学院附属医院检验科,内蒙古 赤峰 024000;3.乌海市人民医院病理科,内蒙古 乌海 016000;4.赤峰学院附属医院病理科,内蒙古 赤峰 024000;
背景与目的:作为黏附蛋白catenin家族中的一员,Delta-catenin蛋白可以促进肿瘤细胞的增殖和侵袭,然而其提高肿瘤细胞增殖能力的机制并不清楚。本研究检测了Delta-catenin对肺癌细胞凋亡的影响及其与丝裂原活化蛋白激酶(mitogen-activated protein hinase,MAPK)信号通路蛋白的关系,并初步探索了Delta-catenin促进肿瘤细胞侵袭增殖的可能机制。方法:采用蛋白[质]印迹法(Western blot)检测肺癌细胞过表达Delta-catenin前后p38、c-jun氨基末端激酶(c-jun N-terminal kinase,JNK)蛋白活性的变化,同时利用流式细胞术检测了肿瘤细胞凋亡数量的改变,还通过Matrigel基质胶侵袭实验检测了肿瘤细胞侵袭数量的变化。结果:与未处理组和空载体对照组相比,过表达Delta-catenin后肺癌细胞的p38蛋白活性没有变化(P>0.05),但JNK的蛋白活性却显著减少(P<0.05),与此同时,肿瘤细胞的凋亡比例显著下降(P<0.05),而肿瘤细胞的侵袭能力却明显增强(P<0.05)。结论:Delta-catenin可能通过抑制肺癌细胞JNK通路的活性而减少肿瘤细胞的凋亡,进而促进肿瘤细胞的侵袭。
Delta-catenin;肺癌;细胞凋亡;c-jun氨基末端激酶通路
Delta-catenin蛋白(也被称之为NPRAP蛋白,基因名称为CTNND2)作为黏附蛋白catenin家族中的一员,其在肿瘤演进过程中所发挥的作用越来越受到人们的关注。数篇文献报道了Delta-catenin在食管癌[1]、前列腺癌[2]、大脑星形细胞瘤[3]及卵巢癌[4]中的表达明显增高且和患者的不良预后密切相关。特别是我们的研究结果证实,在非小细胞肺癌中存在Deltacatenin蛋白的高表达[5],且Delta-catenin的表达促进了肺癌细胞的增殖和侵袭。然而,上述结果仅仅是一些表面现象,Delta-catenin促进肺癌增殖侵袭的具体机制以及究竟哪条信号通路参与了Delta-catenin对肺癌细胞凋亡的影响目前尚不明确。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族成员在细胞的生物学活动中发挥重要作用,特别是p38和c-jun氨基末端激酶(c-jun N-terminal kinase,JNK)通路参与了细胞受到外界刺激时引起的细胞凋亡[6-9]。有文献报道,在神经元中JNK可以通过磷酸化Delta-catenin而使后者通过蛋白酶体途径降解,从而使Delta-catenin促进神经元突触形成的能力显著降低[10]。本研究旨在探讨Deltacatenin对JNK通路活性的影响,以及Deltacatenin能否通过降低JNK通路的活性而减少肿瘤细胞的凋亡并促进瘤细胞的侵袭、增殖等生物学行为。
1 材料和方法
1.1细胞培养
人肺腺癌细胞系SPC-A-1(以下称SPC)、SK-MES-1(以下称SK)均购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。上述细胞系培养于含100 U/mL青链霉素(购自美国Sigma-Aldrich公司)和10%FBS(购自美国Gibco公司)的RPMI-1640或DMEM(购自美国Gibco公司)培养基中。在37 ℃、CO2体积分数为5%的条件下培养。每2天用0.25%胰酶(购自美国Invitrogen公司)消化传代。
1.2质粒转染
含人源性全长Delta-catenin cDNA的质粒pCMV5-FLAG/Delta-catenin由日本神户大学Nakamura博士惠赠[11],并经宝生物工程(大连)有限公司扩增和验证。用LipofectamineTM2000(购自美国Invitrogen公司)脂质体转染试剂将pCMV5-FLAG/Delta-catenin质粒导入SPC或SK肺癌细胞系中,并以空载体pCMV5作为阴性对照。实验分3组:未处理组、空载体对照组、Delta-catenin过表达组。
1.3蛋白[质]印迹法(Western blot)检测
用RIPA裂解液(购自上海碧云天生物技术有限公司)充分裂解收集的细胞,收集上清液并进行蛋白定量。取等量总蛋白经SDS-PAGE电泳分离后转印至PVDF膜(购自美国Millipore公司),再分别与一抗Delta-catenin、p38、磷酸化的p38(p-p38)、JNK、磷酸化的JNK(p-JNK)和β-actin(均为美国Santa Cruz公司产品)在4 ℃条件下温育过夜。随后PVDF膜与HRP标记山羊抗小鼠二抗(购自美国Santa Cruz公司)在室温下温育2 h,再经ECL发光(购自美国Pierce公司)并曝光胶片(购自日本富士胶片株式会社)。目的蛋白/β-actin的灰度比值作为该目的蛋白的相对表达量。
1.4细胞凋亡测定
收集对数生长期细胞并制成1×107个/mL的细胞悬液。取1 mL细胞悬液用75%冷乙醇于4 ℃固定过夜,离心(110×g,2 min)后制成500 μL的细胞悬液,加50 μg/mL的PI染液(购自美国Sigma-Aldrich公司),于4 ℃避光染核45 min后上流式细胞仪(购自美国BD公司)检测,采用ModFit LT 3.0软件分析细胞凋亡比例。
1.5细胞侵袭实验
利用Matrigel基质胶(购自美国BD公司)和Transwell小室(购自美国Corning公司)检测肺癌细胞的侵袭能力。将1∶4稀释的Matrigel基质胶100 μL加入到上室,待胶凝固后加入100 μL细胞悬液(细胞密度为3×105个/mL),下室加入含血清的细胞培养液600 μL。将已转染Delta-catenin质粒24 h的肿瘤细胞接种到Matrigel基质胶上继续培养24 h,随后用预冷甲醇固定,并用棉签擦掉微孔膜上表面未侵袭的肿瘤细胞,然后用苏木精复染细胞核。显微镜下随机计数5个高倍视野中侵袭到微孔膜下表面的细胞,然后取平均值作为该实验组的平均侵袭细胞数。
1.6统计学处理
应用SPSS for Windows 13.0软件进行数据分析。所有实验均重复3次,数据结果以示,并采用t检验进行组间比较。P<0.05为差异有统计学意义。
2 结果
2.1过表达Delta-catenin可以显著抑制JNK通路的活性
为了探讨Delta-catenin对MAPK通路蛋白中p38、JNK活性的影响,在肺癌细胞系SPC和SK中分别转染pCMV5-FLAG/Delta-catenin质粒后观察p38、JNK蛋白及其各自磷酸化状态的蛋白(即p-p38、p-JNK)表达水平是否改变。结果显示,无论是p38还是p-p38蛋白水平在过表达Delta-catenin前后均没有显著变化(图1A,P>0.05)。与此同时,JNK的总蛋白水平虽然没有变化(图1B,P>0.05),但其磷酸化状态蛋白p-JNK的表达水平却显著下降(图1B,P<0.05)。无论是SPC细胞系还是SK细胞系均显示了类似的蛋白表达结果。说明过表达Delta-catenin可以显著降低JNK通路的活性。
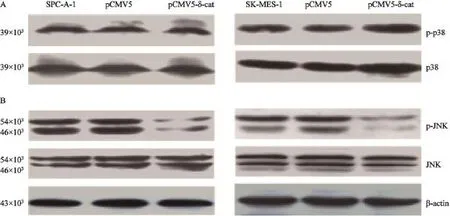
图1 在SPC或SK细胞系中过表达Delta-catenin后p38、p-p38、JNK和p-JNK蛋白表达水平的变化Fig. 1 The alteration of p38, p-p38, JNK, p-JNK protein expressive level in SPC or SK cell lines with Delta-catenin overexpression
2.2过表达Delta-catenin显著减少肺癌细胞的凋亡比例
为了探讨Delta-catenin蛋白对肺癌细胞凋亡的影响。本研究采用流式细胞仪检测不同实验组肿瘤细胞凋亡比例的改变。在SPC细胞系中,过表达Delta-catenin后瘤细胞的平均凋亡比例显著减少,为(3.03±0.68)%,而未转染的细胞和转染空载体的细胞凋亡比例分别为(19.49±0.88)%和(17.01±1.06)%,且过表达组与未转染组或空载体组比较差异均有统计学意义(P<0.05)。与此类似,在SK细胞系中过表达Delta-catenin后瘤细胞的平均凋亡比例也显著减少,为(2.15±0.47)%,而未转染的细胞和转染空载体的细胞凋亡比例分别为(6.97±0.92)%和(7.51±0.74)%,且过表达组与未转染组或空载体组比较差异均有统计学意义(图2,P<0.05)。
2.3过表达Delta-catenin显著增强肺癌细胞的侵袭能力
本研究采用Matrigel基质胶侵袭实验观察了过表达Delta-catenin前后肺癌细胞侵袭能力的改变。在SK细胞系中,过表达Delta-catenin蛋白后穿过微孔膜的瘤细胞数量[(36.12±4.33)个]明显多于未处理组[(15.00±3.78)个]和空载体对照组[(13.68±1.46)个],差异有统计学意义(P<0.05)。同样,在SPC细胞系中过表达Delta-catenin蛋白后穿过微孔膜的瘤细胞数量[(67.31±8.02)个]也显著高于未处理组[(24.62±4.78)个]和空载体对照组[(22.89±2.39)个],差异有统计学意义(图3,P<0.05)。
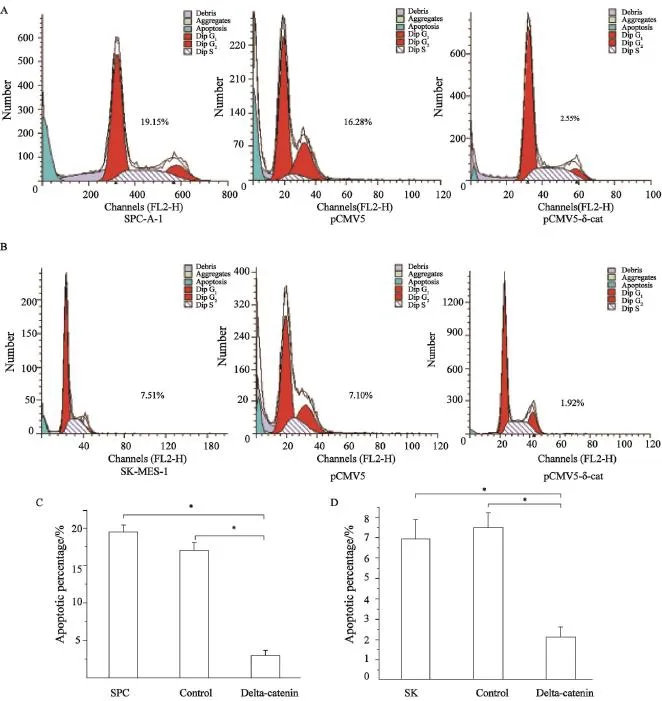
图2 在SPC和SK细胞系中过表达Delta-catenin后瘤细胞凋亡的变化Fig. 2 The apoptotic alteration of tumor cell in SPC and SK cell lines with Delta-catenin overexpression The percent number of upper figure means only one experiment; *: P<0.05, compared with pCMV-Delta-catenin group

图3 在SK和SPC细胞系中过表达Delta-catenin后瘤细胞侵袭数量的变化Fig. 3 The number alteration of invasive tumor cell in SK and SPC cell lines with Delta-catenin overexpression.
3 讨论
Delta-catenin蛋白的表达与恶性肿瘤之间的关系研究已有较多报道[2-5]。包括我们在食管癌中关于Delta-catenin表达的最新研究在内[1],Delta-catenin蛋白及基因表达水平在多个所研究的恶性肿瘤中表达都明显增加,而且它的阳性表达与肿瘤患者的不良预后密切相关。因此,把Delta-catenin作为一个预测恶性肿瘤发生、发展的生物标记物可能具有重要的临床意义。然而,既然不久的将来可以把Deltacatenin作为临床预测患者预后或判断患者治疗效果的肿瘤标记物来应用,但是Delta-catenin促进肿瘤增殖侵袭的确切机制却仍然不清楚,这也为Delta-catenin检测的临床推广增加了难度。因此,在本研究中我们针对Delta-catenin可能的促癌机制进行了初步探讨。
众所周知,MAPK家族成员p38、JNK、细胞外信号调节激酶(extracellular regulated kinase,ERK)在多种细胞生理和病理条件下发挥重要的作用,而其中的p38、JNK对于细胞凋亡的促进起主要影响[12]。本研究结果显示,在肺癌细胞系中过表达Delta-catenin对p38及p-p38的表达水平并没有影响,并且对JNK的表达也没有影响,但却显著降低p-JNK的表达水平,而我们知道只有磷酸化的JNK才可以发挥细胞内信号转导作用。以上结果说明,Deltacatenin可以明显降低JNK蛋白的活性,而我们知道JNK蛋白活性的增加是促进细胞凋亡的主要途径,那么Delta-catenin是否可以通过降低JNK的活性而减少肿瘤细胞的凋亡呢?因此,我们借助流式细胞术观察了过表达Delta-catenin后JNK蛋白活性下降的同时肿瘤细胞的凋亡是否明显减少。与我们的猜测一致,过表达Delta-catenin后肺癌细胞的凋亡比例也显著减少,而我们以前的研究发现,过表达Delta-catenin可以促进肺癌细胞的增殖[5],也就是说Delta-catenin可能通过抑制肿瘤细胞的凋亡而促进肿瘤细胞的增殖。此外,我们通过Matrigel基质胶侵袭实验发现过表达Delta-catenin还可以增强肿瘤细胞的侵袭能力。那么,结合本次研究结果得出,Deltacatenin高表达可能通过降低JNK通路的活性而导致肿瘤细胞凋亡比例的下降并进而促进了瘤细胞的增殖,也进一步促进了肿瘤细胞的侵袭转移,这也印证了我们之前关于Delta-catenin高表达与肿瘤患者的不良预后密切相关的结论。
总之,Delta-catenin促进肿瘤细胞恶性表型的机制可能比较复杂,因为我们之前的研究还显示Delta-catenin可能通过改变小GTPases (包括RhoA、Cdc42和Rac1)的活性而促进细胞骨架的重新装配,进而使肿瘤细胞的运动能力增强,也就促进了肿瘤细胞的侵袭转移[13]。所以,Delta-catenin可能通过多条通路来促进肿瘤细胞的侵袭转移,而且这些通路之间可能存在多处Crosstalk位点,如果我们今后能找到决定Delta-catenin多条信号传递通路的限制性位点,那么开发针对Delta-catenin的分子靶向药物将会变得更加容易且高效。
[1] ZHANG J Y, BAI C Y, BAI Y Q, et al. The expression of δ-catenin in esophageal squamous cell carcinoma and its correlations with prognosis of patients [J]. Hum Pathol, 2014, 45(10): 2014-2022.
[2] LU Q, DOBBS L J, GREGORY C W, et al. Increased expression of delta-catenin/neural plakophilin-related armadillo protein is associated with the down-regulation and redistribution of E-cadherin and p120ctn in human prostate cancer [J]. Hum Pathol, 2005, 36(10): 1037-1048.
[3] WANG M, DONG Q, ZHANG D, et al. Expression of deltacatenin is associated with progression of human astrocytoma[J]. BMC Cancer, 2011, 11: 514. doi: 10.1186/1471-2407-11-514.
[4] FANG Y, LI Z, WANG X, et al. Expression and biological role of δ-catenin in human ovarian cancer [J]. J Cancer Res Clin Oncol, 2012, 138(10): 1769-1776.
[5] ZHANG J Y, WANG Y, ZHANG D, et al. Delta-catenin promotes malignant phenotype of non-small cell lung cancer by non-competitive binding to E-cadherin with p120ctn in cytoplasm [J]. J Pathol, 2010, 222(1): 76-88.
[6] BENHAR M, ENGELBERG D, LEVITZKI A. ROS, stressactivated kinases and stress signaling in cancer [J]. EMBO Rep, 2002, 3(5): 420-425.
[7] LEWIS T S, SHAPIRO P S, AHN N G. Signal transduction through MAP kinase cascades [J]. Adv Cancer Res, 1998, 74: 49-139.
[8] SHEN H M, LIU Z G. JNK signaling pathway is a key modulator in cell death mediated by reactive oxygen and nitrogen species [J]. Free Radic Biol Med, 2006, 40(6): 928-939.
[9] KYRIAKIS J M, AVRUCH J. Mammalian mitogen-activated protein kinase signal transduction pathways activated by stress and inflammation [J]. Physiol Rev, 2001, 81(2): 807-869.
[10] EDBAUER D, CHENG D, BATTERTON M N, et al. Identification and characterization of neuronal mitogenactivated protein kinase substrates using a specific phosphomotif antibody [J]. Mol Cell Proteomics, 2009, 8(4): 681-695.
[11] FUJITA T, OKADA T, HAYASHI S, et al. δ-Catenin/ NPRAP (neural plakophilin-related armadillo repeat protein) interacts with and activates sphingosine kinase 1[J]. Biochem J, 2004, 382(Pt 2): 717-723.
[12] YANG C B, PEI W J, ZHAO J, et al. Bornyl caffeate induces apoptosis in human breast cancer MCF-7 cells via the ROS-and JNK-mediated pathways [J]. Acta Pharmcol Sin, 2014, 35 (1): 113-123.
[13] 张俊毅, 董彩凤, 刘晓辉, 等. NPRAP蛋白通过调节小GTP酶活性促进肺癌细胞的恶性转化[J]. 肿瘤, 2013, 33(6): 483-489.
Delta-catenin protein reduces apoptosis of lung cancer cells via inhibiting the activity of JNK pathway
DONG Caifeng1, SUN Lihong2, ZHANG Jian3, ZHANG Chaojun1, ZHANG Junyi4
(1.Department of Respiratory, the Affiliated Hospital of Chifeng University, Chifeng 024000, Inner Mongolia Autonomous Region, China; 2.Clinical Laboratory, the Affiliated Hospital of Chifeng University, Chifeng 024000, Inner Mongolia Autonomous Region, China; 3.Department of Pathology, People’s Hospital of Wuhai City, Wuhai 016000, Inner Mongolia Autonomous Region, China; 4.Department of Pathology, the Affiliated Hospital of Chifeng University, Chifeng 024000, Inner Mongolia Autonomous Region, China)
Correspondence to: ZHANG Junyi E-mail: zhangjunyi77@sina.com
Background and purpose: As a member of the catenin family, Delta-catenin protein could promote proliferation and invasion of tumor cells, but the accurate mechanism of Delta-catenin promoting cell proliferation is not clear. In the present study, we illustrated that Delta-catenin’s effect on cell apoptosis and their relationship with mitogen-activated protein kinase (MAPK) signaling pathway, and the possible mechanism was also explored for Deltacatenin promoting invasion and proliferation of tumor cells. Methods: The alterations of p38 and c-jun N-terminal rinasel JNK protein activity were detected in SPC and SK lung cancer cell lines with Delta-catenin overexpression or not, by Western blot method. At the same time, the apoptotic number of tumor cells was also examined by FCM method. Furthermore, the number of invasive tumor cells was examined by Matrigel invasive experiment. Results: Compared with untreated group and empty vector group, the activity of p38 protein was unchanged in lung cancer cell lines with Delta-catenin overexpressed (P>0.05), but the activity of JNK protein was decreased significantly (P<0.05),meanwhile, apoptotic proportion of tumor cells were also reduced (P<0.05), and invasive ability of tumor cells was enhanced significantly (P<0.05). Conclusion: Delta-catenin probably decreases apoptosis number of lung cancer cells via inhibiting the activity of JNK pathway, and then promotes invasive ability of tumor cells.
Delta-catenin; Lung cancer; Cell apoptosis; c-jun N-terminal kinase pathway
10.19401/j.cnki.1007-3639.2016.11.004
R734.2
A
1007-3639(2016)11-0902-06
国家自然科学基金(81201844);内蒙古自然科学基金(2014MS0869);内蒙古卫计委医疗卫生科研计划项目(201303156)。
张俊毅E-mail:zhangjunyi77@sina.com
(2015-11-11
2016-03-07)
