丙酸互营氧化菌群对厌氧消化过程中丙酸累积的调控研究进展
2016-12-14马诗淳
凡 慧, 马诗淳, 黄 艳, 邓 宇
(1.农业部沼气科学研究所, 成都 610041; 2.农业部农村可再生能源开发利用重点实验室, 成都 610041)
丙酸互营氧化菌群对厌氧消化过程中丙酸累积的调控研究进展
凡 慧1,2, 马诗淳1,2, 黄 艳1,2, 邓 宇1,2
(1.农业部沼气科学研究所, 成都 610041; 2.农业部农村可再生能源开发利用重点实验室, 成都 610041)
在厌氧消化产沼气过程中乙酸、丙酸和丁酸等挥发性有机酸是重要的中间代谢产物,其中丙酸最为重要。通常厌氧消化系统有机负荷的提高等因素会导致系统丙酸的累积,从而引起系统酸化,抑制厌氧消化系统中微生物的生长、影响系统稳定性。因此,丙酸的降解被认为是厌氧消化过程的限速步骤。然而由于丙酸降解为乙酸,CO2和H2反应所需自由能较高,反应不能自发进行。研究表明丙酸的降解可以通过丙酸氧化菌和氢营养型产甲烷菌等互营合作而完成。文章将从厌氧消化过程中丙酸累积及调控角度出发,分析了影响丙酸累积的几大原因,并总结了近年来针对丙酸累积提出的调控办法和丙酸互营氧化菌群的研究进展,以期为厌氧消化技术的推广应用提供基础。
丙酸互营氧化菌; 丙酸; 厌氧消化系统; 调控
在厌氧消化产沼气过程中,主要通过多种微生物将有机物质转化为CH4和CO2,其中乙酸、丙酸和丁酸等挥发性有机酸是该过程中最为重要的中间代谢产物。有机酸产生于厌氧消化酸化阶段,在产氢产乙酸阶段被降解为乙酸等,为产甲烷菌提供底物[1]。然而,由于丙酸和丁酸转化为乙酸等所需能量较高(△G0> 0),因此反应不能自发进行。有研究表明[2],系统甲烷产量中大约有35%以上是由丙酸转化而来的,丙酸的降解被认为是厌氧消化过程的限速步骤,一旦系统有机负荷超过一定限制或运行不稳定就会造成丙酸的累积[3]。当丙酸等挥发性有机酸浓度达到6.7~9.0 mol·m-3时,则会对厌氧微生物产生抑制作用,降低产甲烷菌对有机酸和H2/CO2的降解速率[4]。2004年,任南琪[5-6]等研究了不同发酵产物对产甲烷的影响,发现当丙酸浓度高于310 mg·L-1时,比产气速率下降,菌群的活性很快被抑制。赵杰红[7]等研究表明,厌氧消化中间代谢产物丙酸的累积会导致体系产气量下降,过量累积时,系统发酵过程被终止。Wei Qiao[8]等采用浸没式厌氧膜生物反应器处理咖啡渣,运行第82 d,由于挥发性有机酸累积,pH值下降至6.6,导致系统失败。因此,提高厌氧消化系统中丙酸的降解效率,缓解或解除厌氧消化系统的酸化是保证系统稳定运行,提高沼气产量,提高原料转化效率的关键措施。
笔者从厌氧消化过程中丙酸累积及调控角度出发,分别对厌氧消化系统丙酸累积的影响因素、对酸化系统的调控以及丙酸互营氧化菌群研究进展等几方面进行总结,以期为厌氧消化系统的推广应用提供基础。
1 影响丙酸累积的因素
1.1 pH值
在厌氧消化过程中,pH值是影响处理效果的重要因素之一,也是厌氧消化过程重要的检测指标和控制参数。厌氧消化过程中,产酸菌群的最适宜pH值范围为5.5~6.5,产甲烷菌群的最适宜pH值在7.0左右,而一些丙酸发酵细菌的最适pH值为7~8[9]。且由于参与丙酸降解的微生物对环境酸碱性较为敏感,pH值的波动有可能会导致微生物代谢活性的下降。在发酵初期由于产生大量挥发酸,若控制不当容易造成丙酸等挥发酸的累积,延长发酵周期,进而破坏整个反应体系[10]。
2000年,张学才[11]等在进行有机垃圾产沼气研究时发现,酸碱对产气情况有较大影响,当 pH 值在 7~8 时,产气状况良好,偏高或偏低都影响正常产气。2009年,吴云[12]的研究表明,餐厨垃圾的厌氧消化,在中性条件(pH值为7.5)下,其COD和有机酸累积溶出量均大幅增加,水解达到稳定的所需时间有所减少,但在碱性条件下(pH值为9.5),微生物活动受到一定抑制,水解产物和水解去除率均低于中性控制条件。2012年,张立国[13]发现,在UASB系统中,食丙酸产氢产乙酸菌Pelotomaculumschinkii在系统中的优势度随着系统内pH值的下降而显著降低,导致系统中丙酸累积。此外,通过调控ABR系统的pH值,可调节系统酸化现象,保证系统的稳定性及处理能力,提高了系统产甲烷能力,提高了有机废弃物的能量回收率。2013年,Wei Qiao[8]等向酸化的厌氧膜生物反应器中添加微量营养元素以及通过NH4HCO3(0.12 gN·g-1TSin)调节pH值,在停止进水22 d后,丙酸逐渐被降解,系统恢复运行。叶凝芳[14]等研究了厌氧发酵过程pH值对微生物多样性和产物分布的影响,得出pH值为7和8时的微生物多样性较高,且这两个pH值环境下微生物的多样性随时间变化规律相似,pH值为5时的微生物多样性较低,而微生物多样性高时比较利于丙酸等挥发酸的产生与降解。因此,有机废弃物的厌氧消化应控制在中性条件下进行。
1.2 有机负荷
有机负荷是消化反应器设计和运行的重要参数,它的提高会刺激系统中适应性强、世代时间短的产酸发酵菌群快速生长,而产甲烷菌群增长缓慢,两者代谢平衡被破坏,使得丙酸、丁酸等代谢产物大量累积,抑制产甲烷菌的活性甚至导致反应器酸化[15]。
张立国[13]研究表明,将有机负荷由36.0 kgCOD·m-3d-1提高到54.0 kgCOD·m-3d-1时,UASB出水中丙酸浓度高达2447 mg·L-1,且随着有机负荷的持续提高,丙酸残留表现出随有机负荷升高而逐渐增加的趋势。2013年,董蕾[16]等在高温条件下处理餐厨垃圾发现,餐厨垃圾厌氧消化正常运行时最大有机负荷可达2.551 kgVS·m-3d-1,此时,每天每千克VS最高可产生甲烷0.622 m3。2014年,夏元亮[17]等在中温条件下利用单相厌氧消化系统处理餐厨垃圾发现,当有机负荷为2.5~3. 0 kg·m-3d-1时,厌氧消化总体效果较好。继续提高有机负荷,丙酸等挥发酸持续累积,导致体系中pH值下降,产气率及有机质降解率明显下降,不利于厌氧消化的进行。2014年,石宪奎[14]等研究表明,在半连续进料的方式下处理餐厨垃圾,当有机负荷在5,6,7 g·L-1d-1的条件下,CSTR反应器可以正常运行,甲烷产率分别为0. 416,0. 414和0. 384 L·g-1d-1,甲烷平均质量分数分别为57. 6%,56%和52. 9%;当有机负荷为8 g·L-1d-1时,pH值由6.7降低至5.5,同时丙酸浓度逐渐上升,系统不能稳定运行,这是由于产酸菌的繁殖速率较产甲烷菌快,当有机负荷较高时,产酸菌分解有机物质产生大量有机酸,产甲烷菌仅能利用少量有机酸,进而导致系统有机酸累积,体系酸化,甲烷产率下降。
1.3 氢分压
文献报道[7],较高的氢分压或较高的氢气产率是引起厌氧消化系统中丙酸等挥发酸累积的主要原因。因为,丙酸在产乙酸菌作用下转化为乙酸和H2,随后乙酸和H2被产甲烷菌转化为甲烷。当氢气累积,则会抑制第一步反应[7]。只有在氢分压和甲酸浓度维持在较低范围内的条件下,互营丙酸氧化菌和产甲烷菌才能正常生长[18]。研究表明,当产氢产乙酸菌(OHPA菌)产生的氢被氢营养型产甲烷菌有效利用,系统中的氢分压较低,反应的自由能为负值时,丙酸则可被降解[12]。
然而,也有一些研究显示人为提高或降低氢分压对厌氧反应器中丙酸的产生无影响[19]。任南琪[6]研究证实,即使氢分压高达50 kPa,也未引起丙酸的大量产生,较高的氢分压并非是造成丙酸累积的主要原因,而特定的pH值和氧化-还原电位(ORP)组成是丙酸产生的生态条件,NADH/NAD+比率的平衡调节是丙酸产生的生理原因。因此,关于较高的氢分压是否是引起丙酸累积的原因,迄今为止还没有较科学和系统的结论和阐述。
2 针对系统酸化的调控方法
厌氧消化反应中的生物相和反应环境比好氧反应更为复杂,要通过优化工艺提高产甲烷速率则须在原有的厌氧消化条件下更深入地细化优化工艺条件以达到理想的产甲烷状态。
2013年,班巧英[20]等以丙酸为底物,UASB的运行为基础,研究发现,在保持进水COD 2000 mg·L-1,HRT由10 h缩短至4 h。体系中的丙酸氧化菌Syntrophobacterfumaroxidans丰度逐渐增加,丙酸氧化菌Pelotomaculumpropionicicum保持稳定,加速了对体系中丙酸的降解,提高了丙酸的降解率,且系统中COD去除率由1.2 kg·kg-1d-1逐渐提高至1.7 kg·kg-1d-1。
Wiegant[21]等曾提出,在废水高温厌氧处理中,当丙酸是主要的有机污染物而氢气的产生不可避免时,应采用两相厌氧反应器,在第二相中丙酸可以被去除。两相系统处理能力提高的原因主要为在第2个反应器中氢分压的降低促进了丙酸的氧化。2009年,Jingxing Ma[22]等指出绝对厌氧的单相消化器运行不稳定,他们通过采用两相厌氧反应器,构建了一个强化丙酸降解(EPAD)的系统,加强了体系对丙酸的降解,促进了产甲烷作用。
两相厌氧工艺不仅提高了反应效率,而且还增加了系统的稳定性,加强了对进料的缓冲能力。许多在单相系统中生物降解不稳定的物质在两相系统中的稳定性很好。但由于其设计和运行维护过于复杂,运行成本较高,在实际应用中选择的并不多[10]。
3 互营微生物对酸化系统的调控
在厌氧消化过程中,不同营养类型微生物的代谢途径及其之间协同关系的改变和发酵过程中菌群结构的演变都会影响到沼气发酵的稳定性和高效性[23]。研究表明[1],向厌氧消化体系中添加Methanosarcina(甲烷八叠球菌),通过与互营乙酸氧化菌(SAO)耦合生长,可以缓解因体系乙酸累积而导致的产甲烷菌群和产甲烷作用被抑制,提高反应器稳定性。
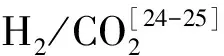
3.1 丙酸氧化菌的分离培养
2005年,Frank[27]等分离得到第一株严格丙酸氧化细菌Pelotomaculumschinkiisp.。2006年,Kendall[28]等从极寒的浅层缺氧海底沉积物中分离得到一株氧化丙酸的互营菌株,并命名为Algorimarinabutyrica,但其生长特别缓慢,笔者富集了超过1年的时间才形成菌落。但这些单独的丙酸氧化菌无法满足厌氧消化过程降解丙酸所需要求,因此,无法实现对丙酸的降解。据报道[29-32],Smithellapropionica,Syntrophobacterfumaroxidans和Pelotomaculumthermopropionicum能够与产甲烷菌互营生长降解丙酸。
Yanlu Gan[33]等证实了温度对互营丙酸氧化菌的活性和群落结构具有一定影响。30 ℃条件下,某些细菌和古菌氧化降解丙酸。在15 ℃时,Pelotomaculumspp.活性较低,且Geobacterspp.和一些厌氧微生物如,Rhodocyclaceae,Acidobacteria,Actinobacteria和Thermomicrobi等也能降解丙酸。
3.2 互营微生物对酸化系统的调控机制
TepidanaerobacteracetatoxydansRe1和Thermacetogeniumphaeum能与产甲烷菌互营合作通过Wood-Ljungdahl 途径氧化乙酸。该途径中,乙酸转化为CO2主要包括4个反应,每个反应均可生成一个电子对。活化乙酸需要消耗1个ATP,同时甲酰四氢叶酸(HCO-THF)通过底物水平磷酸化转化为甲酸过程中可生成1个ATP,因此,乙酸氧化过程中可维持能量守恒[34]。
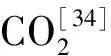
Narihiro[36]等以丙酸等为底物,分别接种活性污泥和猪粪作为菌种进行传代富集培养,分析第11代菌群结构发现,在丙酸降解过程中,互营菌群的关系和结构主要受底物影响,初始接种物对其几乎无影响。Moertelmaier[37]等研究发现,反应器中丙酸的浓度与丙酸氧化菌的数量呈负相关,丙酸氧化菌数量较多有利于丙酸的降解。
3.3 丙酸互营养化菌群对酸化系统的调控
李建政[38]等采用丙酸和丁酸为混合培养基,经过选择培养基的不断传代培养,筛选到2个产氢产乙酸互营共培养体7-m-2a和11-o-1。这两个共培养体对丙酸和丁酸具有很强的降解能力和产乙酸能力,且不产CH4和H2S,为开发高效的厌氧生物处理技术提供理论基础。
Christoph Moertelmaier[39]等研究了重启改良后的的厌氧消化器中挥发性有机酸的新陈代谢和种群变化。结果表明,在启动初期,乙酸和丙酸逐渐累积,Methanosaetasp.数量几乎保持不变,Methanosarcinasp.减少,Methanomicrobiales增加。且乙酸和丙酸降解及累积期间,丙酸氧化细菌的数量逐渐升高,占总细菌数量的5.1%,其中Pelotomaculumsp.占优势,其次为Smithellasp.和Syntrophobactersp.。丙酸氧化细菌数量的升高促进了体系中有机酸的降解,有利于维持系统稳定,到反应后期,有机酸浓度逐渐降低。
因此,通过丙酸互营氧化菌群调控酸化的厌氧消化系统,对保证系统稳定运行,提高底物转化率从而提高沼气产量具有一定的应用前景。
4 小结
丙酸是厌氧消化产沼气过程中较为重要的中间代谢产物,其累积和调控对厌氧生物处理具有重大意义,减少丙酸累积能够有效地维持厌氧消化系统的稳定性。通过总结丙酸累积的原因和调控研究进展发现,目前,针对于丙酸降解的研究主要集中于丙酸互营氧化菌的富集和分离、丙酸去除的影响因素、厌氧消化系统的修复工艺和丙酸互营氧化菌对酸化系统的修复作用,而对于厌氧消化系统丙酸累积的原因和参与修复酸化系统的微生物及其作用机理的研究还比较缺乏。同时,通过丙酸互营氧化菌群调控酸化的厌氧消化系统,对保证系统稳定运行,提高底物转化率从而提高沼气产量具有一定的应用前景。
[1] Shah F A, Mahmood Q, Shah M M, et al. Microbial ecology of anaerobic digesters: the key players of anaerobiosis[J]. The Scientific World Journal, 2014:29.
[2] Mah R A, Xun L Y, Boone D R, et al. Methanogenesis from propionate in sludge and enrichment systems[M]. Springer US :Microbiology and Biochemistry of Strict Anaerobes Involved in Interspecies Hydrogen Transfer,1990.
[3] Tatara M, Makiuchi T, Ueno Y,et al. Methanogenesis from acetate and propionate by thermophilic down-flow anaerobic packed-bed reactor[J]. Bioresource Technology, 2008, 99(11):4786-4795.
[4] 张存胜. 厌氧发酵技术处理餐厨垃圾产沼气的研究[D].北京: 北京化工大学, 2013.
[5] 任南琪, 王爱杰. 厌氧生物技术原理与应用[M]. 北京: 化学工业出版社, 2004.
[6] 任南琪, 赵 丹, 陈晓蕾, 等. 厌氧生物处理丙酸产生和积累的原因及控制对策[J]. 中国科学(B辑化学), 2002(01):83-89.
[7] 赵杰红, 张 波, 蔡伟民. 厌氧消化系统中丙酸积累及控制研究进展[J]. 中国给水排水, 2005(03):25-27.
[8] Qiao W, Takayanagi K, Shofie M, et al. Thermophilic anaerobic digestion of coffee grounds with and without waste activated sludge as co-substrate using a submerged AnMBR: System amendments and membrane performance[J]. Bioresource Technology, 2013, 150:249-258.
[9] 万顺刚, 孙 蕾, 胡朝华. 城市固体有机废弃物厌氧消化处理技术研究进展[J]. 广东农业科学, 2014(23):138-144.
[10] 陈 杰. 城市有机废物厌氧消化技术研究进展[J]. 科技创新与应用, 2012(25):22-23.
[11] 张学才, 陈明功. 城市有机生活垃圾的生物气化[J]. 淮南工业学院学报, 2000(02):34-37.
[12] 吴 云. 餐厨垃圾厌氧消化影响因素及动力学研究[D]. 重庆:重庆大学, 2009.
[13] 张立国. UASB和ABR系统中产氢产乙酸菌群对OLR与pH的生态响应规律[D]. 哈尔滨:哈尔滨工业大学, 2012.
[14] 叶凝芳, 何品晶, 吕 凡, 等. 厌氧发酵过程pH对微生物多样性和产物分布的影响(英文)[J]. 应用与环境生物学报, 2007(02):238-242.
[15] 石宪奎, 王 磊, 胡 超, 等. 不同有机负荷下餐厨垃圾厌氧消化的甲烷产率[J]. 黑龙江科技大学学报, 2014(02):144-148.
[16] 董 蕾, 占美丽, 孙英杰, 等. 餐厨垃圾高温厌氧消化[J]. 环境工程学报, 2013(06):2355-2360.
[17] 夏元亮, 刘 程, 吕 丹, 等. 有机负荷对餐厨单相厌氧消化产甲烷的影响[J]. 环境卫生工程, 2014(06):66-68.
[18] Schink B. Energetics of Syntrophic Cooperation in Methanogenic Degradation[J]. Microbiology and Molecular Biology Reviews, 1997(6):262-280.
[19] Inanc B, Matsui S, S. I. Propionic acid accumulation and controlling factors in anaerobic treatment of carbohydrate: effect of H2and pH[J]. 1996, 34(5):317-325.
[20] 班巧英, 李建政, 张立国, 等. HRT对丙酸去除效能的影响及丙酸氧化菌群的响应[J]. 哈尔滨工业大学学报, 2013(08):50-55.
[21] Wiegant W M, Hennink M, Lettinga G. Separation of the propionate degradation to improve the efficiency of thermophilic anaerobic treatment of acidified wastewaters[J]. Water Research, 1986, 20:517-524.
[22] Ma J, Carballa M, Van De Caveye P, et al. Enhanced propionic acid degradation (EPAD) system: Proof of principle and feasibility[J]. Water Research, 2009, 43(13):3239-3248.
[23] 马诗淳. 沼气发酵微生物代谢调控技术研究 [D]. 北京: 中国农业科学院, 2009.
[24] Stams A J M, Plugge C M. Electron transfer in syntrophic communities of anaerobic bacteria and archaea[J]. Nature Reviews Microbiology, 2009, 7(8):568-577.
[25] McInerney M J, Struchtemeyer C G, Sieber J, et al. Physiology, Ecology, Phylogeny, and Genomics of Microorganisms Capable of Syntrophic Metabolism[J]. Annals of the New York Academy of Sciences, 2008, 1125(1):58-72.
[26] 吴 云. 餐厨垃圾厌氧消化影响因素及动力学研究[D]. 重庆:重庆大学, 2009.
[27] Frank A M De Bok, Hermie J M Harmsen, Caroline M. Plugge, et al. The first true obligately syntrophic propionate-oxidizing bacterium, Pelotomaculum schinkii sp. nov., co-cultured with Methanospirillum hungatei, and emended description of the genus Pelotomaculum[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(4):1697-1703.
[28] Kendall M M, Liu Y, Boone D R. Butyrate- and propionate-degrading syntrophs from permanently cold marine sediments in Skan Bay, Alaska, and description of Algorimarina butyrica gen. nov., sp. nov[J]. FEMS Microbiol Lett, 2006, 262(1):107-114.
[29] Hiroyuki Imachi, Yuji Sekiguchi, Yoichi Kamagata, et al. Pelotomaculum thermopropionicum gen. nov, sp. nov, an anaerobic, thermophilic, syntrophic propionate-oxidizing bacterium[J]. International Journal of Systematic and Evolutionary Microbiology, 2002, (52):1729-1735.
[30] Hermie J. M. Harmsen, Bernardina L. M. Van Kuijk, Caroline M. Plugge, et al. Syntrophobacter furnaroxidans sp. nov., a syntrophic propionate-degrading sulfate- reducing bacterium[J]. international Journal of Systematic Bacteriology, 1998(48):1383-1387.
[31] Liu Y, Balkwill D L, Aldrich H C, et al. Characterization of the anaerobic propionate-degrading syntrophs Smithella propionica gen. nov., sp. nov. and Syntrophobacter wolinii[J]. Int J Syst Bacteriol, 1999, 49 Pt 2:545-556.
[32] Tomoyuki Kosaka, Taku Uchiyama, Shun-ichi Ishii, et al. Reconstruction and Regulation of the Central Catabolic Pathway in the Thermophilic Propionate-Oxidizing Syntroph Pelotomaculum thermopropionicum[J]. Journal of bacteriology, 2006, 188(1):202-210.
[33] Gan Y, Qiu Q, Liu P, et al. Syntrophic oxidation of propionate in rice field soil at 15 and 30 ℃ under methanogenic conditions[J]. Applied and environmental, 2012.
[34] Worm P, Koehorst J J, Visser M, et al. A genomic view on syntrophic versus non-syntrophic lifestyle in anaerobic fatty acid degrading communities[J]. Biochimica et Biophysica Acta (BBA) -Bioenergetics, 2014, 1837(12):2004-2016.
[35] Worm P, Stams A J M, Cheng X, et al. Growth- and substrate-dependent transcription of formate dehydrogenase and hydrogenase coding genes in Syntrophobacter fumaroxidans and Methanospirillum hungatei[J]. Microbiology, 2010, 157(1):280-289.
[36] Narihiro T, Nobu M K, Kim N, et al. The nexus of syntrophy-associated microbiota in anaerobic digestion revealed by long-term enrichment and community survey[J]. Environmental Microbiology, 2015,17(5):1707-1720.
[37] Moertelmaier C, Li C, Winter J, et al. Fatty acid metabolism and population dynamics in a wet biowaste digester during re-start after revision[J]. Bioresource Technology, 2014,166:479-484.
[38] 李建政, 孙 倩, 刘 枫, 等. 一种产氢产乙酸菌互营共培养体的筛选及其群落结构解析[J]. 科技导报, 2009, 16(27):78-82.
[39] Moertelmaier C, Li C, Winter J, et al. Fatty acid metabolism and population dynamics in a wet biowaste digester during re-start after revision[J]. Bioresource Technology, 2014, 166:479-484.
Research Progress on Propionic Acid Accumulation and Regulation by Syntrophic Propionate-oxidizing Bacteria Community in Anaerobic Digestion Process /
FAN Hui1,2, MA Shi-chun1,2, HUANG Yan1,2, DENG Yu1,2/
( 1. Biogas Institute of Ministry of Agriculture, Chengdu 610041, China; 2. Key Laboratory of Development and Application of Rural Renewable Energy of Ministry of Agriculture, Chengdu 61004, China)
Volatile organic acid is important intermediate metabolite during anaerobic digestion process, especially propionic acid. Propionic acid often accumulates under an excessively high organic loading rate, which may cause a rapid acidification and inhibiting the growth of microbes in anaerobic digesters. Thus, the degradation of propionic acid is regarded as the rate-limiting step in anaerobic digestion. However, the anaerobic conversion of propionic acid to acetate, CO2and H2is highly endergonic and does not occur naturally. Studies showed that propionic acid could be degraded by the syntrophic cooperation of propionate-oxidizing microbes and hydrogenotrophic methanogens. Therefore, based on propionic acid accumulation and its regulation during anaerobic process, the major influential factors of propionic acid accumulation were analyzed in this paper, The regulation methods on propionic acid accumulation suggested in recent years, and the research progress of syntrophic propionate-oxidizing bacteria community were reviewed and summarized, expecting to provide basis for applications of anaerobic digestion technique.
syntrophic propionate-oxidizing bacteria; propionic acid; anaerobic digestion system; regulation
2016-06-01
项目来源: 四川省科技计划项目(2012GZ0003;2014NZ0045); 四川省应用基础研究计划项目(2013JY0006); 四川省科技基础条件平台项目(15010302)
凡 慧(1989- ),女,四川资中人,在读硕士,主要从事环境微生物学研究工作,E-mail:fan.hui.chengdu@outlook.com
邓 宇,E-mail:dengyu@caas.cn
X172; X505
A
1000-1166(2016)04-0003-05
