佛手瓜鲨烯合酶基因克隆及酶分子结构分析
2016-12-14苏何玲肖雅伦谭燕莲谷云艳刘永明吴耀生
苏何玲,肖雅伦,谭燕莲,梁 斌,谷云艳,刘永明,吴耀生
(1.广西医科大学生物化学与分子生物学教研室,广西南宁 530000;2.桂林医学院医药生物技术重点实验室,广西桂林 541004)
佛手瓜鲨烯合酶基因克隆及酶分子结构分析
苏何玲1,2,肖雅伦2,谭燕莲2,梁 斌2,谷云艳2,刘永明2,吴耀生1*
(1.广西医科大学生物化学与分子生物学教研室,广西南宁 530000;2.桂林医学院医药生物技术重点实验室,广西桂林 541004)
[目的]克隆佛手瓜鲨烯合酶(SQS)基因,并基于克隆的SQS序列分析该酶的分子结构,为佛手瓜生物活性成分的利用提供理论依据。[方法]根据SQS基因 5′末端保守序列和3′race方法扩增的佛手瓜SQS基因3′末端序列设计佛手瓜SQS基因克隆引物。扩增的佛手瓜SQS基因片段插入pGEM-T Easy Vector后经DNA测序。应用生物信息学方法分析克隆序列的开放阅读框架(ORF)、酶蛋白的疏水性/亲水性和蛋白质磷酸化位点,预测酶蛋白的二级结构、结构域、三级结构和跨膜区。以布朗葡萄藻为outgroup,应用MEGA 5.0进行UPGMA算法构建系统树,并进行1 000次的Bootstrap 测试。[结果]佛手瓜SQS由417氨基酸残基构成,等电点为6.983。构象预测提示该酶二级结构以α螺旋为主,是一种只有三级结构的单体酶,其活性中心是主要由几个α螺旋围绕形成的穴状结构,酶蛋白肽链中具有1个跨膜区。结构域分析表明SQS属于异戊二烯合酶家族。磷酸化位点分析显示该酶共有17个磷酸化位点,其中,S48位于与酶活性中心相关模体中,而S196为陆生植物SQS基因的正选择位点。以佛手瓜SQS基因ORF序列构建系统发生树得到的系统发生分类结果与形态学分类结果一致。[结论]佛手瓜SQS是由417氨基酸残基构成的单体酶,具有1个跨膜区和17个磷酸化位点,其中,S48和S196可能是佛手瓜SQS酶活性调节的关键性磷酸化位点。
佛手瓜;鲨烯合酶;基因克隆;结构分析
佛手瓜(SechiumeduleSwartz)为葫芦科多年生宿根性草质藤本植物,其果实肉质细嫩,富含蛋白质、碳水化合物、维生素、胡萝卜素及钙、磷、铁、硒等营养物质,是具有保健作用的珍稀蔬菜[1]。研究表明,佛手瓜根、茎、叶和果实含有叶酸、泛酸、烟酸、黄酮类和皂甙类等生物活性物质[2-3]。与甜瓜和罗汉果等其他葫芦科植物含有四环三萜的葫芦素(Cucurbitacins)不同,佛手瓜不含葫芦素而含有五环三萜类化合物(Pentacyclic Triterpenoids)齐墩果酸型皂甙[4],具有抗肿瘤[5-8]、抗炎[9-11]、调节血糖和降血压[12-16]等药理功效。植物中五环三萜类化合物的生物合成主要通过甲羟戊酸(Mevalonic Acid Pathway,MVA)途径,即首先由两分子乙酰辅酶A在乙酰辅酶A乙酰基转移酶的作用下形成乙酰乙酰辅酶A,再经由3-羟基-3-甲基戊二酸单酰辅酶A、甲羟戊酸、异戊烯二磷酸及鲨烯等中间产物最终合成五环三萜类化合物。在MVA途径中,鲨烯合酶(Squalene Synthase,SQS)催化合成的产物鲨烯是三萜、甾醇和胆固醇等物质生物合成的重要共同前体,是该途径的关键酶。因此,SQS活性与佛手瓜五环三萜类化合物的含量密切相关。目前关于佛手瓜SQS分子结构和酶活性调节机制尚不明确。笔者克隆了佛手瓜SQS基因开放阅读框架(Open Reading Frame,ORF),并应用生物信息学方法对该酶的分子结构进行分析。
1 材料与方法
1.1 材料 供试材料为2015年6月购自驻马店市志海种业有限公司的佛手瓜一代大田用种,将种子于温室种植至发芽10 cm后,取其叶片在液氮中保存备用。T4DNA连接酶和TaqDNA聚合酶购自大连宝生物公司,2×TaqPCR MasterMix、核酸电泳Marker DL 2000、质粒小提试剂盒和大肠杆菌DH5α购自天根生化科技有限公司,X-gal、SanPrep柱式DNA胶回收试剂盒、异硫氰酸胍粉剂及引物购自上海生工生物工程股份有限公司,3′-Full RACE Core Set with PrimeScriptTM RTase购自日本TaKaRa公司,pGEM-T Easy Vector连接试剂盒购自美国Promega公司。克隆测序送上海生工生物工程股份有限公司。
1.2 方法
1.2.1 总RNA提取及逆转录。佛手瓜叶片中的总RNA采用改进异硫氰酸胍法提取。取叶片0.01~0.02 g,剪成碎片置于2 mL冻存管底部,存入液氮罐,过夜。次日取出冻存管,立即加入异硫氰酸胍提取缓冲液(25 mmol/L柠檬酸钠,0.5%十二烷基肌氨酸钠(pH 7.0),4 mol/L异硫氰酸胍,用前加β-巯基乙醇至总浓度2%),用手提式S10高速匀浆机匀浆。加入200 μL氯仿,100 μL 2 mol/L NaAc(pH 4.0),800 μL饱和酚,漩涡振荡混匀,置于冰上5 min,4 ℃、15 000 r/min 离心10 min。将上层水相转移至新的1.5 mL离心管中,加入2/3体积的5 mol/L KAc,混匀,置于冰上5 min,4 ℃、15 000 r/min 离心10 min。将上层水相转移至新的1.5 mL离心管中,加入1/2体积的异丙醇,混匀。-20 ℃冰浴10 min,4 ℃、15 000 r/min 离心10 min。弃上清,加入70%乙醇洗沉淀后用无RNA酶水溶解沉淀,-80 ℃保存备用。取1 μg总RNA,用Oligo(dT)为引物反转录为cDNA作为扩增佛手瓜SQS的ORF模板。取1 μg总RNA,按3′-Full RACE Core Set with PrimeScriptTM RTase说明书操作,反转录为模板后用于扩增佛手瓜SQS基因的3′末端序列。
1.2.2 佛手瓜SQS基因部分片段的扩增及3′端序列的扩增。参照NCBI上GenBank中其他葫芦科植物SQS序列中的高度保守序列,设计引物P1:5′-CAACAACGTTGAAG-TCTTCAGGGG-3′,P2:5′-CCGACTGCTCGCATGTTTTC-3′,扩增佛手瓜SQS基因部分片段,扩增长度为302 bp,扩增条件:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火 30 s,72 ℃延伸30 s,40个循环;72 ℃延伸5 min。将扩增产物送上海生工生物工程股份有限公司测序,并证实所得序列为佛手瓜SQS基因部分序列。根据测序结果设计佛手瓜SQS基因3′末端特异性内部引物P3:5′-GGTCAACAGTGATCCTAATGC-3′及特异性外部引物P4:5′-CGATTGCGGATGTCTATGGAGC-3′。佛手瓜SQS基因3′末端的克隆按3′-FullRACECoreSetwithPrimeScriptTMRTase说明书操作,将克隆菌液送上海生工生物工程股份有限公司进行测序,并证实所得序列为佛手瓜SQS基因 3′末端序列。
1.2.3 佛手瓜SQS基因ORF的克隆。鉴于SQS基因5′末端高度保守,根据NCBI上GenBank中其他葫芦科植物SQS基因序列及上述所得的佛手瓜SQS基因3′末端序列设计扩增佛手瓜SQS基因ORF的引物P5:5′-GATTGAGAGCGA-GAAATGGG-3′,P6:5′-GGCTAACCAACCTGTATGA-3′。扩增条件:94 ℃ 预变性5min;94 ℃ 30s,51 ℃ 30s,72 ℃ 60s,35个循环;72 ℃延伸5min。将PCR扩增产物胶回收,并将回收后的产物按美国Promega公司的pGEM-TEasyVector试剂盒克隆佛手瓜SQS基因ORF,将获得的质粒送上海生工生物工程股份有限公司测序。
1.2.4 生物信息学分析。将获得的佛手瓜SQS基因序列置于NCBI上,通过OpenReadingFrameFinder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)寻找ORF,并以DNASTAR将获得的序列ORF翻译为氨基酸序列,运用NetPhos2.0Server(http://www.cbs.dtu.dk/services/NetPhos/)对蛋白质磷酸化位点进行预测,以ProtParam(http://web.expasy.org/cgi-bin/protparam/protparam)及ProtScale(http://web.expasy.org/protscale/)分析佛手瓜SQS蛋白的疏水性/亲水性。运用DNASTART软件中的protean以及在线网站NPS@(/https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)分析其二级结构;在NCBICD-Search(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)网站上进行结构域预测。运用TMHMMServerv.2.0分析跨膜区。
通过在线软件SWISS-MODEL对佛手瓜SQS蛋白质的三级结构进行预测,RASTOP2.0软件进行编辑。从GenBank中下载植物SQS基因,布朗葡萄藻为outgroup,以Clustalx1.8对已报道的绞股蓝、香瓜、黄瓜、人参、丹参、拟南芥、甘草、番茄、马铃薯、烟草、玉米等物种的SQS氨基酸序列进行比对分析,并构建系统进化树,在MEGA5.0软件上进行UPGMA算法,并进行1 000次的Bootstrap测试。
2 结果与分析
2.1 佛手瓜总RNA提取结果 提取的佛手瓜子叶总RNA用Nanodrop2000检测,其A260/280均在1.8~2.0,A260/230也均大于2.0,且琼脂糖凝胶电泳显示,28SrRNA与18SrRNA的亮度接近2∶1,表明所提取的总RNA质量良好。
2.2 佛手瓜SQS基因的扩增结果 参照NCBI上GenBank中其他葫芦科植物SQS基因序列中的高度保守序列,设计引物P1及P2,扩增佛手瓜SQS基因部分片段,扩增长度与预期相符,测序结果在NCBI的BLASTRefSeqGene上进行比对,结果获得SQS基因部分序列。按3′-FullRACECoreSetwithPrimeScriptTMRTase说明书克隆佛手瓜SQS基因 3′末端,扩增结果与预期相符。将PCR产物克隆入pGEM-TEasy载体中,测序结果在NCBI的BLASTRefSeqGene上比对,结果获得佛手瓜SQS基因 3′末端序列。
2.3 佛手瓜SQS 基因的克隆 根据获得的序列设计扩增佛手瓜SQS基因ORF的引物P5和P6,并扩增佛手瓜SQS基因ORF片段,扩增结果与预测相符。将PCR产物克隆至pGEM-T Easy 载体中,将测序结果于NCBI的BLAST RefSeqGene上进行比对,结果获得佛手瓜SQS基因ORF序列。
2.4 生物信息学分析
2.4.1 佛手瓜SQS核苷酸序列分析。将获得的佛手瓜基因序列传至NCBI(http://www.ncbi.nlm.nih.gov/)Analyz中的ORF Finder(Open Reading Frame Finder),并对佛手瓜SQS基因ORF 核苷酸序列进行分析,结果显示,佛手瓜SQS基因ORF编码417个氨基酸,等电点为 6.983。将佛手瓜SQS基因ORF与其他植物SQS基因进行核苷酸序列比对构建系统树,显示系统发生分类结果与形态学分类结果一致(图1)。
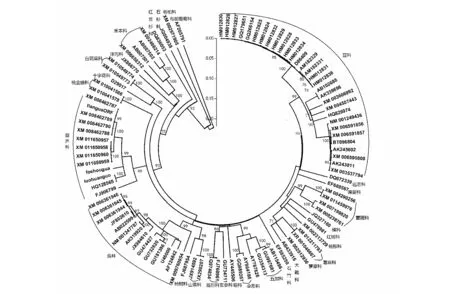
图1 佛手瓜SQS 基因与其他植物SQS基因序列比对构建的系统进化树Fig.1 Phylogenetic tree constructed by comparing the nucleotide sequence of Sechium edule Swartz SQS with those of the SQS genes from other plants
2.4.2 佛手瓜SQS氨基酸序列分析。结合NCBI中的ORF Finder工具以及DNASTART软件,将佛手瓜SQS基因ORF 核苷酸序列推衍出其氨基酸序列,佛手瓜SQS与葫芦科其他植物氨基酸序列比对,结果见图2。由图2可知,与酶活性中心相关的47VSRSF52、Y70、R74、77DTVED81、Y164、G202、L205、212RDYLED217、R225均高度保守。ProtParam分析结果表明,佛手瓜SQS为亲水性蛋白,多肽链中包含50个碱性氨基酸、52个酸性氨基酸。极性氨基酸91个,疏水性氨基酸163个,GRAVY值为-0.024。NetPhos 2.0 Server分析表明,佛手瓜SQS共有17个磷酸化位点,其中,丝氨酸磷酸化位点6个,分别为S48、S196、S249、S349、S358、S407;苏氨酸磷酸化位点6个,分别为T78、T144、T161、T318、T325、T366;酪氨酸磷酸化位点5个,分别为 Y15、 Y165、Y236、Y245、Y273。

图2 佛手瓜SQS磷酸化位点分析Fig.2 Prediction analysis of the phosphorylation sites in Sechium edule Swartz SQS
2.4.3 佛手瓜SQS蛋白质结构生物信息学分析。二级结构分析显示,该蛋白的二级结构中α螺旋占66.91%,β折叠占7.67%,延伸主链占8.87%,无规则卷曲占16.55%,佛手瓜SQS主要由α螺旋构成(图3A)。结构域预测结果显示,佛手瓜SQS蛋白质属于异戊二烯合酶家族,含结合镁离子及法呢酰基二磷酸的结合位点,以及富含天冬氨酸模体(图3B)。跨膜区分析提示,佛手瓜鲨烯合酶具一个跨膜区,为386~408氨基酸,1~385氨基酸位于膜外侧,409~417氨基酸位于膜内侧(图4)。三级结构预测提示,佛手瓜SQS为单体蛋白结构(图5),其活性中心主要由几个α螺旋围绕形成一穴状活性中心结构,其17个磷酸化位点均位于蛋白质的表面。
3 结论与讨论
SQS是齐墩果酸型皂甙生物合成的关键酶,其活性对齐墩果酸型皂甙的生物合成具有关键性作用。因此,对佛手瓜SQS进行酶分子结构分析,了解该酶活性调节的分子基础,可为佛手瓜齐墩果酸型皂甙生物合成调节研究提供理论依据。
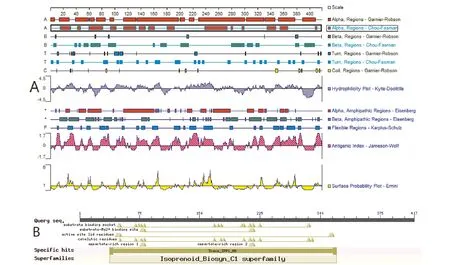
注:A.佛手瓜SQS二级结构;B.佛手瓜SQS结构域。Note:A.The result of the secondary structure prediction of Sechium edule Swartz SQS.B.The result of the domain prediction of Sechium edule Swartz SQS.图3 佛手瓜SQS二级结构和结构域预测Fig.3 Prediction analysis of the secondary structure and domain of Sechium edule Swartz SQS
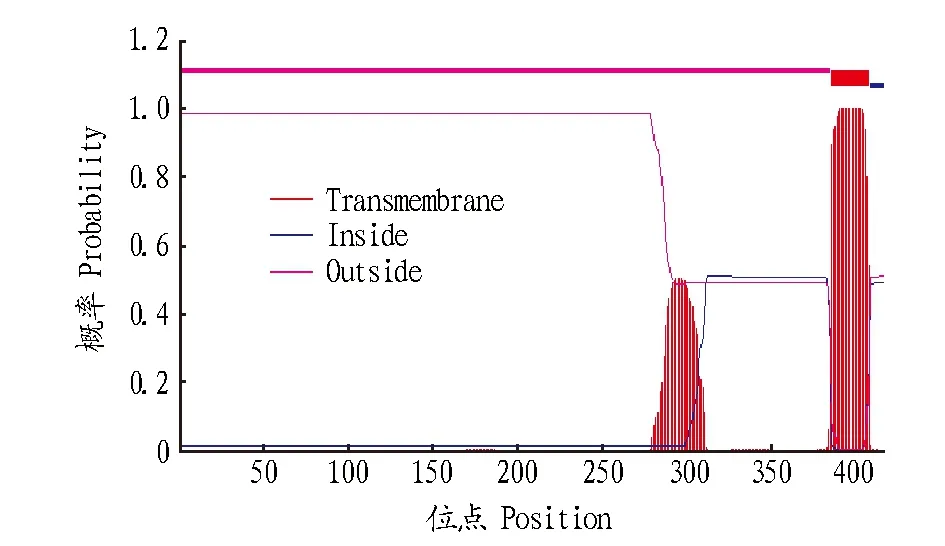
图4 佛手瓜SQS跨膜区结构预测分析Fig.4 Transmembrane segments structure prediction of Sechium edule Swartz SQS
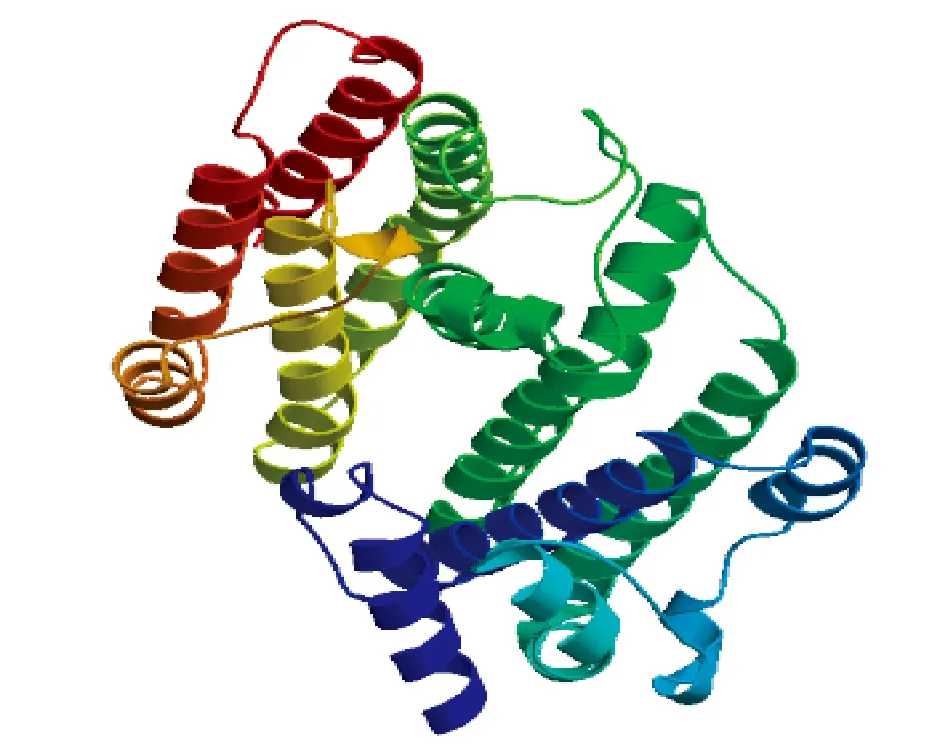
图5 佛手瓜SQS 三级结构预测分析Fig.5 Tertiary structure prediction of Sechium edule Swartz SQS
基于克隆的佛手瓜SQS基因ORF,推导出佛手瓜SQS的氨基酸序列。序列分析表明,佛手瓜SQS是由417氨基酸残基构成的单体酶。佛手瓜SQS与甜瓜SQS的结构相似[22],二级结构以α螺旋为主,活性中心为穴状结构,主要由几个α螺旋的肽段围绕形成。但与甜瓜SQS具有2个跨膜区序列不同,佛手瓜SQS仅有一段跨膜区序列,为386~408氨基酸,1~385氨基酸位于内质网膜外侧,409~417氨基酸位于内质网膜内侧。从GenBank下载葫芦科的绞股蓝、罗汉果及黄瓜SQS序列,推衍出相应氨基酸序列之后分析其跨膜区,发现绞股蓝、罗汉果的SQS有2个跨膜区而黄瓜SQS仅有一个跨膜区。
佛手瓜SQS分子中与酶活性密切相关的47VSRSF52、Y70、R74、77DTVED81、Y164、G202、L205、212RDYLED217和R225关键氨基酸位点均位于内质网膜外侧。此外,该酶共有17个磷酸化位点,除磷酸化位点S407位于酶蛋白的跨膜区外,其他16个磷酸化位点均位于酶蛋白的内质网膜外侧。其中,磷酸化位点S48位于与酶活性中心相关的47VSRSF52模体中,而磷酸化位点S196是陆生植物SQS的正选择位点,提示S48和S196可能是佛手瓜SQS酶活性调节的关键性磷酸化位点。佛手瓜SQS这些酶分子结构特点与甜瓜SQS相似。
以获得的佛手瓜ORF基因序列与其他植物SQS基因进行核苷酸序列比对构建系统树,结果发现,系统发生分类结果与目前形态学分类结果一致。该结果为葫芦科的分类系统提供分子生物学依据。但就葫芦科的种属分类系统而言,基因序列数据过少,种类不多,不足以对整个葫芦科的植物进行种属的系统发生分析。邱明华等[23]以葫芦科植物所含的化合物对葫芦科植物进行分类,结果表明,单独以葫芦科植物的化学证据还很难支持整个科的某一个系统,应综合细胞、胞粉、染色体、分子生物学等结果进行分析。
该研究在克隆葫芦科植物佛手瓜SQS基因的基础上,应用生物信息学方法分析佛手瓜SQS的分子结构,结果发现该酶是由417氨基酸残基构成的单体酶,分子中仅具一个跨膜区。综合跨膜区、酶活性相关模体、磷酸化位点及正选择位点分析结果,提示S48和S196可能是佛手瓜SQS酶活性调节的关键性磷酸化位点。
[1] 关佩聪.佛手瓜[M]//中国农业百科全书总编辑地蔬菜卷编辑委员会,中国农业百科全书编辑部.中国农业百科全书:蔬菜.北京:农业出版社,1990:77.
[2] 张奇志,邓欢英,林丹琼,等.佛手瓜果实中营养保健成分的分析研究[J].食品研究与开发,2007,28(8):139-142.
[3] SICILIANO T,DE TOMASSI N,MORELLI I,et al.Study of flavononids ofSechiumedule(Jacq)Swartz(Cucurbitaceae)different edible organs by liquid chromatography photodioide array mass spectrometry[J].J Agric Food Chem,2004,52(21):6510-6515.
[4] CASTRO V H,RAMIREZ E,MORA G A,et al.Structures and antip roliferative activity of saponins fromSechiumpittieriandS.talamancense[J].Chem Pharm Bull,1997,45(2):349-358.
[5] YAN S L,HUANG C Y,WU S T,et al.Oleanolic acid and uraolic acid induce apoptosis in four human liver cancer cell lines[J].Toxicol In Vitro,2010,24(3):842-848.
[6] RAWENDRA R D,LIN P Y,CHANG C D,et al.Potentiation of acute promyelocytic leukemia cell differentiation and prevention of leukemia development in mice by oleanolic acid[J].Anticancer Res,2015,35(12):6583-6590.
[7] 温少瑾,郝敬全,江劲波.中药诱导肿瘤细胞凋亡机制的研究进展[J].湖南中医杂志,2013,29(5):125-127.
[8] HUANG Z,FU J,LIU L,et al.Glycosylated diazeniumdiolate-based oleanlic acid derivatives:Synthesis,invitroandinvivobiological evaluation as anti-human hepatocellular carcinoma agents[J].Organic & biomolecular chemistry,2012,10(19):3882-3891.
[9] 张明发,沈雅琴.甘草酸及其衍生物的抗炎和抗变态反应研究进展[J].现代药物与临床,2011,26(5):359-364.
[10] HSU H Y,YANG J J,LIN C C.Effects of oleanolic acid and ursolic acid on inhibiting tumor growth and enhancing the recovery of hematopoietic system postirradiation in mice[J].Cancer Lett,1997,111(1/2):7-13.
[11] 王会敏,田炜,喇孝瑾,等.葛根素、齐墩果酸及其配伍对 T2DM 大鼠氧化应激和炎症反应的影响[J].中国实验方剂学杂志,2013,19(15):174-177.
[12] GAO D W,LI Q W,LI Y,et al.Antidiabetic potential of oleanolic acid fromLigustrumlucidumAit[J].Can J Physiol Pharmacol,2007,85(11):1076-1083.
[14] SOMOVA L I,SHODE F O,RAMNANAN P,et al.Antihypertensive,antiatherosclerotic and antioxidant activity of triterpenoids isolated fromOleaeuropaea,subspecies africana leaves[J].J Ethnopharmacol,2003,84(2/3):299-305.
[15] WEN X A,SUN H B,LIU J,et al.Naturally occurring pentacyclic triterpenes as inhibitors of glycogen phosphorylase:Synthesis,structure-activity relationships,and X-ray crystallographic studies[J].J Med Chem,2008,51(12):3540-3554.
[16] ORTIZ-ANDRADE R R,GARCA-JIMÉNEZA P,et al.α-Glucosidase inhibitory activity of the methanolic extract from Tournefortia hartwegiana:An antihyperglycemic agent [J].J Ethnopharmacol,2007,109(1):48-53.
[17] 戴云,董学畅.佛手瓜果脯系列食品的研制[J].食品科学,2001,1(3):60-62.
[18] 黄丽,杨君,林丹琼,等.酱制佛手瓜加工技术研究[J].中国调味品,2011,36(7):69-73.
[19] 唐克华,喻世锋,董爱文,等.佛手瓜脯真空浸糖加工工艺研究[J].食品工业科技,2004,25(5):80-82.
[20] 杨胜敖.佛手瓜酸奶生产工艺技术研究[J].中国乳品工业,2009,37(5):58-60.
[21] 张建华,胡飞,陈火英.佛手瓜菜汁饮料和南瓜发酵饮料的研制[J].上海农学院学报,2000,18(2):115-118.
[22] 黄海霞,苏何玲,史云龙,等.甜瓜鲨烯合酶基因克隆及酶分子结构分析[J].广西植物(2016-03-24)[2016-07-15].http://www.cnki.net/kcms/detail/45.1134.q.20160324.0938.002.html.DOI:10.11931/guihaia.gxzw201601035.
[23] 邱明华,陈书坤,陈剑超,等.葫芦科化学分类学[J].应用与环境生物学报,2005,11(6):673-685.
Gene Cloning and Molecular Characterizations of Squalene Synthase fromSechiumeduleSwartz
SU He-ling1,2, XIAO Ya-lun2, TAN Yan-lian2, WU Yao-sheng1*et al
(1.Department of Biochemistry and Molecular Biology, Guangxi Medical University, Nanning ,Guangxi 530000; 2. Key Laboratory of Medicinal Biotechnology, Guilin Medical University, Guilin,Guangxi 541004)
[Objective] To clone the gene of squalene synthase (SQS) fromSechiumeduleSwartz and characterize the molecular structure of the enzyme, and thus provide the groundwork for exploiting the bioactive components ofSechiumeduleSwartz. [Method] Primers for cloning of theSQSgene fromSechiumeduleSwartz were designed according to the 5′ end conservative sequence ofSQSgenes and the 3′ end sequence of theSQSgene fromSechiumeduleSwartz obtained by 3′race amplification. The amplified fragment of theSQSgene fromSechiumeduleSwartz was inserted into the pGEM-T Easy Vector and verified by DNA sequencing. The analyses of the open reading frame (ORF) of theSechiumeduleSwartzSQSgene sequence cloned, the hydrophobicity/hydrophily and the phosphorylation sites of the zymoprotein, as well as the predictions of the secondary structure, domain, tertiary structure and transmembrane region of the enzyme were conducted using bioinformatics methods. The phylogenetic tress was constructed by performing the UPGMA of MEGA 5.0 and carrying out 1000 times of Bootstrap test, using botryococcus braunii as outgroup. [Result]SechiumeduleSwartzSQSis constituted of 417 amino acid residues with an isoelectric point of 6.983. Conformation prediction analyses suggested that α helix is the main kind of the secondary structure inSechiumeduleSwartzSQSzymoprotein, and the SQS is a monomeric enzyme with a cave-like activity center formed by α helixes. Domain analysis showed that the enzyme molecule possesses a transmembrane region and suggested that the SQS is belonged to the isoprenoid biosynthase superfamily. And the analysis of phosphorylation site indicated that there are 17 phosphorylation sites in the enzyme protein, among which the S48locates in the activity center-related motif and the S196is a positive selection site of theSQSgene. The result of phylogenetic classification based on the phylogenetic tress constructed with the ORF sequence of theSQSgene was in accordance with that of morphologic classification. [Conclusion]SechiumeduleSwartz SQS is a monomeric enzyme constituted of 417 amino acid residues and possesses a transmembrane region and 17 phosphorylation sites, among which the S48and S196may be the critical sites for the regulation of the SQS activity.
SechiumeduleSwartz; Squalene synthase; Gene cloning; Molecular structure analysis
国家自然科学基金项目(31260069);广西高等学校优秀中青年骨干教师培养工程资助项目。
苏何玲(1973- ),女,广西桂林人,教授,硕士,从事生物化学与分子生物学研究。*通讯作者,教授,博士,博士生导师,从事生物化学与分子生物学研究。
2016-09-08
S 188;Q 946.83
A
0517-6611(2016)32-0142-05
