建立符合人类诊断标准的变应性鼻炎大鼠模型初探*
2016-12-14周柳青刘勇强张小兵
周柳青,刘勇强,张小兵
(1.兰州大学第一医院耳鼻咽喉头颈外科,甘肃兰州730000;2.兰州大学基础医学院人体解剖学研究所,甘肃兰州730000)
建立符合人类诊断标准的变应性鼻炎大鼠模型初探*
周柳青1,刘勇强2,张小兵1
(1.兰州大学第一医院耳鼻咽喉头颈外科,甘肃兰州730000;2.兰州大学基础医学院人体解剖学研究所,甘肃兰州730000)
建立符合人类诊断标准的变应性鼻炎大鼠模型。取6-8周龄的Wistar大鼠27只,雌雄各半,随机分为模型组(n=12)和对照组(n=12),另有3只空白大鼠用于被动皮肤过敏试验(PCA)。模型组以卵清蛋白(OVA)作为变应原辅以氢氧化铝佐剂进行腹腔注射,完成基础致敏;之后用2%OVA生理盐水进行鼻内激发。对照组以生理盐水替代OVA。模型组基础致敏阶段完成后,PCA(+),证明IgE产生;鼻内激发阶段完成后,各大鼠行为学评分均>5分,出现喷嚏、鼻痒、流清涕等典型症状,鼻粘膜病理切片HE染色示嗜酸性粒细胞浸润。对照组无上述变化。本实验成功建立了符合人类诊断标准的可重复的变应性鼻炎大鼠模型。
耳鼻咽喉头颈外科;变应性鼻炎;大鼠模型;IgE;嗜酸性粒细胞
近年来变应性鼻炎(allergic rhinitis,AR)患病率直线上升,全球患者超过5亿,围绕其预防、诊疗所开展的科学研究成为热点[1]。AR是一种发生在鼻粘膜的I型变态反应疾病,其诊断要点为发作时典型的临床症状、IgE抗体阳性和鼻粘膜嗜酸性粒细胞浸润[2]。此次,我们设计并建立了符合以上诊断标准的AR大鼠模型,通过行为学再现了AR发作时的典型临床症状[3],使用PCA试验说明了IgE抗体阳性[4],通过鼻粘膜病理切片HE染色展示了嗜酸性粒细胞浸润[5]。
1 材料与方法
1.1 动物与试剂
1.1.1 实验动物及分组
6~8周龄Wistar大鼠 (兰州大学实验动物中心提供),共27只,雌雄各半,体重180~220g,SPF级。在清洁空调动物房饲养,避免常见过敏原存在,早晚12h间断照明。随机分为两组,每组12只。第1组为模型组;第2组为对照组。另有3只空白大鼠用于被动皮肤过敏试验 (passive cutaneous anaphylaxis reaction,PCA)。
1.1.2 药品与试剂
卵白蛋白(ovalbumin,OVA,美国Sigma公司,V级)。氢氧化铝佐剂制备:AlCl3+3NaOH=Al(OH)3↓+ 3NaCl。反应产物经过反复混匀、抽吸和洗涤后得到新鲜配制的胶态氢氧化铝[6]。
1.2 造模方法
1.2.1 基础致敏
模型组:0.3mgOVA+1mlAl(OH)3佐剂,腹腔注射,隔日1次,共7次。对照组:1mL生理盐水+ 1mLAl(OH)3佐剂,腹腔注射,隔日1次,共7次。
1.2.2 鼻内激发
基础致敏阶段末次腹腔注射结束后隔日开始鼻内激发阶段。模型组:每日每侧鼻腔滴入2%OVA生理盐水20ul,连续10d。对照组:每日每侧鼻腔滴入生理盐水20ul,连续10d。
1.3 模型评价项目
1.3.1 行为学观察
激发后即刻至30min内,用数码摄像对大鼠行为进行记录,观察动物挠鼻、喷嚏、流涕症状。评分标准见表1[3,7]。
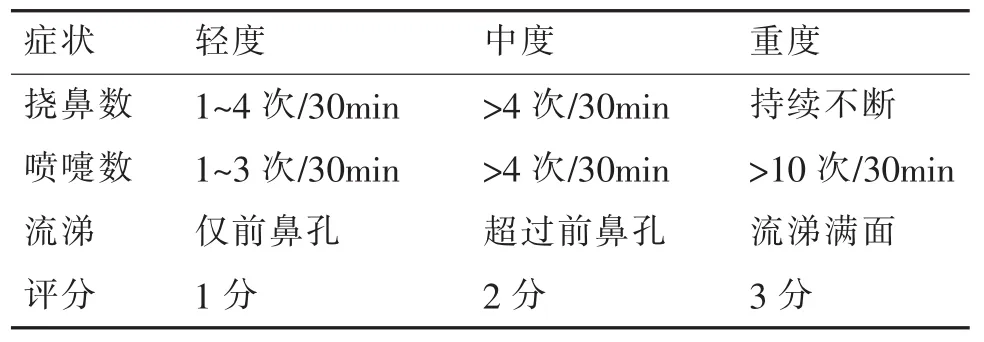
表1 变应性鼻炎大鼠
1.3.2 PCA反应
血清制备:基础致敏完成后,自模型组和对照组中随机各取3只大鼠,脱毛开胸心脏采血约5mL。血液样本于4℃保存2~4h,随后离心(3000 rpm,4℃)以获得血清。
另取空白大鼠3只,麻醉后脱毛,背部皮下分4个区域,每个区域1个注射点,每点间隔大于2cm。将所制备的各组血清原液,分别皮内注射于相应空白大鼠背部皮肤,0.1mL/点。7h后尾静脉注射含有相同致敏剂量的抗原和伊文思蓝(Evans Blue,北京索莱宝科技有限公司)等量混合液,共1mL。30min后处死大鼠,剥离背部皮肤,测量蓝斑直径,直径大于5mm者判断为阳性[8]。
1.3.3 组织病理学评价
鼻标本提取:末次激发1h后,各组大鼠以10%水合氯醛300mg/kg行腹腔注射。麻醉后取鼻中隔粘膜固定于10%中性甲醛溶液中,石蜡包埋,制成4um厚切片。石蜡切片常规脱蜡入水后做HE染色,用以观察鼻粘膜的嗜酸性粒细胞浸润等组织病理学改变。
1.4 统计学分析
计数结果以 “均数±标准差”表示,应用SPSS17.0统计软件进行统计学分析,采用单因素方差分析进行组件比较,采用q检验进行两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 行为学评分
每次鼻内激发后,模型组动物均出现频繁挠鼻、喷嚏及流水样涕,每只的叠加量化评分都大于5分,平均评分为(7.6±0.7)。对照组大鼠激发后,偶有挠鼻,无其他上述症状,叠加量化评分为(1.9±1.3)。两组的行为学评分比较有统计学差异(P<0.05)。
2.2 PCA反应
模型组PCA反应(+),对照组PCA反应(-)
2.3 HE染色
模型组中除去PCA试验已用去的3只大鼠,剩余9只中有3只可见鼻粘膜嗜酸性粒细胞增多,杯状细胞增多,部分粘膜上皮脱落(如图1所示)。对照组鼻粘膜均未见嗜酸性粒细胞及杯状细胞增多,粘膜上皮排列整齐。

图1 鼻粘膜HE染色(40×)模型组鼻粘膜大量嗜酸性粒细胞增多,杯状细胞增多,部分粘膜上皮脱落
3 讨论
目前国内外复制、评价AR动物模型尚无统一标准[9]。Wistar大鼠是常见的模型动物,通常以OVA作为变应原致敏,所建的AR模型常以行为学评分作为评价标准,不够客观[10,11]。因此尝试建立了此模型,并用人类的AR诊断标准对其进行了初步评价。
AR是机体暴露于变应原后主要由IgE介导的鼻粘膜非感染性慢性炎性疾病,其确诊需要检测针对变应原(与病人病史有关的)的IgE反应或检测血清中的 IgE,临床常用的方法有皮肤针刺试验(skinpricktest,SPT)[12]。本试验采用PCA反应作为检测IgE的手段,其原理与SPT相同,都是利用抗原与注射部位的肥大细胞上的抗体起反应,导致组胺释放而出现局部过敏反应。因此可准确的判断出I型变态反应的标志IgE的产生。
嗜酸性粒细胞升高是人类AR诊断的重要客观指标[13-14]常使用无创的鼻分泌物涂片为手段,在高倍显微镜下观察嗜酸性粒细胞比例>5%作为诊断标准。由于大鼠鼻腔容积小,提取鼻分泌物较困难,因此我们选用经典的病理学诊断方法——鼻粘膜病理切片HE染色,来评价鼻粘膜嗜酸性粒细胞的变化。经过与对照组比较,清晰的观察到模型组鼻粘膜嗜酸性粒细胞增多,从而作出AR的诊断,这也是临床上最为可靠、常用的诊断方法。
参阅以往关于建立变应性鼻炎动物模型的文献,此次研究以人类变应性鼻炎诊断标准为依据,在Wistar大鼠上再现了变应性鼻炎发作时的临床症状及诊断指标--IgE和嗜酸性粒细胞增高,且所选用的评价手段简便易行、成本低廉、可操作性及特异性好,但成模率仍有待提高。
[1] Bousquet J,Schunemann HJ,Samolinski B,et al.Allergic rhinitis and its impact on asthma(ARIA):Achievements in 10 years and future needs[J]. Journal of Allergy and Clinical Immunology,2012,130(5): 1049-1062.
[2] Greiner AN,Hellings PW,Rotiroti G,et al.Allergic rhinitis [J].Lancet,2011,378(9809):2112-2122.
[3] 赵秀杰,董震,杨占泉.鼻超敏反应实验模型的建立[J].中华耳鼻咽喉科杂志,1993,28(1):17-18.
[4] 马毅,桂岩,王有虎,等.18β-甘草次酸对变应性鼻炎大鼠鼻粘膜上皮细胞紧密连接的影响[J].2014,28(20):1590-1594.
[5] Mota I.The mechanism of anaphylaxis.I.production and biological properties of' mast cell sensitizing' antibody[J].Immunology,1964,7:681-699.
[6] Skoner DR.Allergic rhinitis:Definition,epidemiology,detection,and pathophysiology,diagnosis[J].J Allergy ClinImmunol, 2001,108(1):S2-S8.
[7] 赵宇,C.AndrewvanHasselt,吴港生,etal.卵白蛋白经鼻致敏建立变应性鼻炎动物模型[J].中华耳鼻咽喉头颈外科杂志, 2005,40(3):175-180.
[8] Mota I.Passive cutaneous anaphylaxis induced with mast cell sensitizing antibody.The role of histamine and 5-hydrox ytryptamine[J].Life Sciences,1963,2(12):917-927.
[9] 李萌,魏肖云,戴启刚,等.变应性鼻炎动物模型的研究现状[J].现代中西医结合杂志,2013,22(12):1360-1363.
[10]李钦,李玉芬,陈彦林,等.白细胞介素5和13受体对变应性鼻炎大鼠血管细胞黏附分子1及干扰素的影响[J].中华耳鼻咽喉头颈外科杂志,2012,47(8):638-641.
[11] 江英,席克虎,陈小婉,等.18β-甘草次酸对变应性鼻炎大鼠鼻黏膜纤毛超微结构的影响[J].第二军医大学学报,2015,36 (1):26-33.
[12] 中华耳鼻咽喉头颈外科杂志编辑委员会鼻科组,中华医学会耳鼻咽喉头颈外科分会鼻科学组.变应性鼻炎诊断和治疗指南(2015年,天津)[J].中华耳鼻咽喉头颈外科杂志, 2016,51(1):6-19.
[13]Naclerio,Robert M.Allergic Rhinitis[J].New England Journal of Medicine325(12):860-869.
[14]Stone K D,Prussin C,Metcalfe DD(2010)IgE,mastcells,basophils, andeosinophils.JAllergyClinImmunol125(2):S73-S80.doi:10. 1016/j.jaci.2009.11.017.
R246.81
国家自然科学基金资助项目(81160449)。
