核糖体蛋白RPL15多克隆抗体的制备与细胞内定位
2016-12-14梁爽爽冀美超胡晓晴付成华朱长军董智雄
梁爽爽,冀美超,胡晓晴,付成华,朱长军,董智雄
(天津师范大学 a.生命科学学院;b.天津市动植物抗性重点实验室;c.分子细胞系统生物学重点实验室,天津 300387)
核糖体蛋白RPL15多克隆抗体的制备与细胞内定位
梁爽爽,冀美超,胡晓晴,付成华,朱长军,董智雄
(天津师范大学 a.生命科学学院;b.天津市动植物抗性重点实验室;c.分子细胞系统生物学重点实验室,天津 300387)
为了解核糖体大亚基蛋白RPL15在细胞中的定位和功能,设计并合成了RPL15蛋白的多肽,作用于抗原免疫兔子,使其产生特异性多克隆抗体,利用蛋白免疫印迹和免疫荧光方法检测RPL15抗体的特异性.结果证实本研究成功制备并纯化了RPL15的多克隆抗体,且该抗体可以特异性识别RPL15蛋白.免疫荧光实验表明RPL15定位于细胞质和细胞核中,主要定位于核仁并呈点状分布,且与UBF、FBL和C23存在部分共定位.
RPL15;核糖体;多克隆抗体;免疫荧光;细胞内定位
核糖体大亚基蛋白RPL15(ribosomal protein L15)隶属于Pfam00827家族,其cDNA包含759个核苷酸,能够编码204个氨基酸,蛋白分子质量约为24×103(24 kDa)[1].关于RPL15蛋白在细胞中的定位,Simoff等[2]和Klein等[3]发现在酵母细胞中该蛋白与Nop1蛋白共定位于核仁,且60%以上的部分与核仁的23S rRNA核苷酸序列结合,表明RPL15蛋白可能参与酵母细胞核糖体的早期组装过程;Wang等[4]研究发现食道癌细胞中RPL15蛋白存在过表达现象,且参与47S prerRNA中ITS1位点的有效切割过程,从而也证实了该蛋白参与核糖体RNA的加工过程.RPL15蛋白与多种疾病的发生和发展密切相关.Landowski等[5]发现在先
天再生障碍性贫血症细胞中RPL15基因缺失;Wang等[6]发现在多个胃癌细胞株(AGS、MKN45、MKN28、SGC7901和KATOⅢ)中RPL15的表达量较高,抑制RPL15的表达就可以抑制SGC7901细胞株的生长[7],RPL15蛋白这种促进癌细胞增殖的作用使其有可能成为抗癌治疗的潜在靶标.
RPL15蛋白在核糖体生物合成及疾病发生过程中具有多种重要功能,但其具体作用机制尚不清楚,该蛋白在细胞对内外刺激应答过程中的作用也需阐明.本研究将RPL15抗原注入兔子体内提取RPL15多克隆抗体,并且明确其在细胞内的定位.这有助于阐明该蛋白分子的生物学功能及分子机制,为其作为疾病的诊断蛋白标记物奠定实验基础.
1 材料与方法
1.1 材料
1.1.1 实验细胞
人宫颈癌细胞株HeLa为天津师范大学分子细胞系统生物学重点实验室所有.
1.1.2 主要试剂
DMEM培养基和胎牛血清,美国Hyclone公司;特异性单克隆鼠抗Tubulin抗体,美国Sigma公司;特异性单克隆鼠抗UBF抗体,美国Santa Cruz公司;特异性单克隆鼠抗Nucleolin(C23)和Fibrillarin(FBL)抗体,英国Abcam公司;辣根过氧化物酶(horse radish peroxidase,HRP)标记的山羊抗兔和山羊抗鼠,美国Immuno公司;Opti-MEM、Tuberfect和抗体纯化试剂盒,美国Thermo Scientific公司.
1.1.3 主要仪器
蛋白电泳仪,美国Bio-Rad公司;激光共聚焦显微镜,日本Nikon公司.
1.2 方法
1.2.1 RPL15抗原多肽序列的设计
设计RPL15抗原的多肽序列:Cys-Ser-Arg-Arg-Ala-Ala-Trp-Arg-Arg-Arg-Asn-Thr-Leu-Gln-Leu-His-Arg-Tyr-Arg,由昂泰生物科技有限公司合成该多肽.
1.2.2 RPL15抗原的制备
在2 mL的PBS(pH6.0)中加入134 μL的钥孔血蓝蛋白(KLH),边搅拌边缓慢加入200 μL的质量浓度为30 mg/mL的乙酸湖泊亚胺酯(MBS),充分混匀.将提前准备好的G-25交联葡聚糖珠子加入Bio-Rad柱中,用50 mL的PBS(pH 7.4)平衡柱子.将KLH和MBS的混合液加入柱中,用pH 7.4的PBS洗脱,同时用1.5 mL的离心管收集液体,每管收集1 mL.用BCA蛋白定量试剂盒测定蛋白质的浓度,选取浓度高的3管液体混合,与100 mg的RPL15抗原多肽交联,搅拌1 h.用pH 7.4的PBS透析12 h,分装液体,于-80℃下保存备用.
1.2.3 抗原免疫兔子和血清的制备
首先抽取兔子的免疫前血清(pre-bleed),1周后对其进行免疫注射RPL15抗原.将RPL15抗原与弗氏完全佐剂(体积比为1∶1)充分混匀.每只兔子第1次免疫需200 μg,即2 mL(1 mL弗氏完全佐剂+1 mL RPL15抗原)抗原.将混匀的2 mL抗原在兔子背部进行皮下注射(共12~15个点).2周后进行第2次免疫注射,从本次开始抗原量降至100 μg,弗氏完全佐剂换为弗氏不完全佐剂.1周后进行第3次免疫注射.从第4周开始抽取血清,用10 mL注射器从兔子耳缘动脉抽取血浆,置于15 mL离心管中,于4℃下放置2~3 d,10 621 r/min离心30 min,上清液即为血清,将其分装在2 mL离心管中,于-80℃下保存.
1.2.4 RPL15血清抗体的纯化
将5 mg的RPL15多肽溶解在100 μL的PBS中,取10 μL加入到1 mL的coupling buffer中,剩余部分加入50 μL的TCEP,室温孵育30 min.将1 mL的coupling buffer过Bio-Rad柱,重复2次,加TCEP溶液到柱中,室温孵育45 min,收集流下的液体.用1 mL的PBS洗柱,重复3次,用1 mL的coupling buffer洗柱,重复1次.向柱中加入1 mL的Cysein·HCl溶液,室温混合15 min,弃去液体,用6 mL的PBS平衡Bio-Rad柱.用10 mL的PBS稀释5 mL血清,于4℃、8 000 r/min下离心15 min,取上清.将上清过柱3次,用10 mL的PBS洗柱.用1 mL的elution buffer洗脱抗体,1.5 mL离心管收集,加入质量分数为0.05%的叠氮钠后于4℃下保存.
1.2.5 细胞培养及传代
采用含有10%(体积分数)胎牛血清的DMEM培养基培养人宫颈癌细胞株HeLa,培养温度为37℃,CO2体积分数为5%.HeLa为贴壁生长细胞,每周传代2~3次,传代时先用胰酶消化细胞,再扩增细胞至新鲜培养基中.
1.2.6 质粒转染
在24孔细胞培养皿中以每孔5×104的数量铺入HeLa细胞,24 h后转染pEGFP和pEGFP-RPL15质粒.将100 μL的Opti-MEM、200 ng质粒和1 μL的Tuberfect混匀,15 min后将混合液加入到培养的细胞中,24 h后通过观察荧光情况确定其转染效率.
1.2.7 小分子干扰RNA(siRNA)转染
在24孔细胞培养皿中以每孔1×104的数量铺入HeLa细胞,24 h后转染RPL15的siRNA.将100 μL
的Opti-MEM、50 nmol/L的RPL15 siRNA和1 μL的Tuberfect混匀,15 min后将混合液加入细胞培养基中,72 h后收集细胞.利用蛋白免疫印迹(Western Blot,WB)检测RPL15的干涉效率.
1.2.8 免疫共沉淀(immunoprecipitate,IP)实验
收集1×106个HeLa细胞,用冰冷的PBS洗1次,加500 μL的RIPA Buffer(体积分数为1%的NP-40+质量分数为1%的脱氧胆酸钠+质量分数为0.1%的SDS+ 150 mmol/L的NaCl+10 mmol/L的Na3PO4+50 mmol/L的NaF+2 mmol/L的EDTA+0.2 mmol/L的Na3VO3)裂解细胞,冰上静置1 h,4℃、20 817 r/min下离心30 min.取出上清,平均分为2管,一管中加0.5 μL的免疫前血清(pre-bleed serum),另一管中加0.5 μL的免疫后血清(anti-RPL15 serum),于4℃摇床上摇4 h.每管裂解液中分别加入10 μL的protein A beads混合液,于4℃摇床上摇2 h.4℃、15 294 r/min下离心2 min.弃去上清,用800 μL的RIPA Buffer洗beads,15 294 r/min离心2 min,重复2次.弃去上清,加入25 μL的SDS上样缓冲液,进行蛋白免疫印迹分析.
1.2.9 蛋白免疫印迹
细胞裂解液经SDS-PAGE电泳分离后,将RPL15蛋白(一抗抗体)转至PVDF膜上,用质量分数为5%的脱脂奶粉/TBS封闭30 min,在质量分数为3%的脱脂奶粉/TBST中孵育,室温杂交2 h,TBST洗3次,每次5 min.再加入对应的二抗抗体室温杂交1 h,TBST洗3次,每次5 min,在PVDF膜上加ECL和H2O2,室温孵育2 min,曝光.
1.2.10 细胞免疫荧光(immunofluorescence,IF)观察
向铺有细胞爬片的24孔板中以每孔3×104的数量接种细胞,于37℃、CO2体积分数为5%的条件下在培养箱中培养.24 h之后,每孔用500 μL的PBS洗3次,每次5 min.弃去PBS,用500 μL的甲醇丙酮(甲醇和丙酮的体积比为1∶1)混合液固定细胞3 min.弃去固定液,用500 μL的PBS洗3次,每次5 min.将爬片小心取出后各加100 μL的封闭液(体积分数为5%的山羊血清+体积分数为0.4%的Triton X-100+PBS),室温封闭30 min.弃去封闭液,用500 μL的PBS洗1次,5 min后弃去PBS,加入50 μL用PBS-TX(含体积分数为0.4%的Triton X-100的PBS溶液)稀释的一抗稀释液(一抗和PBS-TX的体积比为1∶300),室温孵育2 h.弃去一抗稀释液,用200 μL的PBS-TX洗3次,每次5 min.弃去PBS-TX,加入50 μL用PBS-TX稀释的荧光标记的二抗稀释液(二抗和PBS-TX的体积比为1∶500),室温避光孵育1 h.弃去二抗稀释液,加入50 μL用PBS-TX稀释的DAPI(DAPI和PBS-TX的体积比为1∶600),染色3 min.弃去DAPI,用200 μL的PBS-TX洗3次,每次5 min.弃去PBS-TX,在载玻片上滴上4 μL抗淬灭剂,将片子取出后细胞面向下放在滴有抗淬灭剂的载玻片上,用指甲油封片,于荧光显微镜下观察.
2 结果
2.1 免疫共沉淀检测RPL15抗体的特异性
用获得的兔子免疫前血清和免疫后RPL15血清进行免疫沉淀-免疫印迹检测(IP-Western),结果如图1所示.
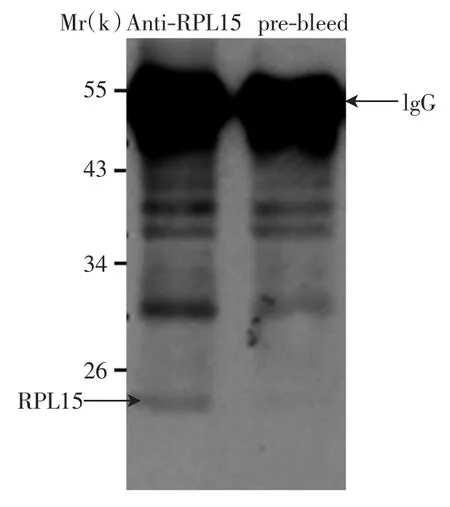
图1 蛋白免疫共沉淀实验检测RPL15抗体Fig.1 Detection of RPL15 antibody by immunoprecipitation experiment
由图1可以看出,免疫前血清(prebleed)中未检测到RPL15条带;免疫后血清(anti-RPL15 serum)在分子质量为24×103(24 kDa)的位置检测到了特异性的RPL15条带,证实本研究成功获得了RPL15抗体.
2.2 RPL15 siRNA敲降后RPL15蛋白的表达
为了进一步检测RPL15抗体的特异性,本研究设计并合成了特异性靶向RPL15的小分子干扰RNA(siRNA)序列,通过转染的方法敲降RPL15蛋白.对细胞裂解液进行Western Blot分析,结果如图2所示.
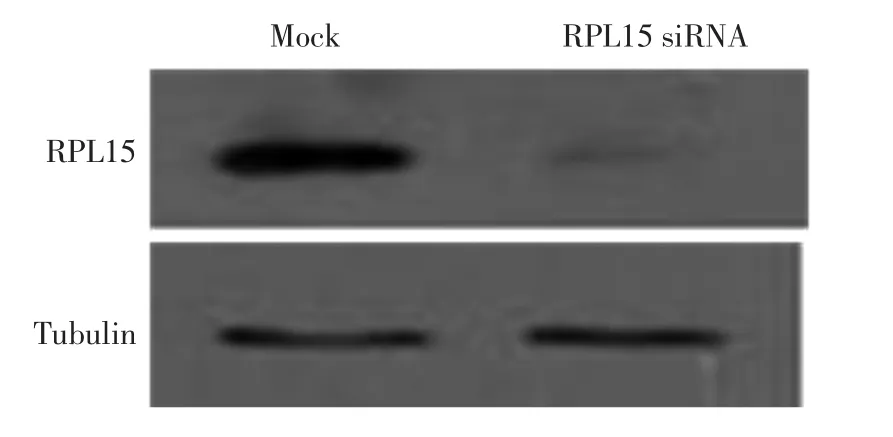
图2 RPL15 siRNA敲降内源RPL15蛋白Fig.2 Knockdown of RPL15 protein by RPL15 siRNA
由图2可以看出,与对照组相比,RPL15的siRNA敲降后检测不到RPL15条带,即本研究获得的RPL15抗体能够被siRNA降解,从而验证了RPL15抗体具有特异性.
2.3 RPL15抗体对外源RPL15蛋白的识别
在人宫颈癌细胞株HeLa中转染外源pEGFP-C1和pEGFP-RPL15质粒.转染24 h后,用全细胞裂解液裂解Hela细胞,并对其进行Western Blot(WB)分析,结果如图3所示.由图3可以看出,绿色荧光蛋白(GFP)抗体可以检测到GFP和GFP-RPL15融合蛋白,本研究自制的RPL15抗体可以检测到GFP-RPL15融合蛋白.由此确定RPL15抗体可以特异性地识别内源和外源RPL15蛋白.
2.4 RPL15的细胞内定位
对得到的RPL15抗体进行纯化,以核仁蛋白UBF、 FBL和C23为参照物,将其与RPL15共染色,免疫荧光实验结果如图4所示.
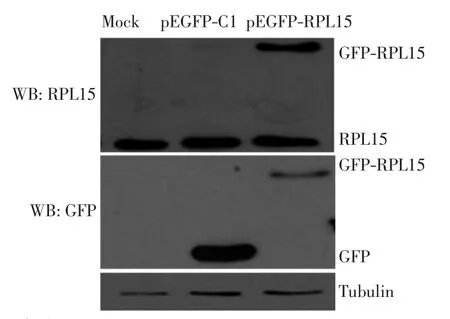
图3 HeLa细胞转染外源pEGFP-C1和pEGFP-RPL15质粒Fig.3 HeLa cells transfected with plasmids expressing pEGFP-C1 and pEGFP-RPL15
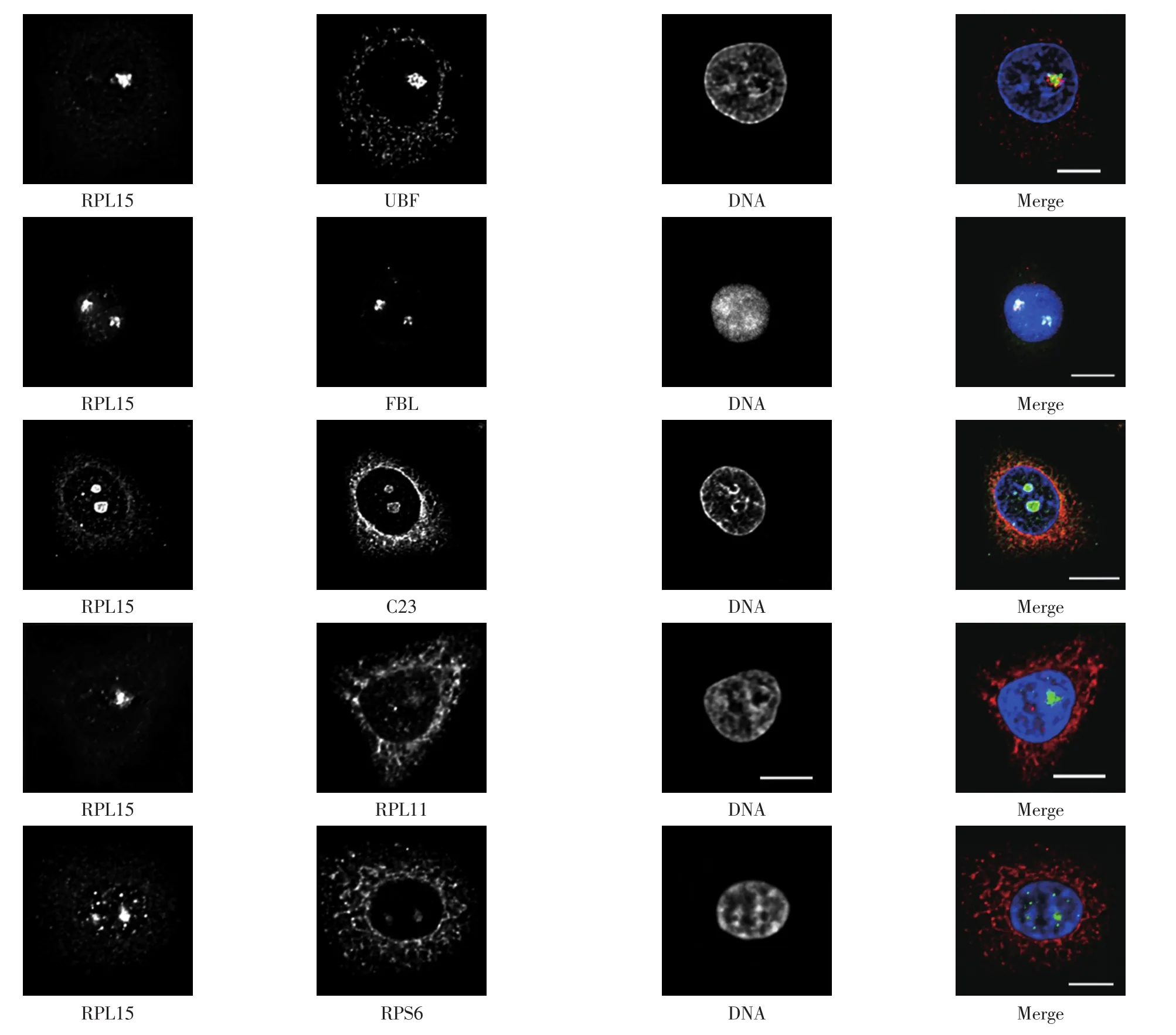
图4 细胞免疫荧光技术鉴定RPL15蛋白的定位Fig.4 Appraisal RPL15 protein localization by cell immunofluorescence technique
由图4可以看出,RPL15定位于细胞质和细胞核内,主要定位于核仁并呈点状分布,且与UBF、FBL和C23存在部分共定位.
3 讨论与结论
在很多癌症中,核糖体蛋白除参与蛋白质合成外还具有其他功能,包括抑制或诱导肿瘤发生、调节基因特异性表达、参与DNA修复、凋亡或促进癌细胞增殖和产生抗药性等[8-12].如在非小细胞肺癌中,RPS29通过下调Bcl-2、Bcl-XL、survivin和上调p53诱导细胞凋亡[13].与正常细胞比较,在癌细胞中一些核糖体蛋白的表达量出现变化,如在直肠癌中,S8、S12、S18、S24、L13a、L18、L28、L32和L35a表达量降低,而S11和L7的表达量明显上调[14];在肝癌中,S8、L12、L23a、L27和L30的mRNA表达水平上调;在肺癌和口腔癌中,RPL14蛋白的表达失效[15].这些结果表明在癌症发生过程中核糖体蛋白的表达量出现变化是一个普遍现象.在肿瘤细胞中很多核糖体蛋白在p53-HDM2路径中发挥作用,如RPL5、RPL11或RPL23等过表达,这些核糖体蛋白与E3泛素连接酶MDM2结合,阻止后者对p53的降解作用,造成p53的积累和活化[16-20],最终导致细胞周期的G1期出现阻滞[21].
本研究制备了核糖体大亚基蛋白RPL15的多克隆抗体,免疫荧光方法表明该蛋白主要定位于细胞核的核仁部位,呈点状分布,并且与UBF、FBL和C23有部分共定位.RPL15在核仁中的定位有利于核仁结构的形成和维持,也可能参与成熟rRNA的形成过程. RPL15可以促进胃癌细胞的生长,因此可作为胃癌诊断的潜在标记物.RPL15影响细胞生长的具体分子机制尚没有明确报道,因此需要进一步对RPL15进行功能研究,探讨RPL15是否也是通过RPs-MDM2-p53路径影响细胞生长.
[1]VAN OERS M M,DOITSIDOU M,THOMAS A A,et al.Translation of both 5′TOP and non-TOP host mRNAs continues into the late phase of Baculovirus infection[J].Insect Mol Biol,2003,12(1):75-84.
[2]SIMOFF I,MORADI H,NYGARD O.Functional characterization of ribosomal protein L15 from Saccharomyces cerevisiae[J].Curr Genet,2009,55(2):111-125.
[3]KLEIN D J,MOORE P B,STEITZ T A.The roles of ribosomal proteins in the structure assembly,and evolution of the large ribosomal subunit [J].J Mol Biol,2004,340(1):141-177.
[4]WANG Q,YANG C,ZHOU J,et al.Cloning and characterization of full-length human ribosomal protein L15 cDNA which was overexpressed in esophageal cancer[J].Gene,2001,263(1/2):205-209.
[5]LANDOWSKI M,O′DONOHUE M F,BUROS C,et al.Novel deletion of RPL15 identified by array-comparative genomic hybridization in Diamond-Blackfan anemia[J].Hum Genet,2013,132(11):1265-1274.
[6]WANG H,ZHAO L N,LI K Z,et al.Overexpression of ribosomal protein L15 is associated with cell proliferation in gastric cancer[J].BMC Cancer,2006,6(1):91-98.
[7]HSU Y A,LIN H J,SHEU J J,et al.A novel interaction between interferon-inducible protein p56 and ribosomal protein L15 in gastric cancer cells[J].DNA Cell Biol,2011,30(9):671-679.
[8]HERAS-RUBIO A D S,PERUCHO L,PACIUCCI R,et al.Ribosomal proteins as novel players in tumorigenesis[J].Cancer Metastasis Rev,2014,33(1):115-141.
[9]CHAILLOU T,KIRBY T J,MCCARTHY J J.Ribosome biogenesis:emerging evidence for a central role in the regulation of skeletal muscle mass[J].J Cell Physiol,2014,229(11):1584-1594.
[10]CLEMENS M J.Targets and mechanisms for the regulation of translation in malignant transformation[J].Oncogene,2004,23(18):3180-3188.
[11]STONELEY M,WILLIS A E.Aberrant regulation of translation initiation in tumorigenesis[J].Curr Mol Med,2003,3(7):597-603.
[12]CHEN F W,IOANNOU Y A.Ribosomal proteins in cell proliferation and apoptosis[J].Int Rev Immunol,1999,18(5/6):429-448.
[13]KHANNA N,SEN S,SHARMA H,et al.S29 ribosomal protein induces apoptosis in H520 cells and sensitizes them to chemotherapy[J]. Biochem Biophys Res Commun,2003,304(1):26-35.
[14]KASAI H,NADANO D,HIDAKA E,et al.Differential expression of ribosomal proteins in human normal and neoplastic colorectum[J].J Histochem Cytochem,2003,51(5):567-574.
[15]SHRIVER S P,SHRIVER M D,TIRPAK D L,et al.Trinucleotide repeat length variation in the human ribosomal protein L14 gene(RPL14):localization to 3p21.3 and loss of heterozygosity in lung and oral cancers[J].Mutat Res,1998,406(1):9-23.
[16]CHENJ,GUOK,KASTANMB.Interactionsofnucleolinandribosomal protein L26(RPL26)in translational control of human p53 mRNA[J].J Biol Chem,2012,287(20):1667-1676.
[17]GAO M,LI X,DONG W,et al.Ribosomal protein S7 regulates arsenite-induced GADD45 alpha expression by attenuating MDM2-mediated GADD45alpha ubiquitination and degradation[J].Nucleic Acids Res,2013,41(10):5210-5222.
[18]SUN X X,DEVINE T,CHALLAGUNDLA K B,et al.Interplay between ribosomal protein S27a and MDM2 protein in p53 activation in response to ribosomal stress[J].J Biol Chem,2011,286(26):22730-22741.
[19]YADAVILLI S,MAYO L D,HIGGINS M,et al.Ribosomal protein S3:a multi-functional protein that interacts with both p53 and MDM2 through its KH domain[J].DNA Repair(Amst),2009,8:1215-1224.
[20]ZHANG X,WANG W,WANG H,et al.Identification of ribosomal protein S25(RPS25)-MDM2-p53 regulatory feedback loop[J].Oncogene,2013,32(22):2782-2791.
[21]ZHOU X,HAO Q,LIAO J M,et al.Ribosomal protein S14 unties the MDM2-p53 loop upon ribosomal stress[J].Oncogene,2013,32(3):388-396.
(责任编校 纪翠荣)
Preparation and localization of ribosomal protein RPL15 polyclonal antibody
LIANG Shuangshuang,JI Meichao,HU Xiaoqing,FU Chenghua,ZHU Changjun,DONG Zhixiong
(a.College of Life Sciences,b.Tianjin Key Laboratory of Animal and Plant Resistance,c.Key Laboratory of Molecular and Cellular Systems Biology,Tianjin Normal University,Tianjin 300387,China)
To learn the location and function of the ribosomal large subunit protein RPL15 in cells,the peptide of RPL15 protein acting as the antigen to immune rabbit was designed and synthesized to produce the polyclonal antibody.The specificity of RPL15 antibody was detected by Western blot and immunofluorescence.The results confirmed that the RPL15 polyclonal antibody was prepared and purified successfully,and the antibody can identify RPL15 protein specifically.Immunofluorescence showed that RPL15 protein was located in cytoplasm and nuclei,mainly in the nucleolus and dotted distribution. Furthermore,the partially co-localization was obtained between RPL15 with UBF,FBL and C23.
RPL15;ribosome;polyclonal antibody;immunofluorescence;localization in cell
Q291
A
1671-1114(2016)05-0055-05
2016-02-15
国家自然科学基金面上资助项目(31271485);2011年教育部“新世纪优秀人才支持计划”资助项目(NCET-11-1066);国家自然科学基金青年基金资助项目(31301138);天津市应用基础与前沿技术研究计划重点资助项目(12JC2DJC21400);天津市应用基础与前沿技术研究计划一般资助项目(14JCYBJC24200);天津市中小企业科技创新基金资助项目(14ZXCXSY00121);天津师范大学中青年教授学术创新推进计划资助项目(52XC1001);天津师范大学“渤海学者”基金资助项目(5RL092);天津师范大学博士基金资助项目(52XB1104).
梁爽爽(1990—),女,硕士研究生.
董智雄(1984—),男,讲师,主要从事分子细胞生物学方面的研究.
