核壳型Ru@Pt在甲醇电催化氧化反应中的电子效应研究
2016-12-14段东红卫国强张忠林郝晓刚刘世斌
赵 硕,段东红,卫国强,张忠林,郝晓刚,刘世斌
(太原理工大学 洁净化工研究所,太原 030024)
核壳型Ru@Pt在甲醇电催化氧化反应中的电子效应研究
赵 硕,段东红,卫国强,张忠林,郝晓刚,刘世斌
(太原理工大学 洁净化工研究所,太原 030024)
通过两步化学还原法合成了不同壳层厚度的核壳型Ru@Pt纳米粒子,采用X射线衍射光谱(XRD)、X射线光电子能谱(XPS)、透射电子显微镜(TEM)和X射线能谱(EDS)等手段对粒子的晶体结构、表面元素、微观形貌及组成进行物理表征;应用循环伏安法和交流阻抗法对电催化氧化甲醇的催化性能进行电化学测试。结果显示,制备的Ru@Pt纳米粒子直径约为2~4 nm,为核壳型结构;不同Ru@Pt样品氢的脱附峰随n(Pt)∶n(Ru)比值的增大呈现先增加后减小的“山形”趋势,其中n(Pt)∶n(Ru)=0.5∶1样品的脱附峰值最高;由于核层Ru对Pt壳层产生电子效应,使核壳型纳米粒子电化学活性面积增大,且电子效应越强活性比表面积越大;随着纳米粒子电子效应的增强,其比质量活性增大,甲醇反应过程的阻抗降低。
Ru@Pt纳米粒子;核壳结构;甲醇电氧化;电子效应;催化活性
能源和人类的生存与发展密切相关,煤、石油、天然气等正日益枯竭。在2050年前石油、天然气等不可再生资源将消耗殆尽,这种看法已经被公认。人类面临着能源的危机,同时化石能源的使用造成了严重的环境污染,绿色能源的研发和使用是实现能源的可持续发展的必然选择。直接甲醇燃料电池(direct methanol fuel cells,DMFCs)能够将燃料甲醇的化学能转变成电能,是一种新型的绿色能源,适用于小型的可移动便携式电源,在能源、环保、通讯、国防等各个领域的应用前景十分广阔,其商业化的呼吁也正日益高涨。
目前,PtRu催化剂是性能最优、使用最普遍的阳极催化剂,解释PtRu催化剂的甲醇电催化氧化的机理主要有双功能机理和电子效应机理,两种机理之间仍存在争论。1987年,WATANABE et al[1]在将PtRu催化剂用于甲醇的电氧化反应的研究中提出了双功能机理,即H2O分子在Ru原子上发生了活化,生成的OHads能够促进Pt在低电势下氧化消除其吸附的CO,从而减少CO对H2活性位的覆盖。此观点得到了HOOGERS et al[2]和SCHMIDT et al[3]的研究结果的支持。1999年,TODA et al[4]提出电子结构改变的理论(电子效应理论),即Ru的加入量增加,使得Pt的d空轨道增加。该理论得到MYLSWAMY et al[5]和GASTIGER et al[6]的支持。双功能效应和电子效应有各自的事实依据,也各自有不能解释的现象。双功能机理从中间产物的角度出发,却不能解释催化剂中金属电子结构发生改变的现象;电子效应是从电子状态及结合能的角度出发,却不能很好地说明中间产物的产生过程。研究催化剂的反应机理可为催化剂的研发及改进提供理论依据,为提高催化剂的性能指明方向,具有显著的学术意义和实际价值。
研究采用化学还原法制备不同核壳比例的Ru@Pt核壳型纳米粒子及纯Pt纳米粒子,利用循环伏安法测试纳米粒子对甲醇的电催化氧化活性,并通过XPS等物理表征数据构建催化性能与电子效应的关系。
1 实验部分
1.1 C粉的处理
在惰性气体氩气中,将C粉置于管式炉,600 ℃下退火2 h,将XC-72碳粉表面的氧化物去除,装入样品瓶中并放置于干燥器中待用。
1.2 纳米粒子的制备
采用化学还原法制备纯Pt纳米粒子及不同粒子比的Ru@Pt核壳型纳米粒子。以n(Pt)∶n(Ru)=1∶1的样品的制备为例,制备方法如下。将0.010 4 g的RuCl3和0.065 6 g四辛基溴化铵(C32H68BrN)溶于5 mL四氢呋喃(C4H8O,THF)中,通N2排除空气,在超声条件下分散溶解;在磁力搅拌的条件下将10 mL的三乙基硼氢化锂(Li(C2H5)3BH)缓慢滴加到RuCL3溶液中,还原反应30 min。将一定比例的PtCl2溶液缓慢地滴加至上述溶液中,反应60 min,得到Ru@Pt核壳纳米粒子的悬浮液,加入0.022 2 g XC-72导电碳粉并负载5 h;将制备好的样品进行液固分离,去掉上清液,用四氢呋喃、乙醇各分散洗涤3次;最后,固体样品在80 ℃的真空烘箱中干燥12 h,即可获得黑色的Ru1@Pt1纳米粒子。不同n(Pt)∶n(Ru)比例的样品可通过改变PtCl2的加入量来制备,纯Pt纳米粒子则无需加入RuCl3。合成的样品标记为Rux@Pty(x=0,1;y=0,2,1,0.5,0.33)。
1.3 工作电极的制备
用Al2O3悬浮液充分擦拭电极表面,然后放在丙酮中去除表面的油污杂质,并于超纯水中超声洗涤数次后烘干;称5 mg制备好的样品粉末,加入5 mL超纯水进行混合,用超声粉碎机将混合物分散成油墨状;用移液器量取6.0 μL油墨状的悬浊液涂在清洁后的玻碳电极表面,烘干,然后取7.2 μL Nafion溶液(全氟聚苯乙烯磺酸溶液)涂在烘干的电极表面,80 ℃下烘烤成膜,即制得薄膜工作电极。
1.4 纳米粒子的物理表征
采用日本Rigaku公司生产的D/max-2500型X射线衍射仪对催化剂的晶相结构进行表征;采用日本电子株氏会社产的JEM-2010型号的透射电子显微镜(TEM)观测催化剂的形貌结构;采用美国产LEO 438VP型能谱分析仪(EDS)表征催化剂的组成元素及各个元素所占比例;采用VG Scientific ESCALab 250i-XL型X射线光电子能谱仪(XPS)测定催化剂的元素组成比例及价态。
1.5 纳米粒子的电化学表征
样品的电化学性能采用美国PAR公司生产的VMP-2型多通道恒电位仪进行测试,测试中采用三电极体系,其中玻碳电极为工作电极,Pt丝为对电极,Hg/Hg2SO4(MSE)为参比电极;电解液由H2SO4浓度为0.5 mol/L加CH3OH浓度为0,0.2,0.5,1.0 mol/L组成。所有实验均在室温(25 ± 1)℃下进行;循环伏安扫描速率50 mV·s-1。每次进行测试前,通入高纯N2于电解液中30 min,以除去其中的溶解O2和CO2等干扰物质。
2 结果与讨论
2.1 纳米粒子的物理性能表征
图1(a)展示了制备的核壳型Rux@Pty(x=1;y=0,2,1,0.5,0.33)纳米粒子的XRD谱图。图中在2θ=39.76°,46.24°,67.45°处的衍射峰分别对应Pt的(111),(200),(220)晶面的衍射峰。

A-n(Pt)∶n(Ru)=2∶1;B-n(Pt)∶n(Ru)=1∶1;C-n(Pt)∶n(Ru)=0.5∶1;D-n(Pt)∶n(Ru)=0.33∶1图1 不同Ru@Pt纳米粒子的XRD谱图(a)以及对应的Pt(111)晶面衍射角偏移值Δθ与n(Pt)∶n(Ru)比值的关系柱状图(b)Fig.1 XRD spectra of Ru@Pt nanoparticles (a) and Δθ histogram of specific Pt (111) diffraction peaks (b)
从图中可以看出,各样品的XRD谱图中Pt(111)晶面的衍射峰出现较明显的偏移。推断其主要原因是Ru核层对Pt壳层产生了电子诱导效应,导致Pt金属的晶格发生改变[7-8]。故衍射峰的偏移可以从侧面反映催化剂的电子效应的强弱,偏移量越大,电子效应越强。而各样品的XRD谱图中几乎没有出现Ru的衍射峰,故可以初步推断Ru核层金属被Pt壳层金属包裹在内部,即催化剂的结构为Pt为壳层,Ru为核层的核壳型纳米粒子[9-10]。
不同Ru@Pt样品Pt(111)晶面的衍射峰相对纯Pt的Pt(111)衍射峰发生的偏移量Δθ如图1(b)所示。由图1(b)可以看出:随着Pt原子比的增大,Ru@Pt纳米粒子的Pt(111)晶面的衍射峰的偏移量呈现逐渐减小的趋势;其中Ru1@Pt0.5催化剂的Pt(111)晶面衍射峰的偏移最为明显,即该催化剂的电子效应最明显。分析其主要原因是:当Pt的含量较高时,壳层Pt的厚度较厚,Ru对外层的Pt金属的电子效应比较弱,Pt(111)晶面的偏移并不明显;而Pt含量最小的 Ru1@Pt0.33催化剂出现Pt(111)晶面的衍射峰的偏移量减小的现象,分析其原因可能为Pt含量太少,不足以将Ru完全包裹住,Pt在Ru表面形成多个微晶薄层而非单晶结构,相对于一个Pt单晶壳层来说Pt微晶薄层晶界面积较大,受到Ru核的电子效应相对较弱,使得Pt微晶的晶格变化相对较小,Pt(111)晶面衍射峰的偏移量相对减小。

图2 Ru1@Pt1纳米粒子的TEM照片(a)及局部放大图(b)Fig.2 TEM photogram of Ru1@Pt1 nanoparticles(a) and locality amplification (b)
图2为Ru1@Pt1纳米粒子的TEM照片及局部放大图。由图2(a)可以看出,由于样品负载在载体碳上,故没有明显的团聚现象;纳米粒子基本为球形,且粒径相对均匀,直径大小为2~4 nm。由于粒径较小,故图2(a)不能看出明显的核壳结构。由局部放大图2(b)可以看到,中间颜色较深的为Ru核层金属,其粒径约为2 nm;外面颜色较浅的壳层为Pt金属,其厚度不到1 nm;说明通过化学还原法制备出的Ru@Pt纳米粒子为核壳型结构。
表1为制备的Rux@Pty(x=0,1;y=0,2,1,0.5,0.33)纳米粒子的EDS测试结果,纳米粒子中Ru和Pt的实测原子数比与化学计量摩尔比呈现相同的变化趋势,并且测出的Ru和Pt的原子数比与前驱体摩尔比相近。这一结果说明,在一定的实验条件下,三乙基硼氢化锂(Li(C2H5)3BH)几乎能够完全还原RuCl3和PtCl2。此外,由于EDS探测的深度约为6~10 nm,故检测到的Ru与Pt原子数比近似为纳米粒子平均摩尔比。
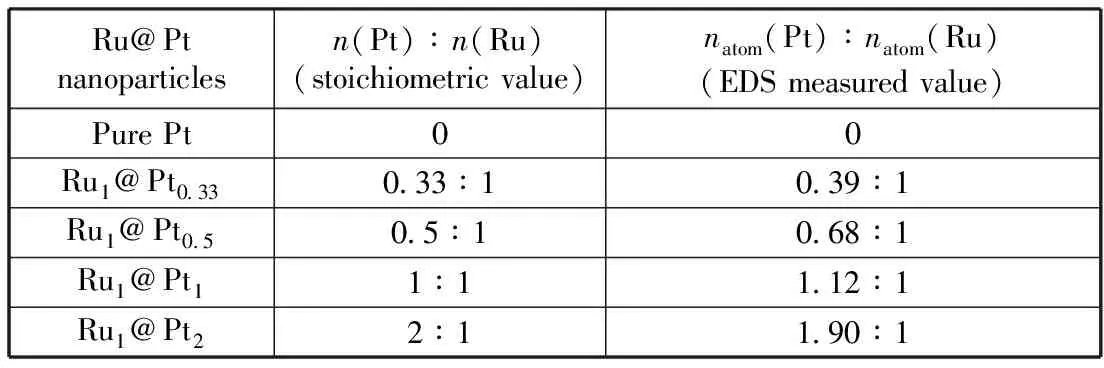
表1 不同Ru@Pt纳米粒子化学计量理论结果与EDS实测原子数比值结果
图3为制备的不同n(Pt)∶n(Ru)比值的Ru@Pt纳米粒子样品的Ru3p轨道的结合能谱图及XPS分峰结果。图中在Ru3p区,约484 eV处为Ru3p的结合能峰,3个样品在484 eV处均出现了较弱的Ru3p的结合能峰。而纯Pt在484 eV处并未出现Ru3p的结合能峰。Ru1@Pt1纳米粒子在484 eV处也没有出现Ru3p的结合能峰,分析其原因是,n(Pt)∶n(Ru)=1∶1比例相同导致Ru被Pt包裹住,且Pt层厚度较大没能检测出内部Ru核层金属,故可以据此进一步确定Ru1@Pt1是核壳型的纳米粒子。
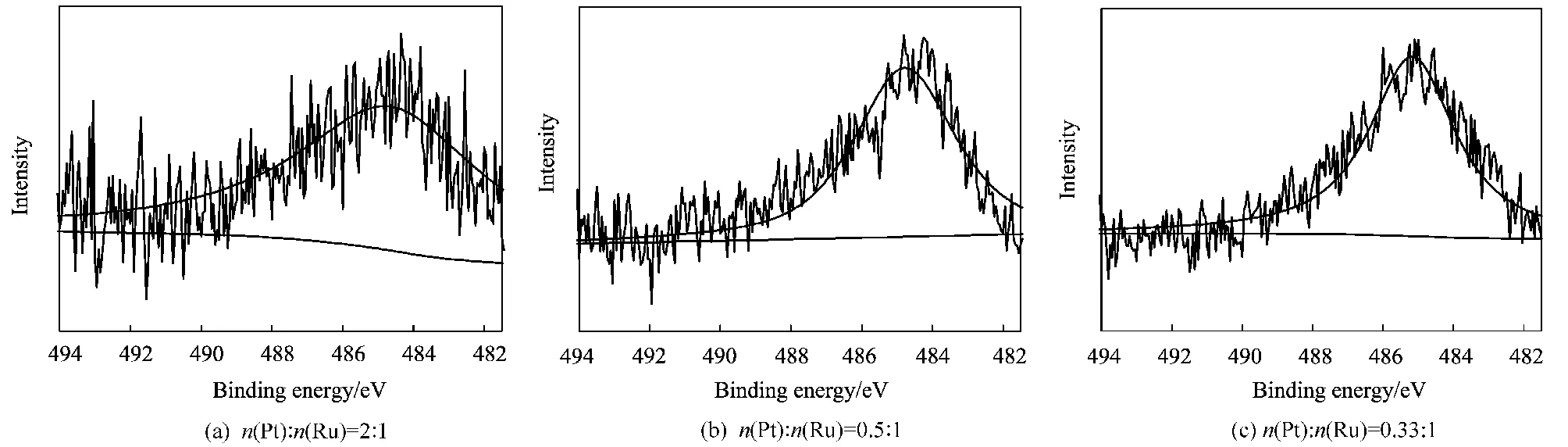
图3 不同Ru@Pt纳米粒子的Ru3p轨道的结合能谱图及分峰结果Fig.3 Spectra of Ru3p binding energy peaks of different Ru@Pt nanoparticles
图4为制备的Rux@Pty(x=0,1;y=0,2,1,0.5,0.33)纳米粒子的Pt4f结合能谱图及分峰结果。在Pt4f区,约71 eV和74 eV左右出现Pt4f7/2和Pt4f5/2的结合能峰,而在72 eV和75 eV左右出现的是Pt2+的强峰。这说明,Ru@Pt纳米粒子的表面具有Pt0和Pt2+两种价态的Pt原子。
表2为Rux@Pty(x=0,1;y=0,2,1,0.5,0.33)纳米粒子的Pt4f轨道电子结合能谱图与表面Pt0的原子数比。由表可以发现,相对于纯Pt/C纳米粒子来说,各Ru@Pt核壳型纳米粒子表层的Pt0与Pt2+的原子数比要大。这主要原因是:核层金属Ru对包覆在其表面的壳层金属Pt产生了电子效应,导致壳层金属Pt的电子态密度有所增加,这就使得核壳型催化剂表层的Pt0的原子数比相对于纯Pt/C催化剂来说要高,而相应的Pt2+的原子数比要低;也就是说,纳米粒子表层的Pt0的原子数比是电子效应的直观表现。除此之外,还发现XPS测得的natom(Ru)∶natom(Pt)原子比明显比EDS测得的natom(Ru)∶natom(Pt)原子比要低很多。依据以上两种测试方法的原理,EDS测得样品中的Ru,Pt原子数比接近于整体纳米粒子的平均摩尔比,而XPS测得的是纳米粒子表层的natom(Ru)∶natom(Pt)原子比。两组数据的差距表明,本研究所制备的纳米粒子的表面具有较高的Pt原子比,这也从侧面说明制备的纳米粒子样品是核壳型结构。

表2 不同Ru@Pt纳米粒子的Pt4f的电子结合能与表面Ru/Pt的原子数比

图4 不同Ru@Pt纳米粒子Pt4f轨道的结合能谱图及分峰结果Fig.4 Spectra of Pt4f binding energy peaks of different Ru@Pt nanoparticles
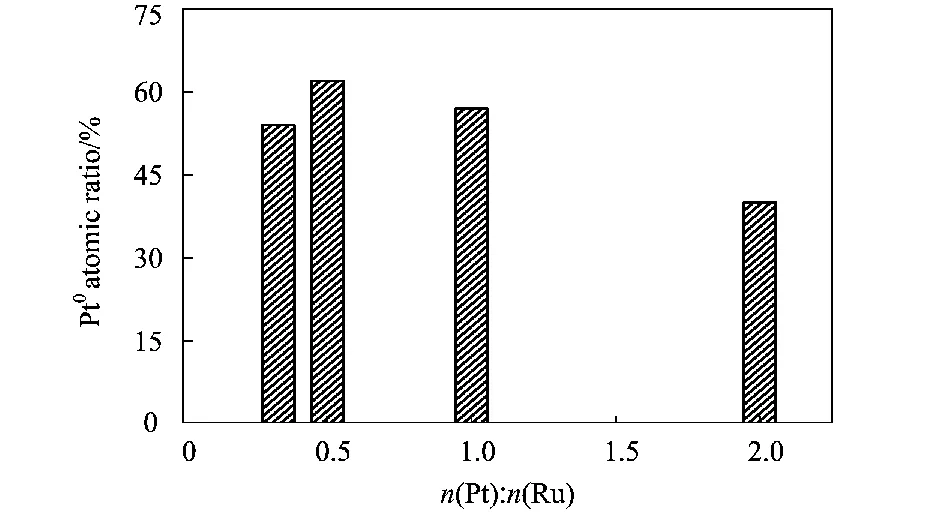
图5 Ru@Pt纳米粒子的n(Pt)∶n(Ru)比值与表面Pt0原子百分比的关系柱状图Fig.5 Histogram of different Ru@Pt nanoparticles between n(Pt)∶n(Ru) values and atom ratios of surface Pt0
不同Ru@Pt纳米粒子中Ru核对Pt壳层的电子效应的强弱程度,可以由催化剂表层Pt0的原子数比来体现,结果如图5所示。由图可以看出,随着n(Pt)∶n(Ru)比值的增大,Ru核对Pt壳层的电子效应呈现逐渐减弱的趋势。当Pt的含量较高时,壳层Pt的厚度较厚,Ru对外层的Pt金属的电子效应减弱。而n(Pt)∶n(Ru)=0.33∶1对应的Ru1@Pt0.33纳米粒子也出现电子效应减弱的原因可能为:Pt含量太少,不足以在Ru核表面形成单晶Pt壳层,而形成Pt微晶薄层;相对于一个单晶Pt壳层来说,Pt微晶壳层比表面积较大,导致该纳米粒子的电子效应相对较弱。
2.2 纳米粒子的电化学性能表征

A-n(Pt)∶n(Ru)=2∶1;B-n(Pt)∶n(Ru)=1∶1;C-n(Pt)∶n(Ru)=0.5∶1;D-n(Pt)∶n(Ru)=0.33∶1;E-Pt/C图6 不同Ru@Pt纳米粒子在氮吹脱的0.5 mol/L H2SO4电解质中的循环伏安图Fig.6 CV curves of Ru@Pt nanoparticles in nitrogen-saturated 0.5 mol/L H2SO4
图6为纯Pt和不同n(Pt)∶n(Ru)比值的Ru@Pt纳米粒子在氮吹脱的0.5 mol/L的H2SO4电解质中的循环伏安图。图中可以看出,不同样品在-0.64 ~-0.40 V之间氢的脱附峰面积,随Pt原子比的增大呈现先增加后减小的“山形”,其中Ru1@Pt0.5样品的峰面积值最高,即该纳米粒子的电化学活性面积相对最高。图中还能看出,各纳米粒子表面含氧物种的还原峰电位相对于纯Pt纳米粒子发生了正移,这说明含氧物种在核壳型纳米粒子上的吸附能比纯Pt要低,也就是含氧物种在核壳型纳米粒子上的脱附能力比纯Pt要强,即核壳型纳米粒子抗中毒能力较强。
从表3中可以看出,在核壳型Ru@Pt纳米粒子中,随着Pt原子数比的增大,电化学活性比表面积呈现先增大后减小的“山形”,其中,Ru1@Pt0.5的电化学活性比表面积最高。由此可以说明,核层Ru对Pt壳层产生电子效应,使核壳型纳米粒子电化学活性面积得到提高,且电子效应越强活性比表面积越大。

表3 不同Ru@Pt纳米粒子的活性比表面积

图7 不同Ru@Pt样品的比质量活性与n(Pt)∶n(Ru)比值的关系柱状图Fig.7 Histogram between specific massic activities and n(Pt)∶n(Ru)
样品在不同浓度甲醇的电解液中所呈现出的电子效应规律基本一致,故以电解液为0.5 mol/L硫酸+1.0 mol/L甲醇条件下的循环伏安曲线为例,做出以1.0 mg Pt为基准计算出的不同比例的Ru@Pt样品在0.2 V电位条件下的比质量活性的柱状图,如图7所示。核壳型纳米粒子的甲醇电催化氧化活性随Pt原子数比的增大,并非单调变化,而是呈现先增大后减小的“山形”,其中Ru1@Pt0.5的纳米粒子活性最高;分析其主要原因是,核层Ru金属对壳层Pt金属产生电子诱导效应,使得表层Pt具有更高的催化活性。
研究中采用Ru@Pt表面的Pt0的原子数比与纯Pt纳米粒子表面Pt0的原子数比的差值来表征电子效应的强弱。从图8(a)中可以看出,随着纳米粒子电子效应的增强,其比质量活性a也呈现增大的趋势。由此可见,Ru@Pt样品中Ru核对Pt壳层的电子效应,对Ru@Pt纳米金属的催化活性起到增强的作用。

图8 不同Ru@Pt样品的比质量活性与电子效应的关系图(a)以及Ru@Pt纳米粒子上甲醇电氧化反应过程的阻抗与电子效应的关系图(b)Fig.8 Relation curves between specific mass activities and electronic effect of different Ru@Pt nanoparticles(a)and relation curves between reaction impedance(Zim)and electronic effect of different Ru@Pt nanoparticles (b)
不同Ru@Pt纳米粒子在1.0 mol/L甲醇+0.5 mol/L硫酸中反应过程的阻抗与电子效应的关系,如图8(b)所示。从图中可以看出,随着纳米粒子电子效应的增强,其反应过程的阻抗呈单调减小的趋势;也就是说,Ru 核层对Pt壳层电子效应的增强,能降低Ru@Pt纳米粒子电催化氧化甲醇反应过程的阻抗。
从表4可以看出,不同Ru@Pt纳米粒子的塔菲尔斜率b不同。由塔菲尔经验公式[11]可得出,b值越小,电极反应的活化过电势随电流密度增大而增大的幅度也越小,反应越容易发生。表中数据表明,随着Pt原子数比的增大,各催化剂的塔菲尔斜率呈现先减小后增大的变化趋势,其中Ru1@Pt0.5的塔菲尔斜率最小,即该纳米粒子更利于甲醇的电催化氧化反应的发生。其原因是,核层Ru对壳层Pt的电子诱导效应增强导致Pt0的比例升高,Pt的电子态密度增大,有利于反馈键的形成,从而降低了中间物的吸附能,降低了反应的活化过电位。
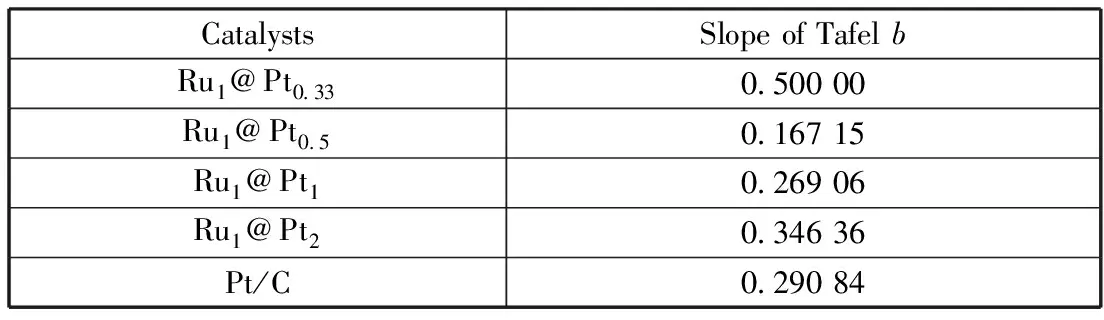
表4 不同Ru@Pt纳米粒子的塔菲尔斜率b
3 结论
1) 用化学还原法制备的Ru@Pt核壳型纳米粒子基本为球形,且粒径相对均匀,其直径为2~4 nm。随着Pt原子数比的增大,核壳型纳米粒子Ru核对Pt壳层的电子效应呈现逐渐降低的趋势。
2) 由于核层Ru对Pt壳层产生电子效应,使核壳型纳米粒子的电化学活性面积和比质量活性得到提高;且电子效应越强,活性比表面积越大,比质量活性也越大;表层Pt具有更高的催化活性。
3) 纳米粒子的电子效应能降低Ru@Pt纳米粒子电催化氧化甲醇反应过程的阻抗,也降低甲醇氧化反应的活化过电位,有利于反应进行。
[1] HOOGERS G,THOMPSETT D.Catalysis in proton exchange membrane fuel cell technology[J].CATTECH,1999,3(2):106-124.
[2] WATANABE M,UCHIDA M,MOTOO S.Preparation of highly dispersed Pt+Ru alloy clusters and the activity for the electrooxidation of methanol[J].Journal of Electroanalytical Chemistry and Interfacial Electrochemistry,1987,229(1):395-406.
[3] SCHMIDT T J,NOESKE M,GASTEIGER H A,et al.Electrocatalytic activity of PtRu alloy colloids for CO and CO/H2electrooxidation: stripping voltammetry and rotating disk measurements[J].Langmuir,1997,13(10):2591-2595.
[4] TODA T,IGARASHI H,WATANABE M.Enhancement of the electrocatalytic O2reduction on Pt-Fe alloys[J].Journal of Electroanalytical Chemistry,1999,460(1):258-262.
[5] MYLSWAMY S,WANG C Y,LIU R S,et al.Anode catalysts for enhanced methanol oxidation: An in situ XANES study of PtRu/C and PtMo/C catalysts[J].Chemical Physics Letters,2005,412(4):444-448.
[6] LIN S D,HSIAO T C,CHANG J R,et al.Morphology of carbon supported Pt-Ru electrocatalyst and the CO tolerance of anodes for PEM fuel cells[J].Journal of Physical Chemistry B,1999,103(1):97-103.
[7] ANTOLINI E,CARDELLINI F.Formation of carbon supported PtRu alloys: an XRD analysis[J].Journal of Alloys & Compounds,2001,315:118-122.
[8] CAMARA G A,GIZ M J,PAGANIN V A,et al.Correlation of electrochemical and physical properties of PtRu alloy electrocatalysts for PEM fuel cells[J].Journal of Electroanalytical Chemistry,2002,537(1):21-29.
[9] DUAN D,LIU S,YANG C,et al.Electrocatalytic performance of Ni core@ Pt shell/C core-shell nanoparticle with the Pt in nanoshell[J].International Journal of Hydrogen Energy,2013,38(33):14261-14268.
[10] LIU Y T,YUAN Q B,DUAN D H,et al.Electrochemical activity and stability of core-shell Fe2O3/Pt nanoparticles for methanol oxidation[J].Journal of Power Sources,2013,243:622-629.
[11] BURSTEIN G T.A hundred years of Tafel’s equation: 1905—2005[J].Corrosion Science,2005,47(12):2858-2870.
(编辑:李文娟)
Electronic Effect of Core-Shell Ru@Pt Nano-Particle Catalysts in Methanol Electro-Oxidation
ZHAO Shuo,DUAN Donghong,WEI Guoqiang,ZHANG Zhonglin,HAO Xiaogang,LIU Shibin
(Institute of Clean Technique for Chemical Engineering,TaiyuanUniversityofTechnology,Taiyuan030024,China)
Thin shell Ru@Pt core-shell nanoparticles with different thicknesses were synthesized through two-step chemical reduction.X-ray diffraction (XRD),X-ray photoelectron spectroscopy (XPS), transmission electron microscopy (TEM) and X-ray energy dispersive spectometry (EDS) were employed to characterize particle crystal structure, surface elements, microstructure and composition of as-prepared Ru@Pt core-shell nanoparticles; the electrochemical catalytic performance of catalytic oxidation of methanol was tested by cyclic voltammetry, AC impedance and chronoamperometry. Results show that, the prepared Ru@Pt core-shell nanoparticles were uniform spheres with average diameters around 2~4 nm. Among Ru@Pt nanoparticles with differentn(Pt)∶n(Ru) values, hydrogen stripping peaks increased and then decreased as "volcano" with the increase of content of Pt, the nanoparticle withn(Pt)∶n(Ru)=0.5∶1 had the highest peak. The electrochemical active area of core-shell nanoparticles was improved by the electronic effect of Ru core on Pt shell, and the stronger the electronic effect was, the bigger the specific surface area was. With the augmentation of the electronic effect, specific mass activity of nanoparticles increaced, and the reaction resistance of methanol was reduced.
Ru@Pt nanoparticles;core-shell;methanol electro-oxidation;electronic effect;catalytic activity
1007-9432(2016)04-0471-07
2015-05-25
国家自然科学基金资助项目:核壳结构M-Pt纳米微米在含甲醇电解液中电催化氧化还原的性能(20676088);教育部博士点基金资助项目:燃料电池规则孔膜电极制备及其性能(20091402110009)
赵硕(1988-),男,河北保定人,硕士,主要从事纳米电催化研究,(E-mail)984597751@qq.com
刘世斌,教授,博导,主要从事纳米电催化、燃料电池、洁净能源等研究,(E-mail)sbliu@tyut.edu.cn
TQ150.1
A
10.16355/j.cnki.issn1007-9432tyut.2016.04.008
