毛囊干细胞体外诱导成血管内皮细胞的实验研究
2016-12-13杜伟斌全仁夫郑宣李强曹国平庄伟邵荣学杨迪生
杜伟斌全仁夫郑宣李强曹国平庄伟邵荣学杨迪生
·论著·
毛囊干细胞体外诱导成血管内皮细胞的实验研究
杜伟斌1全仁夫1郑宣1李强1曹国平1庄伟1邵荣学2杨迪生3
目的 建立简单、可靠的毛囊干细胞体外定向分化为血管内皮细胞的方法。方法 无菌条件下切取1周龄SD大鼠触须部皮肤,Dispase酶和Ⅳ型胶原酶混合液消化,显微镜下分离毛囊隆突部,改良的组织块贴壁法培养rHFSCs,差速贴壁法纯化,流式细胞仪检测及细胞免疫荧光染色联合鉴定。用含10 ng/ml和20 ng/ml VEGF165作为主要诱导因子将细胞分为两种浓度组别,不传代的情况下分别在1、2、3周内观察诱导后细胞形态;通过流式细胞和细胞免疫荧光染色检测分化效率;选取最佳诱导因子浓度和工作时间,对诱导后的细胞进行体外官腔形成实验,并在透射电镜下观察W-P小体。流式细胞术检测分化效率实验数据的比较采用单因素方差分析及独立t检验。结果 分离、培养、纯化的rHFSCs克隆能力好,活力强,生长曲线呈S型。流式细胞及免疫荧光染色联合检测β1(98.9﹪)、α6整合素(97.9﹪),CK15(68.1﹪)、P63(98.5﹪)呈高表达,阴性表达CD31(13.6﹪)、VE-cadherin(17.9﹪)。在诱导液的作用下,两组细胞从1周到3周后,均由扁平铺路石样改变到完全被长梭形样细胞占据。流式细胞及免疫荧光染色检测CD31和VE-cadherin显示,CD31在诱导1周时表达最强,两种诱导因子比较无差异[(65.27±0.57﹪)vs(66.13±0.60)﹪,t = -1.812,P = 0.145]。而VE-cadherin在诱导1周时表达也最强,10 ng/ml要优于20 ng/ml VEGF165的诱导作用[(95.57±0.85)﹪ vs(78.10±1.25)﹪,t = 19.977,P = 0.001]。10 ng/ml VEGF165诱导1周后的细胞体外管腔形成实验阳性,在透射电镜下可以观察到内皮细胞特有结构W-P小体。结论 毛囊干细胞体外在10ng/ml VEGF165的诱导下,1周后可成功得到性能良好的血管内皮细胞。可为组织工程血管、细胞移植治疗缺血性疾病等提供理想的种子细胞。
毛囊; 干细胞; 血管内皮细胞; 诱导因子; 组织工程
创伤愈合、再生性循环及肿瘤形成等一系列生理病理的过程都有赖于血管新生和形成。而血管内皮细胞作为构建血管组织间屏障的重要成分,积极参与了这两个过程的发生,所以其也逐渐成为构建组织工程化血管主要的种子细胞[1-2]。但是,内皮细胞自体取材来源有限,极易引起桥血管的狭窄、闭塞而加重对患者的损伤。且原代分离培养的血管内皮细胞周期短,增殖能力有限,又极易老化[3-6]。干细胞可能为解决该问题带来关键性飞跃。利用干细胞诱导分化潜能,将其高效定向分化为目的细胞,成为再生医学的研究热点之一[7-8]。毛囊干细胞(hair follicle stem cells,HFSCs)作为一种具有未分化性、自我更新和体外增殖能力强等特点的干细胞,存在于毛囊外根鞘隆突部。具有形成心肌细胞、神经细胞、黑色素细胞和表皮层细胞,血管平滑肌细胞及结缔组织等多向分化潜能[9-13]。其来源广,数量多,自体取材方便,又无严重并发症[14-15]。VEGF165是VEGF的5种亚型之一,活性最强,分布范围最广,在血管新生、形成及内皮细胞诱导分化中有重要作用[16-17]。因此,本实验运用改良的大鼠毛囊干细胞体外培养方法获取种子细胞,利用诱导因子VEGF165进行体外定向诱导,并寻求VEGF165的最佳工作浓度和作用时间。以建立简单、可靠的毛囊干细胞定向分化为血管内皮细胞的方法,为组织工程血管、细胞移植治疗缺血性疾病等提供理想的种子细胞。
材料与方法
一、主要材料及试剂
1.实验动物:清洁级1周龄SD大鼠6只,雌雄不拘,体重(24±4)g,由浙江省实验动物中心提供,实验动物许可证号:SCXK(浙)2014-0001。
2.主要试剂:DMEM/F12(1:1)培养基、KSR血清替代物、Ⅳ型胶原酶、Dispase酶、Coating Matrix Kit试剂盒、TrypLETMSelect(1X)胰蛋白酶替代酶、L-谷氨酰胺、非必需氨基酸、羟基乙醇(美国Gibco公司);重组人表皮细胞生长因子(EGF)、重组人碱性成纤维细胞生长因子(bFGF)(美国R&D公司);青-链霉素混合液(北京索莱宝科技有限公司);氢化可的松、台盼蓝染色剂(上海生工生物工程有限公司);Ⅳ型胶原(美国BD公司);CCK-8试剂盒(杭州诺杨生物科技有限公司);Integrin-β1抗体(美国Biolegend公司);Integrin-α6、VE-cadherin抗体(美国Santa Cruz公司);Keratin-15、p63、CD31抗体(英国abcam公司);DAPI(瑞士Roche公司);Recom binant Rat VEGF165(美国Peprotech公司);胎牛血清(美国Gibco公司)。
二、方法
(一)rHFSCs的分离培养、纯化鉴定
1.分离培养及纯化:参考文献方法[18-20]并对其进行改良,1周龄SD大鼠经处死;75﹪乙醇消毒;获取触须部皮肤;PBS漂洗;1﹪Ⅳ型胶原酶和1﹪Dispase酶混合液消化;Matrix胶包被;体视显微镜下分离、脱鞘得到隆突部;并行组织贴壁等步骤后,加入1 ml完全培养基(869 μl/ml DMEM/ F12、100 μl/ml KSR、10 μl/ ml青、链霉素混合液、10 μl/ml L-谷氨酰胺、10 μl/ml非必需氨基酸、20 ng/ml EGF、10 ng/ mlbFGF、1 μl/ml羟基乙醇、10 ng/ml氢化可的松)。37℃、5﹪CO2条件下培养1 h,再缓缓加入2 ml完全培养基继续培养3 h,待组织基本贴壁后继续缓慢加入3 ml完全培养基,之后每2 ~ 3 d换液。培养8 ~ 10 d后用胰蛋白酶(0.25﹪Trypsin + 0.02﹪EDTA)-PBS稀释液(1:3)漂洗3次,再用TrypLETMSelect(1X)胰蛋白酶替代酶37℃、5﹪CO2培养箱中消化约8 min,并对吕国忠等[21-22]研究加以改良,用Ⅳ型胶原差速贴壁法,使Ⅳ型胶原室温预包被1 h,利用15 ~ 20 min贴壁时间差,对
此时间内贴壁的细胞继续用完全培养基培养,达到筛选纯化目的,之后每2 ~ 3 d换液1次;第2代细胞再纯化1次。倒置相差显微镜下观察细胞形态。
2.流式及免疫荧光鉴定:收集第3代细胞,调整细胞密度为1.0×106个/ml,PBS离心洗2次。80﹪甲醇将细胞室温固定5 min,0.1﹪ PBST将细胞室温静置20 min,5﹪BSA-PBS上摇床封闭30 min;PBS各洗1次。每管流式管100 μl(1X annexin-binding buffer),1×106cell。分别加入Integrin β1-PE;Integrin α6、CK15、P63、CD31、VE-cadherin抗体避光孵育30 min。加入荧光素标记羊抗鼠、兔抗鼠二抗避光孵育30 min,PBS洗1次。PBS每管流式管500 μl单悬,上机流式检测。同时每管样品设立同型阴性对照。
同样以第3代细胞做爬片。37℃、5﹪CO2培养2 d后,吸去培养液。加入4﹪ PFA-PBS固定10 min,5﹪BSA-PBS室温封闭,PBS各洗3次×5 min。分别加入一抗Integrin β1、Integrin α6、CK15、P63、CD31抗体(1:100)及VE-cadherin抗体(1:50)。阴性对照组以PBST代替一抗,排除非特异性二抗的结合。然后4℃孵育过夜,PBST洗涤后,加入荧光素标记羊抗鼠、兔抗鼠二抗避光30 min;加 DAPI(1:2000)染核10 min,避光晾干封片。激光共聚焦显微镜下拍照。
(二)VEGF165为主诱导分化rHFSCs
1.向血管内皮细胞的诱导及形态学观察:将VEGF165稀释成终工作浓度为10 ng/ml 和20 ng/ml,并以此设置为两个诱导浓度组别。将原先培养基中的KSR更换成FBS。其余培养基组分不变。取纯化后的第3代rHFSCs,待贴壁细胞达到约60﹪融合,逐进行体外诱导。诱导时吸去原培养基,分别加入不同VEGF165浓度的诱导培养基到各自的组别,37℃、5﹪CO2条件下培养,之后每2天换液1次。倒置相差显微镜下观察细胞形态变化,分别在1、2、3周拍照记录。
2.流式及免疫荧光检测CD31和VE-cadherin的表达:分别在1、2、3周收集两组诱导后的细胞,流式细胞仪检测和细胞免疫荧光检测的具体操作步骤如前,分别送检上机检测。
3.体外管腔形成实验:从-20℃冰箱中取出Matrigel胶放在4℃冰箱中过夜,使之成为液态。实验前将移液枪头、24孔板等器材也置于4℃冰箱中预冷30 min。实验过程在冰上操作:按50 μl/cm2浓度Matrigel胶加入到24孔板的一孔中,轻轻晃动使之均匀分布,然后放入37℃、5﹪CO2培养箱中30 min,使其成胶。对最佳诱导因子浓度和工作时间所诱导的细胞进行收集,按每孔2×105/500 μl接种于Matrigel包被的24孔中。设置3个复孔,分别继续培养2、4、6 h后,在荧光显微镜下拍照。
4.透射电镜观察W-P结构:取最佳诱导因子浓度和工作时间所诱导的细胞,2.5﹪戊二酸PBS冲液固定4 h,经过0.1 mol/L PBS漂洗,1﹪锇酸固定,dd H2O漂洗,2﹪醋酸铀固定/染色,50﹪、70﹪、90﹪、100﹪乙醇及100﹪丙酮梯度脱水,并通过渗透、包埋、聚合三个过程。最后超薄切片,醋酸铀-柠檬酸铅染色,透射电镜下观察诱导后细胞内部结构。
三、统计学分析方法
所有数据采用SPSS 20.0统计软件进行分析。流式细胞术检测分化效率实验数据用x ± s表示,比较采用单因素方差分析及独立t检验。以P < 0.05为差异有统计学意义。
结 果
一、rHFSCs的分离培养和纯化
倒置相差显微镜观察到,经改良后组织块培养法培养,毛囊隆突部约2 ~ 3 d开始爬出细胞,6 ~ 7 d细胞数量增加。细胞排列紧密,呈铺路石状分布。用差速贴壁法纯化后的P3代细胞与原代细胞形态一致,且呈典型的铺路石状,折光度好、克隆性强,具有典型的干细胞生物学特性。(图1)

图1 倒置相差显微镜下观察rHFSCs(×100)
二、流式细胞仪检测结果
对rHFSCs的特征性标志物进行流式细胞术检测,结果显示:rHFSCs特征性标志物integrin
β1、integrin α6、P63高表达,中等表达CK15,低弱阳性表达CD31、VE-cadherin。符合rHFSCs标记鉴定。(图2)
三、免疫荧光鉴定结果
对rHFSCs进行细胞免疫荧光染色结果显示:标志物integrin β1、integrin α6、CK15、P63均阳性表达、阴性表达CD31、VE-cadherin。通过标志物的检测,证明该细胞是rHFSCs。(图3)
四、诱导后细胞形态的变化
在诱导液的作用下,两组细胞总趋势变化为:1周后细胞扁平发展,核内染色质增加而显得更明显,铺路石样转变更显著。2周后细胞出现梭形样改变,并且高浓度诱导因子组早于低浓度组。3周后,细胞完全被长梭形样细胞演变占据,内皮样形态消失。(图4)
五、两组诱导细胞流式细胞仪检测结果

图2 流式细胞术对rHFSCs特征性标志物的检测
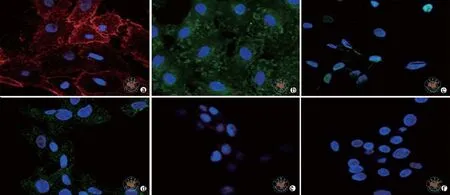
图3 共聚焦荧光显微镜下观察rHFSCs特征性标志物(免疫荧光染色×63)
分别在1、2、3周,对诱导后的两组细胞,进行血管内皮细胞特征性标志物流式细胞术检测,结果显示:两组诱导因子浓度在各自不同时间点,CD31和VE-cadherin的阳性率随时间增加而递减,且高浓度组随着时间的增加,两个标志物表达阳性率下降更明显。总趋势表现为1周中高表达,2周低表达,3周阴性表达。其中CD31在10 ng/ml和20 ng/ml VEGF165作用下组内均存在统计学差异(F = 7724.55,P <0.001;F = 17150.570,P <0.001)。而两
组组间在1、2周比较差异无统计学意义[(65.27± 0.57)﹪vs(66.13±0.60)﹪,t = -1.812,P = 0.145;(12.87±0.75)﹪vs(11.50±0.66)﹪,t = 2.375,P = 0.076)],在3周时虽然比较差异有统计学意义[(6.57±0.57)﹪ vs(2.43±0.95)﹪,t = 6.49,P = 0.003],但是阳性率已非常低。又VE-cadherin两组组内亦均存在统计学差异(F = 6336.192,P < 0.001;F = 9423.430,P <0.001)。且1、2、3周两组组间比较差异均具有统计学意义[(95.57±0.85)﹪vs(78.10±1.25)﹪,t = 19.977, P = 0.000;(19.07± 0.42)﹪ vs(7.93±0.35)﹪,t = 35.404,P < 0.001;13.30±0.46)﹪ vs(1.03±0.21)﹪,t = 42.212,P < 0.001)。所以CD31在诱导1周时表达最强,两种诱导因子浓度无差异。而VE-cadherin在诱导1周时表达也最强,10 ng/ml要优于20 ng/ml的诱导作用。(表1、2)

图4 倒置相差显微镜下观察两组诱导细胞(形态学变化总趋势 (×100)
表1 流式细胞术检测诱导后细胞CD31阳性率(﹪,± s)
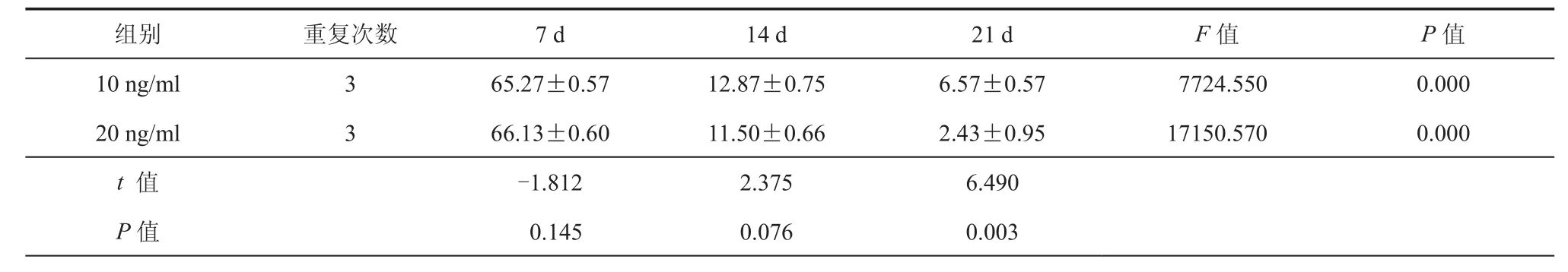
表1 流式细胞术检测诱导后细胞CD31阳性率(﹪,± s)
组别重复次数7 d14 d21 dF值P值10 ng/ml365.27±0.5712.87±0.756.57±0.57 7724.5500.000 20 ng/ml366.13±0.6011.50±0.662.43±0.9517150.5700.000 t 值-1.8122.3756.490 P值 0.1450.0760.003
表2 流式细胞术检测诱导后细胞VE-cadherin阳性率(﹪± s)
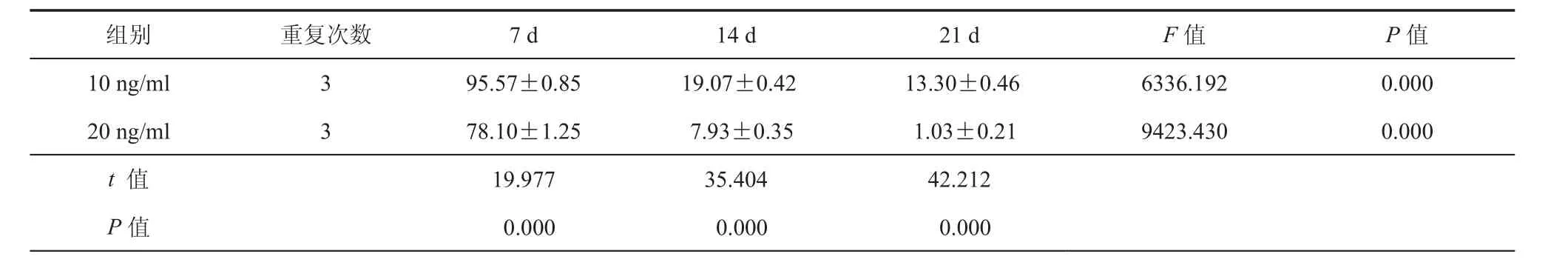
表2 流式细胞术检测诱导后细胞VE-cadherin阳性率(﹪± s)
组别重复次数7 d14 d21 dF值P值10 ng/ml395.57±0.85 19.07±0.42 13.30±0.466336.1920.000 20 ng/ml378.10±1.25 7.93±0.35 1.03±0.219423.4300.000 t 值19.97735.40442.212 P值 0.000 0.000 0.000
六、免疫荧光鉴定结果
对两组诱导后细胞进行免疫荧光染色结果显示:血管内皮细胞标志物CD31、VE-cadherin在1周均阳性表达,2周时表达减弱明显,到三周时均阴性表达。(图5)
七、体外官腔形成实验测试
在流式及免疫荧光染色联合鉴定下,得出1周时成血管内皮细胞效率最高,且两组浓度的诱导效果无明显差异,因此选取VEGF165浓度为10 ng/ml的诱导后细胞进行官腔形成实验。发现在
Matrigel胶上2 h开始出现线状结构,4 h线状结构增多,官腔逐渐形成,6 h后基本形成完好的管状网络结构。(图6)
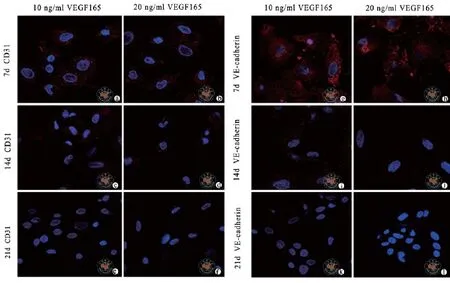
图5 共聚焦荧光显微镜下观察血管内皮细胞特征性标志物 (免疫荧光染色 ×63)
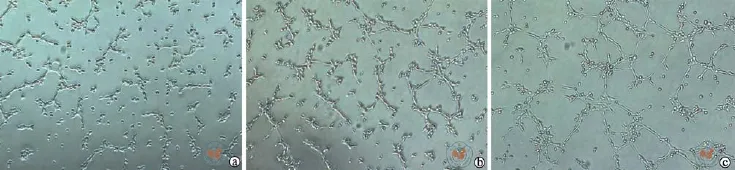
图6 倒置相差显微镜下观察诱导后的细胞官腔形成情况 (×40)
八、透射电镜观察W-P小体
透射电镜下,×5 900倍镜可见细胞核扁平,核内染色质较丰富,核仁明显,胞浆内多线粒体、高尔基体和粗面内质网。×17 000倍镜黑色棒状结构-W-P小体明显(黑色箭头所指),符合内皮细胞的结构特征(图7)。
讨 论
虽然目前大口径人工血管普遍运用,疗效可靠。但是小口径人造血管由于张力高,阻力大,血流速度缓慢,易导致管管堵塞,中远期的疗效不容肯定[23-25]。因此,利用干细胞作为种子细胞将其诱导分化,构建组织工程血管越来越有必要去研究并运用。
目前研究最多的干细胞,如胚胎干细胞、骨髓间充质干细胞、脂肪干细胞等,都具有多向分化的潜
能和增殖能力强等特点。但是也存在着各自的缺点:如伦理道德观念的限制,取材不便、易伤供体,来源及数量有限,异体移植免疫排斥反应大等,这势必延缓了组织工程研究快速发展的脚步[26-29]。

图7 透射电镜下观察诱导后细胞内部结构 (× 5 900)及W-P小体 (× 17 000)
而毛囊干细胞作为较为新兴的种子细胞研究对象,存在的先天优势,克服了上述干细胞的缺点。当前对毛囊干细胞的鉴定尚无一种确切可靠的特异性标志物,所以现阶段普遍认同运用两种或以上的标志物对其进行联合鉴定。已有研究表明,整合素家族表达率越高,目的细胞的干性越强,分化程度越低。integrin α6、integrin β1都是公认的HFSCs表面标志物,并常和其他标志物用来联合鉴定毛囊干细胞[30-32]。而也有学者[33]发现角蛋白K15比K19表达减少更早,因此逐渐被认为K15是较为特异性的HFSCs标志物,更有鉴别意义。P63是肿瘤抑制因子之一,也是表皮干细胞的一种特异性标志物,因毛囊隆突部也存在表皮干细胞,P63也被认为是鉴定HFSCs一种有效的标志物[34]。本实验通过改良的大鼠毛囊干细胞培养、扩增、纯化、鉴定体系,得到了高效价的毛囊干细胞。
干细胞诱导分化的方法,作为当前干细胞领域研究的热点之一,常规可以通过以下不同的途径来实现:(1)化学试剂、诱导液诱导分化;(2)外源性细胞因子、蛋白诱导分化;(3)转基因诱导分化;(4)通过将干细胞与其他细胞共培养的方式诱导干细胞分化等。而各种诱导所产生的成熟细胞数量、纯度、成熟度、细胞移植治疗成活率各有不同[35-38]。基于这些理论,本研究设计了将活性最强的VEGF165作为诱导因子,对毛囊干细胞进行定向分化为血管内皮细胞的探究。
在鉴定毛囊干细胞是否诱导为血管内皮细胞时,本实验运用流式细胞技术、免疫荧光染色、体外官腔形成实验、透射电镜观察超微结构这四种手段联合鉴定。其中,CD31即血小板内皮细胞黏附分子-1,VE-cadherin即血管内皮钙黏蛋白,主要表达在内皮细胞膜和胞浆中,两者都是鉴定内皮细胞关键性的特异性标志物,都可以通过流式技术和免疫荧光法来鉴定、分选、纯化。对血管内皮再生,维持血管内皮完整性以及调节血管张力等方面具有关键性作用[39-41]。经过研究发现,以10 ng/ml VEGF165浓度诱导一周后,流式和免疫荧光显示CD31和VE-cadherin表达量明显增加,效价最高。1982年,Wagner等人通过透射电镜观察到了W-P小体,该细胞器属内皮细胞特有,后来被认定为最特征性的形态学指标,而体外官腔的形成多是内皮细胞、吞噬细胞及部分肿瘤干细胞的特点。为进一步证实本次诱导的内皮细胞在功能和形态结构上的完整性,即选取效价最高的10 ng/ml VEGF165组细胞进行体外官腔形成实验和透射电镜下观察W-P小体,结果显示6 h后官腔形成完整,W-P小体显现。运用四种手段联合鉴定,已证明本实验的诱导体系的诱导效率较高,细胞从结构、功能、蛋白表达等方面都已转化为内皮细胞。
至此,研究不仅改良优化了一套较为完整的大鼠毛囊干细胞分离培养和纯化检测的方法,也建立了一个较为有效的诱导成为内皮细胞的体系。诱导后细胞能较好表达血管内皮细胞的表型,功能和结构也较完善。下一步,通过抑制通路的形式,初步探寻诱导大鼠毛囊干细胞分化为血管内皮细胞的作用机制,并进行裸鼠体内成血管的实验,分析细胞在体内的作用能力和效率。为进一步进行血管构建、血管修复以及促进皮肤创面早期血管化研究提供理论依据,也为缺血性疾病、组织工程皮肤在临床治疗中的应用提供了新思路。
1 Sabry D, Noh O, Samir M. Comparative evaluation for potential differentiation of endothelial progenitor cells and mesenchymal stem cells into Endothelial-Like cells[J]. Int J Stem Cells, 2016, 9(1):44-52.
2 许志成, 李宏, 张群. 毛囊干细胞体外诱导分化为血管内皮细胞的实验研究[J]. 组织工程与重建外科杂志, 2012, 8(5):241-244.
3 Choi S, Kim JA, Kim KC, et al. Isolation and in vitro culture of vascular endothelial cells from mice[J]. Korean J Physiol Pharmacol, 2015, 19(1):35-42.
4 Gurel PG, Torun KG, Hasirci V. Infl uence of co-culture on osteogenesis and angiogenesis of bone marrow mesenchymal stem cells and aortic endothelial cells[J]. Microvasc Res, 2016, 29(108):1-9.
5 Liu Y, Xue Q, Tang Q, et al. A simple method for isolating and
culturing the rat brain microvascular endothelial cells[J]. Microvasc Res, 2013, 90:199-205.
6 Gillies PJ, Bray LJ, Richardson NA, et al. Isolation of microvascular endothelial cells from cadaveric corneal limbus[J]. Exp Eye Res, 2015, 131:20-28.
7 Badylak SF, Nerem RM. Progress in tissue engineering and regenerative medicine[J]. Proc Natl Acad Sci U S A, 2010, 107(8): 3285-3286.
8 Lasala GP, Minguell JJ. Vascular disease and stem cell therapies[J]. Br Med Bull, 2011, 98:187-197.
9 Xu ZC, Zhang Q, Li H. Differentiation of human hair follicle stem cells into endothelial cells induced by vascular endothelial and basic fi broblast growth factors[J]. Mol Med Rep, 2014, 9(1):204-210.
10 Zc X, Zhang Q, Li H. Human hair follicle stem cell differentiation into contractile smooth muscle cells is induced by transforming growth factor-p1 and platelet-derived growth factor BB[J]. Mol Med Rep, 2013, 8(6):1715-1721.
11 Yamazaki A, Yashiro M, Mii S, et al. Isoproterenol directs hair follicleassociated pluripotent (HAP) stem cells to differentiate in vitro to cardiac muscle cells which can be induced to form beating heartmuscle tissue sheets[J]. Cell Cycle, 2016, 15(5):760-765.
12 Najafzadeh N, Esmaeilzade B, Dastan IM. Hair follicle stem cells:In vitro and in vivo neural differentiation[J]. J Invest Dermatol.World J Stem Cells, 2015, 7(5):866-872.
13 Nishimura EK. Melanocyte stem cells: a melanocyte reservoir in hair follicles for hair and skin pigmentation[J]. Pigment Cell Melanoma Res, 2011, 24(3):401-410.
14 Nath M, Offers M, Hummel M, et al. Isolation and in vitro expansion of Lgr6-positive multipotent hair follicle stem cells[J]. Cell Tissue Res, 2011, 344(3):435-444.
15 Mokos ZB, Mosler EL. Advances in a rapidly emerging fi eld of hair follicle stem cell research[J]. Coll Antropol, 2014, 38(1):373-378.
16 Ye SS, Liu XJ, Mao BY, et al. Paeonol enhances thrombus recanalization by inducing vascular endothelial growth factor 165 via ERK1/2 MAPK signaling pathway[J]. Mol Med Rep, 2016, 13(6): 4853-4858.
17 Liu Q, Zhou HC, Yang XL, et al. Embolus-carried vascular endothelial cell growth factor 165 improves angiogenesis in thromboangiitis obliterans[J]. Genet Mol Res, 2014, 13(1):1744-1752.
18 Wang Y, Liu J, Tan X, et al. Induced pluripotent stem cells from human hair follicle mesenchymal stem cells[J]. Stem Cell Rev, 2013, 9(4):451-460.
19 Yang RH, Xie JL, Shu B, et al. An improved method for the isolation and culture of rat epidermal stem cells[J]. Int J Clin Exp Pathol, 2013, 6(11):2529-2534.
20 Quan R, Zheng X, Xu S, et al. Gelatin-chondroitin-6-sulfatehyaluronic acid scaffold seeded with vascular endothelial growth factor 165 modifi ed hair follicle stem cells as a three-dimensional skin substitute[J]. Stem Cell Res Ther, 2014, 5(5):118.
21 杨珂, 姜自林, 杨恬. 大鼠毛囊干细胞的体外分离培养及增强型绿色荧光蛋白示踪[J]. 中国组织工程研究与临床康复, 2008, 12(8):1481-1484.
22 吕国忠, 周红梅, 赵朋, 等. 体外培养表皮干细胞复合高分子支架原位修复深度烧伤创面的研究[J]. 中华损伤与修复杂志, 2011, 6(1):20-32.
23 Tang GH, Pinney SP, Broumand SR, et al. Excellent outcomes with use of synthetic vascular grafts for treatment of mycotic aortic pseudoaneurysms after heart transplantation[J]. Ann Thorac Surg, 2011, 92(6):2112-2116.
24 Losi P, Lomhardi S, Briganti E, et al. Luminal surface microgeometry affects platelet adhesion in small-diameter synthetic grafts[J]. Biomaterials, 2004, 25(18):4447-4455.
25 Bznz Y, Rieben R. Endothelial cell protection in xeno transplantation: looking after a key player in rejection[J]. Xenotransplantation, 2006, 13(1):19-30.
26 赵蕊, 吕学诜. 人胚胎干细胞建系培养及体外诱导分化的研究进展[J]. 国际遗传学杂志, 2010, 33(1):12-15.
27 Cao L, Yang F, Liu G, et al. The promotion of cartilage defect repair using adenovirus mediated Sox9 gene transfer of rabbit bone marrow mesenchymal stem cells[J]. Biomaterials, 2011, 32(16):3910-3920.
28 Charruyer A, Ghadially R. What's new in dermatology: epidermal stem cells.[J]. G Ital Dermatol Venereol, 2011, 146(1):57-67.
29 鲁彦玮, 王志军. 组织工程皮肤种子细胞和支架材料的研究现状[J].中国美容整形外科杂志, 2011, 22(6):373-376.
30 Kloepper JE, Tiede S, Brinckmann J, et al. Immunophenotyping of the human Bulge region: the quest to define useful in situ markers for human epithelial hair follicle stem cells and their niche[J]. Exp Dermatol, 2008, 17(7):592-609.
31 Eckert RL, Adhikary G, Balasubramanian S, et al. Biochemistry of epidermal stem cells[J]. Biochim Biophys Acta, 2013, 1830(2):2427-2434.
32 Oh JH, Mohebi P, Farkas DL, et al. Towards expansion of human hair follicle stem cells in vitro[J]. Cell Prolif, 2011, 44(3):244-253.
33 Wang GY, Wang J, Mancianti ML, et al. Basal cell carcinomas arise from hair follicle stem cells in Ptch1(+/-) mice[J]. Cancer Cell, 2011, 19(1):114-124.
34 Leirós GJ, Kusinsky AG, Drago H, et al. Dermal papilla cells improve the wound healing process and generate hair Bud-Like structures in grafted skin substitutes using hair follicle stem cells[J]. Stem Cells Transl Med, 2014, 3(10):1209-1219.
35 Preitschopf A, Schoerghofer D, Kinslechner K, et al. Rapamycin-Induced hypoxia inducible factor 2a is essential for chondrogenic differentiation of amniotic fl uid stem cells[J]. Stem Cells Transl Med, 2016, 5(5):580-590.
36 Wang YW, Xu DP, Liu Y, et al. The effect of tumor necrosis factoralpha at different concentrations on osteogenetic differentiation of bone marrow mesenchymal stem cells[J]. J Craniofac Surg, 2015, 26(7):2081-2085.
37 Medhekar SK, Shende VS, Chincholkar AB. Recent stem cell advances: cord blood and induced pluripotent stem cell for cardiac regeneration-a review[J]. Int J Stem Cells, 2016, 9(1):21-30.
38 Tansriratanawong K, Tamaki Y, Ishikawa HA. Co-culture with periodontal ligament stem cells enhances osteogenic gene expression in de-differentiated fat cells[J]. Hum Cell, 2014, 27(4):151-161.
39 Zhang H, Chang H, Wang LM, et al. Effect of polyelectrolyte film stiffness on endothelial cells during Endothelial-to-Mesenchymal transition[J]. Biomacromolecules, 2015, 16(11):3584-3593.
40 Vilgrain I, Sidibé A, Polena H, et al. Evidence for post-translational processing of vascular endothelial (VE)-cadherin in brain tumors: towards a candidate biomarker[J]. PLoS One, 2013, 8(12):e80056.
41 Cheung K, Ma L, Wang GS, et al. CD31 signals confer immune privilege to the vascular endothelium[J]. Proc Natl Acad Sci U S A, 2015, 112(43):E5815-E5824.
Induction of hair follicle stem cells into endothelial cells in vitro
Du Weibin1, Quan Renfu1,Zheng Xuan1, Li Qiang1, Cao Guoping1, Zhuang Wei1, Shao Rongxue2, Yang Disheng3.1The Affiliated JiangNan Hospital of Zhejiang Chinese Medical University orthopedics, Hangzhou, 311201, China;2Zhejiang Chinese Medical University, Hangzhou 310053, China;3The Second Affiliated Hospital, School of Medical, Zhejiang University, Hangzhou 310009, China
Objective To establish a simple, reliable method of hair follicle stem cells directional differentiation into vascular endothelial cells. Methods The tentacles of skin of 1-week SD rat were removed in aseptic condition and digested with Dispase enzyme and type Ⅳcollagenase mixture. The hair follicle bulges were picked out under a microscope. After culture, HFSCs were identified by flow cytometry and immunofluorescence staining. Cells were cultured in the presence of 10 ng/ml and 20 ng/ml VEGF165 and cell morphology were inspected at 1, 2, and 3 weeks. Differentiation efficiency was evaluated by flow cytometry and immunofluorescence staining; Formation of newspeak and W-P corpuscle was observed under transmission electron
Hair follicle; Stem cells; Vascular endothelial cells; Inducible factor; Tissue engineering
2016-04-24)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2016.05.004
浙江省科学技术厅公益技术研究社会发展项目(2010C33133);杭州市萧山区社会发展重大科技攻关项目(2014205)
311201 杭州,浙江中医药大学附属江南医院骨科1;310053 杭州,浙江中医药大学2;310009 杭州,浙江大学附属第二医院骨科3
全仁夫,Email:quanrenfu@126.com
microscope. The experimental data were compared with one factor analysis of variance and t test. Results rHFSCs formed clone and positive for integrin β1(98.9﹪), integrin α6(97.9﹪), CK15(68.1﹪), and P63(98.5﹪). Expression levels of CD31(13.6﹪)and VE-cadherin(17.9﹪)were low. Under induction, spindle-shaped cells appeared after 1 week. Cells expressed high-level CD31 in the presence of both 10 ng/ml and 20 ng/ml VEGF165 after 1 week [(65.27±0.57)﹪ vs (66.13±0.60)﹪,t = -1.812,P = 0.145]. VE-cadherin was also expressed after 1 week (95.57± 0.85 vs 78.10±1.25,t = 19.977,P = 0.000). At the presence of 10 ng/ml VEGF165, induced cells had newspeak and W-P corpuscles specific for endothelial cells. Conclusion With induced factor of 10 ng/mlVEGF165 concentration, rHFSCs can get good performance of vascular endothelial cells successfully after 1 week.which provide vascular tissue engineering, cell transplantation treatment of ischemic diseases ideal seed cells.
杜伟斌,全仁夫,郑宣,等. 毛囊干细胞体外诱导成血管内皮细胞的实验研究[J/CD].中华细胞与干细胞杂志:电子版, 2016, 6(5):284-291.
