IGF-1、TGF-β1在早产儿视网膜病中的表达及临床意义
2016-12-13陈健萍袁海超赵云开卢燕玲广东省东莞市人民医院新生儿科广东东莞523000
陈健萍 袁海超 赵云开 卢燕玲广东省东莞市人民医院新生儿科,广东东莞 523000
IGF-1、TGF-β1在早产儿视网膜病中的表达及临床意义
陈健萍 袁海超 赵云开 卢燕玲
广东省东莞市人民医院新生儿科,广东东莞 523000
目的 观察IGF-1、TGF-β1在早产儿视网膜病中的表达及临床意义。 方法 资料来源于我院2011年11月~2013年10月间出生的早产儿,其中发生ROP组30例;未发生ROP 30例为早产对照组,同时选择同期健康足月对照组30例。比较各组的IGF-1、TGF-β1含量。 结果 ROP组生后1周、纠正胎龄32周、纠正胎龄34周、纠正胎龄36周的血清IGF-1、TGF-β1含量分别低于未发生ROP组及健康足月对照组(P<0.05),但ROP组与未发生ROP组、健康足月对照组纠正胎龄40周的IGF-1、TGF-β1含量比较,差异无统计学意义(P>0.05)。 结论 IGF-1、TGF-β1均参与了早产儿视网膜病的发生发展过程,通过动态监测IGF-1、TGF-β1的变化情况,有利于为早产儿视网膜病的诊断和治疗提供参考依据。
外周血胰岛素样生长因子;转化生长因子;早产儿视网膜病;新生血管
早产儿视网膜病(ROP)是未成熟的视网膜血管异常发育和增生导致的病变,研究发现,新生血管的形成在ROP发生中起主导作用[1]。现已发现多种细胞因子参与新生血管的形成,如血管内皮生长因子(VEGF)、胰岛素样生长因子-1(IGF-1)、转化生长因子(TGF-β)等。已有研究证实这些因子与ROP的发生发展可能密切相关[2]。本研究旨在观察血清IGF-1、TGF-β1在早产儿视网膜病中的表达及临床意义,现报道如下。
1 资料与方法
1.1一般资料
资料来源于我院2011年11月~2013年10月间出生的早产儿,胎龄<34周或出生体重<2000g,按我国现行的ROP筛查标准[3],于生后4~6周或矫正胎龄32周开始进行眼底筛查,随访至周边视网膜血管化。发生ROP的设为ROP组,共30例;无发生ROP的设为早产对照组,选取30例。ROP组30例,男18例、女12例,胎龄27~32周,平均(30.08±1.12)周,出生体重990~1990g,平均(1456.80±260.16)g;早产对照组30例,男15例、女15例,胎龄27~32周,平均(29.80±1.31)周,出生体重890~1990g,平均(1422.26±270.93)g;ROP组与早产对照组的性别比例、胎龄、体重方面无统计学差异(P均>0.05)。同时设同期健康足月对照组30例,男15例、女15例。
1.2检测指标
早产儿分别于生后1周、纠正胎龄32、34、36周及40周时,足月儿于出生后3d内,晨取外周静脉血1mL,离心2000转/min 15min,置-70℃冰箱保存待测。IGF-1及TGF-β1的测定采用双抗夹心ELISA法,试剂盒选用德国DRG公司提供的进口试剂盒。
1.3统计学方法
2 结果
2.1各组血清IGF-1含量比较
ROP组生后1周、纠正胎龄32周、纠正胎龄34周、纠正胎龄36周的血清IGF-1含量分别低于未发生ROP组及健康足月对照组,差异具有统计学意义(P<0.05),ROP组与未发生ROP组、健康足月对照组纠正胎龄40周的IGF-1含量比较,差异无统计学意义(P>0.05)。见表1。
表1 各组血清IGF-1含量比较

表1 各组血清IGF-1含量比较
注:与ROP组比较,*P<0.05,t1代表未发生ROP组与ROP组比较,t1值分别为6.231,11.346,12.532,18.873,0.235。t2代表健康足月对照组与ROP组比较,t2值分别为9.124,13.4532,16.125,29.343,0.573
组别 n 生后1周 纠正胎龄32周 纠正胎龄34周 纠正胎龄36周 纠正胎龄40周ROP组 30 23.93±10.23 31.20±10.14 37.32±14.85 41.34±13.88 44.23±15.03未发生ROP组 30 35.14±13.19* 53.71±24.63* 67.07±28.26* 72.69±32.58* 45.71±18.23健康足月对照组 30 48.25±62.28* 62.18±57.19* 80.46±0.65* 90.34±0.42* 50.37±4.37 F 8.231 7.308 6.238 9.239 0.763 P<0.05 <0.05 <0.05 <0.05 >0.05
2.2各组血清TGF-β1含量比较
ROP组生后1周、纠正胎龄32周、纠正胎龄34周、纠正胎龄36周的血清TGF-β1含量分别低于未发生ROP组及健康足月对照组,差异具有统计学意义(P<0.01),ROP组与未发生ROP组、健康足月对照组纠正胎龄40周的TGF-β1含量比较,差异无统计学意义(P>0.05)。见表2。
表2 各组血清TGF-β1含量比较
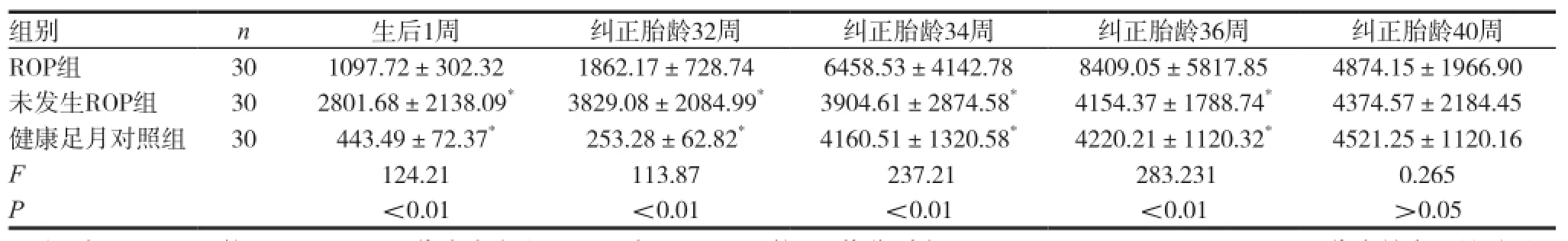
表2 各组血清TGF-β1含量比较
注:与ROP组比较,*P<0.05,t1代表未发生ROP组与ROP组比较,t1值分别为123.64,186.23,232.16,218.45。t2代表健康足月对照组与ROP组比较,t2值分别为139.64,183.31,216.45,239.53
生后1周 纠正胎龄32周 纠正胎龄34周 纠正胎龄36周组别 n纠正胎龄40周ROP组 30 1097.72±302.32 1862.17±728.74 6458.53±4142.78 8409.05±5817.85 4874.15±1966.90未发生ROP组 30 2801.68±2138.09* 3829.08±2084.99* 3904.61±2874.58* 4154.37±1788.74* 4374.57±2184.45健康足月对照组 30 443.49±72.37* 253.28±62.82* 4160.51±1320.58* 4220.21±1120.32* 4521.25±1120.16 F 124.21 113.87 237.21 283.231 0.265 P<0.01 <0.01 <0.01 <0.01 >0.05
3 讨论
目前研究证实,ROP的发病机制为视网膜新生血管伴有纤维组织增生,新生血管形成在ROP发生中起主导作用[4]。现已发现多种细胞因子参与血管生成,如VEGF、IGF-1、TGF-β、bFGF等,且与ROP的发生发展可能密切相关[5]。其中,IGF-1是由70多个氨基酸组成的单链多肽,基因位于12号染色体。体内多种器官和组织能合成和分泌IGF-1,循环中的IGF-1主要来自肝脏[6]。在正常视网膜IGF-1和IGF-1受体mRNA分布于视网膜神经感觉全层、视网膜色素上皮细胞(RPE)以及脉络膜和视网膜的毛细血管内皮细胞。研究发现,低水平IGF-1会减慢视网膜血管的正常发育,导致无血管区增大,继发视网膜缺氧损伤。低水平IGF-1持续时间愈长,视网膜无血管区越多,视网膜缺氧损伤越重,发生ROP的风险则越高[7-8]。本研究表1结果显示,ROP组生后1周、纠正胎龄32周、纠正胎龄34周、纠正胎龄36周的血清IGF-1含量分别低于未发生ROP组及健康足月对照组,ROP早产儿更低。新生儿生后早期的血清IGF-1主要来源于母体及自身合成。早产儿在母体来源不足的同时受到多种病理因素的影响,因此生后早期的IGF-1水平会偏低。早产儿即使在胎龄、出生体重及病理情况同等的条件下,发生ROP的早产儿其生后早期血中的IGF-1水平仍明显低于无ROP早产儿。因此动态监测早产儿生后血清IGF-1水平,将有助于临床预测ROP的发生。TGF-β是多功能肽类生长因子,几乎存在于所有正常组织中[9]。TGF-β在哺乳动物体内主要存在3种同分异构体:TGF-β1 、TGF-β2、和TGF-β3。TGF-β1通过调节细胞的生长、增殖、分化、凋亡及血管生成、细胞外基质的重建和机体免疫功能等在抑制肿瘤细胞的增殖中发挥重要作用。TGF-β1是纤维化形成与发展的启动枢纽,是导致多种器官和组织纤维化的关键性炎症细胞因子之一[10]。且研究发现,在糖尿病视网膜病变及增生性玻璃体视网膜病变的发生机制中华TGF-β起了重要作用[11]。而ROP也存在广泛的视网膜血管增生及疤痕组织形成的病理过程,因此推测TGF-β在ROP发生中起重要作用。本研究表2结果显示,ROP组生后1周、纠正胎龄32周、纠正胎龄34周、纠正胎龄36周的血清TGF-β1含量分别低于未发生ROP组及健康足月对照组,考虑可能是由于早产儿缺乏母体来源的TGF-β1,导致出生后血清TGF-β1水平较低,加上早产儿生后早期常并发肺透明膜病、低氧血症、酸中毒、营养不良、感染等会进一步导致TGF-β1减少。表2显示,生后血清TGF-β1水平随周龄的增长呈上升趋势,至纠正胎龄40周时血清TGF-β1水平能恢复至健康足月儿水平。早产儿外周血TGF-β1水平恢复正常与ROP进程的停止发生在同一时期,TGF-β1与ROP的发生发展病程的进展密切相关[12-15]。综上,外周血胰岛素样生长因子、转化生长因子均参与了早产儿视网膜病的发生发展过程,通过动态监测上述指标的变化情况,对于寻找早期预测ROP发生的指标,对临床及早发现ROP,早期干预,改善视力预后具有重大意义。
[1] 连朝辉.早产儿氧疗及其风险//吴本清,黄丽娜,张国明.早产儿视网膜病变[M].广州:广东科技出版社,2007:15-22.
[2] Modrzejewska M.Retinopathy of prematuritypathogenesis and prevalence[J].Ann Acad Med Stetin,2006,52(1):67-72.
[3] Engel RR,Oden NL,Cohen GR,et al.Influence ofprior assignmenton refusal rates in a trialofsupplementaloxygen for retinopathy of prematurity [J].Paediatr Perinat Epidemiol,2006,20(4):348-359.
[4] Fortes FJB,Eekert GU,Tartarella MB,et a1.Prevention of retinopathy of prematurity[J].Arq Bras Oftalmol,2011,74(3):217-221.
[5] 储昭节,王雨生.我国大陆地区近2O年早产儿视网膜病发病概况[J].中华眼科杂志,2012,48(2):179-183.
[6] 唐兰芬,方林彬,朱晓波,等.20例早产儿视网膜病变转归的临床分析[J].国际医药卫生导报,2011,17(17):2089-2091.
[7] 张德双,王华.早产儿视网膜病变的最新研究进展[J].中华妇幼临床医学杂志(电子版),2012,8(6):670-673.
[8] Hellstrom A,Perruzzi C,Ju M,et al.Low IGF-1 suppresses VEGF-survival signaling in retinal endothelial cells:direct correlation with clinical retinopathy of prematurity[J].Proc Natl Acad Sci USA,2001,98(10):5804-5808.
[9] 赵有为,傅万海.早产儿视网膜病的影响因素[J]实用儿科临床杂志,2011,26(8):600-601,615.
[10] 杜鹃,陈超.早产儿血清IGF-1浓度变化及与早产儿视网膜病关系[J].临床儿科杂志,2008,26(9):757-762.
[11] 张燕,欧明明,徐晓燕.早产儿视网膜病的研究进展[J].安徽医学,2015,36(10):1304-1305.
[12] 张德双,王华,陈娟. 早产儿视网膜病变的最新研究进展[J].中华妇幼临床医学杂志(电子版),2012,8(6):783-786.
[13] 中华医学会. 早产儿治疗用氧和视网膜病变防治指南[J].中华眼科杂志,2005,41:375.
[14] 邵肖梅,叶鸿瑁,丘小汕. 实用新生儿学[M].第4版.北京:人民卫生出版社,2010: 887-892.
[15] 马萍萍,张敏,张秋玲,等. 东莞市早产儿视网膜病变筛查初步报告[J].中华眼底病杂志,2011,27(2):179-180.
[16] 郑靖阳,肖秀漫,陈清.血清IGF-1、bFGF及VEGF浓度与早产儿视网膜病的关系[J].医学研究杂志,2015,44(11):670-673.
Expression of IGF-1 and TGF-β1 in retinopathy of prematurity and its clinical significance
CHEN Jianping YUAN Haichao ZHAO Yunkai LU Yanling
Department of Neonatology, Dongguan People's Hospital, Guangdong, Dongguan 523000, China
Objective To observe the expression of IGF-1 and TGF-β1 in retinopathy of prematurity and its clinical significance. Methods Data were from the data of premature infant in our hospital from November 2011 to October 2013. 30 cases occurred ROP were selected as ROP group, 30 cases un-occurred ROP were selected as premature control group, and 30 cases of healthy full-term newborn infants over the same period were selected as full-term control group. The contents of IGF-1 and TGF-β1 in each group were compared. Results Serum contents of IGF-1 and TGF-β1 at 1 week after birth, 32 weeks of gestational age, 34 weeks of gestational age and 36 weeks of gestational age of ROP group were respectively lower than those of un-occurred ROP and full-term control group (P<0.05). But there was no statistical significance in the contents of IGF-1 and TGF-β1 at 40 of gestational age between ROP group, un-occurred ROP group and full-term control group (P> 0.05). Conclusion Both IGF-1 and TGF-β1 are involved in the occurrence and development of the occurrence and development of retinopathy of premature infants. By dynamic monitoring the change of IGF-1 and TGF-β1, it is benefit to provide reference for the diagnosis and treatment of retinopathy of premature infants.
Peripheral blood insulin like growth factor; Transforming growth factor; Retinopathy of retinopathy; New blood vessel
R774.1
B
2095-0616(2016)17-195-03
广东省东莞市科技计划医疗卫生类科研项目(201110515001099)。
(2016-06-13)
