磁性修饰的工程酵母吸附水中银离子研究
2016-12-13陶虎春崔晓冰李金波石刚
陶虎春 崔晓冰 李金波 石刚
磁性修饰的工程酵母吸附水中银离子研究
陶虎春†崔晓冰 李金波 石刚
北京大学深圳研究生院环境与能源学院, 深圳市重金属污染控制与资源化重点实验室, 深圳 518055; † E-mail: taohc@pkusz.edu.cn
采用水基磁性Fe3O4纳米颗粒修饰表面展示CueR蛋白的酿酒酵母(), 获得磁响应性能良好的磁修饰工程酵母细胞。傅里叶变换红外光谱分析表明, 磁修饰细胞较好地保留了工程酵母细胞和磁性材料的官能团。研究吸附动力学、等温吸附模型以及不同因素(如时间、温度和 pH 值)对磁修饰细胞吸附Ag+的影响, 结果表明, 磁修饰酵母对 Ag+的吸附速率很快, 18分钟基本上达到吸附平衡; 最适宜吸附温度为20~30℃; 最佳吸附pH值等于 7。磁修饰酵母对Ag+的吸附符合准一级动力学模型和Langmuir等温吸附模型。多金属等摩尔浓度竞争条件下的吸附结果表明, 磁修饰后的工程酵母对Ag+仍具有选择吸附性, Ag+的吸附量为Ni2+的10.6倍, Zn2+的9.0倍, Co2+的7.5倍, Cu2+的3.0倍。
磁修饰; 工程酵母; 银离子; 选择性吸附; 磁分离
随着工业的迅猛发展, 大量的重金属废水排入环境中, 造成严重的污染问题。废水中的银主要来源于化工、电子、感光材料和电镀等行业[1], 自由态的银离子毒性很强, 危害水生生物及人体健 康[2]。此外, 银属于贵金属, 具有较高的经济价值。因此, 对工业废水中银离子进行去除、富集和回收, 具有环境保护和资源利用的双重意义。
重金属废水的处理方法包括化学沉淀、活性炭吸附、离子交换和电渗析等[3–4]。相较于传统的物理化学处理方法, 微生物吸附法因其高效、廉价、环保以及在低浓度情况下去除效果良好等优点, 受到广泛关注[5–7]。国内外学者对微生物吸附剂进行基因工程改造, 大大提高了吸附效率[8–9]。但是, 游离和悬浮微生物的体积小, 机械强度低, 处理后的生物体与出水难以分开, 成为工业化进程中需要解决的问题。常用的固液分离方法包括离心、过滤、沉降和浮选等, 但存在成本高或耗时长等问题。污水处理厂利用固定床等设备可将微生物固定化, 解决固液分离困难问题, 但工艺庞大复杂, 且固液两相接触不充分, 难以达到最佳效果[10]。
磁分离技术具备分离迅速、操作方便等优点, 可以有效地解决这一问题。利用磁铁矿(Fe3O4)或磁赤铁矿(γ-Fe2O3)的纳米或微米颗粒对微生物进行表面修饰, 使微生物负载上磁性, 进而利用磁场进行快速的固液分离, 可以很好地解决微生物吸附后难以与出水分离的问题[11]。同时, 进行磁性修饰后的细胞在反应的过程中可以均匀地分散在废液中, 使两相充分接触, 达到良好的吸附效果。目前已有很多研究采用磁修饰微生物去除 Cu2+, U6+, Hg2+, Pb2+, Cd2+和 Ni2+等重金属[12–17]以及水溶性染料[18–19], 实验证明磁修饰微生物具备良好的吸附性能。
本文结合基因工程菌的吸附优势和磁性材料的分离技术, 利用磁性 Fe3O4纳米颗粒对本研究组改造所得的表面展示 CueR 蛋白酿酒酵母进行磁性修饰, 构建一种对 Ag+具有高效吸附和选择吸附能力的磁性修饰工程菌, 在达到高效去除Ag+的前提下, 实现微生物与水溶液的快速分离。
1 材料与方法
1.1 菌种
本研究采用的菌种为表面展示 CueR 蛋白的酿酒酵母(), 由本研究组改造保存。CueR 蛋白是对 Ag+/Cu+具有选择性识别功能的转录调控因子, 来源于恶臭假单胞菌。基于CueR 蛋白, 利用细胞表面工程技术对酿酒酵母进行改造强化, 构建对 Ag+具有特异性吸附的工程酵母。
1.2 主要药品及培养基
聚烯丙基胺盐酸盐(Poly allylamine hydrochlo-ride, PAH), 购自 Sigma-Aldrich, 四甲基氢氧化铵溶液(Tetramethylammonium hydroxide, TMA)购自阿拉丁试剂(上海)有限公司, 氯化铁、氯化亚铁及氨水等均为分析纯级药品。
含 2%葡萄糖的 YNB-CAA 培养基: 0.67% 无氨基酵母氮源(yeast nitrogen base without amino acids, YNB), 0.5%酪蛋白氨基酸(casamino acids, CAA), 2% 葡萄糖; 含2%半乳糖的YNB-CAA培养基: 0.67% YNB, 0.5% CAA, 2%半乳糖。
重金属测试液: 使用硝酸银配制不同Ag+浓度和不同 pH 值的 Ag+溶液; 使用硝酸银、硝酸铜、硝酸锌、硝酸镍和硝酸钴配制多金属混合溶液。上述所有重金属溶液均溶于 50 mmol/L HEPES 缓冲液中。溶液 pH 值使用 0.1 mol/L NaOH 和 0.1 mol/L HNO3调节。
1.3 菌悬液制备
挑取转化成功后的酿酒酵母菌株于含2%葡萄糖的YNB-CAA液体培养基中, 30 ℃振荡培养过夜, 当菌悬液的 OD600值在 2 ~ 5 之间时, 将菌体转移至含2%半乳糖的YNB-CAA液体培养基中, 调节OD600值至0.5~1.0, 20℃恒温振荡培养 24 小时即可成功诱导重组蛋白表达与展示。取已诱导表达CueR蛋白的菌液, 用50 mmol/L HEPES缓冲液洗去培养基并调节 OD600值至 4.0 (约为 3.6 mg 干重/ mL)待用。
1.4 磁性Fe3O4制备
参照 Massart[20]和 Fakhrullin 等[11]的方法制备磁性纳米Fe3O4。将2.0 mL 1 mol/L FeCl3和0.5 mL 2 mol/L FeCl2水溶液混合, 置于磁力搅拌器上快速搅拌, 加入25 mL 1.0 mol/L氨水, 出现黑色磁铁矿沉淀。用磁铁将黑色沉淀分离, 并用超纯水洗至上清液pH达到7.0。加入2 mL 25% TMA水溶液, 形成 Fe3O4磁性纳米棒的稳定悬浊液。取 100 μL 该悬液稀释于 10 mL 10 mg/mL 的 PAH 水溶液中, 超声处理 20 分钟, 得到 PAH 包裹着的磁性纳米颗粒, 用超纯水洗去游离的 PAH, 最终制成 0.5 mg 干重/mL 的 Fe3O4悬液, 颗粒直径约为 30 nm (马尔文Mastersizer 3000激光粒度仪测定)。
1.5 磁修饰酵母细胞及其表征
上述工程酵母菌悬液(yeast)及磁性纳米颗粒悬液(magnetic nanoparticles, MNPs)按照yeast:MNPs= 4:1混合, 室温下160 r/min振荡20分钟, 制成磁性纳米Fe3O4修饰的酵母细胞, 约为 3 mg 干重/mL。取部分磁修饰前细胞悬液、磁修饰后细胞悬液和磁性材料离心去上清液后, 真空冷冻干燥 48小时, 称取 2 mg 冻干样品, 加入 100 mg 干燥的KBr, 充分研磨压片, 用傅里叶变换红外光谱仪(岛津傅里叶变换红外光谱仪, IRPrestige-21)测定其表面官能团。
1.6 磁修饰酵母细胞对重金属的吸附试验
将磁修饰酵母菌悬液离心弃上清液后, 于 1.5 mL 离心管中用 700 μL 重金属测试液将菌体重悬, 使得溶液中磁修饰细胞浓度为 3 mg 干重/mL。置于恒温摇床上振荡吸附 2 小时, 然后离心分离(10000 r/min, 5 分钟), 收集上清液, 稀释后使用ICP-OES (Teledyne Leeman Labs, Prodigy XP)测定样品重金属浓度。每个试验均设置3个平行样。
在初始浓度影响试验中, Ag+初始浓度设定为10, 20, 30, 40, 50, 60, 80 mg/L, pH = 5, 摇床温度=30℃。在温度影响试验中, 摇床温度设置为20, 30, 40和50℃, Ag+溶液浓度为50 mg/L, pH=5。在pH值影响试验中, pH值设定为2, 3, 4, 5, 6, 7和8, Ag+溶液浓度为50 mg/L,= 30℃。在多金属竞争吸附试验中, 所有重金属浓度为1 mmol/L, pH=5,=30℃。
吸附时间对吸附效率影响试验方法: 向 100 mL锥形瓶中加入150 mg (干重)磁修饰细胞菌体和50 mL Ag+溶液(50 mg/L, pH = 5), 使得溶液中磁修饰细胞浓度为 3 mg 干重/mL; 置于摇床中振荡吸附, 220 r/min,= 30℃; 取样时间点设定为= 5, 8, 18, 30, 40, 55, 80和120分钟。
2 结果与分析
2.1 磁修饰细胞的磁响应
如图 1 所示, 经磁修饰后, 细胞在磁场的作用下达到良好的固液分离状态, 表明已成功地负载上磁性。从图 1(a)可以看出, 经磁性Fe3O4修饰后, 原本呈乳白色的酵母菌悬液变为棕褐色。这是因为PAH包裹的磁性Fe3O4为黑色, 表面带正电荷, 而细胞表面带负电荷[11], 二者混合后, 由于表面电荷相异, 相互吸引, 粒径较小的磁性纳米颗粒包裹在细胞外面, 与细胞相结合, 从而使细胞外观颜色发生改变, 同时成功地负载上磁性。故在磁场的作用下, 磁修饰酵母可以迅速被磁铁吸引, 1分钟内可达到图 1(b)右侧的固液分离状态, 而未经修饰的酵母细胞则保持原样。当撤去外界磁铁后, 经手动振荡即可快速恢复到图 1(a)右侧的状态, 再次均匀地分散在液体中。从工业应用的角度而言, 磁修饰细胞在废水中快速分离能力可以大大缩短菌体沉降时间, 提高工作效率, 而快速重新分散能力有助于吸附剂的再生利用。
2.2 傅里叶变换红外光谱
傅里叶变换红外光谱可对材料的官能团进行表征。通过对比磁性修饰前后酵母细胞官能团的变化, 可初步判断磁性材料Fe3O4在细胞表面的沉积是否会覆盖或改变细胞表面原有的官能团, 从而影响细胞的吸附性能。
图 2 为磁修饰前工程酵母细胞、磁修饰后酵母细胞和磁性Fe3O4的红外吸收波谱。对比发现, 经过磁性修饰后酵母细胞的红外吸收峰与修饰前酵母细胞保持一致。查询吸收谱[21]以及文献[22]可知, 其对应的基团: 2925±5 cm-1为烷烃CH2反对称伸缩振动频率, 仲酰胺羰基 C=O 伸缩振动频率在1650 cm-1左右, 1541~1543 cm-1为仲酰胺NH面内弯曲振动频率, 1043~1047 cm-1为酯类 C—O—C对称伸缩和P—O—C的反对称伸缩振动频率。
不同化合物中的羟基OH伸缩振动频率有所不同, 比如, 糖类 C—OH 的 OH 伸缩振动频率为3570~3050 cm–1, 羧酸二聚体的OH伸缩振动频率为3400~2200 cm–1等。3304~3447 cm–1均位于羟基OH伸缩振动频率内, 从图 2 可以看出, 与修饰前的细胞和磁性材料相比, 磁修饰后细胞的OH伸缩振动频率带较宽, 表明磁修饰细胞综合了磁性材料和细胞的化合物基团。磁性材料在584 cm–1附近的吸收峰为 Fe—O 化学键振动吸收的结果, 表明磁性材料的成功合成。磁修饰细胞在频率为581 cm–1处也有吸收峰, 验证了它的磁响应能力。532 cm–1位于指纹区附近, 成分复杂, 这里不做分析。
此外, 酵母细胞在 1236 cm–1处有吸收峰, 为仲酰胺的 C—N 伸缩振动峰, 可能有 P=O 伸缩振动或 C—O—C 反对称伸缩贡献。磁修饰细胞在该振动峰的吸收带发生了位移, 从 1236 cm–1变化为1225 cm–1, 表明细胞的磁修饰过程可能不仅是静电作用的结果, 还存在部分基团参与的络合反应。
综上所述, 磁性材料在细胞表面的负载没有破坏细胞原有基团, 磁修饰细胞较好地保留了工程酵母细胞和磁性材料的官能团。
2.3 初始浓度对吸附效率的影响
初始浓度对吸附效率的影响见图 3。随着溶液初始浓度的增加, 吸附量也逐渐增加, 溶液中Ag+的去除率则逐渐减少。这是由于溶液中吸附剂的量是一定的, 为 Ag+提供的吸附位点也是一定的, 当重金属浓度初始浓度较低时, 几乎所有的 Ag+均可与吸附位点结合, 达到较高的去除率。例如, 当初始浓度为10 mg/L时, 去除率高达98%, 但吸附量只有3.267 mg/g。随着重金属离子浓度增大, 传质推动力也增大, 吸附平衡时吸附剂单位吸附量会随之增加[13,23]。此外, 由于溶液中流动的Ag+增加, 增加了金属离子与吸附位点的接触机会, 因而提高吸附量[13]。当初始浓度从 40 mg/L变化为 50 mg/L时, 去除率从 86%降至 75%, 吸附量从 11.49 mg/g增至 12.47 mg/g, 开始趋向饱和。继续增大溶液初始浓度对吸附量的影响不大, 却大大降低去除率。因此, 综合考虑吸附剂的利用效率和废水的处理效果, 初始浓度为50 mg/L时可以得到最优化结果, 选取该初始浓度进行后面的吸附研究。
2.4 吸附时间对吸附效率的影响
吸附平衡时间是考察吸附剂在废水处理中应用经济性的一个因素[16]。如图 4 所示, 随着吸附时间的推移, 磁修饰细胞吸附量迅速增加。前 10 分钟的吸附速率最大; 在 5 分钟内, 重金属去除率约达到 50%; 第 8 分钟时, 去除率增长至66%, 吸附量约为 11.00 mg/g; 之后吸附速率开始减慢, 在第 18分钟时, 磁修饰细胞的吸附量开始趋向饱和, 为12.17 mg/g; 后 100 分钟吸附时间内, 吸附效率变化不大。
初始阶段的高吸附速率是因为溶液中金属离子浓度高, 传质推动力大, 且吸附剂表面提供的可吸附位点多, 有利于吸附。随着吸附的进行, 吸附剂剩余的吸附位点减少, 溶液中金属浓度降低, 已占据吸附位点的 Ag+与将要与空位点结合的 Ag+还存在斥力作用, 增大了结合难度, 故吸附速率减 缓[13]。这个结果与诸多文献报道的酿酒酵母快速吸附特征[6,24–25]一致。快速高效吸附过程还表明大多数的重金属吸附发生在吸附剂的表面, 磁修饰细胞的大部分吸附位点也存在于表面[16]。
通常使用准一级、准二级反应动力学方程对吸附实验数据进行拟合[26–27]。从表 1 的结果可以看出, 磁修饰细胞对Ag+的吸附过程更符合准一级动力学模型, 决定系数为 0.9578, 模型计算所得的平衡吸附量为12.26 mg/g (标准差为 0.1237 mg/g), 更接近实验平衡吸附量12.30 mg/g。准二级动力学模型的决定系数为 0.8217, 计算平衡吸附量为12.83 mg/g (标准差为0.3387 mg/g), 拟合度没有准一级方程高。Das 等[28]使用8种不同动力学模型对大型真菌吸附Ag+的过程进行拟合, 发现准一级动力学模型的拟合度最高。
2.5 温度对吸附效率的影响
从图 5 可以看出, 在20~50℃内, 温度对吸附效率的影响不大, 4个温度下, 吸附量的波动值仅为0.3 mg/g, 去除率波动范围为 2%。磁修饰酵母对Ag+的吸附量受温度影响小, 属非依赖温度的生物吸附过程, 即吸附 Ag+所需吸附活化能低[6]。Wang等[29]认为, 这在一定程度上表明, 由于离子交换机制受温度的影响小, 离子交换机制存在于生物吸附过程中。Chen 等[30]通过酿酒酵母吸附Ag+前后的表面特征分析证明了这一推断。磁修饰细胞的温度应用范围广, 适用性强, 可用于处理不同温度的重金属废水, 具备实用性。相比较而言, 20~30℃为磁修饰细胞最适宜反应温度, 吸附量在12.65 mg/g左右, 去除率约为76%。
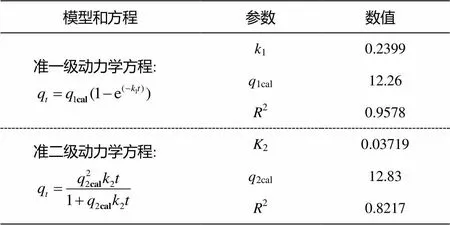
表1 吸附动力学方程及参数
说明:q为(min) 时刻的Ag+吸附量(mg/g),1cal和2cal分别为准一级和准二级动力学模型计算平衡吸附量(mg/g),1(1/min)和2(g/(mg·min))分别为准一级和准二级反应速率常数。
2.6 pH对吸附效率的影响
pH值是影响生物吸附重金属的一个重要因素。从图 6 可见, 随着 pH 值的增大, 磁修饰酵母细胞对 Ag+的吸附效率也逐渐增大, 当 pH=7 时, 吸附效率达到最大, 吸附量为 13.12 mg/g, 去除率约 79%。随着 pH 值的继续增大, 当 pH=8 时, 吸附效率有所下降。溶液 pH 值较低时, 磁修饰酵母的吸附性能较差, 当 pH=2 时, 吸附量为 7.130 mg/g, 去除率为 41%, 仅为最优 pH 值下吸附效率的一半。这是因为在强酸性条件下, 溶液中水合氢离子[H3O+]浓度较高, [H3O+]与 Ag+竞争细胞表面结合位点, 从而降低了溶液中 Ag+的吸附效率[29]。此外, pH值还会影响细胞表面蛋白电荷。在酸性条件下, 表面基团(如羟基和羧基等)会被质子化带正 电[31], 影响表面展示蛋白与 Ag+之间的静电作用, 削弱吸附位点与 Ag+的结合能力[12]。实验结果表明, 中性条件更适合磁修饰酵母细胞对 Ag+的吸附, 磁修饰酵母的最佳吸附pH值为7。
2.7 吸附等温线
采用 Langmuir 和 Freundlich 等温吸附模型拟合磁修饰细胞对 Ag+的吸附过程, 结果见图 7 和表 2。可看出, Langmuir 模型的拟合效果更佳, 决定系数2=0.9825, 理论最大吸附量13.09 mg/g, 试验最大吸附量为12.81 mg/g, 两者接近。Freundlich模型是一个经验方程, 决定系数2= 0.8359, 经验常数为 5.265。一般认为, 1/越小, 吸附性能越好。当 1/在 0.1~0.5 之间时, 易于吸附; 当 1/大于 2 时, 则难以吸附[31]。本实验的 1/值约为0.2, 说明磁修饰细胞容易吸附银离子。
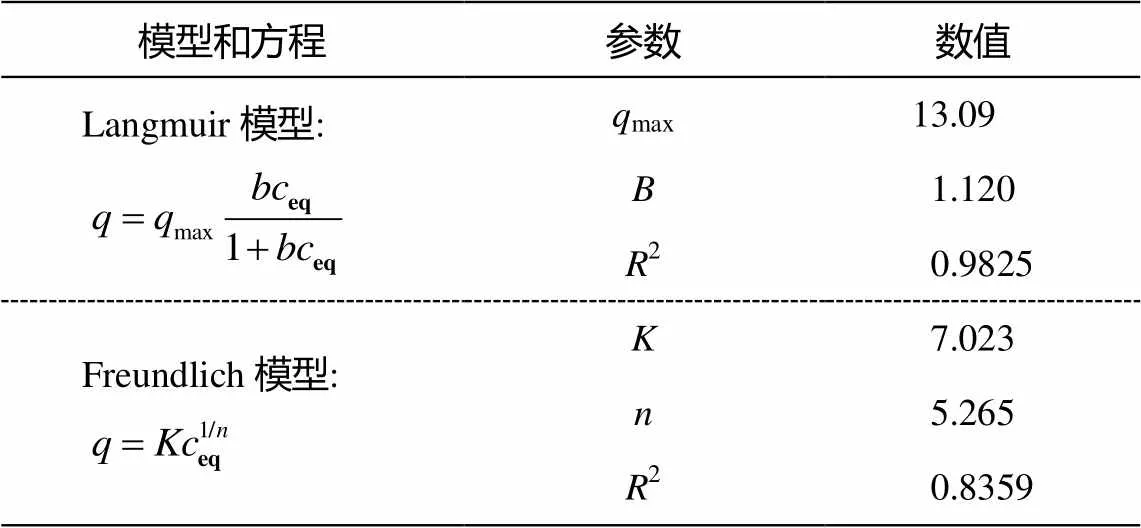
表2 吸附等温线模型方程及参数
说明:为 Ag+的平衡吸附量(mg/g),eq为 Ag+的平衡浓度(mg/L),max为理论最大吸附量(mg/g),为 Langmuir 平衡常数(L/mg),和为Freundlich经验常数。
2.8 多金属竞争吸附实验
实际废水中含多种金属, 吸附剂在其他金属离子共存的情况下, 对银离子的吸附能力值得探究。本研究中使用的酵母菌为经基因工程改造后的酿酒酵母, 表面展示 CueR 蛋白对银离子具有选择吸附性。如图 8 所示, 在多金属条件下, 工程酵母对银离子的吸附量最大, 达0.1323 mmol/g, 显著高于其余 4 种金属的吸附量, 优先顺序依次为 Ag+> Cu2+> Zn2+> Co2+> Ni2+。经过磁性材料修饰后, 酵母的选择吸附性并没有改变, 虽然对 Ag+的吸附量稍有下降, 但仍是最高。可能是因为磁性材料覆盖了工程酵母表面展示蛋白的某些特异性吸附位点, 导致对银离子的吸附特异性下降。这也从侧面验证了工程酵母细胞对银离子的吸附特异性, 且经磁修饰后的细胞仍保留这一特性。此外, 细胞表面修饰的磁性材料 Fe3O4纳米颗粒比表面积大, 孔隙多, 也是一种优良的吸附剂。磁性材料提供的非特异性结合位点, 增加了其余金属与吸附剂的结合机会, 故经磁修饰后, Zn2+, Co2+和 Ni2+的吸附量增大。
总体而言, 磁修饰细胞对 Ag+仍具选择吸附性, 吸附量为 Ni2+的 10.6 倍, Zn2+的 9.0 倍, Co2+的 7.5倍, Cu2+的 3.0 倍。磁修饰酵母的这一特性使其可在多金属条件下对银离子进行选择性的富集回收, 有利于下一步的资源再生利用, 具备实用价值。
3 结论
1) 磁修饰酵母的磁响应性能优良, 在磁场中固液分离迅速。傅里叶变换红外光谱图表明磁修饰后细胞很好地保留了磁性材料和工程酵母的官能团。
2) 在 Ag+初始浓度为 50 mg/L,磁修饰细胞浓度为3 mg 干重/mL条件下, 磁修饰细胞对Ag+的吸附速率很快, 18 分钟内达到吸附平衡; 温度对吸附效率影响不大, 最适宜反应温度为20~30℃; 吸附效率随pH值增大而增加, 最佳吸附pH值为7。
3) Langmuir等温吸附模型和准一级动力学模型对磁修饰细胞吸附Ag+实验结果拟合良好。
4) 多金属竞争吸附实验表明, 磁修饰后的工程酵母仍保留对 Ag+的选择吸附性。磁修饰细胞对Ag+的吸附量为 Ni2+的 10.6 倍, Zn2+的 9.0 倍, Co2+的7.5倍, Cu2+的3.0倍。
参考文献
[1]Purcell T W, Peters J J. Sources of silver in the environment. Environmental Toxicology and Chemi-stry, 1998, 17(4): 539–546
[2]Ratte H T. Bioaccumulation and toxicity of silver compounds: a review. Environmental Toxicology and Chemistry, 1999, 18(1): 89–108
[3]Barakat M A. New trends in removing heavy metals from industrial wastewater. Arabian Journal of Che-mistry, 2011, 4(4): 361–377
[4]Fu F, Wang Q. Removal of heavy metal ions from wastewaters: a review. Journal of Environmental Management, 2011, 92(3): 407–418
[5]王建龙, 陈灿. 生物吸附法去除重金属离子的研究进展. 环境科学学报, 2010, 30(4): 673–701
[6]陈灿, 王建龙. 酿酒酵母对 Ag+的吸附特性研究. 环境科学, 2008, 29(11): 3200–3205
[7]马前, 张晓龙. 国内外重金属废水处理新技术的研究进展. 环境工程学报, 2007, 1(7): 10–14
[8]Li P S, Tao H C. Cell surface engineering of microorganisms towards adsorption of heavy metals. Critical Reviews in Immunology, 2013: doi: 10.3109/ 1040841X.2013.813898
[9]Kuroda K, Ueda M. Molecular design of the microbial cell surface toward the recovery of metal ions. Current Opinion in Biotechnology, 2011, 22(3): 427–433
[10]马伟. 固水界面化学与吸附技术. 北京: 冶金工业出版社, 2011: 261–262, 241
[11]Fakhrullin R F, García-Alonso J, Paunov V N. A direct technique for preparation of magnetically functionalised living yeast cells. Soft Matter, 2010, 6(2): 391–397
[12]Uzun L, Sağlam N, Safarikova M, et al. Copper biosorption on magnetically modified yeast cells under magnetic field. Separation Science and Tech-nology, 2011, 46(6): 1045–1051
[13]Bai J, Wu X, Fan F, et al. Biosorption of uranium by magnetically modified. Enzyme and Microbial Technology, 2012, 51(6/7): 382–387
[14]Yavuz H, Denizli A, Güngüneş H, et al. Biosorption of mercury on magnetically modified yeast cells. Separation and Purification Technology, 2006, 52(2): 253–260
[15]Zhang Y S, Zhu J Y, Zhang L, et al. Synthesis of EDTAD-modified magnetic baker’s yeast biomass for Pb2+and Cd2+adsorption. Desalination, 2011, 278: 42–49
[16]Xu M, Zhang Y S, Zhang Z M, et al. Study on the adsorption of Ca2+, Cd2+and Pb2+by magnetic Fe3O4yeast treated with EDTA dianhydride. Chemical Engineering Journal, 2011, 168(2): 737–745
[17]Wong P K, Fung K Y. Removal and recovery of nickel ion (Ni2+) from aqueous solution by magnetite-immobilized cells ofsp. 4-2. Enzyme and Microbial Technology, 1997, 20: 116–121
[18]Safarik I, Rego L F T, Borovska M, et al. New magnetically responsive yeast-based biosorbent for the efficient removal of water-soluble dyes. Enzyme and Microbial Technology, 2007, 40(6): 1551–1556
[19]Safarikova M, Ptackova L, Kibrikova I, et al. Biosorption of water-soluble dyes on magnetically modifiedsubsp.cells. Chemosphere, 2005, 59(6): 831–835
[20]Massart R. Preparation of aqueous magnetic liquids in alkaline and acidic media. IEEE Transactions on Magnetics, 1981, 17(2): 1247–1248
[21]翁诗甫. 傅里叶变换红外光谱分析. 2 版. 北京: 化学工业出版社, 2010: 377–388
[22]陈灿, 王建龙. 酿酒酵母与Ag+的相互作用机制研究. 环境科学, 2008, 29(12): 3561–3567
[23]Gok C, Aytas S. Biosorption of uranium (Ⅵ) from aqueous solution using calcium alginate beads. Jour-nal of Hazardous Materials, 2009, 168(1): 369–375
[24]Volesky B, May-Phillips H A. Biosorption of heavy metals by. Applied Micro-biology and Biotechnology, 1995, 42: 797–806
[25]Brady D, Duncan J R. Bioaccumulation of metal-cations by. Applied Micro-biology and Biotechnology, 1994, 41: 149–154
[26]Ho Y S. Second-order kinetic model for the sorption of cadmium onto tree fern: a comparison of linear and non-linear methods. Water Research, 2006, 40(1): 119–125
[27]Kumar K V, Sivanesan S. Selection of optimum sorption kinetics: comparison of linear and non-linear method. Journal of Hazardous Materials, 2006, 134: 277–279
[28]Das D, Das N, Mathew L. Kinetics, equilibrium and thermodynamic studies on biosorption of Ag(Ⅰ) from aqueous solution by macrofungus. Journal of Hazardous Materials, 2010, 184: 765–774
[29]Wang J, Chen C. Biosorption of heavy metals by: a review. Biotechnology Advances, 2006, 24: 427–451
[30]Chen C, Wen D H, Wang J L. Cellular surface characteristics ofbefore and after Ag(Ⅰ) biosorption. Bioresource Techno-logy, 2014, 156: 380–383
[31]刘伟, 杨琦, 李博. 磁性石墨烯吸附水中Cr(Ⅵ)研究. 环境科学, 2015, 36(2): 537–544
Biosorption of Silver by Magnetically Modified Surface-EngineeredCells
TAO Huchun†, CUI Xiaobing, LI Jinbo, SHI Gang
Shenzhen Key Laboratory for Heavy Metal Pollution Control and Reutilization, School of Environment and Energy, Peking University Shenzhen Graduate School, Shenzhen 518055; † E-mail: taohc@pkusz.edu.cn
Surface-engineered yeast () cells were magnetically modified using water based magnetic nanoparticles to prepare a new type of magnetically responsive adsorbent. Infrared spectroscopy analysis revealed that magnetically modified cells remained the functional groups of engineered yeast and magnetic materials. The kinetic and adsorption isotherm law and factors influencing adsorption (such as time, temperature and pH) were analyzed. The results showed that adsorption equilibrium was achieved within 18 min. The optimal condition for the Ag+adsorption was 20~30℃, pH 7.0. The pseudo-first-order kinetic model and Langmuir model fitted the adsorption data well. The results of multi-metal competitive adsorption indicated that magnetically modified cells still showed adsorption selectivity for Ag+than other heavy metal ions. The adsorption amount of Ag+was 10.6 times that of Ni2+, 9.0 times that of Zn2+, 7.5 times that of Co2+, 3.0 times that of Cu2+.
magnetic modification; surface-engineered yeast; silver; selective adsorption; magnetic separation
10.13209/j.0479-8023.2016.105
X703
2015-05-12;
2015-07-06;
网络出版日期: 2016-11-05
深圳市基础研究项目(JCYJ20130329174424934)和深圳市重点实验室项目(CXB201111240110A)资助
