利用TALEN技术建立恒河猴TRIM5α基因突变细胞株
2016-12-12王小莉余庆袁雅红腾智平李东升曾毅
王小莉余庆袁雅红腾智平李东升曾毅
(1. 北京工业大学生命科学与生物工程学院,北京 100124;2. 湖北医药学院附属太和医院生命科学研究所,十堰 442000;3. 中国预防医学科学院病毒所,北京 100052)
利用TALEN技术建立恒河猴TRIM5α基因突变细胞株
王小莉1,2余庆2袁雅红1,2腾智平3李东升2曾毅1
(1. 北京工业大学生命科学与生物工程学院,北京 100124;2. 湖北医药学院附属太和医院生命科学研究所,十堰 442000;3. 中国预防医学科学院病毒所,北京 100052)
利用TALEN技术建立恒河猴TRIM5α基因突变细胞株,为进一步研究TRIM5α基因的功能奠定基础。构建针对TRIM5α打靶基因的TALEN,通过点突变的方法获得包含TRIM5α第7个外显子中打靶位点1 211-1 224的基因序列并构建点突变donor载体。将打靶TRIM5α基因的TALEN质粒和donor质粒电转入恒河猴肾细胞(LLC-MK2)中,无限稀释法获得单克隆细胞系,通过抽提基因组DNA,再利用PCR技术扩增目标序列并测序筛选出TRIM5α碱基缺失(1 215-1 216)和点突变(1 213-1 215,1 217)的细胞系。通过共转TALEN质粒和点突变的donor质粒筛选获得了TRIM5α基因敲除和TRIM5α基因点突变的LLC-MK2细胞系。
TRIM5α;TALEN;恒河猴;点突变
艾滋病,即获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS),由人免疫缺陷病毒(human immunodeficiency virus,HIV)引起,并以全身免疫系统损害严重为特征的传染性疾病。目前全世界每天约有 1.5万 HIV 新发感染者,艾滋病已成为 21 世纪人类面临的最严峻的考验之一。艾
滋病的有效治疗需要疫苗和药物的研发,而目前艾滋病疫苗和药物研发的一个瓶颈就是没有合适的动物模型[1-4]。与人类最相近的非人灵长类动物是研究艾滋病的理想动物模型,但HIV病毒不能有效在非人灵长类动物体内复制,其最主要原因就是非人灵长类动物存在天然的抗逆转录病毒的固有免疫限制因子[5-7]。这些固有免疫分子在不同种属宿主中的进化,限制了HIV-1以及其他逆转录病毒的跨种间传播。正是这些固有免疫因子的异源分化性阻碍了HIV-1感染动物模型的建立。TRIM5α是目前发现的最主要的限制性因子之一,也是HIV进入感染细胞最先遇到的限制性因子,它可以结合感染的逆转录病毒的衣壳,并将其灭活[8,9]。因此如何改造猴子的TRIM5α基因使其失去抵御HIV感染的能力成为建立非人灵长类动物HIV模型的关键。本研究将利用TALEN技术建立恒河猴TRIM5α基因点突变的细胞株,旨为进一步研究TRIM5α基因突变对HIV病毒感染能力的影响及建立恒河猴HIV感染动物模型奠定基础。
1 材料与方法
1.1 材料
DNA ladder(碧云天生物技术公司);100 bp DNA marker、基因组提取试剂盒、点突变试剂盒、小量质粒提取试剂盒、PCR mix(天根生化技术有限公司);T4 DNA Ligase、BamH I酶、Pst I酶(NEB公司);Opti-MEM、DMEM、胎牛血清(Gibco公司);TALEN试剂盒(斯丹塞生物技术有限公司)。
1.2 方法
1.2.1 细胞培养 恒河猴胚肾细胞系LLC-MK2细胞加入含10%胎牛血清的DMEM培养基,37℃,5% CO2培养箱中培养。隔天换液,保持细胞生长状态良好。
1.2.2 TALEN质粒的构建及鉴定 根据TRIM5α基因序列设计打靶位点,根据TALEN试剂盒说明书构建TRIM5α TALEN左右臂质粒。PCR、酶切筛选鉴定阳性菌落。PCR筛选正向引物为:5'-CTCCCCTTCAGCTGGACAC-3',反向引物为:5'-AGCTGGGCCACGATTGAC-3'。PCR反应条件为:95℃ 5 min;95℃ 10 s,56℃ 30 s,72℃ 2 min,30个循环;72℃延长10 min。PCR筛选的阳性菌落提质粒BamH I和Pst I双酶切鉴定。鉴定正确的质粒送上海生工生物工程有限公司测序。
1.2.3 点突变donor序列的获得 收集LLCMK2细胞按基因组提取试剂盒的说明书提取基因组,PCR的方法获得donor序列连入T载体并筛选出阳性克隆提取质粒,PCR正向引物为:5'-TATCCCCTAACTGACCTGT-3',反向引物为:5'-GGAGAATATGGCACAAGA-3'。PCR反应条件为:95℃ 5 min;95℃ 10 s,56℃ 30 s,72℃ 1 min,30个循环;72℃延长10 min。按点突变试剂盒说明书步骤操作,选取单克隆测序并筛选出成功点突变的donor克隆。
1.2.4 TALEN质粒打靶细胞 将8 μg TRIM5α TALEN质粒(左右臂质粒各4 μg)、2 μg点突变的Donor PCR回收产物与90 μL含1×106LLC-MK2细胞的Opti-MEM混合,150 V电击5 s后将细胞转移至六孔板中37℃培养。
1.2.5 T7E1酶切 根据TRIM5α打靶位点两端的序列设计PCR上游引物:5'-GACACTGGCTCCAAACA -3',下游引物:5'-TCTACGAAAACTCCAACAC-3'。PCR反应条件为:95℃ 5 min;95℃ 10 s,56℃ 30 s,72℃ 1 min,30个循环;72℃延长10 min。PCR产物37℃ T7E1酶切30 min后琼脂糖凝胶电泳。检测打靶效率时打靶细胞基因组PCR产物直接T7E1酶切,挑选阳性克隆时野生型与打靶细胞PCR产物经变性退火后再T7E1酶切。
1.2.6 挑细胞单克隆测序 打靶后的细胞采用无限稀释法,接种到96孔板,置于37℃,5% CO2培养箱中培养。10 d后在显微镜下观察标记单克隆细胞,细胞长满后传入24孔板继续培养,提取基因组PCR扩增T7E1酶切鉴定,阳性克隆目的片段PCR产物连入T载体并测序。
2 结果
2.1 打靶TRIM5α基因TALEN质粒的构建及鉴定
研究表明,恒河猴TRIM5α基因序列中可与小的泛素化相关的修饰蛋白相互作用的位点(SIM)与HIV病毒感染的限制性有关,本研究设计的TALEN打靶位点主要是针对TRIM5α基因的SIM位
点。根据NCBI中恒河猴TRIM5α的基因组序列和对TRIM5α基因的分析,按TALEN试剂盒设计原则,设计的TALEN打靶左右臂的序列如图1-A所示。菌落PCR筛选阳性菌落,阳性菌落的PCR产物大小约为1 700 bp,如图1-B所示,左右臂各挑3个克隆,筛选出左臂两个阳性克隆右臂一个阳性克隆。阳性菌落扩大培养提质粒BamH I和Pst I双酶切鉴定,酶切后产物的大小与理论大小相符(图1-C)。质粒进一步的送测序公司测序,测序的结果通过比对完全正确。以上结果表明,成功构建了打靶恒河猴TRIM5α的TALEN左右臂质粒。

图1 打靶TRIM5α基因的TALEN设计及质粒的构建鉴定
2.2 恒河猴Trim5 alpha点突变donor的构建及鉴定
本研究通过PCR扩增获得了针对打靶恒河猴TRIM5α基因序列中SIM位点两端的donor序列,结果如图2-A所示。通过点突变试剂盒将donor序列中SIM位点的基因序列进行点突变,菌落PCR筛选阳性克隆,结果如图2-B所示。选取菌落PCR鉴定正确的菌落扩增培养提质粒测序鉴定,SIM位点的序列成功点突变,测序结果如图2-C所示。以上结果表明,成功获得了恒河猴TRIM5α点突变的donor序列。
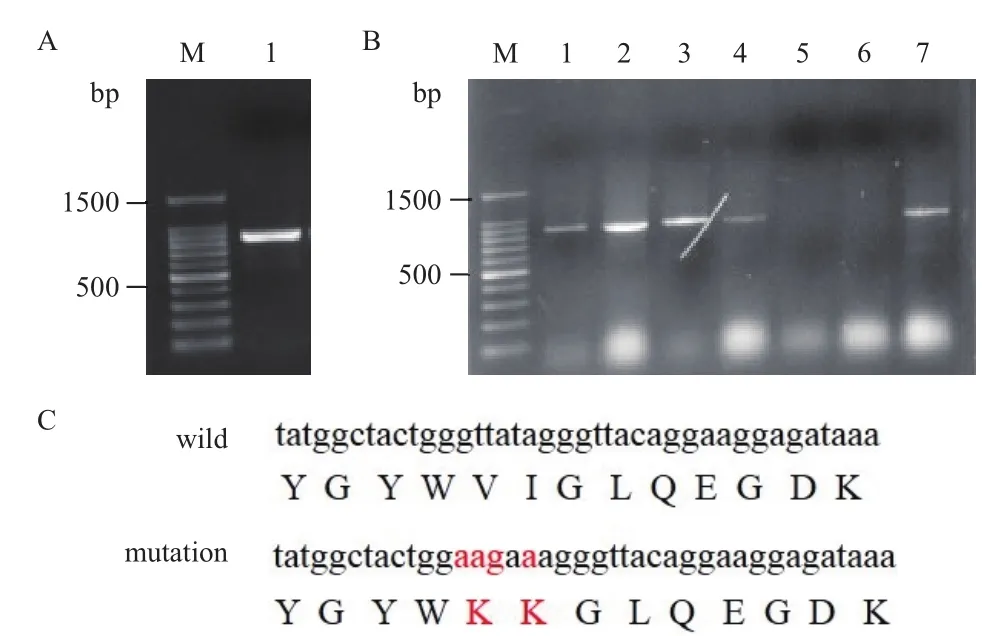
图2 恒河猴TRIM5α点突变donor的构建及鉴定
2.3 T7E1酶切检测TALEN打靶效率
将构建鉴定正确的打靶恒河猴TRIM5α的TALEN左右臂质粒电转到LLC-MK2细胞中,TALEN右臂质粒可表达GFP,电转24 h后荧光显微镜观察质粒的转染情况,70%左右的细胞均为GFP阳性,结果如图3-A所示。转入打靶恒河猴TRIM5α的TALEN质粒的细胞和野生型的细胞提取基因组,PCR扩增含打靶位点的序列,产物经T7E1酶切,琼脂糖凝胶电泳检测结果(图3-B)显示,理论打靶酶切后得到的产物大小为150 bp和450 bp左右的两条带,电泳结果与理论相符,经灰度分析打靶效率约为50%。以上结果表明构建的打靶恒河猴TRIM5α的TALEN质粒可成功打靶TRIM5α基因。

图3 TALEN打靶恒河猴TRIM5α基因
2.4 筛选TRIM5α基因突变的细胞克隆
将打靶恒河猴TRIM5α的TALEN左右臂质粒和突变donor序列的PCR产物通过电转的方法导入LLC-MK2细胞中,无限稀释法获得单克隆细胞。提取基因组后PCR的产物与野生型PCR产物混合变性退火T7E1酶切,单克隆T7E1酶切的结果如图4-A所示。共挑取了12个单克隆,其中6个为打靶的单克隆。将打靶的单克隆细胞基因组PCR产物连入T载体,每个单克隆细胞挑取10个进行测序,经分析测序结果(图4-B)显示,成功筛选出打靶位点附近基因组缺失和点突变的细胞克隆。

图4 TRIM5α基因突变细胞克隆的筛选
3 讨论
TRIM5α是三基序蛋白大家族的一个成员,包含4个主要的结构域,即 RING 结构域、B-box 结构
域、coiled-coil 结构域和PRYSPRY。它是一种环状域E3泛素化连接酶,可以在1型人类免疫缺陷性病毒(HIV-1)和其它逆转录病毒入侵细胞浆时,迅速阻止病毒对细胞的感染[10]。PRYSPRY 的 C 末端是决定灵长类动物限制反转录病毒的种属特异性的区域[11,12]。小的泛素化相关的修饰蛋白(SUMO)可与细胞中的蛋白发生相互作用从而调节细胞,这种相互作用是由SUMO interacting motifs(SIMs)介导的。近来的研究表明,SIMs在TRIM5α基因的不同物种之间相对保守且决定了细胞能否感染某种病毒,将恒河猴TRIM5α基因的SIMs位点突变转入人的细胞中发现其失去了抗病毒活性[13,14]。将猴子的TRIM5α基因组中的SIMs位点进行改造能否使猴子感染HIV,目前尚无这方面的研究报道。
TALE核酸酶(TALENs)是一类能够与靶位点特异性人工DNA结合域结合,形成特异性DNA损伤的人工酶。随着基因打靶技术的快速发展,TALENs已经成为多种生物靶基因中断的重要工具[15]。本研究根据文献报道的TRIM5α基因组中的SIMs位点对病毒的限制性作用,设计了针对此位点的TALEN打靶质粒,实验结果表明构建的TALEN质粒正确,可通过电转高效转入恒河猴细胞中,成功打靶TRIM5α基因。由于TRIM5α基因的功能除了具有限制HIV病毒感染的作用之外,还具有免疫调节方面的功能[16,17],因此如何改造TRIM5α基因使其失去对HIV病毒的感染能力同时又不破坏基因其
他方面的功能是建立非人灵长类动物HIV感染动物模型的关键。本研究通过对SIMs位点进行点突变获得了点突变的donor序列,将打靶恒河猴TRIM5α的TALEN左右臂质粒和突变donor序列共转染恒河猴细胞,挑单克隆细胞测序最终筛选出TRIM5α基因SIMs位点附近基因组缺失和点突变的细胞克隆。本研究利用TALEN技术成功建立了恒河猴TRIM5α基因组缺失和点突变的细胞株,为进一步研究TRIM5α基因对HIV病毒感染能力的影响及建立恒河猴HIV感染动物模型奠定基础。
4 结论
本研究利用TALEN打靶技术成功建立了恒河猴TRIM5α基因缺失和点突变的细胞克隆。
[1]Richman DD, Margolis DM, Delaney M, et al. The challenge of finding a cure for HIV infection[J]. Science, 2009, 323(5919):1304-1307.
[2]Excler JL, Robb ML, Kim JH. Prospects for a gGlobally effective HIV-1 vaccine[J]. Am J Prev Med, 2015, 49(6 Suppl 4):S307-318.
[3]Smaglik P. AIDS vaccine researchers turn from chimps to monkeys[J]. The Scientist, 1999, 13(16):7-9.
[4]Antony JM, MacDonald KS. A critical analysis of the cynomolgus macaque, Macaca fascicularis, as a model to test HIV-1/SIVvaccine efficacy[J]. Vaccine, 2015, 33(27):3073-3083.
[5]Friedrich BM, Dziuba N, Li G, et al. Host factors mediating HIV-1 replication[J]. Virus Res, 2011, 161(2):101-114.
[6]Malim MH, Bieniasz PD. HIV restriction factors and mechanisms of evasion[J]. Cold Spring Harb Perspect Med, 2012, 2(5):a006940.
[7]Sauter D. Counteraction of the multifunctional restriction factor tetherin[J]. Front Microbiol, 2014, 5:163.
[8]Newman RM, Hall L, Connole M, et al. Balancing selection and the evolution of functional polymorphism in Old World monkey TRIM5alpha[J]. Proc Natl Acad Sci USA, 2006, 103(50):19134-19139.
[9] Puvvada MP, Patel SS. Role of trim5α in the suppression of crossspecies transmission and its defence against human immunodeficiency virus[J]. Curr HIV Res, 2013, 11(8):601-609.
[10] Sakuma R, Mael AA, Ikeda Y. Alpha interferon enhances TRIM5-alpha-mediated antiviral activities in human and rhesus monkey cells[J]. J Virol, 2007, 81(18):10201-10206.
[11] Sastri J, Johnsen L, Smolin N, et al. Restriction of HIV-1 by rhesus TRIM5α is governed by alpha helices in the Linker2 region[J]. J Virol, 2014, 88(16):8911-8923.
[12] Li X, Kim J, Song B, et al. Virus-specific effects of TRIM5α(rh)RING domain functions on restriction of retroviruses[J]. J Virol, 2013, 87(13):7234-7245.
[13]Lukic Z, Goff SP, Campbell EM, et al. Role of SUMO-1 and SUMO interaction motifs in rhesus TRIM5α-mediated restriction[J]. Retrovirology, 2013, 10:10.
[14]Brandariz-Nuñez A, Roa A, Valle-Casuso JC, et al. Contribution of SUMO- interacting motifs and SUMOylation to the antiretroviral properties of TRIM5α[J]. Virology, 2013, 435(2):463-471.
[15]Mussolino C, Alzubi J, Fine EJ, et al. TALENs facilitate targeted genome editing in human cells with high specificity and low cytotoxicity[J]. Nucleic Acids Res, 2014, 42(10):6762-6773.
[16]Lascano J, Uchil PD, Mothes W, et al. TRIM5 retroviral restriction activity correlates with the ability to induce innate immune signaling[J]. J Virol, 2015, 90(1):308-316.
[17]Kimura T, Jain A, Choi SW, et al. TRIM-mediated precision autophagy targets cytoplasmic regulators of innate immunity[J]. J Cell Biol, 2015, 210(6):973-989.
(责任编辑 马鑫)
Establishment of Mutagenesis Cell Line of Macaca mulatta Gene TRIM5α by TALEN
WANG Xiao-li1,2YU Qing2YUAN Ya-hong1,2TENG Zhi-ping3LI Dong-sheng2ZENG Yi1
(1. College of Life Sciences,Beijing University of Technology,Beijing 100124;2. Life Science Institute,Affiliated Taihe Hospital,Hubei University of Medicine,Shiyan 442000;3. Institute of Virology,Chinese Academy of Preventive Medicine,Beijing 100052)
Using transcription activator-like effector nuclease(TALEN)to establish the mutagenesis cell line of Macaca mulatta gene TRIM5α is to lay the foundation for further studying the function of TRIM5α gene. The TALEN plasmids targeting TRIM5α was constructed. The site-directed gene mutagenesis donor vector was obtained by site-directed gene mutagenesis technology and the sequence contained the seventh exon of TRIM5α at the position from 1 211 to 1 224. The TALEN plasmids and donor vector were co-transfected into the M. mulatta’s kidney cell line(LLC-MK2)by electroporation. The single cell line was obtained by the infinite dilution method. By extracting the genomic DNA and amplifying the target sequence by PCR,the cell line with base deletion(1 215-1 216)and site mutations(1 213-1 215,1 217)of TRIM5α was screened. Conclusively,the LLC-MK2 single cell line with knockout and site-directed gene mutagenesis of gene TRIM5α was obtained.
tripartite motif 5 alpha;TALEN;Macaca mulatta;site-directed gene mutagenesis
10.13560/j.cnki.biotech.bull.1985.2016.12.010
2016-04-21
国家科技部重大专项(2013ZX10001004-002-005)
王小莉,女,博士研究生,研究方向:肿瘤病毒学;E-mail:xiaolitina@126.com
曾毅,男,院士,研究方向:肿瘤病毒学;E-mail:zengy@public.bta.net.cn
