荔枝成花期诱导性低温对其叶片光合特性的影响
2016-12-12张红娜苏钻贤陈厚彬
张红娜,苏钻贤,陈厚彬
(1.农业部热带果树生物学重点实验室/中国热带农业科学院南亚热带作物研究所,广东 湛江 524091;2.华南农业大学园艺学院,广东 广州 510642)
荔枝成花期诱导性低温对其叶片光合特性的影响
张红娜1,2,苏钻贤2,陈厚彬2
(1.农业部热带果树生物学重点实验室/中国热带农业科学院南亚热带作物研究所,广东 湛江 524091;2.华南农业大学园艺学院,广东 广州 510642)
以盆栽荔枝苗为试验材料,研究荔枝成花期诱导性低温对其叶片光合特性和叶绿素荧光参数的影响。结果表明,在低温处理下,糯米糍和妃子笑两种荔枝叶片的Pn、Tr和Gs随处理时间的延长呈下降趋势,而Ci则呈上升趋势,说明低温处理下荔枝光合效率的下降可能来源于非气孔因素抑制。低温处理后糯米糍品种的Fo有所增加,Fm和Fv变化不大,Fv/Fm稍有下降;而妃子笑品种的Fo和Fv/Fm无明显变化,Fm和Fv呈下降趋势。两种荔枝的ФPSⅡ均呈下降趋势,品种间差异不显著。说明低温对两个荔枝品种的光化学效率都有一定的影响,是造成其叶片光合速率下降的主要原因。
荔枝;低温;光合特性;叶绿素荧光;成花诱导
荔枝(Litchi chinensis Sonn.)是我国热带亚热带地区广泛栽培的特产果树,具有极高的经济价值。温度是影响荔枝营养生长和生殖生长的主要因素之一,0℃以下时荔枝秋梢出现冻害,0~4℃时营养生长基本停止,8~10℃时生长开始恢复,10~12℃时生长缓慢,13~18℃时生长增快,21℃以上生长良好[1]。冬季低温与荔枝花芽分化密切相关,一般认为10~15℃低温有利于诱导荔枝成花,而20℃是一些荔枝品种成花的边缘温度[2-4]。孙谷畴[5]指出,荔枝叶片光合作用的最适温度是22~26℃,当叶温高于或低于此范围时,光合作用降低。一直以来,有关不同栽培措施(遮荫[6-7]、环剥[8]和间伐回缩[9]等)与荔枝叶片光合作用的关系已有一些研究报道。然而,随着近年来区域性小气候的异常变化,特别是冬季极端低温频繁出现,有必要探索不同荔枝品种对环境温度的响应,特别是荔枝成花期间诱导性低温对荔枝叶片光合特性影响的基础研究。为此,本研究以糯米糍和妃子笑荔枝盆栽苗叶片为研究对象,利用人工气候室给予一定的诱导性低温处理,分析低温处理不同时间对不同品种叶片光合和荧光特性的影响,了解成花诱导期间荔枝叶片对温度的耐受能力,为该属植物的低温光合生理特性研究提供理论基础。
1 材料与方法
1.1 试验材料
试验在华南农业大学人工气候室进行,选用树龄3~4年、植株健壮、长势一致的盆栽糯米糍和妃子笑品种为试材,每个品种各选10株。人工气候室设置两个不同温室,分别为常温室26℃/23℃(非诱导成花的温度)、低温室15℃/10℃(诱导成花的温度),将处于相同枝梢生长状态的两种盆栽荔枝置于常温中,常规管理,待其末次梢叶片完全老熟1周后,将其移入低温室进行低温诱导处理,并于处理后0、7、26 d时随机选取不同方向的健壮枝条,取顶部向下数第2片复叶中的第2片小叶,每株测定6个叶片,对低温室中两个荔枝品种的光合作用指标和叶绿素荧光参数进行测定。
1.2 试验方法
1.2.1 光合作用指标测定 气体交换参数采用美国Li-cor公司生产的Li-6400便携式光合测定系统进行测定,蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)等可同步测得,叶片瞬时水分利用效率(WUE)计算公式为:WUE = Pn/Tr。光合有效辐射(PAR)设为1 200 μmol/m2·s、大气CO2浓度(Ca)设为400 μmol/mol。大气温度(Ta)、叶温(TL)、相对湿度(RH)等参数均采用仪器自控系统控制,随外界环境变化而变化。
1.2.2 叶绿素荧光参数测定 叶绿素荧光参数采用FM S-2便携调制式荧光仪进行活体测定,在自然光下测定初始荧光(Fo)和最大荧光(Fm),再将叶片暗适应20 min后测光合机构全部光系统Ⅱ(PSⅡ)等指标。可变荧光(Fv)和最大光化学效率(Fv/Fm)计算公式为:Fv=Fm-Fo,Fv/Fm=(Fm-Fo)/ Fm。
试验数据采用Microsoft office 2007和SPSS16.0软件进行统计分析。
2 结果与分析
2.1 诱导性低温对荔枝叶片光合特性的影响
从图1可以看出,在诱导性低温处理下,糯米糍和妃子笑荔枝叶片的Pn、Tr和Gs都呈持续下降趋势,且低温处理的时间越长,下降幅度越大。妃子笑和糯米糍两种荔枝在低温处理26 d后其Pn分别降至2.46、2.27 μmol/m2·s,比处理前分别下降了68.5%和50.9%。品种间的Pn和Tr差异不显著(图1),Gs则表现为糯米糍品种稍高于妃子笑(图1C);低温处理后,糯米糍和妃子笑荔枝叶片的Ci变化趋势与Pn等相反,呈逐渐增加趋势,且妃子笑品种的Ci明显高于糯米糍品种(图1D)。
2.2 诱导性低温对荔枝叶片荧光特性的影响
低温处理后糯米糍品种的Fo有所增加,而妃子笑品种的Fo无明显变化(图2A);从图2B、C可以看出,常温时妃子笑品种的Fm和Fv明显高于糯米糍品种,而诱导性低温对糯米糍的Fm和Fv影响不大,但妃子笑的Fm和Fv随着低温处理时间的延长呈下降趋势;在诱
导性低温处理后,妃子笑荔枝叶片的Fv/Fm变幅不大,而糯米糍品种的Fv/Fm稍有下降(图2D)。从图2E可以看出,低温处理后,糯米糍和妃子笑叶片的ФPSⅡ均呈下降趋势。
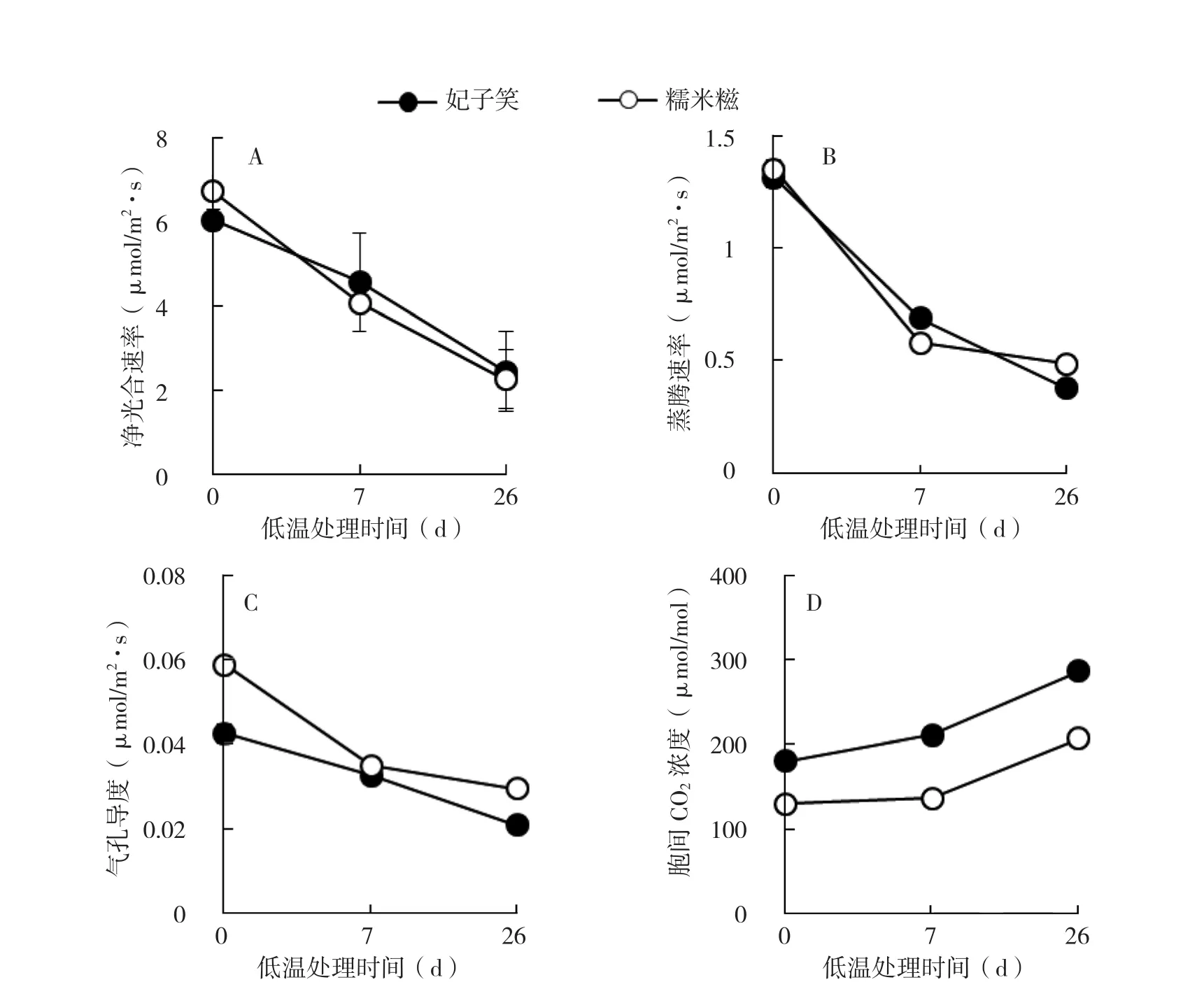
图1 低温处理对两种荔枝叶片光合特性的影响

图2 低温处理对两种荔枝叶片荧光特性的影响
3 结论与讨论
净光合速率是光合系统功能的直接体现,也是判断植株光合系统工作正常与否的指标之一[10]。植物在生长过程中常受外界低温的胁迫,会损伤植物膜系统,导致光合机构不稳定,光合酶活性降低,表现出叶片净光合速率下降的现象[11-12]。Pn下降主要由气孔限制因素和非气孔限制因素两个原因引起。气孔是植物与大气进行H2O和CO2交换的通道,气孔对CO2导度的变化会引起细胞间隙CO2浓度变化,进而影响植物的光合速率。气孔限制因素引起的Pn下降表现为Gs和Ci均下降,非气孔限制因素引起的Pn下降表现为Gs下降、Ci升高[13]。Martin等[14]发现经低温处理的番茄叶片光合作用显著下降,其中75%归因于叶绿体受损,25%归因于气孔导度下降。吴雪霞等[15]在研究低温对茄子幼苗叶片光合特性影响时发现,Ci在处理时间较短时随着温度的降低而降低,但随着处理时间的延长Ci随着温度的降低反而增加。类似的结果在杨梅上也有报道[16]。本研究发现,妃子笑和糯米糍两种荔枝在低温处理26 d后其Pn分别下降了68.5%和50.9%,且随低温处理时间的延长,两个品种的Pn、Gs和Tr含量均持续下降,而Ci含量持续上升。因此,荔枝成花诱导期Pn下降可能是由于低温造成光合器官损伤,引起Ci升高,导致气孔关闭,非气孔因素可能是引起成花诱导期荔枝光合速率降低的主要原因,这与Farquhar等[17]的研究结果相吻合。
植物体内叶绿素荧光动力学是以光合作用理论为基础,利用体内叶绿素发射的荧光作为天然探针来研究完整植株或部分器官在各种环境条件下光合作用的真实行为,经常被用于评价光合机构功能和环境胁迫对光合能力的影响,具有快速、灵敏、无损伤等优点[18-19]。初始荧光强度(Fo)是指植物叶片暗适应后,PSⅡ反应中心都开放时的荧光强度,其值大小主要与激发光的强度及叶绿素含量有关,可反映逆境对植物叶片PSⅡ永久性伤害程度[20]。低温处理后糯米糍品种的Fo有所增加,而妃子笑品种的Fo无明显变化,说明糯米糍品种的PSⅡ反应中心在低温处理后受到不可逆转的失活或破坏,最终引起光合速率下降。最大荧光Fm是已经暗适应的光合机构全部的 PSⅡ中心都关闭时的荧光强度,可反映 PSⅡ电子传递情况[21]。可变荧光Fv可反映PSⅡ反应中心的活性,Fv愈强,PSⅡ活性愈高[22]。 本研究发现低温诱导下妃子笑品种的Fm和Fv呈下降趋势,而糯米糍品种无明显变化,表明低温可对妃子笑品种叶片PSⅡ反应中心的电子传递潜力产生明显抑制,PSⅡ活性降低,致使其光能转换效率降低。PSⅡ光化学效率通常用暗适应的光合机构可变荧光和最大荧光的比值Fv/Fm来表示,可用Fv/ Fm的大小来表征PSⅡ受光抑制的程度。Genty等[23]研究表明,Fv/Fm在非胁迫条件下比较恒定,一般介于0.80~0.85之间,不受物种和生长条件的影响,但在胁迫条件下该参数明显下降,因此Fv/Fm被认为是表征植物抗冷性的指标之一。本试验中,低温处理使糯米糍品种的Fv/Fm下降,说明PSⅡ潜在的活性中心已受损,光合作用原初反应产生抑制,诱导性低温对糯米糍品种的叶片产生一定的胁迫。PSⅡ实际光化学效率(ΦPSⅡ)反映了在照光条件下,PSⅡ反应中心部分关闭情况下的实际原初光能捕获效率,表示光化学反应消耗的能量比例[24]。诱导性低温处理后,两个品种的ФPSⅡ均呈下降趋势,表明低温对两个荔枝品种的光化学效率都有一定影响。综上所述,成花诱导期低温造成荔枝叶片光合速率下降的主要原因可能是低温降低其光化效率,导致其不能充分的利用光能。
[1] 李建国. 荔枝学[M]. 北京:中国农业出版社,2007:206-290.
[2] Menzel C. The control of floral initiation in lychee:A review[J]. Scientia Horticulturae,1983,21(3):201-215.
[3] Menzel C M,Simpson D R. Effect of temperature on growth and flowering of 1itchi(Litchi chinensis Sonn. )cultivars[J]. Journal of Horticultural Science,1988,63:349-360.
[4] 季作梁,叶自行. 气温对荔枝开花坐果的影响[J]. 果树科学,1995,12(4):250-252.
[5] 孙谷畴. 荔枝的光合特性[J]. 武汉植物学研究,1987,5(2):165-172.
[6] 莫伟平,周琳耀,张静逸,等. 遮荫和环剥对荔枝枝梢生长和光合生理的影响[J]. 园艺学报,2013,40(1):117-124.
[7] 周琳耀,莫伟平,张静逸,等. 遮阴对荔枝光合特征及矿质营养积累的影响[J]. 果树学报,2014,31(2):270-275.
[8] 戴宏芬,邱燕萍,袁沛元,等. 螺旋环剥对幼龄‘桂味’荔枝果期光合和蒸腾作用的影响[J].园艺学报,2010,37(8):1241-1246.
[9] 戴宏芬,邱燕萍,袁沛元,等. 间伐回缩修剪对荔枝叶片光合和蒸腾作用的影响[J]. 果树学报,2016(6):701-708.
[10] Zhou J,Yang L F,Hao F G,et al. Photosynthesis and chlorophyll-fluorescence of Magnolia grandiflora seedlings under low temperature stress. Acta Botanica Boreali-Occidentalia Sinica,2009,29(1):136-142.
[11] 张振文,郑永清,叶剑秋,等. 木薯叶片光合特性研究[J]. 西南农业学报,2009,22(2):300-303.
[12] 何洁,刘鸿先,王以柔,等. 低温与植物的光合作用[J]. 植物生理学通讯,1986(2):1-6.
[13] 刘建,项东云,陈健波,等. 低温胁迫对桉树光合和叶绿素荧光参数的影响[J]. 桉树科技,2009,26(1):1-6.
[14] Martin B,Ort D R,Boyer J S. Impairment of photosynthesis by chilling-temperatures in tomato[J]. Plant Physiol,1981,68:329-334.
[15] 吴雪霞,陈建林,查丁石. 低温胁迫对茄子幼苗叶片光合特性的影响[J]. 华北农学报,2008,23(5):185-189.
[16] 刘辉,郭延平,胡美君. 杨梅光合作用的低温光抑制[J]. 热带亚热带植物学报,2005,13(14):338-342.
[17] Farquhar G D,Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology,1982,33(3):317-345.
[18] 王立丰,王纪坤. 叶绿素荧光动力学原理及在热带作物研究中的应用[J]. 热带农业科学,2013,33(11):16-22.
[19] Krause G H,Weis E. Chlorophyll fluorescence and photosynthesis[J]. Annual Review Plant Physiology and Plant Molecular Biology,1991,42:313-349.
[20] 张守仁. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学通报,1999,16(4):444-448.
[21] Baker N R. Chlorophyll fluorescence:a probe of photosynthesis in vivo[J]. Annual Review of Plant Biology,2008,59:89-113.
[22] 许大全,张玉忠,张荣铣. 植物光合作用的光抑制[J]. 植物生理学通讯,1992,28(4):237-243.
[23] Genty B,Briantais J M,Baker N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J]. Biochimica Biophysica Acta,1989,990:87-92.
[24] Bilger W,Bjorkman O. Role of the xanthophylls cycle in photoprotection elucidated by measurements of light induced absorbance changes fluorescence and photosynthesis in leaves of Hedera anriensis[J]. Photosynth Research,1990,25:173-185.
(责任编辑 白雪娜)
Effects of low temperature on photosynthetic and chlorophyll fluorescence parameters of litchi leaves during flowering induction period
ZHANG Hong-na1,2,SU Zuan-xian2,CHEN Hou-bin2
(1.Key Laboratory of Ministry of Agriculture for Tropical Fruit Biology,South Subtropical Crops Research Institute,Chinese Academy of Tropical Agricultural Sciences,Zhanjiang 524091,China;2.College of Horticulture,South China Agricultural University,Guangzhou 510642,China)
Potted litchi trees were used to investigate the influences of low temperature on its photosynthetic and chlorophyll fluorescence parameters during flowering induction period. The results showed that net photosynthetic rate (Pn),transpiration rate (Tr) and stomatal conductance (Gs) decreased over time under low temperature induction,while intercellular CO2(Ci) concentration increased. The decreasing of Pn by low temperature treatment was mostly caused by non-stomatal limitation. The results also showed that after the low temperature treatment,Fo of Nuomici ascended slightly,Fm and Fv had no obvious changes,Fv/Fm descended slightly,while Fo and Fv/Fm of Feizixiao unchanged significantly,their Fm and Fv descended over time. ФPSⅡof both species were on the decline,but there was no obvious difference between varieties. The results suggested that low temperature had certain influence on the photochemistry efficiency of litchi,which was the main reason for the decreasing of Pn.
litchi (Litchi chinensis Sonn.);low temperature;photosynthetic parameter;chlorophyll fluorescence;floral induction
S667.1
A
1004-874X(2016)10-0059-05
2016-08-09
国家荔枝龙眼现代农业产业技术体系建设专项(CARS-33);广东省省级现代农业(重要热带作物)产业技术研发中心建设项目
张红娜(1986-),女,博士,助理研究员,E-mail:zhanghongna6789@163.com
陈厚彬(1963-),男,博士,研究员,E-mail:hbchen@scau.edu.cn
张红娜,苏钻贤,陈厚彬. 荔枝成花期诱导性低温对其叶片光合特性的影响[J].广东农业科学,2016,43(10):59-63.
