海水养殖鱼类病毒性神经坏死病防控技术研究进展
2016-12-12李璐璐王艳红任春华胡超群王冬梅詹钟仁
黄 文,陈 偿,赵 哲,李璐璐,罗 鹏,王艳红,任春华,胡超群*,方 哲,王冬梅,詹钟仁
(1.中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室,广东省应用海洋生物学重点实验室,广东 广州510301;2.南海资源开发与保护协同创新中心,广东 珠海 519082;3.利津县海洋与渔业局,山东 东营 257400;4.中国热带农业科学院热带生物技术研究所,海南 海口 571101;5.三亚福联水产发展有限公司,海南 三亚 572026)
海水养殖鱼类病毒性神经坏死病防控技术研究进展
黄 文1,2,陈 偿1,2,赵 哲1,2,李璐璐3,罗 鹏1,2,王艳红1,2,任春华1,2,胡超群1,2*,方 哲4,王冬梅4,詹钟仁5
(1.中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室,广东省应用海洋生物学重点实验室,广东 广州510301;2.南海资源开发与保护协同创新中心,广东 珠海 519082;3.利津县海洋与渔业局,山东 东营 257400;4.中国热带农业科学院热带生物技术研究所,海南 海口 571101;5.三亚福联水产发展有限公司,海南 三亚 572026)
神经坏死病毒(Nervous necrosis virus,NNV)是一种能导致海水鱼脑、中枢神经及视网膜等神经系统坏死的病毒,该病毒引发的鱼类病毒性神经坏死病主要发生在稚鱼和幼鱼期,较强的致病力及高致死率给海水鱼养殖业带来了沉重的打击,成为海水鱼类养殖产业可持续发展最重要的限制因素之一。文章主要综述了NNV的基本特征、诊断技术、病毒传播、疫苗免疫学等研究进展,介绍了NNV的防控技术及策略,为海水养殖鱼类NNV的防控工作提供参考。
海水鱼类;病毒性神经坏死病;综述;乙型野田村病毒;病害防控
神经坏死病毒(Nervous necrosis virus,NNV)隶属于乙型野田村病毒属(又称β诺达病毒属,Betanodavirus)[1-2],能导致海水鱼脑、神经及视网膜组织坏死,因此,由该病毒感染而引发的疾病又被称为病毒性神经坏死病(Virial nervous necrosis,VNN)或病毒性脑及视网膜病(Viral encephalopathy and retinopathy,VER)。
有关NNV的报道最早见于1990年,日本科学家Yoshikoshi和Inoue在大量死亡的条石鲷(Oplegnathusfasciatus)幼苗中发现患病鱼神经元及神经胶质细胞质中有大量不具外套膜、直径约为34 nm且具有二十面体结构的病毒颗粒,并将该病称为神经坏死病(Nervous necrosis)[3];同年,澳大利亚科学家Glazebrook等在大批量死亡的尖吻鲈(Latescalcarifer)幼苗中也发现了类似的病毒颗粒[4]。NNV具有较强的传染性,且患病死亡率接近100%[1-2],到目前为止,已在多种石斑鱼(Epinephelusakaara、Epinephelusseptemfasciatus、Epinephelusfuscogutatus)[5-7]、欧洲海鲈(Lateolabraxjaponicus)[8]、大菱鲆(Scophthalmusmaximus)[9]、黄带拟鲹(Pseudocaranxdentex)[10]等40多种海水鱼类的报道中出现过该病毒感染[11],给海水鱼养殖产业造成了较大的经济损失。
本文主要综述了NNV的基本特征、诊断技术、病毒传播、疫苗免疫学等的研究进展,并介绍了NNV的防控技术及策略,为海水养殖鱼类NNV的防控工作提供参考。
1 病毒的基本特征
NNV由外壳和基因组两部分组成,病毒大小约为25~30 nm,不具外套膜;病毒外壳由180个蛋白亚单位组成,病毒基因组大小约4.5 kb,主要由RNA1和RNA2两条正义单链RNA组成;RNA1(3.1 kb)负责编码复制酶(110 kDa),RNA2(1.4 kb)则负责编码外壳蛋白(42 kDa)[11]。其中,RNA2编码的外壳蛋白具有物种识别的功能。通过浸泡感染回接实验发现,一定来源的NNV只感染相似种类的幼苗并出现感染死亡的现象[12];Iwamoto等利用重组不同种类RNA1和RNA2病毒的方法也证明了RNA2负责识别宿主[13]。
根据病毒RNA2序列的同源性,可将鱼类NNV归为4种血清型,分别为:红鳍东方鲀(Takifugurubripes)神经坏死病病毒(Tiger puffer nervous necrosis virus,TPNNV)、黄带拟鲹(Pseudocaranxdentex)神经坏死病病毒(Striped jack nervous necrosis virus,SJNNV)、条斑星鲽(Veraspermoseri)神经坏死病病毒(Barfin flounder nervous necrosis virus,BFNNV)和赤点石斑鱼神经坏死病病毒(Redspotted grouper nervous necrosis virus,RGNNV)[11,14-15]。
NNV对外界环境具有很强的耐受性。Arimoto等研究发现,在0.05 mg/L的次氯酸钠、次氯酸钙、苯扎氯铵或者碘的作用下才能将SJNNV完全灭活,需要10 mL/L以上浓度的甲酚才能灭活SJNNV,而乙醇和甲醇以及氯仿、高碱度等对SJNNV不起作用[16]。Frerichs等在不同pH、温度的培养液中评估NNV的活力,发现SBNNV(Sea bass nervous necrosis virus)在5%胎牛血清中15℃条件下保存1年以上仍然具有感染力,在pH 2~11的蒸馏水中可以耐受24 h以上而不会影响病毒活力[17]。NNV较强的耐受性可能是该病毒在海水鱼类中广为传播的原因。
2 诊断技术
病毒性神经坏死病的病症表现为体色黑化、趴底侧躺、不进食、游泳异常等特征(图1),感染NNV后,利用光学和电子显微镜,在脑和视网膜组织中会出现典型的空泡化病变,并可在脑和视网膜组织中观察到病毒颗粒(图2)[18-19]。精确的诊断方法有细胞培养、ELISA、免疫荧光和PCR技术等[20-21]。
利用病毒敏感的细胞系或细胞株进行体外培养是鉴定、分离及确诊病原的重要方法。病毒感染细胞后,通过电镜切片可以观察到与病变组织相同的病毒颗粒,利用培养的病毒细胞对个体进行回接感染后会出现相同的病症。如Gomez等利用E-11细胞系分离出了饵料杂鱼中的NNV,并对健康的七带石斑鱼(E.septemfasciatus)进行回接感染,2周后,发现健康个体的脑及神经中出现了同样的病毒颗粒,并造成90%~100%的死亡率,从而确认了饵料杂鱼中的病毒是潜在的感染源[22]。
酶联免疫吸附测定(Enzyme linked immunosorbent assay,ELISA)及免疫荧光技术都是利用抗原抗体结合专一性进行免疫反应的检测方法,具有灵敏度高、特异性强的优点[1-2]。ELISA及免疫荧光技术作为经典的免疫检测方法,已经被应用于NNV检测及防控研究。利用ELISA检测的报道,如:Breuil等利用ELISA技术有效地检测出海鲈亲鱼中是否含有诺达病毒,从而筛选出具有阴性检测结果的亲鱼进行繁殖[20];Watanabe等通过ELISA方法检测条斑星鲽亲鱼,结果发现当ELISA抗体检测滴度小于40时,该方法能够成功筛选出不带病毒的亲鱼,筛选出来的亲鱼繁殖后,其子代不易发生病毒性神经坏死病[21]。利用免疫荧光技术检测的报道,如Iwamoto等利用免疫荧光技术检测宿主细胞中重组的NNV与正常的病毒,证明了重组的NNV同样具备侵染宿主细胞的能力[13]。
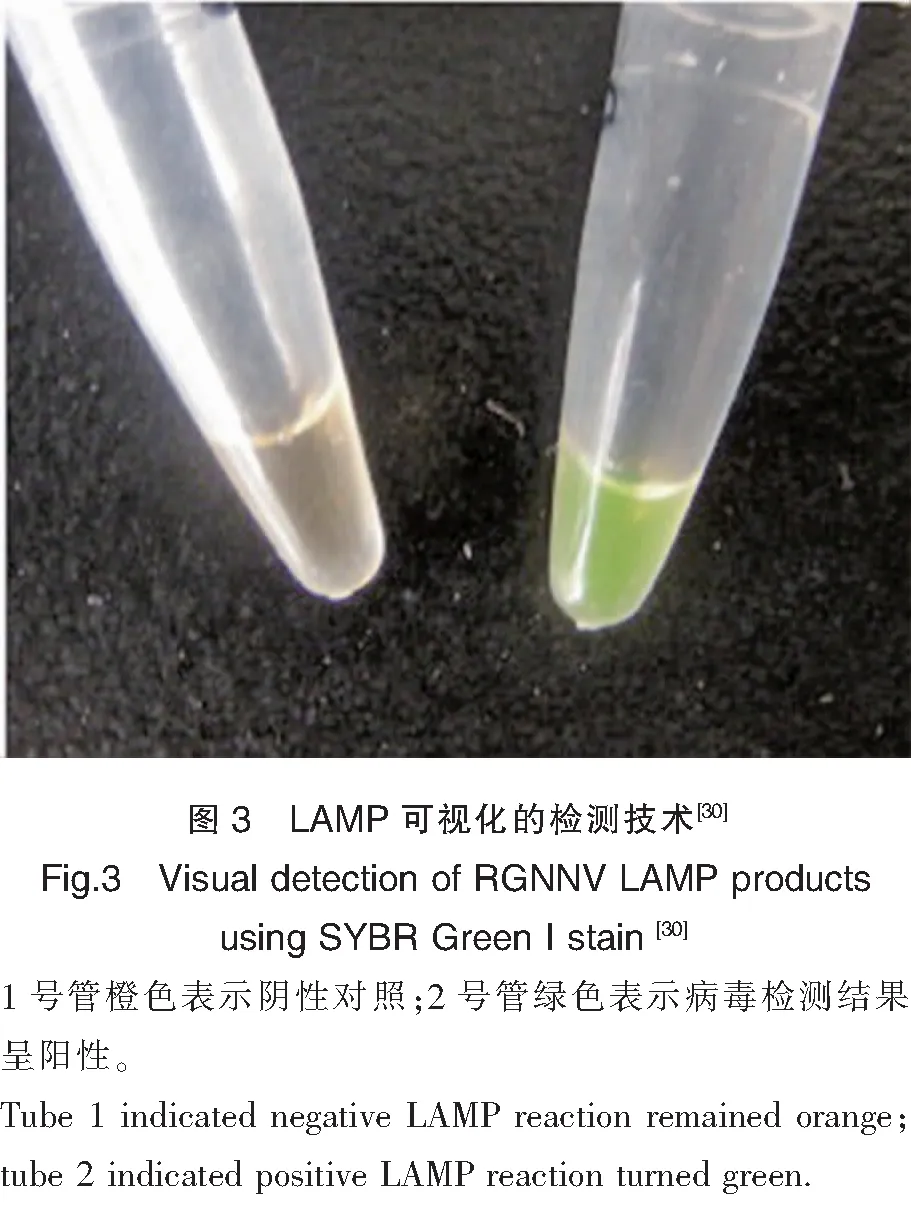
PCR检测技术是针对病毒基因组进行扩增检测的方法。最早应用PCR技术检测病毒性神经坏死病的鱼类是黄带拟鰺,Nishizawa等利用设计的引物确认得到的序列是SJNNV的RNA2 cDNA序列[23]。随着技术的发展,已经发展出RT-PCR、RT-qPCR、RT-nest PCR等多种PCR检测方法。陈信忠等利用RT-PCR成功地在5种养殖石斑鱼中扩增出421 bp的NNV RNA2条带[24];Mu等检测到25%~40%的正常斜带石斑仔鱼中携带了NNV[25];Kuo等通过RT-qPCR的方法检测到了鱼鳍中携带了NNV,推测诺达病毒可能通过鱼鳍互相接触的方式进行水平传播[26]。巢式PCR(Nested PCR)能够显著提高检测灵敏度和准确度,其灵敏度比普通PCR高10~100倍,比细胞培养高1万倍左右[27],Gomez等发现普通PCR能检测出30个阳性样品,而巢式PCR能检测出116个阳性样品,巢式PCR技术的灵敏度优势显而易见[28]。较高的灵敏度能够提前发现病毒,如Thiery等发现巢式PCR技术能够检测发病前1个月的幼苗中是否携带病毒[29]。环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)是一种先进的核酸扩增方法,具有简单、快速、特异性强的特点,通过恒温1~2 h孵育便可完成PCR反应,Xu等在赤点石斑鱼的研究中,发现LAMP的检测灵敏度比巢式PCR高100倍左右[30]。在LAMP中添加荧光染料,能够将检测结果可视化(图3),在养殖现场进行病害监测方面具有较大的技术优势。
综上可知,PCR技术耗时短、技术难度低,是最简便、快速、有效的检测方法,特别是LAMP检测方法,能够在1~2 h内完成扩增反应且无需特殊设备,目前已被广泛地应用于病毒现场检疫领域。细胞培养、ELISA、免疫荧光等检测方法由于技术难度大、耗时长,不适宜养殖现场检测,然而却是细胞学、免疫学等研究不可或缺的技术方法。

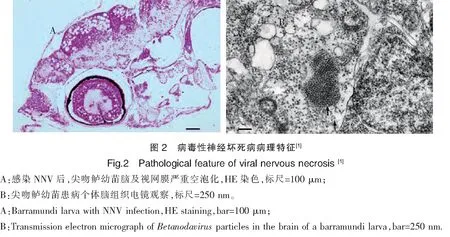
3 病毒传播途径
阻断传播是防控病毒病害大规模流行重要的手段。NNV的传播途径有两种:一种是通过亲鱼的垂直传播,另一种是通过养殖水体、互相接触、饵料等形成的水平传播[2,11]。
通过筛选不携带NNV的亲鱼进行繁殖,阻断病毒的垂直传播是防控病毒病害的重要研究方向。在海水鱼类病毒性神经坏死病的研究中已有成功的报道,如Watanabe等利用ELISA和PCR技术相结合的方法,检测条斑星鲽亲鱼是否携带NNV,并筛选出不带病毒的亲鱼进行繁殖,结果发现其子代不容易发生病毒性神经坏死病,因此认为通过剔除带病毒亲鱼进行繁殖的方法能够有效地阻断病毒的传播[21];相似的报道还见于海鲈及黄带拟鰺的相关研究[20,31]。由以上研究可知,筛选不携带NNV的亲鱼进行繁殖,是有效防控NNV传播的途径之一[31]。
水平传播也是NNV扩散另一种重要的途径。海水鱼类NNV的水平传播途径已经被多次证明,如Manin和Ransangan将鲈鱼和褐点石斑鱼的幼鱼与病鱼的匀浆液浸泡后,在全部幼鱼个体中都检测到了NNV,表明NNV可以通过水平传播的方式进行传播[32];Kuo等通过荧光定量PCR的方法,揭示了NNV可能通过鱼鳍互相接触的方式进行水平传播[26];Gomez等通过反转录PCR的方法在饵料鱼中检测出了NNV,利用从饵料鱼中分离出的NNV对七带石斑鱼进行回接感染,发现饵料鱼中的NNV能对七带石斑鱼幼苗造成90%~100%的死亡率,揭示了NNV的潜在传播途径[22]。有的学者甚至认为,NNV的垂直传播并不是病害暴发的主要因素,养殖水体恶化或者未经消毒等水平传播的方式才是导致NNV病害暴发的主要原因,Hick等利用反转录PCR技术检测尖吻鲈的受精卵和仔鱼,发现在所有批次的亲鱼、受精卵和仔鱼中均未检测到NNV,但是却在2/6批次的幼鱼中却发生了NNV并造成了最高100%的死亡率,由此认为水平传播才是造成病害大规模流行的主要原因[33]。
以上的研究表明,垂直传播和水平传播都是NNV重要的传播方式,因此需要加强亲鱼、饵料、水体等各环节的检疫,进行综合防控才能有效阻断病毒的传播。
4 免疫防控
疫苗免疫是重要和有效的病毒防治手段之一。在海水鱼病毒性神经坏死病的研究中已有较多成功的报道,如在褐点石斑鱼和七带石斑鱼幼鱼中,通过注射疫苗的方式,证明了NNV疫苗能够提高约67%的成活率[34-35];Kai等通过疫苗浸泡的方式对褐点石斑鱼进行病毒免疫,10 d后检测到了病毒抗体,攻毒后免疫组存活率高达87%,对照组全部死亡[36];Lin等通过口服疫苗的方法对斜带石斑鱼幼鱼进行免疫,7 d之后发现了病毒抗体,免疫组成活率达到69.5%[37]。
对亲鱼进行疫苗免疫,可以直接将病毒抗体传递给后代,在源头上解决石斑鱼稚、幼苗的病害问题,如Kai等分别对斜带石斑鱼和黑斑石斑鱼亲鱼注射NNV疫苗,结果发现在免疫组亲鱼的受精卵中有病毒抗体存在,对照组未免疫亲鱼的受精卵中则无抗体[38]。
除了灭活病毒疫苗之外,其他类型的疫苗也可取得较好的免疫保护效果,如Lu等将NNV的外壳蛋白基因ORF框构建到了质粒上,并通过大肠杆菌表达出类病毒外壳的蛋白颗粒,这些重组的类病毒颗粒与NNV在神经细胞表面竞争结合位点,大大减少了病毒侵入石斑鱼神经细胞的效率,对宿主起到了保护作用[39];Sommerset等利用重组的病毒外壳蛋白进行免疫,发现10 μg重组蛋白剂量具有较好的免疫保护效果[40];Coeurdacier等证明了人工合成的外壳蛋白多肽可对海鲈产生免疫保护效果[41]。
以上的研究表明,不同类型的神经坏死病毒疫苗(如灭活病毒、重组病毒外壳蛋白及人工合成病毒外壳蛋白多肽)及不同的免疫方式(如注射、浸泡及口服)都能够对海水鱼类产生免疫保护效果。然而在生产实践中,稚鱼或幼鱼的特异性免疫系统还未充分发育,免疫后,稚鱼或幼鱼经常在未产生免疫保护之前即开始大规模发病死亡[15];通过免疫亲鱼遗传获得的抗体是否能持续地对稚鱼或幼鱼产生免疫保护作用也不得而知。有效的海水鱼类免疫防控技术仍需深入研究。
5 展望
从1990年第一次被报道开始,病毒性神经坏死病就一直危害着海水鱼养殖产业,给该产业带来了持续的经济损失[3-4]。NNV对海水鱼幼苗的成活率威胁巨大,研究NNV的防控技术及策略是该产业发展不可回避的重要课题。
疫苗免疫通常是防治病毒病的最有效方法之一。灭活疫苗或者重组的疫苗蛋白能够对石斑鱼产生较好的免疫保护效果[34],然而,NNV主要作用于稚鱼、幼鱼,该阶段幼苗的免疫系统可能未充分发育,使得疫苗的保护效果非常有限[15]。对繁殖亲鱼进行疫苗免疫,使得子代获得病毒免疫力[38],该方法能够阻断病毒的垂直传播,并使后代获得先天的病毒免疫能力,相关技术具有较高的潜在应用价值,值得进一步开发。
加强病毒检测,提前排除病毒媒介或携带者,阻断病毒传播,也是实现病毒防控的重要方法。随着生物技术的发展,病毒的检测技术已较为成熟,可对养殖过程中的各个环节进行检测。然而,海水鱼养殖产业的病毒检疫防控工作仍不全面。Gomez等发现无脊椎动物(双斑蟳Charybdisbimaculata、长额虾Pandalushypsinotus、紫贻贝Mytilusgalloprovincialis)中也携带了NNV[42]。在海水鱼类稚鱼养殖过程中,轮虫、丰年虫等低等浮游生物饵料必不可少,该环节的病毒检测工作至关重要,相应的研究仍需得到重视并加强。
现阶段需要继续加强病毒免疫学研究,开发出商业化的疫苗及合理的免疫方法。同时,需要加强病毒检疫,制定出阻断病毒传播的综合防治方案,最终为海水鱼养殖业的快速发展提供助力。
[1]MUNDAY B,KWANG J,MOODY N,et al.Betanodavirus infections of teleost fish:a review[J].J Fish Dis,2002,25(3):127-142.
[2]NAKAI T,MORI K,SUGAYA T,et al.Current knowledge on Viral nervous necrosis(VNN)and its causative betanodaviruses[J].Isr J Aquacult-Bamid,2009,61(3):198-207.
[3]YOSHIKOSHI K,INOUE K.Viral nervous necrosis in hatchery-reared larvae and juveniles of Japanese parrotfish,Oplegnathusfasciatus[J].J Fish Dis,1990,13(13):69-77.
[4]GLAZEBROOK J,HEASMAN M,BEER S,et al.Picorna-like viral particles associated with mass mortalities in larval barrmundi,Latesclcarifer(Bloch)[J].J Fish Dis,1990,13(3):245-249.
[5]MORI K,NAKAI T,NAGAHARA M,et al.A viral disease in hatchery-reared larvae and juveniles of redspotted grouper[J].Fish Pathol,1991,26(4):209-210.
[6]FUKUDA Y,NGUYEN H,FURUHASHI M,et al.Mass mortality of cultured sevenband grouper,Epinephelusseptemfasciatus,associated with viral nervous necrosis[J].Fish Pathol,1996,31(3):165-170.
[7]CHI S,LO C,KOU G,et al.Mass mortalities associated with viral nervous necrosis(VNN)disease in two species of hatchery-reared grouper,EpinephelusfuscogutatusandEpinephelusakaara[J].J Fish Dis,1997,20(3):185-193.
[8]BREUIL G,BONAMI J,PEPIN J,et al.Viral infection(picorna-like virus)associated with mass mortalities in hatchery-reared sea-bass(Dicentrarchuslabrax)larvae and juveniles[J].Aquaculture,1991,97(2-3):109-116.
[9]BLOCH B,GRAVNINGEN K,LARSEN J,et al.Encephalomyelitis among turbot associated with a picornavirus-like agent[J].Dis Aquat Organ,1991,10(1):65-70.
[10]MORI K,NAKAI T,MUROGA K,et al.Properties of a new virus belonging to nodaviridae found in larval striped jack(Pseudocaranxdentex)with nervous necrosis[J].Virology,1992,187(1):368-371.
[11]陈信忠.石斑鱼病毒性神经坏死病研究[D].厦门:厦门大学,2005:1-122.
[12]TANAKA S,KURIYAMA I,NAKAI T,et al.Susceptibility of cultured juveniles of several marine fish to the sevenband grouper nervous necrosis virus[J].J Fish Dis,2003,26(2):109-115.
[13]IWAMOTO T,YASUSHI O,KAZUYUKI M,et al.Identification of host-specificity determinants in betanodaviruses by using reassortants between striped jack nervous necrosis virus and sevenband grouper nervous necrosis virus[J].J Virol,2004,78(3):1256-1262.
[14]NISHIZAWA T,FURUHASHI M,NAGAI T,et al.Genomicclassification of fish nodaviruses by molecular phylogenetic analysis of the coat protein gene[J].Appl Environ Microb,1997,63(4):1633-1636.
[15]陈文捷,刘晓丹,胡先勤,等.鱼类神经坏死病毒研究进展与发展趋势[J].水产学报,2014,38(9):1666-1672.
[16]ARIMOTO M,SATO J,MARUYAMA K,et al.Effect of chemical and physical treatments on the inactivation of striped jack nervous necrosis virus(SJNNV)[J].Aquaculture,1996,143(1):15-22.
[17]FRERICHS G,TWEEDIE A,STARKEY W,et al.Temperature,pH,and electrolyte sensitivity,and heat,UV and disinfectant inactivation of sea bass(Dicentrarchuslabrax)neuropathy nodavirus[J].Aquaculture,2000,185(1-2):13-24.
[18]BRETON A,GRISEZ L,SWEETMAN J,et al.Viral nervous necrosis(VNN)associated with mass mortalities in cage-reared sea bass,Dicentrarchuslabrax(L.)[J].J Fish Dis,1997,20(2):145-151.
[19]GROTMOL S,BERGH O,TOTLAND G,et al.Transmission of viral encephalopathy and retinopathy(VER)to yolk-sac larvae of the Atlantic halibutHippoglossushippoglossus:occurrence of nodavirus in various organs and a possible route of infection[J].Dis Aquat Organ,1999,36(2):95-106.
[20]BREUIL G,PEPIN J,CASTRIC J,et al.Detection of serum antibodies against nodavirus in wild and farmed adult sea bass:application to the screening of broodstock in sea bass hatcheries[J].B Eur Assoc Fish Pat,2000,20(3):95-100.
[21]WATANABE K,NISHIZAWA T,YOSHIMIZU M,et al.Selection of broodstock candidates of barfin flounder using an ELISA system with recombinant protein of barfin flounder nervous necrosis virus[J].Dis Aquat Organ,2000,41(3):219-223.
[22]GOMEZ D,MORI K,OKINAKA Y,et al.Trash fish can be a source of betanodaviruses for cultured marine fish[J].Aquaculture,2010,302(3):158-163.
[23]NISHIZAWA T,MORI K,NAKAI T,et al.Polymerase chain reaction(PCR)amplification of RNA of striped jack nervous necrosis virus(SJNNV)[J].Dis Aquat Organ,1994,18(2):103-107.
[24]陈信忠,苏亚玲,龚艳清,等.逆转录聚合酶链式反应(RT-PCR)检测5种养殖石斑鱼的神经坏死病毒[J].中国水产科学,2004,11(3):202-207.
[25]MU Y,LIN K,CHEN X,et al.Diagnosis of nervous necrosis virus in orange-spotted grouper,Epinepheluscoioides,by a rapid and convenient RT-PCR method[J].Acta Oceanol Sin,2013,32(10):88-92.
[26]KUO H,WANG T,CHEN P,et al.Real-time quantitative PCR assay for monitoring of nervous necrosis virus infection in grouper aquaculture[J].J Clin Microbiol,2011,49(3):1090-1096.
[27]DALLA V,ZANELLA L,PATARNELLO P,et al.Development of a sensitive diagnostic assay for fish nervous necrosis virus based on RT-PCR plus nested PCR[J].J Fish Dis,2000,23(5):321-327.
[28]GOMEZ D,SATO J,MUSHIAKE K,et al.PCR-based detection of betanodaviruses from cultured and wild marine fish with no clinical signs[J].J Fish Dis,2004,27(10):603-608.
[29]THIERY R,RAYMOND J,CASTRIC J,et al.Natural outbreak of viral encephalopathy and retinopathy in juvenile sea bass,Dicentrarchuslabrax:study by nested reverse transcriptase-polymerase chain reaction[J].Virus Res,1999,63(1-2):11-17.
[30]XU H,FENG J,GUO Z,et al.Detection of red-spotted grouper nervous necrosis virus by loop-mediated isothermal amplification[J].J Virol Methods,2010,163(1):123-128.
[31]MUSHIAKE K,NISHIZAWA T,NAKAI T,et al.Control of VNN in striped jack-selection of spawners based on the detection of SJNNV gene by polymerase chain-reaction(PCR)[J].Fish Pathol,1994,29(3):177-82.
[32]MANIN B,RANSANGAN J.Experimental evidence of horizontal transmission of betanodavirus in hatchery-produced Asian seabass,Latescalcariferand brown-marbled grouper,Epinephelusfuscoguttatusfingerling[J].Aquaculture,2011,321(1-2):157-165.
[33]HICK P,SCHIPP G,BOSMANS J,et al.Recurrent outbreaks of viral nervous necrosis in intensively cultured barramundi(Latescalcarifer)due to horizontal transmission of betanodavirus and recommendations for disease control[J].Aquaculture,2011,319(1-2):41-52.
[34]YAMASHITA H,NAKAI T.The efficacy of inactivated virus vaccine against viral nervous necrosis(VNN)[J].Fish Pathol,2005,40(1):15-21.
[35]PAKINGKING R,NORWELL-BRIAN B,EVELYN-GRACE J,et al.Protective immunity against viral nervous necrosis(VNN)in brown-marbled grouper(Epinephelusfuscogutattus)following vaccination with inactivated betanodavirus[J].Fish Shellfish Immun,2010,28(4):525-533.
[36]KAI Y,CHI S.Efficacies of inactivated vaccines against betanodavirus in grouper larvae(Epinepheluscoioides)by bath immunization[J].Vaccine,2008,26(11):1450-1457.
[37]LIN C,LIN J,CHEN M,et al.An oral nervous necrosis virus vaccine that induces protective immunity in larvae of grouper(Epinepheluscoioides)[J].Aquaculture,2007,268(1-4):265-273.
[38]KAI Y,SU H,TAI K,et al.Vaccination of grouper broodfish(Epinephelustukula)reduces the risk of vertical transmission by nervous necrosis virus[J].Vaccine,2010,28(4):996-1001.
[39]LU M,LIU W,LIN C,et al.Infection competition against grouper nervous necrosis virus by virus-like particles produced inEscherichiacoli[J].J Gen Virol,2003,84(Pt 6):1577-1582.
[40]SOMMERSET I,SKERN R,BIERING E,et al.Protection against Atlantic halibut nodavirus in turbot is induced by recombinant capsid protein vaccination but not following DNA vaccination[J].Fish Shellfish Immun,2005,18(1):13-29.
[41]COEURDACIER J,LAPORTE F,PEPIN J,et al.Preliminary approach to find synthetic peptides from nodavirus capsid potentially protective against sea bass viral encephalopathy and retinopathy[J].Fish Shellfish Immun,2003,14(5):435-447.
[42]GOMEZ D,BAECK G,KIM J,et al.Molecular detection of betanodaviruses from apparently healthy wild marine invertebrates[J].J Invertebr Pathol,2008,97(3):197-202.
Review on disease control researches of marine fish NNV
HUANG Wen1,2,CHEN Chang1,2,ZHAO Zhe1,2,LI Lulu3,LUO Peng1,2,WANG Yanhong1,2,REN Chunhua1,2,HU Chaoqun1,2*,FANG Zhe4,WANG Dongmei4,ZHAN Zhongren5
(1.Key Laboratory of Tropical Marine Bio-resources and Ecology(LMB)/Key Laboratory of Applied Marine Biology of Guangdong Province(LAMB),South China Sea Institute of Oceanology,Chinese Academy of Sciences,Guangzhou 510301,China;2.South China Sea Bio-Resource Exploitation and Utilization Collaborative Innovation Center,Zhuhai 519082,China;3.Oceanic and Fishery Administration of Lijin County,Dongying 257400,China;4.Institute of Tropical Bioscience and Biotechnology,Chinese Academy of Tropical Agricultural Sciences,Haikou 571101,China;5.Sanya Fulian Aquatic Development Limited Company, Sanya 572026,China)
Nervous necrosis virus(NNV)can lead to nervous,encephalopathy or retinopathy necrosis in marine fishes.The virus causing the nervous necrosis disease in marine fishes mostly infects the grouper fries and fingerlings,the strong pathogenicity and high mortality rate is a hammer blow to the marine fish culture,which had become one of the most important restrictions of marine culture industry.The study mainly reviews on the research progresses of basic characteristics,diagnostic techniques,transmission,vaccine immunology and controlling strategies of NNV.This paper will provide the
for preventing and controlling the NNV disease of marine fish culture industry.
marine fish;viral nervous necrosis;review;Betanodavirus;disease control
2016-07-20 基金项目:海南省产学研一体化专项资金项目资助(编号:cxy20150038);广东省省级科技计划项目资助(编号:2014B030301064).
黄 文(1987-),男,江西省井冈山人,助理研究员,博士,主要从事海洋生物技术与病害研究.Tel:020-89023216.E-mail:huangwen@scsio.ac.cn
胡超群(1962-),研究员,主要从事海洋生物技术与病害研究.E-mail:hucq@scsio.ac.cn
S942.2
A
1006-5601(2016)05-0419-08
黄 文,陈 偿,赵 哲,等.海水养殖鱼类病毒性神经坏死病防控技术研究进展[J].渔业研究,2016,38(5):419-426.
