人附睾分泌蛋白4在子宫内膜癌组织中的表达及临床意义*
2016-12-10孙润蛟金仙玉刘桂香王文建刘言厚高言国
孙润蛟 金仙玉 刘桂香 王文建 刘言厚 高言国
人附睾分泌蛋白4在子宫内膜癌组织中的表达及临床意义*
孙润蛟①金仙玉②刘桂香①王文建③刘言厚①高言国④
目的:通过检测人附睾分泌蛋白4(HE4)在子宫内膜癌组织中的表达水平,观察HE4与不同临床及病理特征的相关性,探讨其在子宫内膜癌诊断、治疗及预后中的临床意义。方法:应用即用型免疫组织化学染色两步法对32例经病理学证实为子宫内膜癌的石蜡标本进行HE4检测。分析HE4表达与子宫内膜癌FIGO分期、病理类型、组织学分级、肌层侵犯深度、肿瘤的大小和年龄的关系等各组间的差异,分析其与子宫内膜癌临床病理特征的关系。结果:(1)HE4阳性颗粒主要定位在细胞膜和细胞质上,在32例子宫内膜癌组织中的HE4的阳性表达率较高,为87.5%。(2)HE4在组织学分级为高分化组的子宫内膜癌组织中的阳性表达率及强度均高于中低分化组(P<0.05)。(3)HE4蛋白在晚期子宫内膜癌组织中阳性表达率及表达强度均高于早期组(P<0.05)。(4)HE4蛋白在子宫内膜癌的阳性表达与年龄、病理分型、肌层侵犯深度及肿瘤大小均无关(P>0.05);但在HE4强阳性表达程度方面,深肌层浸润者强阳性表达(61.5%)多于无深肌层浸润者(36.8%),其直径≥2 cm的肿瘤强阳性表达(61.1%)高于直径<2 cm的肿瘤(28.6%),差异均有统计学意义(P<0.05)。结论:HE4基因的高表达与子宫内膜癌的侵袭、进展等方面关系密切,可以作为肿瘤侵袭进展的标志以及评估子宫内膜癌预后的一个重要指标。
人附睾分泌蛋白4; 子宫内膜癌; 免疫组化法; 预后
First-author’s address:The Central Hospital of Zhuanghe,Zhuanghe 116400,China
众所周知,子宫内膜癌是原发于子宫内膜的一组上皮性恶性肿瘤,是女性生殖道最常见的恶性肿瘤之一,占女性全身恶性肿瘤的7%。可发生于任何年龄,平均发病年龄为60岁,其中50岁以上女性发病居多。近些年由于生存年龄的增加、外源性雌激素的广泛使用及内分泌疾病的增加,以及人们保健意识的增强,在世界范围内发病率有上升趋势,同时平均发病年龄也有低龄化的趋势。治疗方式总的原则是以手术为主,术后依据手术分期以及高危因素决定是否进一步辅以放化疗或内分泌治疗等。早期发现,治愈率高,预后良好;但晚期及复发性子宫内膜癌的预后不良,死亡率高。
众多研究表明,子宫内膜癌是一个复杂的过程,它的病因机制目前尚未完全阐明,分子遗传学研究支持不同类型的子宫内膜癌在发生发展过程中有不同的遗传学改变这一假说:Ⅰ型出现DAN错配修复基因,PTEN,K-ras基因的变化,Ⅱ型则经常出现P53和HER-2基因突变和扩增[1]。所以,免疫组化在子宫内膜癌的诊断中具有愈来愈重要的作用,如判断预后及影响因素、指导术后内分泌治疗或化疗等。
人附睾分泌蛋白4(HE4)作为WAP四硫化核心域2(WFDC2),是人类血清中分泌的小分子糖蛋白。作为血清学指标,经多位学者证实,它对女性卵巢癌、子宫内膜癌及宫颈癌均有诊断意义。可以单独或结合CA125成为检测子宫内膜癌的有效生物指标。一项新的研究发现:HE4作为子宫内膜癌的肿瘤标志物,它的敏感性和特异性在诊断预后和疾病的监测中,是迄今为止发现的最敏感最准确的子宫内膜癌标志物[2]。很多证据表明子宫内膜癌组织中HE4 mRNA和蛋白表达显著增加[3-7]。而研究中也证实HE4在密切关联的阶段组织中的表达与血清中HE4的表达一致,血清中HE4水平能代表子宫内膜癌组织中HE4的表达水平[8-9],推测这与肿瘤组织局部分泌HE4增加及负荷加重有关。但目前大多数研究集中在血清学检测的开发和改进及HE4与盆腔良性疾病的鉴别诊断中。
本研究通过免疫组化检测HE4在子宫内膜癌中的表达。并分析HE4表达与子宫内膜癌FIGO分期,病理类型,组织学分级,肌层侵犯深度,肿瘤的大小和年龄的关系,探讨其临床意义,现报道如下。
1 资料与方法
1.1一般资料 收集大连市中心医院2011年1月1日-2014年2月18日行子宫切除后经病理学证实为子宫内膜癌的标本蜡块共32例。排除标准:(1)子宫内膜癌术前行激素治疗者;(2)术前行化疗或放疗;(3)同时合并其他恶性肿瘤者。32例子宫内膜癌,年龄42~80岁,中位年龄56岁;根据世界卫生组织提出的年龄划分法,青、中年组(<60岁)18例,老年组(≥60岁)14例;组织学分级高分化组病例8例,中-低分化组病例24例;按照FIGO分期(2009)早期(Ⅰ~Ⅱ期)25例,晚期(Ⅲ~Ⅳ期)7例;子宫内膜腺癌23例,特殊类型子宫内膜癌9例,其中包括子宫内膜浆液性腺癌4例,浆乳伴透明细胞癌1例,鳞腺癌2例,腺癌伴部分透明细胞癌2例;肌层侵犯深度<1/2者19例,≥1/2者13例;肿瘤大小<2 cm者14例,≥2 cm者18例。
1.2主要试剂与方法
1.2.1主要试剂 HE4鼠抗人单克隆抗体、免疫组化二步法试剂盒,防脱片剂APES、DAB试剂等分别于北京中山金桥生物科技有限公司购买。
1.2.2免疫组织化学 采用免疫组化两步法检测HE4蛋白的表达。严格按试剂盒说明书进行操作。石蜡包埋组织以3~4 μm连续切片石蜡包埋组织;常规脱蜡和水化;孵育;高压抗原修复;滴加1滴或50 μL的I抗(鼠抗人附睾蛋白4单克隆抗体),在室温下孵育1 h;PBS缓冲液冲洗;滴加通用型IgG抗体-Fab段-HRP多聚体,室温孵育10~15 min。PBS液冲洗后滴加2滴或100 μL新鲜配制的DAB显色剂;自来水冲洗干净,过蒸馏水。苏木素复染2 min。蒸馏水冲洗、复染、脱水、透明、封片。以PBS代替I抗作阴性对照,上皮性浆液性卵巢恶性肿瘤阳性切片作HE4免疫组化染色的阳性对照。
1.3判定标准 光学显微镜400倍下每张切片随机选取10个视野的癌细胞,根据染色的阳性细胞百分比分为四级:<10%、10%~24%、25%~49%、50%,分别评为0、1、2、3分。根据阳性细胞染色深浅程度,将不显色、淡黄色、棕黄色、棕褐色分别评为0、1、2、3分,目前多采用积分综合计量,两者得分相乘作为该切片的最终结果:<3分为阴性,>4分为阳性,>6分为强阳性。病理切片分别由3位高年资病理医师轮流读片评定。
1.4统计学处理 运用SPSS 18.0统计学软件对HE4在不同子宫内膜癌组织中的表达差异进行相关性分析,计量资料用(±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用 χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1HE4在子宫内膜癌组织中的表达 HE4阳性颗粒主要定位在细胞膜及细胞浆上;着色呈棕黄色或棕褐色;视野内阳性细胞呈点、片状分布,见图1~5。在32例癌组织中的HE4阳性13例(阳性表达率为40.6%),强阳性15例(阳性表达率为46.9%),总阳性表达率为87.5%。

图1 HE4在ⅠB1期子宫内膜鳞腺癌中呈阴性表达(×400)

图2 HE4在ⅠB2期子宫内膜腺癌组织中呈阴性表达(×400)
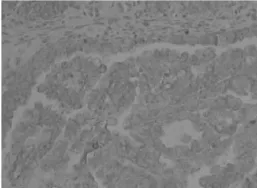
图3 HE4在ⅢA3期子宫内膜浆液性乳头样腺癌组织中呈阳性表达(×400)
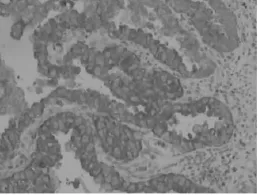
图4 HE4在ⅢA3期子宫内膜浆液性乳头状腺癌伴部分透明细胞癌中呈强阳性表达(×400)

图5 HE4在ⅡB2-3期子宫内膜腺癌中呈强阳性表达(×400)
2.2HE4在不同临床病理特征的子宫内膜癌组织中的表达
2.2.1子宫内膜癌组织中HE4表达与组织学分级的关系 HE4在组织学分级分别在高、中-低分化组的子宫内膜癌组织中的阳性表达率为62.5%、95.8%,两者比较差异有统计学意义( χ2=8.253,P=0.004)。HE4在分化程度好的高分化中多呈弱阳性表达或阴性表达,随着组织学分级增加,表达强度也显著增加。HE4在子宫内膜癌组织中表达强度和组织学分级为正相关关系(r=0.477,P=0.018)。见表1。
2.2.2子宫内膜癌组织中HE4表达与临床分期的关系 标本按照FIGO 2009手术-病理分期标准进行分期,因Ⅱ期病例少,仅3例,没有Ⅳ期病例,将早期(Ⅰ~Ⅱ期)和晚期(Ⅲ~Ⅳ期)子宫内膜癌组织HE4水平进行比较分析,总阳性表达率分别为84.0%、100%,两者比较差异有统计学意义( χ2=7.515,P=0.009)。而随着分期的进展,组织中HE4蛋白的表达程度比早期增强,提示HE4的表达程度与临床分期呈正相关关系(r=0.238,P=0.026)。见表2。

表1 子宫内膜癌组织中HE4表达与组织学分级的关系 例(%)

表2 子宫内膜癌组织中HE4表达与临床分期的关系 例(%)
2.2.3子宫内膜癌组织中HE4表达与深肌层浸润的关系 HE4在有深肌层浸润的子宫内膜癌组织中与无深肌层浸润者总阳性表达率分别为84.6%、89.5%,两者比较差异无统计学意义( χ2=0.441,P=0.802),提示HE4的表达程度与深肌层浸润无关系(r=0.117,P=0.067)。但在表达程度上,HE4在深肌层浸润者强表达(61.5%)多于无深肌层浸润者(36.8%),差异有统计学意义(P<0.05)。见表3。

表3 子宫内膜癌组织中HE4表达与深肌层浸润的关系 例(%)
2.2.4子宫内膜癌组织中HE4表达与肿瘤直径大小的关系 HE4在肿瘤直径大小≥2 cm者阳性表达率(94.4%)高于肿瘤直径<2 cm者(78.6%),两者比较差异无统计学意义( χ2=3.66,P=0.16),提示HE4的表达程度与肿瘤直径大小无关系(r=0.125,P=0.13)。但在两组强表达比较中,HE4在肿瘤直径大小≥2 cm者(61.1%)高于肿瘤大小<2 cm者(28.6%),差异有统计学意义(P<0.05)。见表4。
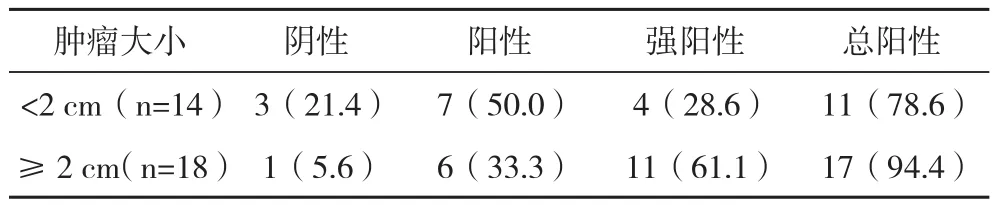
表4 子宫内膜癌组织中HE4表达与肿瘤直径大小的关系 例(%)
2.2.5子宫内膜癌组织中HE4表达与年龄的关系 HE4在<60岁和≥60岁的子宫内膜癌组织中,总阳性率分别为83.3%、92.9%,两者比较差异无统计学意义( χ2=3.817,P=0.371),提示HE4的表达程度与年龄无关系(r=0.311,P=0.16),见表5。

表5 子宫内膜癌组织中HE4表达与年龄的关系 例(%)
2.2.6子宫内膜癌组织中HE4表达与组织病理类型的关系 32例研究的样本中,子宫内膜腺癌23例,特殊类型9例,其中包括子宫内膜浆液性腺癌4例,浆乳伴透明细胞癌1例,腺鳞癌2例,腺癌伴部分透明细胞癌2例。HE4在腺癌及特殊类型子宫内膜癌组织中总阳性率分别为87.0%、88.9%,两者比较差异无统计学意义( χ2=0.384,P=0.825),提示HE4的表达程度与组织病理类型无关系(r=0.099,P=0.36),见表6。

表6 子宫内膜癌组织中HE4表达与的关系 例(%)
3 讨论
HE4基因又名WFDC2(WAP四二硫化物核心域2),是乳清酸蛋白(WAP)结构域家族蛋白中的一员,位于20q12-q1312,全长约12 kb,有5个外显子和4个内含子组成,位点包含14个编码WAP同源蛋白的基因。分子结构中包含特征性WAP结构域。Chhikara等[10]研究证实,HE4是一种新的跨类蛋白酶抑制剂。分析同属于4-DSC家族中具有WAP结构的蛋白酶抑制剂如SLPI(分泌型白细胞蛋白酶抑制因子),推测HE4可能会有助于抵抗蛋白水解性质的微生物毒力因子、参与免疫防御,发挥免疫调节作用。
有研究认为子宫内膜癌中频繁基因扩增的热点是染色体20q、HE4存在区和WAP,提供一个潜在的HE4表达增加的机制[11-12]。Micci等[12]表明,20q的获得是一个子宫内膜癌中的常见异常。许多癌基因通过基因扩增来实现高水平的表达。人类中HE4、SLPI(分泌型白细胞蛋白酶抑制因子)和其他几个在20q12-13的WAP成员在人体某个区域经常放大各种癌症[12-13]。这些结果表明,体细胞遗传物质的获得可能是一种机制,通过这种机制HE4在子宫内膜癌细胞中实现高水平表达。
在郭冰沁等[14]的研究中采用小鼠异种移植模型测量体内癌细胞扩散中发现HE4超表达显著促进细胞增殖、细胞入侵能力、克隆性生长和子宫内膜癌异种移植中的肿瘤生长等恶性表型;同时体内实验表明,HE4超表达促进子宫内膜癌异种移植在SCID鼠中的增长,这证明HE4超表达直接影响子宫内膜癌肿瘤的进展。因此,该研究认为HE4不是癌细胞的副产品,也不是恶性肿瘤的替代标志,它可能是子宫内膜癌发展的致瘤或肿瘤促进因素[15]。
房青等[16]在卵巢癌的研究中也发现,HE4-siRNA能有效地特异性下调卵巢癌细胞内HE4mRNA和蛋白表达,能显著抑制侵袭率,但他的研究结果提示HE4能同时抑制细胞的增殖活力下降约40%,提示HE4有可能成为卵巢癌转移防止的潜在靶点[16]。现在已经有将PHE4-652作为启动子应用于卵巢癌的靶向性基因治疗的研究[17]。但目前还没有将HE4应用于子宫内膜癌治疗方面的报道或研究。
HE4在子宫内膜癌组织中的表达,1991年Kirchhoff对HE4蛋白组织定位,结果显示正常组织HE4主要分布在生殖系统中的上皮细胞如曲精细管、附睾、输精管、输卵管上皮细胞和子宫内膜。除了卵巢浆液性癌中高表达外,其他的恶性肿瘤如子宫内膜癌、乳腺癌、肺癌、胰腺癌也中度表达,而胃肠道和泌尿道肿瘤则表达较低。Drapkin等[18]及Galgano等[19]在子宫内膜癌组织及细胞株中发现HE4 mRNA和HE4蛋白的明显高表达,文献[3]研究认为HE4具备成为子宫内膜癌的肿瘤标记物的候选基因。本组应用免疫组化研究子宫内膜癌组织中HE4的表达情况,结果发现HE4阳性颗粒主要定位在细胞膜及细胞浆上;着色呈棕黄色或棕褐色;视野内阳性细胞呈点、片状分布。32例子宫内膜癌组织中表达率均较高,总阳性表达率为87.5%,与文献[19]报道的90%基本一致,这也证实HE4可以作为子宫内膜癌的高敏感性的肿瘤标记物。
HE4表达与子宫内膜癌临床病理因素的关系,目前各家学者对HE4在子宫内膜癌中的表达研究大致相同,认为血清HE4水平与手术病理分期、淋巴转移、肌层浸润、宫颈转移呈正相关,并在术前预测、评估及术后监测等方面具有良好的价值。报道结果不一致的是在HE4在子宫内膜癌中的表达水平的相关因素中,大多数认为与年龄、分化程度无关;但少数研究认为,HE4的表达程度与年龄及分化程度有关。杨彩虹等[4]用免疫组化方法的研究中发现:HE4的表达水平在子宫内膜癌组织中的增加与手术-病理分期为正相关关系,和患者的年龄,组织学分级和病理类型是不相关的。而Bignotti等[20]用实时定量PCR及免疫组化方法检测HE4基因mRNA和组织中HE4蛋白的表达,酶联免疫吸附法测定血清HE4蛋白的表达,检测结果在子宫内膜癌组织中,HE4 mRNA表达和HE4蛋白表达高于正常子宫内膜组及子宫内膜良性病变组,且血清HE4水平与高龄、FIGO分期、绝经状态、病理分级、肌层浸润深度、腹水阳性、淋巴结阳性等呈正相关。
在笔者的研究发现中,随着组织学分级、临床分期增加HE4表达阳性率增加,且差异有统计学意义(P<0.05)。HE4与组织学分级和临床分期呈正相关。HE4在分化程度较好的高-中分化多呈弱阳性或阴性表达,随着组织学分级的增加,它的表达程度也显著增强;晚期病例组中HE4表达的明显强于早期病例组。本研究中深肌层浸润和原发肿瘤大小在HE4的总表达率方面差异无统计学意义(P>0.05)。但在表达程度方面,深肌层浸润的癌组织的HE4的表达强度明显高于浸润深度小于1/2层。而肿瘤直径≥2 cm的表达也明显高于肿瘤直径小者,提示肿瘤越大,肌层侵犯越深,HE4的表达越强。子宫内膜癌的预后危险因素有:非子宫内膜样癌或低分化腺癌、深肌层浸润、脉管间隙受累、肿瘤体积大、宫颈转移、淋巴结转移和子宫外转移等[21]。研究中发现HE4高表达与组织FIGO分期、分化程度、及深肌层浸润及癌灶大小有关,这表明随着病情的发展和恶性程度的增高,HE4在子宫内膜癌组织中明显过度表达,提示HE4的高表达参与了子宫内膜癌的进展,同时HE4与子宫内膜癌的预后密切相关,HE4可以作为侵袭进展的标志以及决定预后的重要指标。在本研究中HE4血清水平与晚期子宫内膜癌以及子宫肌层的深部入侵和原发肿瘤直径密切相关,血清HE4水平的增加和较差的预后因素相关。
有研究显示:子宫内膜受到激素水平的严格控制,或其受体的变化影响,而这也可能导致子宫内膜癌细胞中的高HE4水平[22]。应用组织微阵列和实时PCR研究证实子宫内膜腺癌和浆液性类型的子宫内膜癌中的HE4高水平表达,笔者的研究结果与既往一致,HE4的表达不论是在雌孕激素受体表达阳性的子宫内膜腺癌或恶性程度高的特殊类型的子宫内膜癌中都有较高表达率,其差异无统计学意义(P>0.05)。这与Galgano等[19]应用寡核苷酸芯片mRNA杂交和组织芯片免疫组化法检测结果相同:即16例子宫内膜癌组织中90%的HE4为阳性,并且与组织病理类型无关。
文献[23-25]报道血清HE4水平和年龄有关,蔡斌等[24]检测健康妇女血清HE4水平,分析913例不同年龄层次中,血清HE4水平在<60岁组和≥60岁组比较,差异有统计学意义(P<0.01)。但在<60岁各年龄组血清HE4水平比较差异无统计学意义(P>0.05)。根据ROC曲线,老年组曲线下面积最小,提示HE4诊断青中年卵巢癌的能力优于老年卵巢癌。国外也有报道指出在1591例受试人群中年龄是影响血清HE4浓度的重要因素。本研究中HE4在老年组子宫内膜癌组织中的阳性表达率略高于中青年组,可能与多数老年组患者细胞分化程度差和肌层浸润发生率高有关,但不同年龄组比较差异无统计学意义(P>0.05),提示HE4在组织中的表达与年龄无关。这与杨彩虹等[4]的研究结果一致。分析血清中分泌的HE4的水平增高可能是老年人肾小球滤过率低的原因。但是,本研究的研究对象只讨论恶性子宫内膜组织中HE4表达水平与年龄的关系,由于病例资料收集的局限性及试验方法的单一,以后可能需要扩大样本并辅以血清学的诊断方法联合试验以进一步证实。
综上所述,HE4基因的高表达在子宫内膜癌的侵袭、进展等方面关系密切。但目前除了将血清学HE4用于临床诊断及监测外,从分子机制水平探索HE4在子宫内膜癌的发病机制有更大的意义,从而为子宫内膜癌治疗的寻找新思路。
[1]曹泽毅.中华妇产科学临床版[M].北京:人民卫生出版社,2010:618-632.
[2] Angioli R,Miranda A,Aloisi A,et al.A critical review on HE4 performance in endometrial cancer: where are we now?[J]. Tumour Biology the Journal of the International Society for Oncodevelopmental Biology & Medicine,2013,35(2):881-887.
[3] Moore R G,Brown A K,Miller M C,et al.Utility of a novel serum tumor biomarker HE4 in patients with endometrioid adenocarcinoma of the uterus[J].Gynecologic Oncology,2008,10(2):196-201.
[4]杨彩虹,徐永辉,张雪玉.人附睾蛋白4在EC组织及血清中的表达及临床意义[J].中国肿瘤临床,2011,38(9):516-519.
[5] Li J,Dowdy S,Tipton T,et al.HE4 as a biomarker for ovarian and endometrial cancer management[J].Expert Review of Molecular Diagnostics,2009,9(6):555-566.
[6] Kirchhoff C,Habben I,Ivell R,et al.A major human epididymis-specific cDNA encodes a protein with sequence homology to extracellular proteinase inhibitors[J].Biology of Reproduction,1991,45(2):350-357.
[7]张丹凤,孙盛梅,窦鹏挥,等.子宫内膜样腺癌患者血清及组织人附睾蛋白表达及其临床意义[J]. 中国老年学杂志,2014,34(16):4497-4499.
[8] Desouza L V,Grigull J,Ghanny S,et al.Endometrial carcinoma biomarker discovery and verification using differentially tagged clinical samples with multidimensional liquid chromatography and tandem mass spectrometry[J].Molecular & Cellular Proteomics Mcp,2007,6(7):1170-1182.
[9] Li H,Desouza L V,Ghanny S,et al.Identification of candidate biomarker proteins released by human endometrial and cervical cancer cells using two-dimensional liquid chromatography/tandem mass spectrometry[J].Journal of Proteome Research,2007,6(6):2615-2622.
[10] Chhikara N,Saraswat M,Tomar A K,et al.Human epididymis protein-4 (HE-4): a novel cross-class protease inhibitor[J].Plos One,2012,7(11):e47 672.
[11] Morisset D,Bourbonnais Y,Tremblay G M.Proteins with wheyacid-protein motifs and cancer[J].Lancet Oncology,2006,7(2):167-174.
[12] Micci F,Teixeira M R,Haugom L,et al.Genomic aberrations in carcinomas of the uterine corpus[J].Genes Chromosomes & Cancer,2004,40(3):229-246.
[13] Dekken H V,Alers J C,Riegman P H J,et al.Molecular cytogenetic evaluation of gastric cardia adenocarcinoma and precursor lesions[J].American Journal of Pathology,2001,158(6):1961-1967.
[14]郭冰沁,俞岚.HE4、NF-κB和MMP-9在卵巢上皮性肿瘤中的表达及其临床意义[J].中国组织化学与细胞化学杂志,2011,20(6):578-583.
[15] Li J,Chen H,Mariani A,et al.HE4(WFDC2) Promotes Tumor Growth in Endometrial Cancer Cell Lines[J].International Journal of Molecular Sciences,2013,14(3):6026-6043.
[16]房青,王在,游嘉,等.RNA干扰下调HE4基因表达对人卵巢癌SK-OV-3细胞增殖和侵袭的影响[J].中国医药生物技术,2014,9(1):20-25.
[17] Berry N B,Cho Y M,Harrington M A,et al.Transcriptional targeting in ovarian cancer cells using the human epididymis protein 4 promoter[J].Gynecologic Oncology,2004,92(3):896-904.
[18] Drapkin R,von Horsten H H,Lin Y,et al.Human epididymis protein 4(HE4) is a secreted glycoprotein that is overexpressedby serous and endometrioid ovarian carcinomas[J].Cancer Research,2005,65(6):2162-2169.
[19] Galgano M T,Hampton G M,Jr F H.Comprehensive analysis of HE4 expression in normal and malignant human tissues[J].Modern Pathology An Official Journal of the United States & Canadian Academy of Pathology Inc,2006,19(6):847-853.
[20] Bignotti E,Tassi R A,Calza S,et al.Secretoglobin expression in ovarian carcinoma: lipophilin B gene upregulation as an independent marker of better prognosis[J].Journal of Translational Medicine,2013,11(1):1-11.
[21]乐杰,张淑兰.妇产科学[M].6版.北京:人民卫生出版社,2004:313-314.
[22] Jiang S W,Chen H,Dowdy S,et al.HE4 transcriptionand splice variants-specific expression in endometrial cancer and correlation with patient survival[J].International Journal of Molecular Sciences,2013,14(11):22 655-22 677.
[23]胡晓舟,崔丽艳,张捷.健康人群HE4水平参考区间的初步探讨[J].中华检验医学杂志,2009,32(12):1376-1378.
[24]蔡斌,席晓薇,刘雪莲,等.HE4在EC诊断中的应用价值探讨[J].实用妇产科杂志,2012,28(5):354-356.
[25]蔡斌,刘雪莲,杨懿霞,等.913例健康体检女性血清HE4水平分布的初步观察[J].实用妇产科杂志,2012,28(12):1045-1047.
Expression and Clinical Significance of Human Epididymis Secretory Protein 4 in Endometrial Carcinoma/
SUN Run-jiao,JIN Xian-yu,LIU Gui-xiang,et al.//
Medical Innovation of China,2016,13(30):001-007
Objective:Through the detection of human epididymis secretory protein 4(HE4) expression in endometrial carcinoma and correlation study of HE4 and different clinical and pathological features,explore the diagnosis of endometrial cancer,the clinical significance of the treatment and prognosis.Method:The paraffin embedded specimens of 32 cases of endometrial carcinoma were confirmed by pathological examination,they were detected by using the two step method of immunohistochemical staining for HE4.The relations of the expression of HE4 in endometrial carcinoma and FIGO staging,pathological type,histological grade,myometrial invasion,tumor size and age differences between groups were analyzed,and its relationship with clinicopathological features of endometrial carcinoma was analyzed.Result:(1)HE4 positive particles were mainly localized in the cell membrane and cytoplasm,and the positive expression rate of HE4 in 32 cases of endometrial carcinoma was higher,which was 87.5%.(2)The positive expression rate and intensity of HE4 in the endometrial carcinoma tissues of the high differentiation group were higher than those in the low and middle differentiation group(P<0.05).(3)The positive expression rate and the expression intensity of HE4 protein in advanced endometrial carcinoma were higher than those in the early stage(P<0.05).(4)The positive expression of HE4 protein in endometrial carcinoma was not related to the age,pathological type, depth of invasion and tumor size(P>0.05),but in the HE4 positive expression level,deep myometrial invasion strong positive expression(61.5%) than no deep myometrial invasion(36.8%),the diameter of the tumor was greater than 2 cm strong positive expression(61.1%)is higher than the diameter <2 cm tumor(28.6%),the differences were statistically significant (P<0.05). Conclusion:The high expression of HE4 gene is closely related with the invasion and progression of endometrial carcinoma,it can be used as a marker for the progression of tumor invasion and an important index of evaluating the prognosis of endometrial carcinoma.
Human epididymis secretory protein 4; Endometrial carcinoma; Immunohistochemical method; Prognosis
辽宁省大连市医学研究科研课题(WSJ/KJC-01-JL-01)
①辽宁省庄河市中心医院 辽宁 庄河 116400
②辽宁省大连市中心医院
③辽宁省庄河市妇幼保健医院
④大连大学附属新华医院
高言国
10.3969/j.issn.1674-4985.2016.30.001
(2016-06-22) (本文编辑:郎威)
