Cd2+处理后麻雀脑组织中糖皮质激素受体和盐皮质激素受体表达变化
2016-12-09索丽娟罗磊高学斌赵洪峰
索丽娟, 罗磊, 高学斌, 赵洪峰
(1.陕西省动物研究所,西安710032;2.陕西师范大学生命科学学院,西安710119)
Cd2+处理后麻雀脑组织中糖皮质激素受体和盐皮质激素受体表达变化
索丽娟1, 罗磊1, 高学斌1, 赵洪峰2*
(1.陕西省动物研究所,西安710032;2.陕西师范大学生命科学学院,西安710119)
目的 检测在Cd2+处理后糖皮质激素受体(GR)和盐皮质激素受体(MR)在麻雀Passermontanus脑组织中的表达变化。方法 6只麻雀随机分成2组,每组3只。处理组饮水中添加500 μg·L-1Cd2+,对照组不添加。用ClustalW2将麻雀的GR和MR氨基酸序列与其他物种氨基酸序列进行相似性比对分析。采用Real-time PCR检测基础水平下麻雀各组织中GR和MR基因的表达水平。Cd2+处理后,测定GR和MR基因在脑组织中的表达变化。结果 麻雀与斑胸草雀Taeniopygiaguttata和原鸡Gallusgallus的GR和MR氨基酸序列的相似性大于90%;GR和MR基因在麻雀肝脏、肠、心脏、眼球、脑、肺、肌肉、肾脏和性腺9个组织中均有表达;Cd2+处理后,处理组脑组织中GR和MR mRNA表达水平均上调,且显著高于对照组(P<0.05)。结论 GR和MR在麻雀各组织中广泛表达;推测GR和MR基因在Cd2+的应激反应中具有重要作用,具体作用还有待于进一步论证,同时该研究为野外工作提供了一定的实验依据。
糖皮质激素受体;盐皮质激素受体;麻雀;基因表达;应激
鸟类是野生动物的一个重要类群,是食物链中的高级消费者。鸟类广泛分布于不同生态环境以及生态环境中的不同生态位,生活史较为复杂,寿命较长,体温高,代谢速率快,从环境中获取物质相对多,对自然环境变化较为敏感(Donaldetal.,2001;Gregoryetal.,2005)。另一方面,鸟类生理行为(内分泌和组织发育)对于重金属污染物有显著的响应(Janssensetal.,2003;Burger & Eichhorstetal.,2005,2007;Carereetal.,2010),因而常被作为环境污染的代表性指示物种。
重金属镉(Cd)是动物体内的非必需元素,属于环境内分泌干扰物,具有激素效应,对生殖和内分泌功能有较大的影响(Messner & Bernhard,2010)。随着现代工农业的发展,Cd2+被大量释放,对环境造成了污染。通过测定鸟体组织(Burger & Eichhorst,2005;张丹等,2013;Luoetal.,2015)中重金属的含量可以反映鸟类所处环境中的重金属浓度。但该方法不足以反映重金属污染的实际毒理效应,所以本研究拟从分子水平上探讨重金属污染对鸟类的影响。
长期的Cd2+污染对鸟是一种慢性应激刺激,Cd2+往往通过取食、饮水、呼吸等途径在鸟体内积累。鸟类应激反应的最早表现为糖皮质激素(glucocorticoid,GC)浓度升高(Sapolskyetal.,2000;Romero,2004)。GC由肾上腺分泌,是下丘脑-垂体-肾上腺(hypothalamus-pituitary-adrenal,HPA)轴激活的终产物,同时可以负反馈调节HPA轴,抑制HPA轴的活性(Aguilera,1998),也可以动员能量储备,调节一系列激素的合成和作用,抑制免疫系统功能,并促进避害和自我维持行为(Wingfield & Kitaysky,2002;邓琼,2014),其功能的发挥往往依赖糖皮质激素受体(glucocorticoid receptors,GR)和盐皮质激素受体(mineralocorticoid receptors,MR)(Duetal.,2014)。GR和MR作为核受体可以调控基因转录(基因组反应)(Oitzletal.,2010),同时也可以介导快速的非基因组反应(Groenewegetal.,2011,2012)。在脊椎动物中,GR和MR的核苷酸和氨基酸序列高度保守(Kwoketal.,2007;Okaetal.,2013)。斑胸草雀TaeniopygiaguttataGR和MR的部分DNA片段已经被克隆(Hodgsonetal.,2007),并成功预测出全长cDNA,且正确性已经被表达序列标签(expressed sequence tag)技术证实(Warrenetal.,2010)。
麻雀Passermontanus是一种常见的杂食性雀形目留鸟,数量庞大,分布广泛,且易于获取,实验室饲养技术成熟,所以被选为本实验的研究对象。首先,将麻雀的GR和MR氨基酸序列与其他物种的进行相似性比较;其次,通过Real-time PCR测定基础水平下GR和MR基因在麻雀不同组织中的表达状况;然后比较Cd2+处理前、后麻雀脑组织中GR和MR基因表达的变化。本研究旨在探讨秦岭水域附近麻雀体内GR和MR基因表达水平变化能否作为监测秦岭水源涵养区重金属污染的敏感标志物之一,并为其提供实践基础和理论依据。
1 材料与方法
1.1 材料
1.1.1 实验对象 6只麻雀购于陕西省西安市朱雀路花鸟鱼虫市场,体质量19.6~20.3 g,均健康无病,饲养在陕西师范大学生命科学学院动物实验室。适应性饲养1周后,随机分成2组,每组3只。处理组饮水中含有500 μg·L-1Cd2+,对照组不添加Cd2+。实验期间,麻雀可以自由取食饮水,食物(带壳的谷子)充足,每日换水3次(早、中、晚)。
1.1.2 主要试剂 RNAiso Plus试剂盒(TaKaRa),氯仿(天津市天力化学试剂有限公司),异丙醇(天津市天力化学试剂有限公司),无水乙醇(天津市天力化学试剂有限公司),焦碳酸二乙酯(DEPC,Amresco),琼脂糖(Biowest Agarose),FastQuant cDNA第一链合成试剂盒[天根生化科技(北京)有限公司],Taq酶(TaKaRa),普通琼脂糖凝胶回收试剂盒[天根生化科技(北京)有限公司],SYBR®PremixExTaqTMⅡ(TaKaRa)。
1.1.3 主要仪器 CFX96 TouchTM荧光定量PCR检测仪(Bio-Rad),高速冷冻离心机(Thermo),Nanodrop分光光度计(Thermo),凝胶成像分析系统(Bio-Rad)。
1.2 方法
1.2.1 总RNA提取 饲养15 d后处死麻雀,解剖取其肝脏、肠、心脏、眼球、脑、肺、肌肉、肾脏和性腺9个组织,液氮浇冻研磨。研磨后按RNAiso Plus试剂盒说明书提取麻雀各组织RNA。1%琼脂糖凝胶电泳检测总RNA完整性。用Nanodrop分光光度计测定RNA样品浓度和OD260/OD280值。样品存于液氮中备用。
1.2.2 总RNA反转录 用DEPC水稀释每个RNA样品浓度至1 μg·μL-1。以此为模板按FastQuant cDNA第一链合成试剂盒说明书合成cDNA第一链。将反转录产物置于-20 ℃保存备用。
1.3 Real-time PCR反应检测体系
根据GenBank中报道的麻雀GR(登录号:KJ414462.1)和MR(登录号:KJ414463.1)基因序列,利用Primer 5设计引物,由上海华大基因科技有限公司合成(表1)。
利用CFX96 TouchTM荧光定量PCR检测仪对各基因的表达情况进行检测,反应体系如下:0.5 μL 20 μmol·μL-1的上、下游引物,1 μL反转录产物,12.5 μL SYBR®PremixExTaqTMⅡ,10.5 μL ddH2O。反应条件为95 ℃30 s;95 ℃5 s,56 ℃30 s,72 ℃30 s,35个循环;在最后1个循环结束后做熔解曲线,温度65 ℃~95 ℃。同一样品重复3个反应。结果采用2-△Ct和2-△△Ct法进行相对表达分析,以β-actin作为内参基因对结果进行标准化。
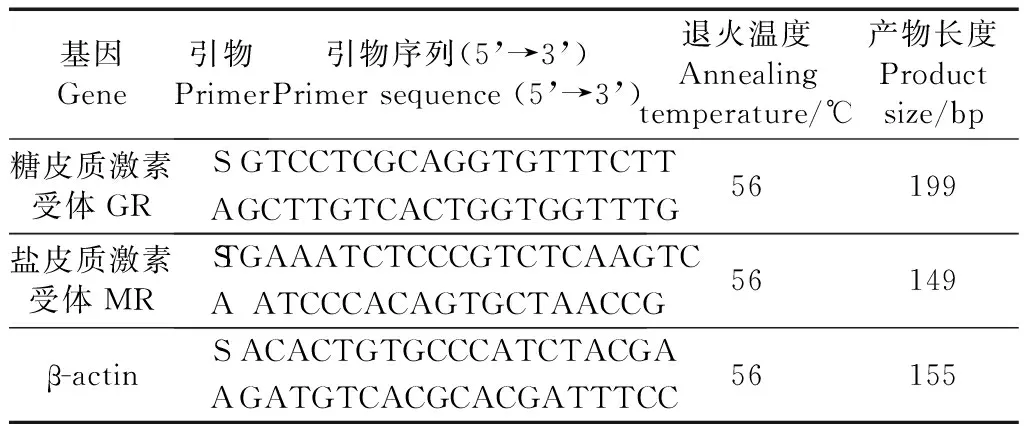
表1 实验引物的相关信息
1.4 数据分析
2 结果
2.1 麻雀GR和MR氨基酸序列相似性分析
在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)中获得8个物种GR和MR的氨基酸序列,采用ClustalW2进行相似性分析(表2)。结果表明,麻雀与斑胸草雀、原鸡Gallusgallus的氨基酸序列相似性较高,均高于90%,与斑马鱼Daniorerio的相似性最低,仅为54.70%。
2.2 GR和MR基因在基础水平各组织的表达分析
采用Real-time PCR检测到GR和MR mRNA在麻雀各组织中均有表达,其在心脏和肌肉中的相对表达量高于其他组织,肝脏、眼球、脑和肺次之,肠、肾脏和性腺较低。脑中的相对表达量与其他各组织相比,差异有统计学意义(P<0.05)(图1)。

表2 麻雀与其他8个物种糖皮质激素受体和盐皮质激素受体氨基酸序列的比对
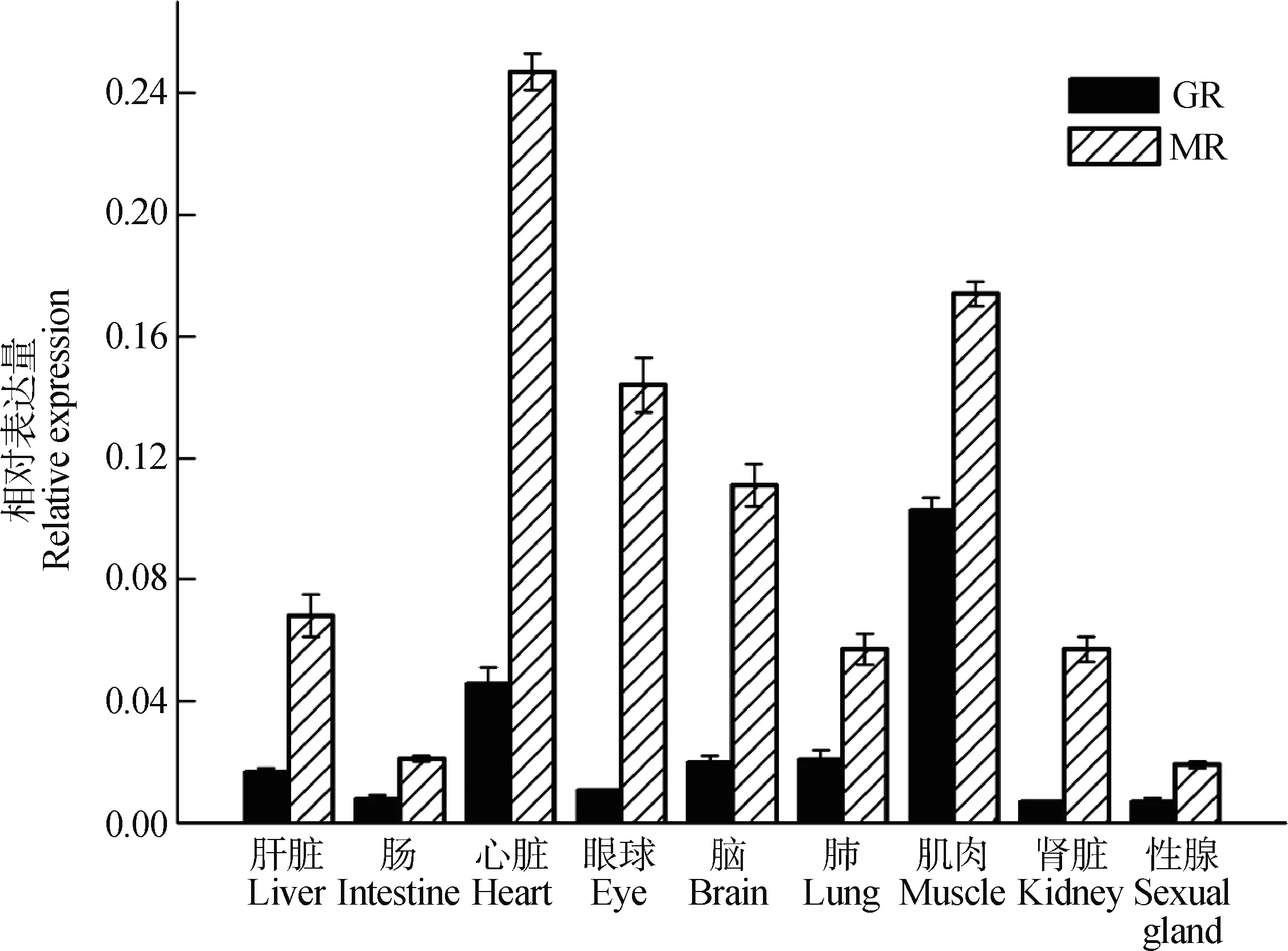
图1 在麻雀不同组织中糖皮质激素受体(GR)和盐皮质激素受体(MR) mRNA的相对表达量(结果用2-△Ct分析)
2.3 Cd2+对麻雀脑组织GR和MR基因表达的影响
在饮水中加入500 μg·L-1Cd2+15 d后,处理组麻雀脑组织中GR和MR mRNA的表达水平均上调,且显著高于对照组(P<0.05)(图2)。
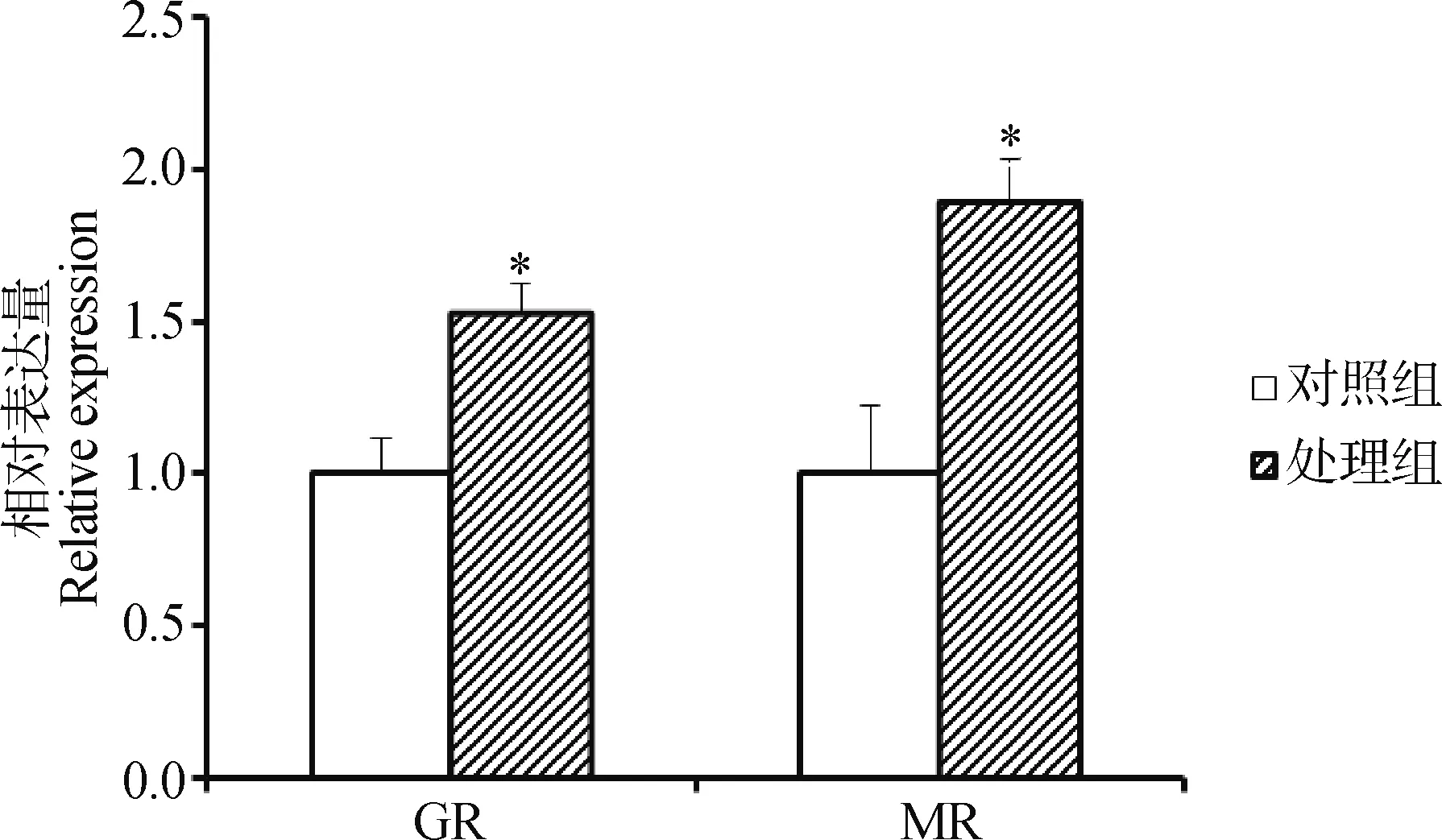
图2 Cd2+对麻雀脑组织中糖皮质激素受体(GR)和盐皮质激素受体(MR) mRNA表达量的影响 (结果用2-△△Ct分析)
3 讨论
GR和MR因参与GC的下游调控而备受关注。ClustalW2分析结果表明,麻雀的GR和MR氨基酸序列与其他鸟类、鱼类、两栖类、爬行类和哺乳类存在相似性。与斑胸草雀的相似性最高,这与它们同属于雀形目是相对应的。另外,有研究表明,GR和MR在家麻雀P.domesticus和斑胸草雀中广谱表达并且参与应激反应(Schmidtetal.,2010;Lattin & Romero,2014),推测麻雀的GR和MR基因也具有类似的分布特征和功能。
对麻雀基础水平下GR和MR基因的组织表达分析是研究这2个基因功能的重要基础工作。本实验随后测定了麻雀不同组织中GR和MR mRNA的相对表达量。Real-time PCR结果分析显示,GR和MR在麻雀的9个组织中均有表达,与家麻雀(Lattinetal.,2012)和斑胸草雀(Schmidtetal.,2010)的研究结果类似,且在肌肉、心脏中表达较高。总体来说,在具有代谢功能的组织中GR和MR表达相对较高,如肝脏是糖异生的主要场所,肾脏是第二场所,肌肉中可以产生糖异生的底物——氨基酸,这些组织可能参与应激反应时的能量动员。
应激反应中,GC的浓度会随着机体生理、环境和社会等因素的变化而变化(Lattinetal.,2012)。GC通过与GR和MR结合发挥生物学效应,并且这2种受体与GC的亲和力不同。MR与GC的亲和力高于GR,低水平GC优先与MR结合,高水平GC优先与GR结合(Oitzletal.,2010)。高水平的GC与GR结合之后,GR被激活,GR-GC复合物进入细胞核内,对下游促炎转录因子发挥转录抑制的调节作用,进而达到抗炎的效应(de Kloetetal.,2005)。另外,在代谢性组织(肌肉、肝脏、脂肪等)中GR-GC可以与GC应答元件结合,促进参与糖异生、蛋白分解和脂肪分解相关基因的转录表达(Poletietal.,2015)。哺乳动物大脑富含GR和MR,而GR和MR共同参与HPA轴的负反馈调节 (Rozeboometal.,2007;Oitzletal.,2010)。在应激反应中,大脑中的MR主要负责维持神经元的完整性和稳定性(Oitzletal.,2010),GR通过抑制HPA的过度反应使GC恢复到基础水平(Tasker & Herman,2011)。为了解Cd2+处理后,麻雀脑组织中GR和MR的表达变化,本实验在麻雀饮水中添加500 μg·μL-1Cd2+15 d后,对其脑组织中MR和GR mRNA表达水平进行检测,结果显示GR和MR mRNA表达水平均显著上调。有研究表明,MR过表达的雄性转基因小鼠脑组织中的GC水平低于正常小鼠,由此可见,MR过表达可能会降低GC水平(Kanatsouetal.,2015)。综上所述,推测上调的MR和GR mRNA都有可能降低GC浓度并使其恢复到正常的水平。随着时间的延长,GC是否会恢复到正常水平,长时间Cd2+刺激是否会引起大脑的病理变化,还有待进一步研究。
邓琼. 2014. 垂体促肾上腺皮质激素细胞的糖皮质激素快速反馈机制研究[D]. 长春: 吉林大学.
张丹, 张军, 欧阳盼, 等. 2013. 南昌市常见鸟类对环境中Cu、Pb、Cd重金属污染物的指示作用研究[J]. 江西师范大学学报(自然科学版), 37(3): 319-323.
Aguilera G. 1998. Corticotrophin releasing hormone, receptor regulation and the stress response[J]. Trends in Endocrinology & Metabolism, 9(8): 329-336.
Burger J, Eichhorst B. 2005. Heavy metals and selenium in grebe eggs from Agassiz National Wildlife Refuge in northern Minnesota[J]. Environmental Monitoring and Assessment, 107(1-3): 285-295.
Burger J, Eichhorst B. 2007. Heavy metals and selenium in grebe feathers from Agassiz National Wildlife Refuge in northern Minnesota[J]. Archives of Environmental Contamination and Toxicology, 53(3): 442-449.
de Kloet ER, Joels M, Holsboer F. 2005. Stress and the brain: from adaptation to disease[J]. Nature Reviews Neuroscience, 6(6): 463-475.
Donald PF, Green RE, Heath MF. 2001. Agricultural intensification and the collapse of Europe's farmland bird populations[J]. Proceedings of the Royal Society of London B: Biological Sciences, 268(1462): 25-29.
Du C, Qiao B, Li Y,etal. 2014. Molecular cloning of glucocorticoid and mineralocorticoid receptors in Eurasian tree sparrowPassermontanus[J]. Ornithological Science, 13(1): 19-27.
Gregory RD, van Strien A, Vorisek P,etal. 2005. Developing indicators for European birds[J]. Philosophical Transactions of the Royal Society of London B: Biological Sciences, 360(1454): 269-288.
Groeneweg FL, Karst H, de Kloet ER,etal. 2011. Rapid non-genomic effects of corticosteroids and their role in the central stress response[J]. Journal of Endocrinology, 209(2): 153-167.
Groeneweg FL, Karst H, de Kloet ER,etal. 2012. Mineralocorticoid and glucocorticoid receptors at the neuronal membrane, regulators of nongenomic corticosteroid signalling[J]. Molecular and Cellular Endocrinology, 350(2): 299-309.
Hodgson ZG, Meddle SL, Roberts ML,etal. 2007. Spatial ability is impaired and hippocampal mineralocorticoid receptor mRNA expression reduced in zebra finches (Taeniopygiaguttata) selected for acute high corticosterone response to stress[J]. Proceedings of Biological Sciences, 274(1607): 239-245.
Janssens E, Dauwe T, Pinxten R,etal. 2003. Effects of heavy metal exposure on the condition and health of nestlings of the great tit (Parusmajor), a small songbird species[J]. Environmental Pollution, 126(2): 267-274.
Kanatsou S, Kuil LE, Arp M,etal. 2015. Overexpression of mineralocorticoid receptors does not affect memory and anxiety-like behavior in female mice[J/OL]. Frontiers in Behavioral Neuroscience, 9: 182 [2015-11-05]. http://dx.doi.org/10.3389/fnbeh.2015.00182.
Kwok AH, Wang Y, Wang CY,etal. 2007. Cloning of chicken glucocorticoid receptor (GR) and characterization of its expression in pituitary and extrapituitary tissues[J]. Poultry Science, 86(2): 423-430.
Lattin CR, Romero LM. 2014. Chronic stress alters concentrations of corticosterone receptors in a tissue-specific manner in wild house sparrows (Passerdomesticus)[J]. Journal of Experimental Biology, 217 (Pt 14): 2601-2608.
Lattin CR, Waldron-Francis K, Richardson JW,etal. 2012. Pharmacological characterization of intracellular glucocorticoid receptors in nine tissues from house sparrow (Passerdomesticus)[J]. General and Comparative Endocrinology, 179(2): 214-220.
Luo J, Ye Y, Gao Z,etal. 2015. Heavy metal contaminations and influence on the red-crowned crane (Grusjaponensis) in Wuyur catchments, northeastern China[J]. Environmental Earth Sciences, 73(9): 5657-5667.
Messner B, Bernhard D. 2010. Cadmium and cardiovascular diseases: cell biology, pathophysiology, and epidemiological relevance[J]. Biometals, 23(5): 811-822.
Oitzl MS, Champagne DL, van der Veen R,etal. 2010. Brain development under stress: hypotheses of glucocorticoid actions revisited[J]. Neuroscience and Biobehavioral Reviews, 34(6): 853-866.
Oka K, Kohno S, Urushitani H,etal. 2013. Molecular cloning and characterization of the corticoid receptors from the American alligator[J]. Molecular and Cellular Endocrinology, 365(2): 153-161.
Poleti MD, DeRijk RH, Rosa AF,etal. 2015. Genetic variants in glucocorticoid and mineralocorticoid receptors are associated with concentrations of plasma cortisol, muscle glycogen content, and meat quality traits in male Nellore cattle[J]. Domestic Animal Endocrinology, 51:105-113.
Romero LM. 2004. Physiological stress in ecology: lessons from biomedical research[J]. Trends in Ecology & Evolution, 19(5): 249-255.
Rozeboom AM, Akil H, Seasholtz AF. 2007. Mineralocorticoid receptor overexpression in forebrain decreases anxiety-like behavior and alters the stress response in mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 104(11): 4688-4693.
Sapolsky RM, Romero LM, Munck AU. 2000. How do glucocorticoids influence stress responses? Integrating permissive, suppressive, stimulatory, and preparative actions[J]. Endocrine Reviews, 21(1): 55-89.
Schmidt KL, Malisch JL, Breuner CW,etal. 2010. Corticosterone and cortisol binding sites in plasma, immune organs and brain of developing zebra finches: intracellular and membrane-associated receptors[J]. Brain Behavior and Immunity, 24(6): 908-918.
Tasker JG, Herman JP. 2011. Mechanisms of rapid glucocorticoid feedback inhibition of the hypothalamic-pituitary-adrenal axis[J]. Stress, 14(4): 398-406.
Warren WC, Clayton DF, Ellegren H,etal. 2010. The genome of a songbird[J]. Nature, 464(7289): 757-762.
Wingfield JC, Kitaysky AS. 2002. Endocrine responses to unpredictable environmental events: stress or anti-stress hormones?[J]. Integrative and Comparative Biology, 42(3): 600-609.
Expression of Glucocorticoid Receptors and Mineralocorticoid Receptors in the Brain ofPassermontanusafter Cadmium Treatment
SUO Lijuan1, LUO Lei1, GAO Xuebin1, ZHAO Hongfeng2*
(1.Shaanxi Institute of Zoology, Xi’an 710032, China; 2.College of Life Science, Shaanxi Normal University, Xi’an 710119, China)
Objective The expression levels of glucocorticoid receptors (GR) and mineralocorticoid receptors (MR) were measured in the brain ofPassermontanusafter cadmium treatment.Method SixP.montanuswere randomly divided into 2 groups.Treatment group was fed with water of 500 μg·L-1Cd2+.Alignment of amino acid sequence of GR and MR was performed using the ClustalW2.Real-time PCR was performed to study the baseline expression levels of GR and MR among different tissues.Finally, the expressions of GR and MR were determined in the brain ofP.montanusafter cadmium treatment.Result The result of amino acid sequence alignment showed that the GR and MR ofP.montanushad high similarity withTaeniopygiaguttataandGallusgallus(>90%).Real-time PCR results showed that the GR and MR expressed in all of nine detected organs and tissues.Compared with the control, the expression levels of GR and MR were significantly up-regulated after cadmium treatment (P<0.05).Conclusion The GR and MR were widely expressed in tissues ofP.montanus.GR and MR might play a significant role under the cadmium stress.This research provided the experimental evidence for fieldwork.
glucocorticoid receptors; mineralocorticoid receptors;Passermontanus; gene expression; stress
2015-11-05 接受日期:2016-03-02 基金项目:陕西省科学院重大项目(2013K-01); 国家自然科学基金项目(31372201)
索丽娟(1985—), 女, 硕士, 研究实习员, 研究方向: 秦岭水源涵养区水质污染对鸟类毒性效应, E-mail:slj1030@163.com
*通信作者Corresponding author,男, 副教授, E-mail:zhaohf@snnu.edu.cn
10.11984/j.issn.1000-7083.20150346
Q786; Q959.7
A
1000-7083(2016)03-0409-05
