转LOS5玉米的大田抗旱性鉴定
2016-12-09杨炳鹏孙宝成章家长唐怀君王天宇张登峰谢小清石云素宋燕春杨小红李建生
刘 成,杨炳鹏,孙宝成,章家长,唐怀君,王天宇,张登峰,谢小清,石云素,宋燕春 ,杨小红,黎 裕,李建生
转玉米的大田抗旱性鉴定
刘 成1,2,杨炳鹏1,孙宝成2,章家长1,唐怀君2,王天宇3,张登峰3,谢小清2,石云素3,宋燕春3,杨小红1,黎 裕3,李建生1
(1中国农业大学农学院国家玉米改良中心,北京100193;2新疆农业科学院粮食作物研究所,乌鲁木齐 830091;3中国农业科学院作物科学研究所,北京100081)
【目的】培育转基因抗旱玉米新品种是解决玉米生产问题的重要途径。通过鉴定和分析拟南芥转入玉米后对玉米田间抗旱性的影响,筛选抗旱性突出的转的玉米株系用于抗旱育种。【方法】在150、225、300、375、450和600 mm(CK)梯度灌水胁迫处理条件下,大田鉴定8个转玉米株系及其受体郑58的抗旱性,测定产量和其他农艺性状的变化,明确在提高玉米抗旱性方面的主要田间表现形式,同时筛选抗旱性显著优于受体的转基因株系。【结果】随着累计灌水量600—150 mm逐渐降低,9个试验材料的产量和抗旱性均相应下降。8个转基因玉米株系的产量在225—450 mm灌水范围内均显著高于受体郑58,且在正常灌水600 mm的一半处理(300 mm)时差异最大化。300 mm灌水处理中,8个转基因株系的抗旱性指数为0.56—0.70,显著高于受体郑58(0.5),抗旱性提高12%—40%。抗旱性从强到弱的材料顺序是T8920B6、T8920B2、T8920B7、T8920B5、T8020B1、T8920B4、T8920B3、T8920B8和受体郑58。营养体生长和发育方面,在灌水150—225 mm处理中,8个转基因材料灌浆末期的叶色SPAD值38.4—42.4,均极显著高于受体郑58(28.7—37.5),但地上部生物重量、株高和穗位高没有显著差异;果穗发育方面,在灌水150—225 mm处理中,8个转基因株系的穗重为42.3—61.6 g,穗长为10.9—13.1 cm,均极显著高于受体(36.4—40.7 g和8.5—11.8 cm),但轴重和穗粗的差异不显著;籽粒发育方面,8个转基因株系的穗粒数为86.6—182.6,行粒数为8.4—15.6,也显著高于受体的穗粒数57.3—83.2和行粒数4.9—7.1,但穗行数和百粒重差异不显著。【结论】转入受体郑58后,对转基因玉米开花前营养生长的影响较小,但在开花之后维持受旱玉米的穗长、行粒数和灌浆后期叶色等方面发挥了积极作用,使受旱玉米的穗重、穗粒数和产量保持在相对较高的水平,从而提高了玉米的抗旱性;转基因玉米株系的抗旱性均高于受体郑58,但抗旱性提高程度有显著差异,对不同转化株系进行大田抗旱性鉴定和筛选是十分必要的;正常灌水量一半的胁迫强度能最大化玉米抗旱性的差异,有利于鉴定和筛选出有利用价值的转基因材料。
玉米;;抗旱性;转基因
0 引言
【研究意义】玉米是世界三大粮食作物之一,也是需水较多、对干旱比较敏感的作物。干旱可以导致玉米生长发育受阻、产量降低。因此,挖掘玉米抗旱基因,运用转基因技术培育抗旱玉米新品种,对提高干旱半干旱地区玉米的稳产性意义重大。【前人研究进展】近年来,转基因技术在玉米抗旱新品种培育中得到越来越多的应用[1]。转化的基因类型包括:(1)功能基因,如玉米磷脂酶C1基因[2]、玉米磷脂酰肌醇合成酶基因[3]、细菌甘氨酸肌氨酸甲酰转移酶基因[4]、细菌二甲基甘氨酸甲酰转移酶基因[4]、大肠杆菌胆碱脱氢酶基因[5-6]、盐芥液泡氢离子-焦磷酸酶基因[6-7]、大肠杆菌谷氨酸脱氢酶基因[8]等;(2)蛋白激酶基因,如烟草蛋白基因[9]等;(3)转录因子基因,如盐芥[10]、玉米[11]、玉米[12]。这些基因转入玉米植株后抗旱性均得到提高。Castiglioni等[13]把大肠杆菌冷休克蛋白基因和枯草杆菌冷休克蛋白基因转移到玉米中培育的抗旱品种在美国已产业化。已有研究表明,脱落酸(ABA)在植物对干旱胁迫的响应中具有重要作用[14],ABA合成过程中的多种酶类均有可能对植物抗旱性产生影响。2001年Xiong等[15]通过突变体在拟南芥中克隆到,该基因编码钼辅因子(MOCO)硫化酶,催化MoCo硫酸化形式的产生,而该形式的MoCo是植物中ABA生物合成途径最后一步起作用的醛氧化酶所必需的辅助因子,证明是调节多种逆境胁迫和ABA合成的关键调节因子。拟南芥转入水稻[16]、棉花[17]、大豆[18]和烟草[19]后,转基因植株均表现出良好的抗旱性;在转基因甘薯[20]和黄瓜[21]中还表现出耐盐性和耐冷性。该基因转入玉米后,耐盐性得以提高[22];转基因植株醛氧化酶活性显著提高,ABA积累增多,抗旱性也得到增强[23]。因此,在植物抗干旱胁迫中起着重要的调控作用,可能具有重要的育种应用价值。【本研究切入点】在前期工作中,通过农杆菌介导的方法转化玉米幼胚,获得了的单拷贝转基因玉米株系,盆栽条件下鉴定了其抗旱性,但缺乏大田抗旱性鉴定验证。且转基因玉米株系在农艺性状和产量性状等方面的抗旱性具体表现仍不明确。为了更好地了解的作用并筛选抗旱性突出的转化株系,需要进一步进行田间抗旱性鉴定研究。【拟解决的关键问题】本研究通过对8个不同的转株系及受体郑58进行不同生育时期的梯度灌水胁迫处理,分析转不同株系材料在干旱胁迫后农艺性状和产量性状的变化以及抗旱性差异,明确抗旱性的具体田间表现形式,筛选抗旱性最为突出的转基因玉米株系。为抗旱转基因玉米新品种培育提供依据。
1 材料与方法
1.1 试验材料
试验材料共9份,其中1份为转基因受体郑58(Z58),另外8份是转入郑58的不同转化株系,分别为T8920B1(B1)、T8920B2(B2)、T8920B3(B3)、T8920B4(B4)、T8920B5(B5)、T8920B6(B6)、T8920B7(B7)和T8920B8(B8),这8份转化材料,是运用农杆菌介导法,将来自拟南芥的编码钼辅因子(MOCO)硫化酶基因在ubiquitin启动子启动时分别以正义和反义2个方向转入玉米幼胚中所获得的单拷贝转基因株系,属于不同的转化事件。PCR和Southern blotting证明外援基因已被整合到转化植株及其后代的玉米基因组中[23],遗传稳定,抗旱表型突出,具有郑58遗传背景。
1.2 试验方法
试验于2010年在新疆乌鲁木齐市北郊新疆农业科学院安宁渠试验场进行。试验区土壤肥力水平中等。2010年试验场玉米生长期5—9月份的降雨量分别为26.2、31.2、13.2、12.5和5.1 mm,合计62.0 mm。试验采用梯度水分胁迫处理[24],5个干旱胁迫处理和1个正常灌水对照,共6个水分处理区,每个处理内3次重复,随机区组。处理之间及四周均设置5 m以上水分隔离带。每个材料4行,行长5 m,行距0.6 m,株距0.3 m。每次每个处理灌水75 mm(750 m3·hm-2)。6个水分处理的总灌水量分别为150、225、300、375、450和600 mm(CK),每1 mm灌水量等价于10 m3·hm-2。具体灌水时间见表1。
1.3 抗旱性评价方法
干旱胁迫后调查各材料的抽雄期、扬花期、吐丝期、叶片萎蔫及卷曲度,收获前分别测定株高、穗位高和有效穗数,收获后测定单株穗重和生物干重,室内考种测定单株粒重、穗粒数和千粒重。用3个重复的单株粒重平均值作为产量衡量指标[25],用抗旱系数(drought resistant coefficient)评价抗旱性[26]。
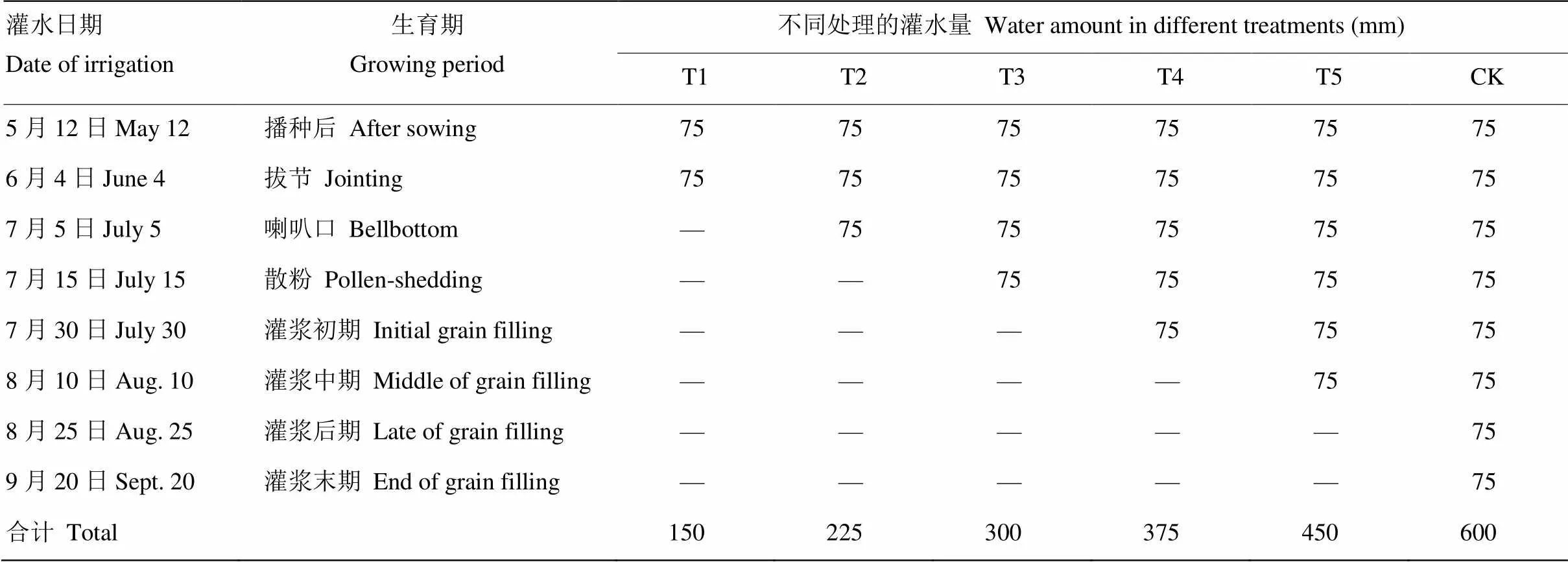
表1 不同处理的灌水时间和灌水量
—表示终止灌水。T1、T2、T3、T4、T5为5个不同的水分胁迫处理,CK为正常灌水处理
— refers to no irrigation. T1, T2, T3, T4 and T5 refer to five water stress treatments, and CK refers to the normal irrigation
抗旱系数=水分胁迫处理区的产量/正常灌水对照区的产量。
用SPAD-502仪测定灌浆后期叶片的SPAD 叶色值(soil and plant analyzer development leaf color)[27]。
1.4 数据分析
用Excel和Statistica7.0软件对数据进行统计分析。采用单因素方差ANOVA和Duncan新复极差法分析每个水分处理区材料之间的差异。
2 结果
2.1 水分胁迫后转基因玉米营养生长的变化
正常灌水条件下(600 mm),8个转基因材料灌浆后期的叶色与受体郑58(Z58)相比无显著差异,而当灌水量下降到225和150 mm后,8个转基因材料的叶色SPAD值为38.4—42.4,极显著高于受体(28.7—37.5),方差分析值分别为42.92**和19.97**,而转基因材料之间无明显差异(图1-A)。
地上部单株鲜重虽然随着灌水量的减少而大幅下降,但8个转基因材料与受体在相同灌水处理中差异不显著(图1-B)。
转基因材料和受体郑58在正常灌水(600 mm)和轻度干旱胁迫(375 mm)条件下的株高和穗位高度存在差异显著。方差分析表明,在600、375、225和150 mm灌水条件下,株高检验值分别为13.09**、3.80**、2.54*和0.751,穗位高检验值分别为19.29**、3.04*、1.394和0.760,表明在正常灌水条件下,9个材料之间的株高和穗位差异在干旱胁迫加大后逐渐减小。从图1-C和图1-D可以看出,株高的差异和穗位高的差异主要存在于8个转基因材料之间,转基因材料与受体郑58(Z58)相比则无明显差异。
以上结果表明,在营养器官的生长发育方面,有明显延缓干旱条件下玉米叶片衰老、保持后期叶绿素含量的效应,但对地上部生物产量、株高和穗位高影响相对较小。
2.2 水分胁迫后转基因玉米穗部性状的变化
在正常条件(灌水600 mm)和轻度干旱胁迫(灌水450 mm)条件下,转基因材料与受体之间的穗重和轴重无显著差异,但在灌水量150和225 mm的中高强度胁迫条件下,8个转基因材料的穗重为42.3—61.6 g,显著高于受体的穗重36.4—40.7 g(值分别为9.74**和8.40*,图2-A),但轴重未达到显著水平(图2-B)。

图2 不同灌水量处理8个LOS5转基因材料与受体郑58(Z58)的穗重(A)、轴重(B)、穗长(C)和穗粗(D)的变化比较
在正常条件(灌水600 mm)和轻度干旱胁迫(灌水450 mm)条件下,转基因材料与受体之间的穗长和穗粗均无显著差异,在当灌水量下降到150和225 mm后,8个转基因材料的穗长为10.9—13.1 cm,极显著高于受体的8.5—11.8 cm(值分别为5.18**和3.02**,图2-C、图2-D)。
以上表明,在维持受旱玉米的穗长和穗重方面有积极作用,而对穗粗和轴重的影响相对较小。
2.3 水分胁迫后转基因玉米籽粒性状的变化
在150—600 mm灌水范围内,转基因材料B1—B8的穗行数差异只在灌水375 mm处理中达到显著水平(=2.54*),相对于受体差异则不显著(图3-A)。在灌水量375—600 mm灌水条件下,9个玉米材料的穗行数和行粒数变化较小,而在灌水量下降到150—225 mm后行粒数大幅下降,此区间中8个转基因材料行粒数为8.4—15.6,极显著高于受体郑58的4.9—7.1(=10.12**和34.87**,图3-B)。

图3 不同灌水量处理8个LOS5转基因材料与受体郑58(Z58)穗行数(A)、行粒数(B)、穗粒数(C)和百粒重(D)的变化比较
在灌水量375、450和600 mm的处理中,9个材料的穗粒数没有明显差异,而在灌水量150和225 mm处理中,8个转基因材料的穗粒数为86.6—182.6,极显著高于受体郑58的57.3—83.2(值10.63**和29.14**,图3-C)。其中,以B2和B6的穗粒数下降最少。随着灌水量的减少,百粒重也有明显的下降趋势,但转基因材料与受体相比,差异不显著(图3-D)。
以上分析表明,与受体相比,转玉米在受旱后有保持穗粒数和行粒数较高水平的作用,而对百粒重和穗行数的影响较小。
2.4 水分胁迫后转基因玉米产量的变化
在灌水600 mm的对照中,转基因材料和受体的产量差异不显著。而随着灌水量的逐渐减少,在灌水150—375 mm,转基因材料和受体的产量均有较大幅度的下降,但8个转基因材料的产量始终显著高于受体,产量差异在正常灌水一半时(300 mm)达到最大化(=15.66**,图4)。因此,8个转基因材料均较受体抗旱。其中,受旱后产量下降最少的是材料B2和B6,这两个材料在225 mm和300 mm灌水处理中产量极显著高于受体(值10.11**和15.66**),在150 mm和375 mm处理中分别显著高于受体(值3.09*和1.85*),表现出相对突出的抗旱性。
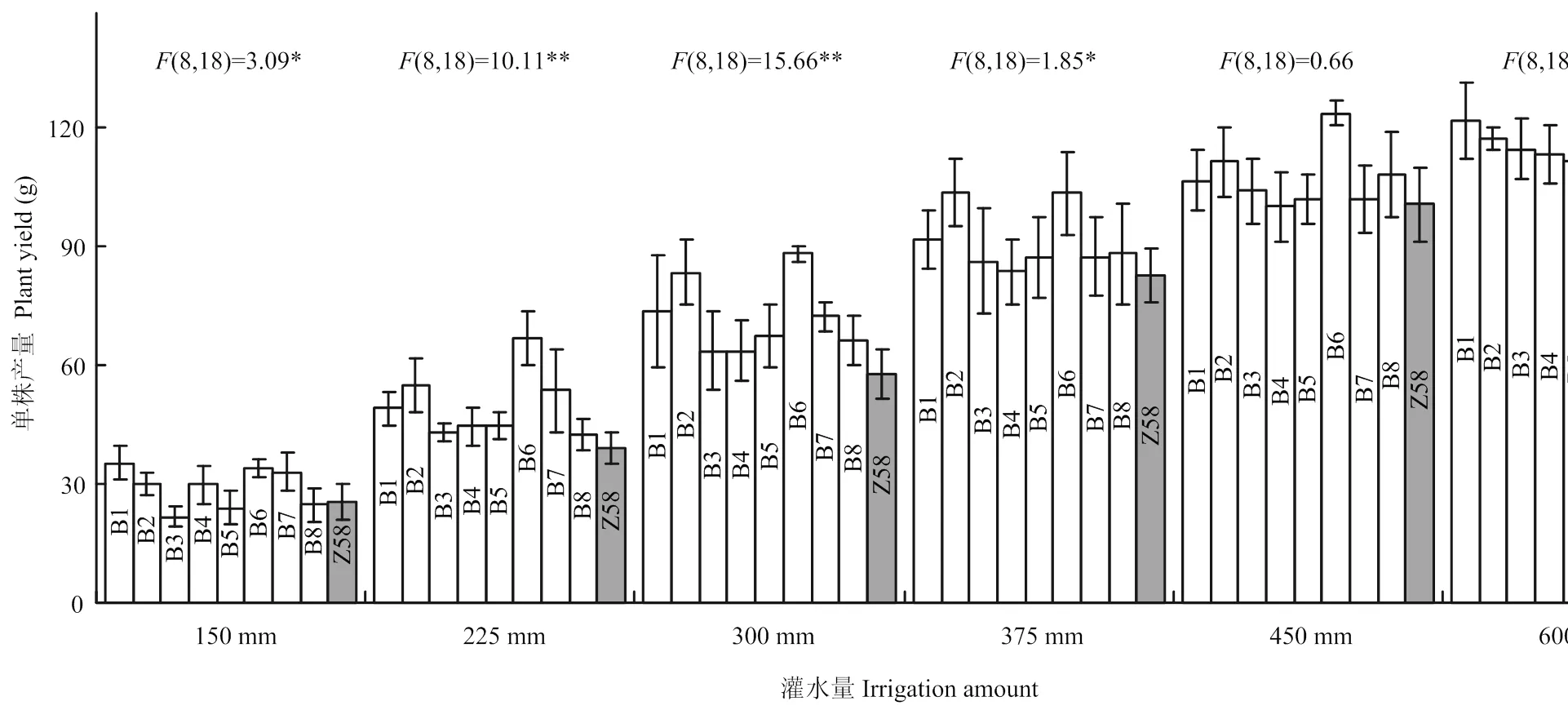
图4 不同灌水量处理的转LOS5材料的单株产量与受体郑58(Z58)的比较
2.5 水分胁迫后转基因玉米抗旱性的变化
在灌水量150—600 mm,随着灌水量的减小,9个试验材料的抗旱系数逐渐下降,但每个处理中,转基因材料的抗旱性总是较受体为高(图5)。在充分灌水(600 mm)和极端胁迫处理(150 mm)条件下,转基因材料的抗旱性与受体的抗旱性差异稍小,但在225—450 mm灌水处理区间,转基因材料与受体的抗旱性差异较大,差异最大的处理仍是300 mm处理,这与产量分析结果相一致。在300 mm灌水处理中,8个转基因株系的抗旱系数为0.56—0.70,较受体郑58的抗旱系数0.50提高12%—40%,特别是B2和B6材料在该处理中,抗旱性系数与受体的差异最为明显(图5)。按照5个胁迫处理的抗旱系数平均值排序,抗旱性从强到弱的材料顺序是B6(T8920B6)、B2(T8920B2)、B7(T8920B7)、B5(T8920B5)、B1(T8920B1)、B4(T8920B4)、B3(T8920B3)、B8(T8920B8)和Z58(郑58)。抗旱性突出的T8920B6和T8920B2转基因株系在节水50%(灌水300 mm)时抗旱系数均为0.70(产量下降30%),而同条件下受体郑58的抗旱性为0.50(产量下降50%),其抗旱性均较受体提高40%,可以用于转基因玉米新品种培育中。

图5 不同灌水量处理8个LOS5转基因材料与受体郑58(Z58)的抗旱性比较
3 讨论
脱落酸(ABA)是植物在逆境胁迫反应过程中的重要调控因子。编码ABA合成的关键酶钼辅因子(MOCO)硫化酶,脱落酸醛氧化成ABA是植物中ABA生物合成的最后一步,因此,与逆境条件下ABA的合成密切相关[15],这可能是具有抗旱应用潜力的重要原因。Lu等[23]应用农杆菌转化法把拟南芥转移到玉米优良自交系郑58中,获得了16个独立转化体。针对其中2个显性纯合的转化体进行了盆栽条件下的抗旱性鉴定评价,发现转基因植株气孔开度减小,由此导致与受体对照相比水分散失降低、相对水分含量较高;同时,转基因植株比受体对照叶片萎蔫程度降低,电解质渗出率、丙二醛和过氧化氢含量更低,抗氧化酶类和脯氨酸含量更高;此外,的过表达导致一批胁迫调控基因的表达,在复水后根系发育和生物量积累比受体对照快[22]。植物受旱后,叶片光合系统受损,叶绿素含量下降,绿色减少,叶色SPAD值降低[28-30]。陈春梅等[31]利用耐旱性不同的51个玉米自交系表明,玉米自交系在吐丝期干旱胁迫与正常灌溉条件下SPAD 的相对值与其耐旱系数呈极显著正相关, SPAD 的相对值和耐旱系数可作为其耐旱性评价指标。本研究对大田干旱胁迫下转基因玉米分析结果显示,在干旱条件下,转株系与受体郑58相比叶色SPAD值更高、持绿性更强。这说明还可能具有降低逆境胁迫条件下叶片叶绿素降解的作用。
Yue等[17]将转入棉花,获得转基因棉花株系,该株系与受体对照在自然条件下的抗旱性鉴定结果,表明转基因棉花株系抗旱性明显优于受体对照,并且转基因棉花在节水50%情况下增产效果极为显著。此外,在棉花[17]、烟草[19]、玉米[23]等作物也发现的抗旱作用。在本试验中,随着600、450、375、300、225和150 mm梯度灌水量的逐渐减少,8个转材料T8920B1—T8920B8的单株产量均有不同程度的下降,但下降量均较受体郑58少,抗旱性均高于受体郑58。在提高作物抗旱性方面可能具有普遍性。
在本试验中,在灌水量450 mm的轻度胁迫和600 mm正常灌水条件下,8个转材料和对照郑58的产量及抗旱性差异不显著。在灌水量370 mm以下的中强度干旱胁迫条件下,材料间的产量及抗旱性差异才达到显著以上水平。其中,产量差异最大的灌水处理为300 mm,即正常灌水量50%时产量差异最大。灌水量一半(本文300 mm灌水量)作为最佳的鉴定条件,能够较好区分材料的抗旱性差异,在过度胁迫(如150 mm灌水)条件下,所有材料几乎不能结实,导致抗旱系数全部接近于0,差异缩小;在胁迫不足的灌水条件下(如450 mm灌水),所有材料受胁迫伤害较轻,产量基本接近充分灌水对照区产量,难以区分材料的抗旱性差异。因此,灌水一半的中等胁迫条件有利于区分转各玉米株系的田间抗旱性。
本研究中,8个转基因玉米受旱后,在植株高度、叶片颜色、生物产量、果穗大小、籽粒数量以及产量等多方面的受旱影响均较受体郑58少,因此,转入郑58后抗旱性的表现是多方面的。但表现最突出的方面在于,一是转玉米维持了果穗长度和行粒数,确保了较高水平的穗粒数和果穗重量,使转基因玉米在胁迫条件下获得了较高的产量。抗旱转基因玉米的穗粒数下降较少与SUN的研究结果[25]一致;二是转入郑58后,极显著延长了灌浆末期叶片的持绿性,确保了灌浆的顺利进行。
试验结果也表明,相对于受体郑58而言,虽然的8个转化事件株系的抗旱性普遍得到了提高,但转化株系之间仍然存在很大的抗旱性差异。抗旱性表现最为突出的T8920B6和T8920B2株系,在节水50%(灌水300 mm)时抗旱系数均为0.7左右(产量下降30%),而同条件下受体郑58的抗旱性为0.50(产量下降50%),其抗旱性均较受体提高40%.但B8920B3和B8920B8在5个胁迫条件下的抗旱性与受体极为接近。因此,在PCR和Southern blotting证明外援基因已被整合并获得稳定遗传后代后,不同转化事件株系的抗旱性具有差异,转化事件株系的抗旱性仍然需要大田鉴定试验的确认和筛选。本研究中筛选出的T8920B6和T8920B2,可作为优良自交系用于抗旱转基因玉米新品种培育。
4 结论
在灌水225—375 mm的胁迫区间,8个转株系的产量下降量均较受体少,抗旱性显著高于受体12%—40%,通过田间抗旱性鉴定和筛选,T8920B6和T8920B2株系可用于抗旱转基因育种。转化事件之间存在抗旱性显著差异,因此,对转化事件株系开展大田抗旱性鉴定和筛选是十分必要的;灌水量为正常灌水一半时,能最大化转基因株系与受体的抗旱性差异,最有利于抗旱性鉴定;对开花前玉米营养生长的影响较小,但在开花期维持受旱玉米的穗长和行粒数方面发挥了显著作用,最终导致受旱玉米将穗重、穗粒数和产量保持在相对较高的水平,表现出较受体更高的抗旱性,在灌浆后期维持叶片持绿性方面也有极显著作用。
References
[1] 黎裕, 王建康, 邱丽娟, 马有志, 李新海, 万建民. 中国作物分子育种性状与发展前景. 作物学报, 2010, 36(9): 1425-1430.
Li Y, Wang J K, Qiu L J, Ma Y Z, Li X H, Wan J M. The traits and development prospect of crop molecular breeding in China., 2010, 36(9): 1425-1430. (in Chinese)
[2] Wang C R, Yang A F, Yue G D, Gao Q, Yin H Y, Zhang J R. Enhanced expression of phospholipase C1 () improves drought tolerance in transgenic maize., 2008, 227: 1127-1140.
[3] Liu X, Zhai S, Zhao Y, Sun B, Liu C, Yang A, Zhang J. Overexpression of the phosphatidylinositol synthase gene () conferring drought stress tolerance by altering membrane lipid composition and increasing ABA synthesis in maize., 2013, 36: 1037-1055.
[4] He C M, He Y, Liu Q, Liu T, Liu C, Wang L, Zhang J. co-expression of genes ApGSMT2 and ApDMT2 for glycine betaine synthesis in maize enhances the drought tolerance of plant., 2013, 31: 559-573.
[5] Quan R D, Shang M, Zhang H, Zhao Y, Zhang J. Engineering of enhanced glycine betaine synthesis improves drought tolerance in maize., 2004, 2: 477-486.
[6] Wei A Y, He C M, Li B, Li N, Zhang J R. The pyramid of transgenes TsVp and BetA effectively enhances the drought tolerance of maize plants., 2011, 9: 216-229.
[7] Li B, Wei A, Song C, Li N, Zhang J. Heterologous expression of the TsVP gene improves the drought resistance of maize., 2008, 6: 146-159.
[8] Lightfoot D A, Mungur R, Ameziane R, Nolte S, Long L, Bernhard K, Colter A, Jones K, Iqbal M J, Varsa E, Young B. Improved drought tolerance of transgenicplants that express the glutamate dehydrogenase gene (gdhA) of., 2007, 156: 103-116.
[9] Shou H X, Bordallo P, Wang K. Expression of the Nicotiana protein kinase (NPK1) enhanced drought tolerance in transgenic maize., 2004, 55: 1013-1019.
[10] Zhang S J, Li N, Gao F, Yang A, Zhang J. Over-expression of TsCBF1 gene confers improved drought tolerance n transgenic maize., 2010, 26: 455-465.
[11] Nelson D E, Repetti P P, Adams T R, Creelman R A, Wu J, Warner D C, Anstrom D C, Bensen R J, Castiglioni P P, Donnarummo M G, Hinchey B S, Kumimoto R W, Maszle D R, Canales R D, Krolikowski K A, Dotson S B, Gutterson N, Ratcliffe O J, Heard J E. Plant nuclear factor Y (NF-Y) B subunits confer drought tolerance and lead to improved corn yields on water-limited acres., 2007, 104: 16450-16455.
[12] Virlouvet L, Jacquemot M P, Gerentes D, Corti H, Bouton S, Gilard F, Valot B, Trouverie J, Tcherkez G, Falque M, Damerval C, Rogowsky P, Perez P, Noctor G, Zivy M, Coursol S. The ZmASR1 protein influences branched-chain amino acid biosynthesis and maintains kenel yield in maize under water-limited conditions., 2011, 157: 917-936.
[13] Castiglioni P, Warner D, Bensen R J, Anstrom D C, Harrison J, Stoecker M, Abad M, Kumar G, Salvador S, D’Ordine R, Navarro S, Back S, Fernandes M, Targolli J, Dasgupta S, Bonin C, Luethy M H, Heard J E. Bacterial RNA chaperones confer abiotic stress tolerance in plants and improved grain yield in maize under water-limited conditions., 2008, 147: 446-455.
[14] Shinozaki K, Yamaguchi-Shinozaki K. Gene expression and signal transduction in water-stress response., 1997, 115: 327-334.
[15] Xiong L, Ishitani M, Lee H, Zhu J K. TheLOS5/ABA3 locus encodes a molybdenum cofactor sulfurase and modulates cold stress- and osmotic stress-responsive gene expression., 2001, 13: 2063-2083.
[16] Xiao B Z, Chen X, Ceng B, Tang N, Zhang Q F, Xiong L Z. Evaluation of seven function-known candidate genes for their effects on improving drought resistance of transgenic rice under field conditions (Special Issue: Abiotic stress tolerance: from gene discovery in model organisms to crop improvement)., 2009, 2(1): 73-83.
[17] Yue Y S, Zhang M C, Zhang J C, Tian X L, Duan L S, Li Z H. Overexpression of the AtLOS5 gene increased abscisic acid level and drought tolerance in transgenic cotton., 2012, 63: 3741-3748.
[18] Li Y J, Zhang J C, Zhang J, Hao L, Hua J P, Duan L S, Zhang M C, Li Z H. Expression of anmolybdenum factor sulphurase gene in soybean enhances drought tolerance and increases yield under field conditions., 2013, 11: 747-758.
[19] Yue Y S, Zhang M C, Zhang J C, Duan L S, Li Z H.LOS5/ABA3 overexpression in transgenic tobacco (cv. Xanthi-nc) results in enhanced drought tolerance., 2011, 181: 405-411.
[20] Gao S, Yuan L, Zhai H, Liu C L, He S Z, Liu Q C. Transgenic sweet potato plants expressing an LOS5 gene are tolerant to salt stress., 2011, 107(2): 205-213.
[21] Liu L, Duan L, Zhang J, Mi G, Zhang X, Zhang Z, Ren H.LOS5 gene enhances chilling and salt stress tolerance in cucumber., 2013, 12: 825-834.
[22] Zhang J, Yu H, Zhang Y, Wang Y, Li M, Zhang J, Duan L, Zhang M, Li Z. Increased abscisic acid levels in transgenic maize overexpressing At LOS5 mediated root ion fluxes and leaf water status under salt stress., 2016, 67: 1339-1355.
[23] Lu U Y, Li Y J, Zhang J C, Xiao Y T, Yue Y S, Duan L S, Zhang M Z, Li Z H. Overexpression ofmolybdenum cofactor sulfurase gene confers drought tolerance in maize (L.)., 2013, 8(1): 39 ref.
[24] 杨启良, 孙英杰, 齐亚峰, 刘艳伟, 王成武, 刘小刚, 戈振扬. 不同水量交替灌溉对小桐子生长调控与水分利用的影响. 农业工程学报, 2012, 28(18): 121-126.
Yang Q L, Sun Y J, Qi Y F, Liu Y W, Wang C W, Liu X G, Ge Z Y. Effect on growth regulation and water use efficiency ofby different water alternate irrigation., 2012, 28(18): 121-126. (in Chinese)
[25] 孙宝成, 刘成, 王天宇, 黎裕, 张登峰, 李亮, 唐怀君, 石云素, 宋燕春. 转基因玉米株高、ASI和穗部性状与抗旱性的关系研究. 新疆农业科学, 2012, 49: 1961-1965.
Sun B C, Liu C, Wang T Y, Li Y, Zhang D F, Li L, Tang H J, Shi Y S, Song Y C. Studies on the relationship between plant height, ASI, ear traits and drought resistance of transgenic maize., 2012, 49: 1961-1965. (in Chinese)
[26] 黎裕, 王天宇, 刘成, 石云素, 宋燕春. 玉米抗旱品种的筛选指标研究. 植物遗传资源学报, 2004, 5: 210-215.
Li Y, Wang T Y, Liu C, Shi Y S, Song Y C. Analysis of criteria for screening drought tolerant maize hybrids., 2004, 5: 210-215. (in Chinese)
[27] 艾天成, 李方敏, 周治安, 张敏, 吴海荣. 作物叶片叶绿素含量与SPAD值相关性研究. 湖北农学院学报, 2000, 20(1): 6-8.
Ai T C, Li F M, Zhou Z A, Zhang M, Wu H R. Correlation study on chlorophyll content and SPAD value of crop leaves., 2000, 20(1): 6-8. (in Chinese)
[28] JOSE L R, DAVID A, RAMIRE Z, WENDY Y, PHILIPPE M, ROBERTO Q. Leaf greenness as a drought tolerance related trait in potato (L.)., 2015, 10: 27-35.
[29] HIDETOSHI A, BENJAMIN K S, HAEFELE M S, KHAMDOK S, KOKI H, YOSHIYUKI K, YOSHIO I, TAT-SUHIKO S, TAKESHI H. Biochar amendment techniques for upland rice production in Northern Laos, 1. Soil physical properties, leaf SPAD and grain yield., 2009, 111: 81-84.
[30] RAHIMI A, MADAH H S, POORYOOSEF M, FATATEH I. Variation of leaf water potential, relative water content and SPAD under gradual drought stress and stress recovery in two medicinal species of Plant ago ovata and., 2010(2): 53-60.
[31] 陈春梅, 高聚林, 苏治军, 于晓芳, 胡树平, 赵晓亮. 玉米自交系吐丝期叶片光合参数与其耐旱性的关系. 作物学报, 2014, 40(9): 1667-1676.
CHEN C M, GAO J L, SU Z J, YU X F, HU S P, ZHAO X L. Relationship between leaf photosynthetic parameters and drought resistance at silking stage in maize inbred lines., 2014, 40(9): 1667-1676. (in Chinese)
(责任编辑 李莉)
Field identification of drought tolerance oftransgenic maize
LIU Cheng1,2, YANG Bing-peng1, SUN Bao-cheng2, ZHANG Jia-chang1, TANG Huai-jun2, WANG Tian-yu3, ZHANG Deng-feng3, XIE Xiao-qing2, SHI Yun-su3, SONG Yan-chun3, YANG Xiao-hong1, LI Yu3, LI Jian-sheng1
(1National Maize Improvement Center, College of agriculture, China Agricultural University, Beijing 100193;2Institute of Grain Crops, Xinjiang Academy of Agricultural Sciences, Urumqi 830091;3Institute of Crop Science, Chinese Academy of Agricultural Sciences, Beijing 100081)
【Objective】Development of transgenic drought tolerant varieties of maize is an effective way to solve the production problems such as drought disaster and water shortage. The objective of this study was to identify and analyze the effectson drought tolerance of maize which were transferred withgene. And, the transgenicmaize lines with strongest drought tolerance were screened out for the maize breeding. 【Method】Under the gradient stress of 150, 225, 300, 375, 450 and 600 mm (CK) irrigation amount, the yield and drought tolerance of eighttransgenic maize lines and their receptor Zheng58 were identified in field. Yield components and other agronomic traits were measured and compared for determining what were the characters most correlated with the enhanced drought tolerance. The transgenic maize lines with significant drought tolerance were screened out for the transgenic breeding application.【Result】The yields and drought tolerances of all 9 maize lines decreased gradually with the decreasing of irrigation amount from 600 to 150 mm. The yields of 8 transgenic maize lines were all significantly higher than that of the receptor Zheng58 in the stress range of 225 mm to 450 mm, and the maximum difference was in the half irrigation (300 mm) of the normal irrigation (600 mm). In the irrigation amount of 300 mm, the drought resistant coefficients of 8 transgenic lines were 0.56 to 0.70, which were significantly higher than that of the receptor Zheng58(0.5), and the drought tolerance then increased by 12% to 40%. The materials in descending order of the drought resistant coefficient were T8920B6, T8920B2, T8920B7, T8920B5, T8920B1, T8920B4, T89B3, B8920B8 and the receptor Zheng58. In the respect of vegetative development, only the leaf color SPAD value of transgenic lines (38.4 to 42.4) were significantly higher than that of the receptor Zheng58 (28.7 to 37.5) in the irrigation of 150 to 225 mm, but the biomass above the ground, plant height and ear site height had no significance among the 9 maize lines. In the development of ear, the ear weight and the ear length of 8 transgenic lines were 42.3 to 61.6 g and 10.9 to 13.1 cm, which were significantly higher than 36.4 to 40.7 g and 8.5 to 11.8 cm of the receptor, respectively, in the irrigation treatments of 150 to 225 mm, but the cob weight and ear diameter were not with significance among the transgenic lines and their receptor. In the grain development, the grain numbers per ear and the grain number per row of the 8 transgenic lines were 86.6 to 182.6 and 8.4 to 15.6, which were significantly higher than 57.3 to 83.2 and 4.9 to 7.1 of the receptor, respectively, but no significant difference was found among the 8 transgenic maize lines and their receptor in the respect of grain rows per ear and 100-grains weight.【Conclusion】had little effect on the vegetable growth of transgenic maize before flowering, but it played a positive role in maintaining of ear length, grain number per row and leaf color of late-filling stage after flowering. And, the ear weight, grain number per ear and yield of transgenic maize were therefore maintained at higher levels when stressed. Drought tolerance oftransgenic lines was enhanced with different degrees, so field identification and screening is necessary. Stress with a half of normal irrigation can maximize the difference of maize drought tolerance, and was satisfactory for the identification and screening.
maize;; drought tolerance; transgenes
2016-06-06;接受日期:2016-08-11
国家转基因生物新品种培育重大专项(2014ZX08003-004)
刘成,Tel:0991-4508076;E-mail:liuchengxj@126.com。通信作者李建生,Tel:010-62732422;E-mail:lijiansheng@cau.edu.cn。通信作者黎裕,Tel:010-62131196;E-mail:liyu03@caas.cn
