某院非发酵菌感染分布及耐药性分析
2016-12-09余广琼
余广琼
(四川省德阳市第二人民医院 618000)
·论 著·
某院非发酵菌感染分布及耐药性分析
余广琼
(四川省德阳市第二人民医院 618000)
目的 探讨医院非发酵菌感染的临床分布及对常用抗菌药物的耐药情况,为临床合理使用药物提供依据。方法 临床标本分离出非发酵菌,采用法国生物梅里埃ATB Expression半自动细菌鉴定分析仪进行病原菌鉴定,采用纸片扩散(K-B)法进行体外药敏试验,对常用抗菌药物的敏感性及其临床感染分布做回顾性分析。结果 2013年1月至2015年1月共检出非发酵菌769株,其中铜绿假单胞菌最常见(占58.05%),其次为鲍曼不动杆菌(占25.60%)和嗜麦芽窄食单胞菌(占8.58%);居前3位非发酵菌对抗菌药物耐药较严重,且呈多重耐药性;非发酵菌主要引起呼吸道感染、泌尿道、菌血症和伤口感染等多部位感染。结论 非发酵菌是引起医院感染的最常见病原菌,易侵袭老年患者,对抗菌药物呈多重耐药,临床实际中应加强对此类细菌感染的认识,根据药敏结果选用敏感药物治疗。
非发酵菌; 感染分布; 耐药性
非发酵菌是指不能利用葡萄糖或仅以氧化形式利用葡萄糖的需氧或兼性厌氧、无芽胞革兰阴性杆菌,主要包括假单胞菌属、不动杆菌属、产碱杆菌属、窄食单胞菌属、伯克霍尔德菌属和黄杆菌属。其广泛存在于自然界及医院环境、人体皮肤和开放腔道中,尤其在医院的分离率较高。多数为条件致病菌,是引起医院感染的重要病原菌之一。近年来,随着广谱抗菌药物的广泛使用、免疫抑制剂及各种介入性操作的应用,非发酵菌感染率和耐药率显著上升,临床治疗日益困难。为了解本院非发酵菌感染的临床分布及耐药性,为临床合理使用抗菌药物提供依据,有效降低非发酵菌的感染率和耐药率,现对本院非发酵菌769株临床分布及耐药状况回顾性分析如下。
1 资料与方法
1.1 一般资料 2013年1月至2015年1月本院各科室住院患者临床标本,包括痰液、尿液、分泌物、胆汁、胸腹水、脓液等。同一患者多次培养所得的相同菌株不重复计数。
1.2 仪器和试剂 细菌鉴定采用法国生物梅里埃ATB Expression半自动细菌鉴定仪;细菌培养基为法国生物梅里埃公司生产的哥伦比亚血平板、麦康凯平板、中国蓝平板;药敏培养基为M-H平板;药敏纸片为英国Oxoid公司产品。
1.3 方法 标本接种于哥伦比亚血平板、麦康凯平板和中国蓝平板上,经35.5 ℃培养18~24 h后,按照《全国临床检验标准操作规程》第3版的要求进行细菌分离,依次进行涂片、革兰氏染色、镜检,氧化酶、克氏双糖铁(KIA)、O/F试验、精氨酸双水解酶试验、赖氨酸脱羧酶试验、硝酸盐还原试验等试验,后采用法国生物梅里埃ATB Expression半自动细菌鉴定仪进行病原菌鉴定,同时使用纸片扩散(K-B)法在M-H平板上进行体外药敏试验。
1.4 药敏质控菌株 大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853均购自国家卫生和计划生育委员会临床检验中心,并按照美国临床实验室标准化委员会(NCCLS)制订的规则和标准进行判读结果。
1.5 统计学处理 采用Whonet5.6软件对试验结果进行统计分析处理。
2 结 果
2.1 769株非发酵菌的种类分布及构成比 共获得非发酵菌769株,最主要为铜绿假单胞菌449株,占58.05%;其次为鲍曼不动杆197株,占25.60%;嗜麦芽窄食单胞菌66株,占8.58%;琼氏不动杆菌11株,占1.43%;鲁氏不动杆菌10株,占1.30%;洋葱伯克霍尔德菌9株,占1.21%;脑膜脓毒血性金黄杆菌8株,占1.20%;木糖氧化产碱杆菌7株,占1.18%;产吲哚金黄杆菌6株,占0.77%;荧光假单胞菌3株,占0.34%;其他3株,占0.34%。见表1。
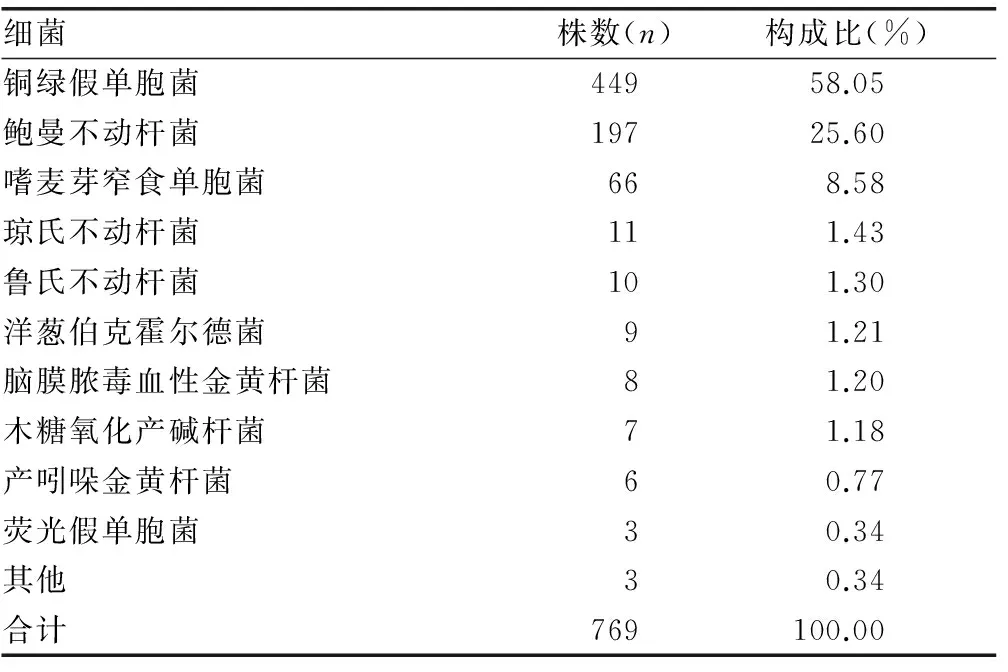
表1 769株非发酵菌的种类分布及构成比
2.2 3种主要非发酵菌在不同科室中的分布 见表2。检出率最高为呼吸科426株,占55.4%;其次为重症监护室(ICU)17株,占22.8%;普外科53株,占6.9%;泌尿外科46株,占5.9%;消化科36株,占4.7%;其他科室33株,占4.3%。
2.3 3种主要非发酵菌的检出率在不同标本中的差异 见表3。769株非发酵菌中检出率最高为痰液326株,占43.1%;其次为尿液148株,占19.2%;伤口分泌物87株,占11.3%;脓液68株,占8.3%;胆汁54株,占7.0%;其他23株,占2.9%。上述标本共检出非发酵菌706株,占769株非发酵菌总数的91.8%。

表2 3种主要非发酵菌在不同科室中的分布
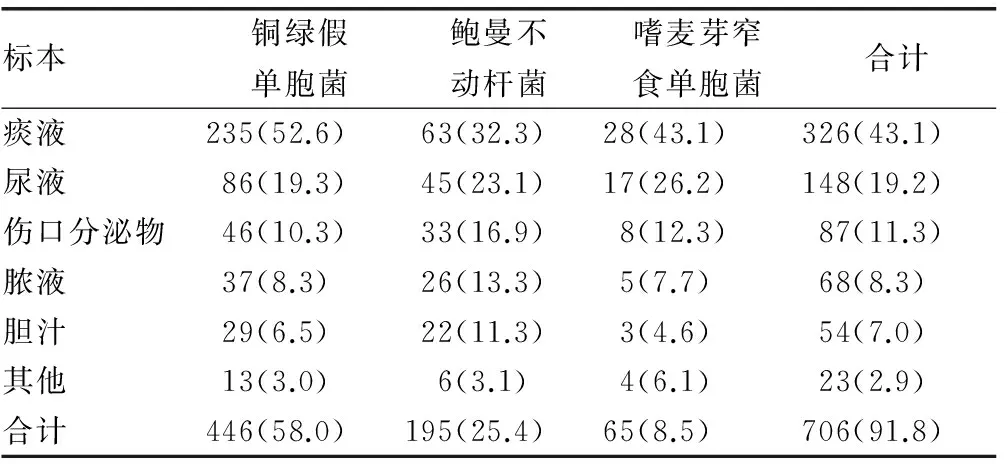
表3 3种主要非发酵菌在不同标本中的分布[n(%)]
2.4 3种主要非发酵菌对常用抗菌药物的药敏率 铜绿假单胞菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌对常用抗菌药物的药敏率,见表4。
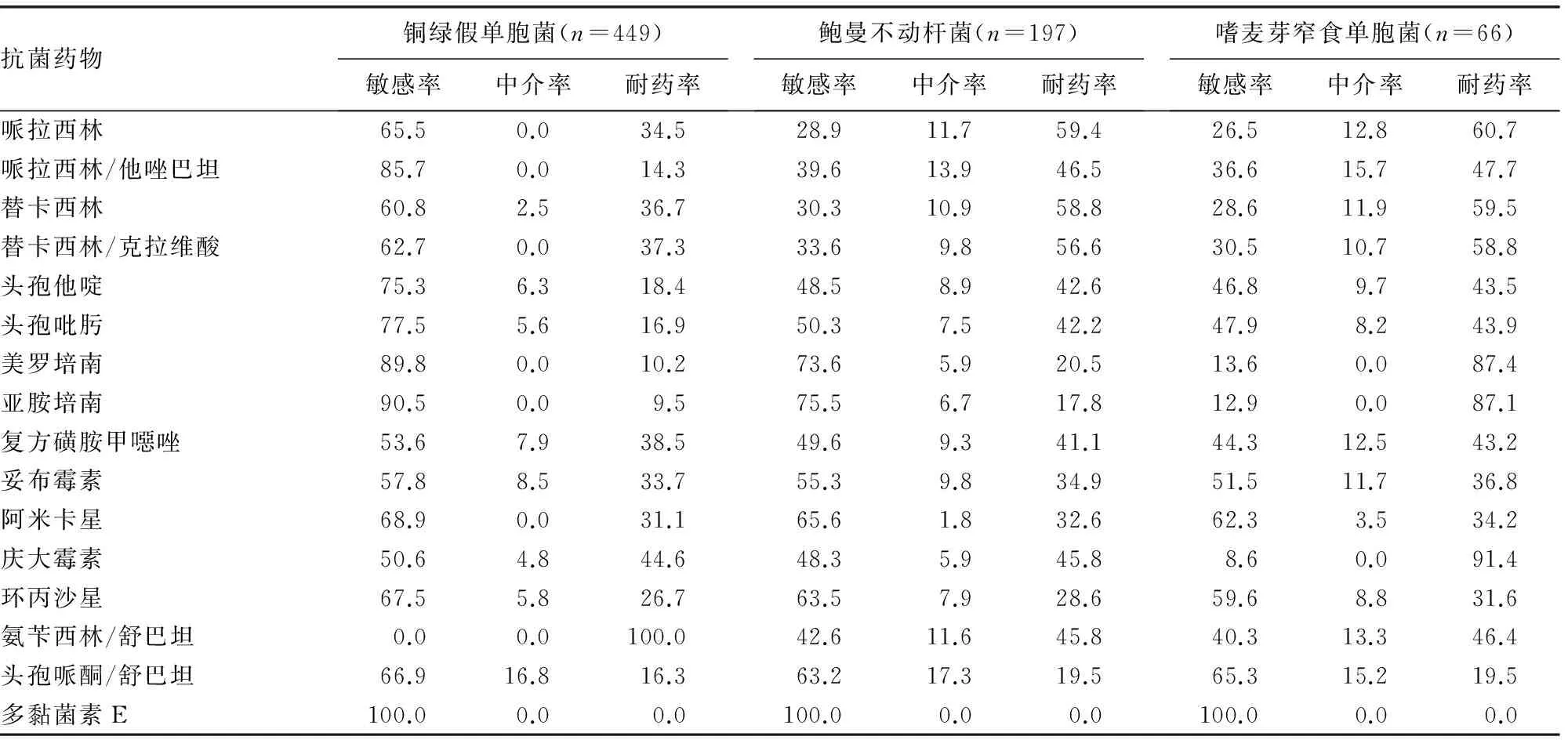
表4 3种主要非发酵菌对常用抗菌药物的药敏率(%)
3 讨 论
非发酵菌指不能以发酵形式利用葡萄糖的革兰阴性杆菌,广泛存在于医院环境。其为临床常见的条件致病菌,当人体抵抗能力下降时,可引起呼吸道、泌尿道、脓液、胆汁、胸腹水、伤口分泌物、菌血症等多部位感染,也是引起医院感染的主要病原菌[1]。引起医院感染的致病菌早期以革兰阳性球菌为主,20世纪70年代,随着广谱抗菌药物大量应用,逐渐以革兰阴性杆菌为主。特别是近年来大量抗菌药物的滥用,导致革兰阴性杆菌的非发酵菌在医院感染中越来越突出,在临床标本中的分离率越来越高,耐药率越来越显著,已成为医院感染的主要病原菌[2]。本研究结果显示,本院住院病房中非发酵菌感染占较大比例,临床标本分离革兰阴性杆菌2 135株,其中非发酵菌769株,占36%。非发酵菌最常见为铜绿假单胞菌449株,占21.0%;其次为鲍曼不动杆菌197株,占9.23%;嗜麦芽窄食单胞菌66株,占3.09%;琼氏不动杆菌11株,占0.52%。其他种类的非发酵菌包括鲁氏不动杆菌、洋葱伯克霍尔德菌、脑膜脓毒血性金黄杆菌、木糖氧化产碱杆菌、产吲哚金黄杆菌、荧光假单胞菌及其他罕见非发酵菌,所占比例相对较少,与报道相符[3]。
非发酵菌引起医院感染的危险因素包括:(1)年龄。年龄越大,机体抵抗力越差,越容易感染。(2)患者自身基础疾病,如慢性呼吸道疾病、糖尿病、尿毒症、肿瘤等。基础疾病越严重,免疫力越低,越容易引起感染。(3)长期使用免疫抑制剂,滥用或长期使用抗菌药物,导致感染概率显著增加。(4)接受各种介入性治疗,长时间住院及未严格执行消毒措施。本次调查结果显示,住院标本中,非发酵菌感染标本最常见为痰(占43.1%),其次为尿液(占19.2%)和伤口分泌物(占11.3%)。呼吸科和ICU的非发酵菌感染率显著高于其他科室,此与呼吸科和ICU住院患者有关。本院呼吸科即老年病科,患者数量相对其他科室多,且大多为老年患者,自身机体抵抗力差,加上严重的基础性疾病,呼吸道清除功能较弱,痰液易淤积于肺组织内不易咳出,为细菌生长繁殖创造了有利环境;患者多数为慢性病,住院时间较长,长期大量使用抗菌药物引起菌群失调,导致感染机会增加;此外,患者可能存在气管插管、使用呼吸机吸痰等各种侵入性操作,损伤了呼吸道黏膜保护屏障,成为导致感染的重要诱因[4-6]。ICU患者均为危重患者,自身患严重基础疾病,机体抵抗力低,有患者在接受大手术后,需长期联合使用多重抗菌药物,侵入性治疗多,诸多因素导致非发酵菌在ICU有较高检出率。上述2个科室患者非发酵菌感染部位主要为呼吸道、泌尿道和手术切口,这3个部位感染的非发酵菌占总非发酵菌感染的91%。
非发酵菌是临床难治性感染的主要病原菌,由于其耐药广泛,治疗困难,病死率高,已成为抗感染治疗领域的棘手难题。其耐药机制复杂,主要包括:(1)β-内酰胺酶的产生。此为主要的耐药机制,可通过β-内酰胺抗菌药物诱导产生。铜绿假单胞菌可产生AmpC酶、碳青霉烯酶、质粒介导酶,鲍曼不动杆菌可产生质粒介导TEM-1、TEM-2、AmpC酶,嗜麦芽窄食单胞菌可产生L1、L2。上述产物可被同时诱导产生,其中亚胺培南为强诱导剂,对几乎所有β-内酰胺酶类抗菌药物耐药。介导β-内酰胺酶的质粒可通过接合、转导、转化等方式在菌种间传递,产生耐药性传播,导致非发酵菌耐药性传播和医院内感染,使得非发酵菌成为临床治疗难题。(2)氨基糖苷类修饰酶的产生。(3)青霉素结合蛋白(PBPs)结构和功能改变。(4)细胞膜主动外排系统。(5)细胞膜蛋白缺失使通透性下降。
铜绿假单胞菌广泛存在于自然界,在健康人体皮肤、呼吸道、医院病房及医疗器械上等较常见,是临床上引起感染的主要条件致病菌之一。铜绿假单胞菌所致疾病包括烧伤创面感染、皮肤感染、肺部感染、泌尿道感染、中耳炎、脑膜炎、心内膜炎、败血症、急性角膜穿孔。对创伤面积大、机体免疫力差的患者,要严格执行医院消毒隔离制度,预防铜绿假单胞菌感染。从试验结果可知,铜绿假单胞菌表现为多重耐药,其耐药机制复杂:其一旦产生β-内酰胺酶,不但对几乎所有β-内酰胺酶类抗菌药物耐药,且对β-内酰胺酶抑制剂、氨基糖苷类、喹诺酮类等多种抗菌药物敏感性下降;其拥有向体外排出多种药物的主动泵出系统,使抗菌药物很难进入细菌体内,易产生获得性耐药;其本身对多种抗菌药物及消毒剂天然耐受;其细胞外膜上无大多数革兰阴性杆菌所具有的高渗透性孔蛋白,其孔蛋白通道对小分子物质的渗透速度仅为典型孔蛋白通道的1%。铜绿假单胞菌对氨苄西林/舒巴坦天然耐药。本研究结果显示,449株铜绿假单胞菌对亚胺培南、美罗培南、哌拉西林/他唑巴坦、头孢他啶、头孢吡肟的敏感率分别为90.5%、89.8%、85.7%、75.3%、77.5%;环丙沙星敏感率仅67.5%,与文献[7]报道环丙沙星对铜绿假单胞菌的体外抗菌活性最强不一致,这可能是由于长期使用此抗菌药物,导致细菌敏感率降低。按照NCCIS推荐的用药规则,治疗铜绿假单胞菌首选庆大霉素、哌拉西林,本研究中庆大霉素和哌拉西林耐药率分别为44.6%和34.5%,这可能是由于长期大量使用上述抗菌药物,导致铜绿假单胞菌对其耐药率不断升高。亚胺培南为碳青霉烯类抗菌药物,有极强抗菌活性,对铜绿假单胞菌有较好治疗效果,特别适用于治疗严重的铜绿假单胞感染。有学者报道1983年亚胺培南对铜绿假单胞菌敏感率为100.0%,而本研究中亚胺培南敏感率仅为90.5%。亚胺培南对铜绿假单胞菌的敏感性已下降。目前,治疗铜绿假单胞菌不再首选庆大霉素、哌拉西林,而是使用亚胺培南和阿米卡星。如果长期大量使用,又会致使细菌对新抗菌药物产生耐药性。临床医师应根据细菌分离鉴定结果和药敏试验,选用适当的抗菌药物,不仅能提高治疗效果,也能防止更多耐药菌株的产生。
随着广谱抗菌药物的使用及侵入性治疗技术的开展,鲍曼不动杆菌的分离率及耐药性逐年上升。据相关资料显示,鲍曼不动杆菌在下呼吸道标本中的分离率仅次于铜绿假单胞菌,位居下呼吸道感染病原菌的第2位[8]。鲍曼不动杆菌耐药机制为产IMP或VIM型金属酶,水解碳青酶烯类、头孢菌素类,不被克拉维酸等酶抑制剂抑制;产TEM-1和CARB型β-内酰胺酶,导致对多种窄谱β-内酰胺酶耐药;产生大量染色体头孢菌素酶和超广谱TEM酶,导致其对新型第3代头孢菌素耐药。本研究结果显示,鲍曼不动杆菌耐药较严重,对亚胺培南、美罗培南的敏感率分别为75.5%、73.6%,对阿米卡星、头孢哌酮/舒巴坦的敏感率为65.6%、63.2%,与报道相符[9]。鲍曼不动杆菌多重耐药机制包括膜通透性降低、基因突变导致拓扑异构酶或DNA旋转酶的改变、产生β-内酰胺酶和氨基糖苷类修饰酶、主动泵出系统等,导致该类菌株耐药性显著高于其他细菌,临床不断出现泛耐药鲍曼不动杆菌(PDR-AB)、多重耐药鲍曼不动杆菌(MDR-AB)甚至“全耐药”菌株的感染,可选用的抗菌药物非常有限甚至无药可用,给临床治疗带来极大困难[10-11]。鲍曼不动杆菌对第1、2代头孢菌素及第1代喹诺酮类药物天然耐药。有研究表明,多黏菌素E较亚胺培南抗菌活性更高,对鲍曼不动杆菌感染有显著疗效[12]。
对嗜麦芽窄食单胞菌敏感性较佳的抗菌药物为头孢哌酮/舒巴坦和阿卡米星,敏感率为65.3%、62.3%;其次是环丙沙星、妥布霉素和头孢吡肟,敏感率分别为59.6%、51.5%和47.9%;其余药物敏感性相对较低。由于该菌可产生2种β-内酰胺酶,L1为金属酶、L2为头孢菌素酶,细胞壁对抗菌药物的亲和力极差,膜蛋白对氨基糖苷类渗透力低下,带有药泵外排机制等多种耐药机制,造成其对多种抗菌药物(包括亚胺培南和美罗培南)天然耐药,对氨基糖苷类天然低水平耐药,对氟喹诺酮普遍耐药。
由于广谱抗菌药物的滥用及细菌自身强大的耐药基因,非发酵菌的高感染率及多重耐药性已成为人类健康面临的严重问题之一。临床应引起高度重视,提高对非发酵菌感染的认识,有效遏制非发酵菌的蔓延,控制医院感染的发生,减缓细菌耐药性的发展及传播。笔者建议采取以下措施:在使用抗菌药物时,遵守抗菌药物使用原则,合理使用各类抗菌药物。头孢哌酮/舒巴坦、哌拉西林/他唑巴坦、亚胺培南、喹诺酮类、头孢他啶等是治疗非发酵菌感染的理想选择。确定需要禁用、控制使用或限制使用的抗菌药物种类和品种。抗菌药物轮换使用(策略性换药或抗菌药物干预策略)。主张多种药物联合使用:铜绿假单胞菌可选用头孢哌酮/舒巴坦(或哌拉西林/他唑巴坦)加阿米卡星、环丙沙星或多黏菌素E,亚胺培南加阿米卡星或环丙沙星,阿米卡星加环丙沙星,头孢他啶加阿米卡星或环丙沙星;鲍曼不动杆菌首选头孢哌酮/舒巴坦、亚胺培南、美罗培南,联合用药可选头孢哌酮/舒巴坦加阿米卡星、环丙沙星,头孢哌酮/舒巴坦加多黏菌素E,阿米卡星加环丙沙星,头孢他啶加阿米卡星、环丙沙星;嗜麦芽窄食单胞菌可联合使用头孢哌酮/舒巴坦(或哌拉西林/他唑巴坦)加阿米卡星、环丙沙星,头孢哌酮/舒巴坦(或哌拉西林/他唑巴坦)加多黏菌素E,环丙沙星加阿米卡星、多黏菌素E,头孢他啶加阿米卡星、环丙沙星。改变抗菌药物治疗策略,谨慎使用第3代头孢菌素,使用β-内酰胺酶抑制剂复合制剂或其他类抗菌药物替换第3代头孢菌素。适当控制碳青霉烯类抗菌药物的使用,若过度使用可导致细菌产金属酶及天然耐药菌株增加、肠黏膜屏障削弱、菌群失调。本研究结果显示,头孢哌酮/舒巴坦对常见非发酵菌有较强抗菌活性,国内外亦有相同的研究结果[13-14]。严格控制适应证及控制预防性用药,缩短抗菌药物使用疗程。提高病原菌分离率,加强对抗菌药物的药物敏感性及耐药性监测,为临床提供使用抗菌药物的依据。提高医务人员对医院获得性感染的认识,改善患者住院环境,病室空气、用具坚持定期消毒并进行细菌培养,严格执行消毒隔离制度,做好消毒隔离工作。严格无菌操作,减少和避免呼吸机、雾化器、血液透析器等不必要的侵袭性操作,同时应提高患者自身免疫能力,预防和控制耐药菌株产生、播散和流行。
[1]赵德军,付维婵,胡昭宇,等.医院鲍曼不动杆菌感染调查及耐药性监测[J].中国消毒学杂志,2013,30(10):923-924.
[2]董晓勤,周田美,施新颜,等.非发酵菌感染的临床分布和耐药谱分析[J].中华医院感染学杂志,2004,14(7):809-811.
[3]毛盛尧,朱幼珠,张翊.医院感染常见非发酵革兰阴性菌的临床分布和耐药性分析[J].中华医院感染学杂志,2006,16(6):694-696.
[4]麦明杰,李芳,韩云.重症监护室泛耐药鲍曼不动杆菌肺炎的危险因素分析[J].中国感染与化疗杂志,2013,13(6):428-432.
[5]汪志方,张益辉,王泽球.鲍曼不动杆菌感染的危险因素及耐药性分析[J].临床肺科杂志,2012,17(1):14-16.
[6]周朝阳,周建英.鲍曼不动杆菌呼吸机相关性肺炎的危险因素分析[J].中国微生态学杂志,2013,25(6),682-684.
[7]Zhanel GG,Ennis K,Vercaigne L,et al.A critical review of the fluoroquinolones:focus on respiratory infections[J].Drugs,2002,62(1):13-59.
[8]李湘燕,吕媛.卫生部全国细菌耐药监测网2011年痰标本来源细菌耐药监测[J].中国临床药理学杂志,2012,28(12):921-926.
[9]王中新,徐元宏,李家斌,等.非发酵菌临床分布及耐药性的动态分析[J].中华医院感染学杂志,2005,15(2):203-206.
[10]赵德军,胡昭宇,付维婵,等.老年患者下呼吸道感染鲍曼不动杆菌检测及耐药性分析[J].中国消毒学杂志,2013,30(7):623-625.
[11]宋志香,薛文英,胡凤军,等.泛耐药鲍曼不动杆菌的临床分布及耐药性监测[J].中国消毒学杂志,2011,28(5):576-578.
[12]史煜波,董燕.替加环素与多粘菌素B对泛耐药鲍曼不动杆菌体外研究[J].中国微生态学杂志,2010,22(9):825-827.
[13]安群,高岩.非发酵菌耐药性分析及抗菌药物治疗对策[J].中华医院感染学杂志,2005,15(5):571-573.
[14]Fu W,Demei Z,Shi W,et al.The susceptibility of non-fermentative gram-negative bacilli to cefoperazone and sulbactam compared with other antibacterial agents[J].Int J Antimicrob Agents,2003,22(4):444-448.
Analysis on infection distribution and drug resistance of non-fermentative bacteria in a hospital
YUGuangqiong
(DeyangMunicipalSecondPeople′sHospital,Deyang,Sichuan618000,China)
Objective To investigate the clinical distribution of non-fermentative bacterial infection and its resistance situation to commonly used antibacterial drugs in order to provide a basis for rational dug use in clinic.Methods Non-fermentative bacteria were isolated from the clinical specimens and the pathogenic bacteria were identified by using the ATB Expression semi-automatic bacterial identification analyzer.The Kirby-Bauer disc diffusion method was used to conduct in vitro susceptibility test.The sensitivity to commonly used antibacterial drugs and their clinical distribution were retrospectively analyzed.Results A total of 769 strains of non-fermentative bacteria were detected from Jan.2013 to Jan.2015,in which Pseudomonas aeruginosa was most common(accounting for 58.05%),followed by Acinetobacter baumannii(25.60%)and Stenotrophomonas maltophilia(8.58%).The top 3 non-fermentative bacteria had serious resistance to antibacterial drugs,moreover showed the multi-drug resistance,non-fermentative bacteria mainly caused the infection in multiple sites such as respiratory tract infection,urinary tract infection,bacteraemia and wound infection.Conclusion Non-fermentive bacteria are the most common pathogens causing hospital infection,which are easy to invade elderly patients and show the multiple resistances to antibacterial drugs.Therefore,the cognition on this bacterial infection should be strengthened in clinical practice and sensitive drugs should be selected for conducting treatment according to the susceptibility test results.
non-fermentative bacteria; infection distribution; drug resistance
余广琼,女,主管技师,主要从事临床微生物检验方面的研究。
10.3969/j.issn.1673-4130.2016.22.021
A
1673-4130(2016)22-3149-04
2016-06-30
2016-08-20)
