皖南黄兔IGF1基因扩增及其多态性分析
2016-12-09黄冬维程广龙汪善义赵小伟杨永新王小飞赵辉玲
黄冬维,汪 勇,杨 普,程广龙,汪善义,吴 东,赵小伟,杨永新,王小飞,赵辉玲
(1.安徽省农业科学院,合肥 230031;2.安徽省义华农牧科技有限公司,池州 245106)
皖南黄兔IGF1基因扩增及其多态性分析
黄冬维1,汪勇2,杨普1,程广龙1,汪善义2,吴东1,赵小伟1,杨永新1,王小飞1,赵辉玲1
(1.安徽省农业科学院,合肥 230031;2.安徽省义华农牧科技有限公司,池州 245106)
胰岛素样生长因子1(IGF1)是动物生长发育等生命过程中的重要调节因子,目前关于家兔IGF1基因序列扩增和多态性的研究还很少。该研究以安徽皖南黄兔为试验动物,通过PCR方法扩增其IGF1基因编码区全序列,利用混合DNA池测序和生物信息学方法分析了IGF1基因扩增区域的遗传变异特性。结果获得皖南黄兔IGF1基因包含第1~5外显子的基因组序列5条,长度分别为316、657、691、757和403 bp,与种子序列一致性分别为100%、99.5%、99.9%、99.7%和99.8%;5个外显子组成432 bp的CDS序列,编码143个氨基酸残基组成的蛋白质。测序和生物信息学分析结果则表明,在皖南黄兔IGF1基因内含子1中存在3个多态位点(3056G>A、3107T>C和3164 G>A),3个位点并不位于剪接位点,但分别位于MZF1、ATF4、CEBPA、HLF和NKX2-8顺式作用元件位置,因而可能影响基因表达。该研究成功扩增获得皖南黄兔IGF1基因全部5个外显子序列,拼接获得基因编码区全序列,并利用混合DNA池测序法发现了内含子3个新的SNP位点,研究结果为揭示肉兔IGF1基因功能奠定了基础。
皖南黄兔;IGF1基因;扩增;多态性
1 前言
胰岛素样生长因子1(insulin like growth factor 1,IGF1)属于IGFs家族成员。IGFs家族包含IGF1和IGF2,具有与胰岛素相似的结构和功能[1],对动物生长发育等多种生命过程产生影响[2-4]。目前,研究表明IGF1在家兔胚胎发育、抗氧化、促进动脉粥样硬化方面具有重要调节作用。Keswani等[5]检测了IGF1基因导入治疗对因胎盘功能障碍而生长受限的胚胎、胎盘以及胎儿肝脏、心脏、骨骼肌重量等的作用,结果发现IGF1使得胚胎、肝脏和骨骼肌重量等都恢复到正常水平。Chothe等[6]研究发现,IGF1能够上调椎间盘细胞钠依赖性维生素C转运蛋白2的表达,椎间盘细胞摄入维生素C,从而提高抗氧化能力。Hirai等[7]给新西兰白兔公兔饲喂添加或不添加IGF1的胆固醇日粮,结果发现IGF1通过影响内皮功能和老化而促进了动脉粥样硬化。而家兔血清IGF1水平受到日粮中中性洗涤纤维和酸性洗涤纤维含量影响,并可能与新西兰白兔窝产仔数等性状相关联[8-9]。另外,家兔肝脏和肌肉IGF1基因表达高低均受到日粮蛋白水平的调节,且伊拉兔骨骼肌发育可能与IGF1基因表达上调有关[10-11]。但是,目前对家兔IGF1基因结构及其多态性的研究还不够深入。
皖南黄兔是安徽省义华农牧科技有限公司与安徽省农业科学院共同选育的肉兔品种。该品种兔体型中等,被毛黄色,生长速度较快,肉质优良,主要分布于安徽黄山、池州等皖南山区,是当地养殖的主要肉兔品种。本研究首先拟结合利用聚合酶链式反应(PCR)和DNA池测序技术扩增,获得皖南黄兔IGF1基因全部外显子序列,并对其遗传变异进行分析,为初步揭示肉兔IGF1基因功能和育种应用奠定基础。
2 材料与方法
2.1试验动物与样品
在安徽义华农牧科技有限公司选择皖南黄兔20只(公、母各10只),用剪耳钳采集耳组织后置于70%酒精,随冰块带回实验室,再转-75℃保存。参照血液基因组提取试剂盒(天根,北京)的使用说明提取耳组织样品基因组DNA。再用微量紫外分光光度计测定浓度和纯度后,制备100 ng/μL标准样品,以备基因扩增用。
2.2引物设计
GenBank查询获得家兔IGF1基因序列作为种子序列(NC_013672.1,complement81679775-81748235,68461bp)。以上述IGF1基因组片段序列为模板,应用Primer5.0和Oligo6.0设计5对引物,分别扩增该基因5个外显子序列。全部引物(见表1)由铂尚生物技术(上海)有限公司合成。

表1 IGF1基因序列扩增引物
2.3扩增测序
通过优化引物浓度和退火温度,确定PCR扩增体系为15μL:2×PCRmix(天根,北京)7.5μL,上、下游引物各0.3μL,基因组DNA 0.8μL,去离子水6.1μL。PCR反应程序:预变性95℃5min,变性95℃30 s,退火60℃30 s,延伸72℃40 s,循环数33个,后延伸72℃4min。将20个样品PCR产物混合,送铂尚生物技术(上海)有限公司直接测序,重复测序3次。
2.4序列分析
扩增序列分析用Water程序和BLAST比对程序,多序列比对用CLUSTW,顺式作用元件分析使用Nsite 5.2013和JASPARCOREVertebrata。
3 结果与分析
3.1PCR扩增结果及序列测定
扩增产物通过琼脂糖凝胶电泳(150 V,45min)检测发现,5对引物扩增产物长度均与预期片段长度相符,电泳条带清晰单一且无杂带(图1),表明扩增成功。PCR产物测序序列经Seqman(Lasergene7.0)处理,构建各外显子重叠群,剔除测序质量差的序列,获得高质量序列5条316、657、691、757和403 bp,经序列比对,结果发现分别与种子序列相应序列匹配率100%、99.5%、99.9%、99.7%和99.8%,分别包含外显子1、2、3、4和5序列,内含子-外显子符合GT-AG规则,表明扩增序列正确。依据家兔序列拼接皖南黄兔IGF1基因编码区(coding sequence,CDS),结果发现其编码区序列为432 bp,编码长度为143个氨基酸残基的蛋白序列(图2)。
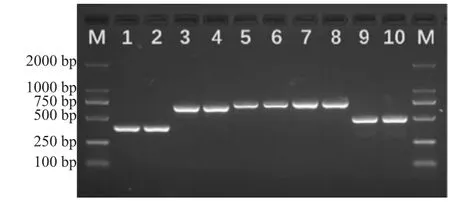
图1 皖南黄兔IGF1基因PCR扩增产物

图2 皖南黄兔IGF1基因CDS和编码蛋白序列
3.2多态性分析
对混合DNA池样本PCR扩增结果进行分析,以确定多态位点。从测序峰图看,5个外显子没有发现序列核苷酸变异,仅在内含子1靠近外显子2的序列中存在3个单核苷酸变异,分别为3056G>A、3107T>C和3164G>A(图3)。

图3 皖南黄兔IGF1基因内含子1核苷酸变异位点
3个变异位点位于内含子1的3’端,是否影响IGF1基因剪接?笔者等针对包含所有3个变异的外显子2上游278 bp序列(从3056G>A上游40 bp到内含子1的3’剪接位点AG)进行了分支位点手动寻找,结果发现上游29~23 bp(CTCTGAC)和113~107 bp(TTCTGAT)两段序列符合动物经典分支位点序列特征。3个变异位点在外显子2上游130、187和238 bp位置,与113~107 bp相隔17、74和125 bp。
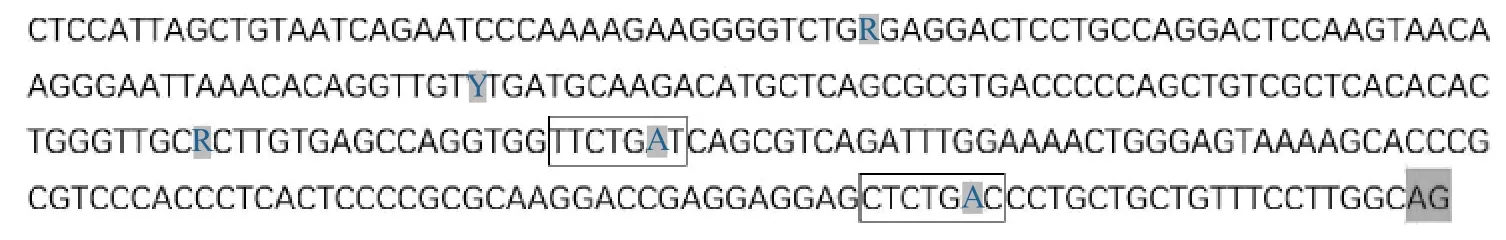
图4 皖南黄兔IGF1基因内含子1剪接分支位点
同时,对内含子顺式作用元件进行生物信息学预测分析。Nsite 5.2013预测到显著的调控序列(RE)共5条(图5),分别为正向163~175 bp、311~319 bp、311~321 bp和反向91~80 bp、299~290 bp,分别结合C/EBP、Sp1、MAZ、GATA-1(c)和SP1及SP3。利用JASPAR数据库预测(脊椎动物,Relative profile score threshold=85%)转录因子结合位点,发现3056G>A、3107T>C和 3164 G>A变异位点分别位于 MZF1、(ATF4、CEBPA和HLF)、NKX2-8转录因子结合序列(图6)。

图5 皖南黄兔IGF1基因内含子1调控序列预测

图6 皖南黄兔IGF1基因内含子1转录因子结合位点预测
4 讨论与结论
4.1IGF1基因结构
IGF1作为胰岛素生长因子家族的重要成员,该基因表达与家兔子宫生长受限[5]、动脉粥样硬化[7]、1型糖尿病[12]等疾病相关。IGF1基因主要通过影响早期胚胎发育而促进动物生长发育,因而,IGF1可能对家兔多种生命过程具有重要影响。目前,家兔IGF1基因组DNA研究并不多,从NCBI查询获得家兔 IGF1基因ID为100008668,该基因定位于第4号染色体,其前体mRNA长432 bp(NM_001082026),蛋白包含143个氨基酸残基(NP_001075495.1)。本研究以家兔IGF1基因(NC_013672.1)为模板,扩增测序获得CDS的5个外显子区段,均与种子序列高度匹配,序列拼接获得全部CDS区序列共432 bp,预测编码IGF1蛋白包含143个氨基酸残基,与前述NCBI种子序列匹配率100%,结果说明所扩增序列即为家兔IGF1基因序列。然而,IGF1基因还可能存在其他剪接体。Argente等[13]扩增家兔IGF1基因mRNA序列,获得了两条剪接体A和B,插入片段为外显子5,长度52 bp。与Argente等[13]研究结果相同,本研究CDS区包含外显子5序列,即剪接体IGF1B。
4.2IGF1基因多态性
遗传变异位点是基因序列的重要特征信息,可能对人类疾病和动物生产性状表现产生遗传效应,从而作为遗传标记应用于抗病治疗和动物遗传育种实践。Arends等[14]研究发现,人IGF1基因PCR1标记的等位基因191可能导致IGF1基因表达下调,并与人类出生体重、体长和头围等较小(SGA)有关,而737/738位点等位基因198纯合则为正常体重。Johnston等[15]把与SGA相关联变异位点定位在IGF1基因启动子至内含子2区域。本研究结果发现,皖南黄兔IGF1基因内含子1存在3个突变位点,虽然它们可能不会影响该基因的正确剪接,但是可能作为增强子或沉默子等顺式作用元件而结合MZF1、(ATF4、CEBPA和HLF)、NKX2-8等转录因子对家兔IGF1基因转录起到调控作用,从而对该基因表达和家兔生长发育起到直接或间接的调节作用[16-17]。另外,本研究还发现皖南黄兔IGF1基因所有5个外显子区均不存在突变位点,这与Argenete等[13]对子宫容量分化选择的两个品系家兔IGF1基因编码区未发现突变位点的结果一致,同时也与欧洲野兔种子序列(NC_013672.1)编码区序列完全相似,因而IGF1基因编码区及蛋白序列在家兔中高度保守,预示其具有重要功能。本研究为肉兔生产性能与IGF1基因相关性分析奠定了基础。
[1]Thieme R,Ramin N,Fischer S,etal.Gastrulation in rabbitblastocysts dependson insulinand insulin-like-growth-factor1[J].MolCellEndocrinol,2012,348(1):112-119.
[2]Matsumoto R,Fukuoka H,IguchiG,etal.Accelerated telomere shortening in acromegaly;IGF-I induces telomere shortening and cellular senescence[J].PLoSOne,2015,10(10):e0140189.
[3]Hu A,Yuan H,Wu L.Theeffectof constitutive over-expression of insulin-like growth factor 1 on the cognitive function in aged mice[J]. Brain Res,2016,1631:204-213.
[4]Yue M,Tian Y G,Wang Y J,et al.Associated analysis of single nucleotide polymorphisms found on exon 3 of the IGF-1 gene with Tibetan miniature pig growth traits[J].GenetMol Res,2014,13(1):1263-1269.
[5]KeswaniSG,BalajiS,Katz A B,etal.Intraplacentalgene therapywith Ad-IGF-1 corrects naturally occurring rabbit model of intrauterine growth restriction[J].Hum Gene Ther,2015,26(3):172-182.
[6]Chothe P P,Chutkan N,Sangani R,et al.Sodium-coupled vitamin C transporter(SVCT2):expression,function,and regulation in intervertebraldisc cells[J].Spine J,2013,13(5):549-557.
[7]HiraiH,Kanaya R,MaedaM,etal.The roleof insulin growth factor on atherosclerosis and endothelial function:the effect on hyperlipidemia and aging[J].Life Sci,2011,88(9-10):425-431.
[8]晁洪雨,井文倩,刘京贞,等.日粮ADF水平对妊娠母兔繁殖性能、血清生化指标及激素水平的影响[J].中国兽医学报,2015a,35(8):1568-1572.
[9]晁洪雨,井文倩,夏春峰,等.日粮NDF水平对妊娠母兔繁殖性能、血清生化指标及激素的影响[J].中国农业大学学报,2015b,20(6):181-188.
[10]吕建敏,刘月环.日本大耳白黑眼兔在不同生长阶段蛋白质营养与肝脏相关基因表达的关系[J].中国实验动物学报,2010,18(3): 208-211,285.
[11]高琴,隋啸一,李福昌,等.不同蛋白水平日粮对肉兔骨骼肌发育及相关因子表达的影响[C]//中国畜牧兽医学会养兔学分会成立大会暨第一届学术交流大会论文集.北京:中国畜牧兽医学会养兔学分会筹委会,2015:1.
[12]Thieme R,Schindler M,Ramin N,et al.Insulin growth factor adjustment in preimplantation rabbit blastocysts and uterine tissues in response tomaternal type1 diabetes[J].MolCell Endocrinol,2012,358(1):96-103.
[13]Argente M J,Merchán M,PeiróR,et al.Candidate gene analysis for reproductive traits in two linesof rabbitsdivergently selected foruterine capacity[J].JAnim Sci,2010,88(3):828-836.
[14]Arends N,Johnston L,Hokken-Koelega A,et al.Polymorphism in the IGF-I gene:clinical relevance for short children born small for gestationalage(SGA)[J].JClin EndocrinolMetab,2002,87(6):2720.
[15]Johnston L B,Dahlgren J,Leger J,et al.Association between insulin-like growth factor I(IGF-I)polymorphisms,circulating IGF-I,and pre-and postnatalgrowth in two European small forgestationalage populations[J].JClin EndocrinolMetab,2003,88(10):4805-4810.
[16]VishwamitraD,CurryCV,Alkan S,etal.The transcription factors Ik-1 and MZF1 downregulate IGF-IR expression in NPM-ALK+T-cell lymphoma[J].MolCancer,2015,14:53.
[17]Marchand A,Tomkiewicz C,Magne L,et al.Endoplasmicreticulum stressinductionofinsulin-likegrowth factor-bindingprotein-1 involves ATF4[J].JBiolChem,2006,281(28):19124-19133.
Am plification and Polym orphism Analysisof IGF1Gene ofWannan Yellow Rabbit
Huang Dongwei1,Wang Yong2,ZhaoHuiling1,etal
(1.AnhuiAcademyofAgriculturalSciences,Heifei230031,China; 2.AnhuiYihua AgriculturalScienceand Technology Co.,LTD.,Chizhou 245106,China)
Insulin-likegrowth factor1(IGF1)isoneof important regulators in animalgrowth and development,whileatpresent,it remainsunclear for the sequencestructureand itspolymorphism of IGF1 gene in rabbit.In thisstudy,wholegenomic sequencesof coding region of rabbit IGF1 genewereamplified successfullyusing PCRmethod and theirpolymorphismeswereanalyzed byways ofpoolDNA sequencingand bioinformatics.The resultshowed that fivesequencescompromisingexon 1 to5were316 bp,657 bp,691 bp,757 bp and 403 bp in lengh,respectively,with highly similarity to the temple sequences(100%,99.5%,99.9%,99.7% and 99.8%respectively);the five exons constituted the CDS(coding sequence)of432 bp in lengh,which could be translated to 143 amino acid residuesof IGF1.Additionally,therewere three polymorphic sites(3056G>A,3107T>Cand 3164G>A)in intron 1,which did not locate in splicing sitesbut in several cis-actingelementssuch asMZF1,ATF4,CEBPA,HLFand NKX2-8,with possibility of regulating geneexpression.To sum up,the five exonssequencesof IGF1 gene ofWannan yellow rabbitand its coding region were acquired,and so did the three new polymorphic sites of partial intron 1.The results of this study can lay foundations for revealing function of IGF1gene inmeat rabbit. Keywords:Wannan yellow rabbit;IGF1 gene;amplification;polymorphism
S829.2
A
2095-3887(2016)06-0006-05
10.3969/j.issn.2095-3887.2016.06.002
2016-09-14
安微省科技攻关项目(1501031098);国家兔产业技术体系(CARS-44-A-3)
黄冬维(1981-),男,助理研究员,博士,主要从事草食动物育种与生产研究。
赵辉玲(1965-),女,研究员,硕士,主要从事草食动物育种与生产研究。
