干旱胁迫对防风叶片保护酶活性、渗透调节物质含量及药材品质的影响
2016-12-08韩忠明胥苗苗王云贺杨利民
韩忠明, 胥苗苗, 王云贺, 张 涛, 韩 梅, 杨利民
(吉林农业大学 中药材学院/吉林省生态系统与生态恢复重点实验室, 吉林 长春 130118)
干旱胁迫对防风叶片保护酶活性、渗透调节物质含量及药材品质的影响
韩忠明, 胥苗苗, 王云贺, 张 涛, 韩 梅, 杨利民
(吉林农业大学 中药材学院/吉林省生态系统与生态恢复重点实验室, 吉林 长春 130118)
【目的】探讨干旱条件下防风Saposhnikoviadivaricata保护酶系统与防风适应干旱的生理机制。【方法】以1年生防风为材料,设置3个梯度的水分供给, 包括充分供水对照(CK)、轻度干旱胁迫(LD)和重度干旱胁迫(SD)处理,研究干旱胁迫对防风叶片保护酶活性、渗透调节物质含量及2种色原酮(升麻素苷和5-O-甲基维斯阿米醇苷)总含量的影响。【结果】试验初期,不同处理下超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性和脯氨酸含量均呈增加趋势,在中期达到最高值后开始呈现下降趋势。不同处理下丙二醛含量在整个试验期持续上升。试验初期,各处理2种色原酮总含量均迅速增加, LD和SD处理在试验中期达到峰值,随后开始下降, 而CK处理在试验中期和后期平缓上升。LD和SD处理的3种酶活性、渗透调节物质含量及2种色原酮总含量变化幅度大于CK,且LD和SD处理各项指标的峰值均大于CK的相应数值。各水分处理下CAT活性、2种色原酮总含量分别与SOD活性显著相关。【结论】在防风栽培过程中,适当施加干旱胁迫可促进叶片保护酶活性、渗透调节物质含量的提高,有利于防风植株健壮生长并最终提高2种色原酮的含量。
防风; 干旱胁迫; 保护酶; 脯氨酸; 丙二醛; 色原酮
水分是植物生存与发展的必要条件,干旱胁迫是影响植物生长和代谢的主要逆境因素之一[1-2],在正常生长情况下,由于存在防御系统,植物体内自由基代谢保持平衡状态[3]。在遭受干旱胁迫的时候,植物体除了产生一系列的生理生化变化,还依靠自身的保护性酶活性变化来清除积累的超氧自由基,维持活性氧的代谢平衡,从而减轻或避免自由基对细胞膜系统造成的伤害[4-5]。许多研究表明,植物在逆境条件下的膜脂过氧化反应和保护酶活性变化在植物抗旱中发挥着极大作用,是衡量植物抗旱性强弱的重要生理指标[6-7]。
防风Saposhnikoviadivaricata是我国常用大宗中药材之一,以未抽薹的干燥根入药。主要种植在干旱半干旱地区,在生长期内倍受土壤和大气干旱的胁迫。因此,加强其抗旱性研究对挖掘干旱、半干旱地区防风生产潜力具有十分重要的意义。近年来对防风药材引种栽培、光合作用、化学成分及药理等方面的研究较多[8-12],但对防风适应干旱环境的生理机制研究较少,特别是防风在干旱胁迫下保护酶活性与植物抗旱性的关系的研究鲜见报道。因此,笔者研究干旱胁迫对防风叶片保护酶[(超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)]活性、渗透调节物质积累、膜脂过氧化程度及升麻素苷和5-O-甲基维斯阿米醇苷2种色原酮含量的影响,旨在探讨干旱条件下防风保护酶系统与防风适应干旱的生理机制,为防风抗旱机理的研究提供理论依据。
1 材料与方法
1.1 试验地概况
试验于2014年在吉林省长春市吉林农业大学药用植物园防雨棚内进行。地理位置为43°48′N、125°25′E,年降水量为573.5 mm,海拔251 m,年均日照2 688 h,年平均气温4.8 ℃,无霜期142 d,相对湿度56%。全年主要降水集中在6—8月份,占全年降水近70%。
1.2 试验材料
试验采用盆栽方式,塑料盆高30.5 cm,上部口径31.4 cm,下部口径20 cm,每盆装土深度28 cm。2014年4月28日播种,保证土壤水分充足,2014年5月29日苗出齐后,每盆定苗5株。7月5日开始进行不同水分处理,9月30日结束。冬季做好防寒,保证人工控制水分供给量条件下,光照和温度等生态因子和供水方法接近自然状况。
1.3 试验设计
模拟长春降水量设计了3个梯度的水分供给量,即:重度干旱胁迫(200 mm,SD);轻度干旱胁迫(400 mm,LD);充分供水(600 mm,CK),3个处理的供水量分别相当于防风不同生长地区全年的降水总量。每个供水处理的浇水次数、时间均相同,选在当天17:00—18:00进行,每隔5 d浇水1次,为了和自然降水相近,试验以长春1990—2010年年平均降水量573.5 mm为参考,7月占全年的26.81%、8月占全年的22.49%、9月占全年的7.80%。由于各月份的降水量不同,所以3种供水处理的各月份浇水量也不同,根据试验用盆将每次浇水量换算成体积(mL), 用喷壶模拟自然降水喷洒在防风植株,具体方案见表1。
2014年7月5日第1次控水前进行第1次取样,之后每半个月取样1次,直至9月30日结束,每次取样在17:00—18:00进行。取样时每个处理随机选取5盆,每盆随机选取2株,将10株样品装入冰盒,带回实验室后迅速将根洗净,叶片用液氮固定,储存于-80 ℃冰箱中,用于测定叶片SOD、POD、CAT活性、丙二醛(MDA)和脯氨酸含量;每个处理重复测定3次。根阴干,用于测定升麻素苷和5-O-甲基维斯阿米醇苷含量。
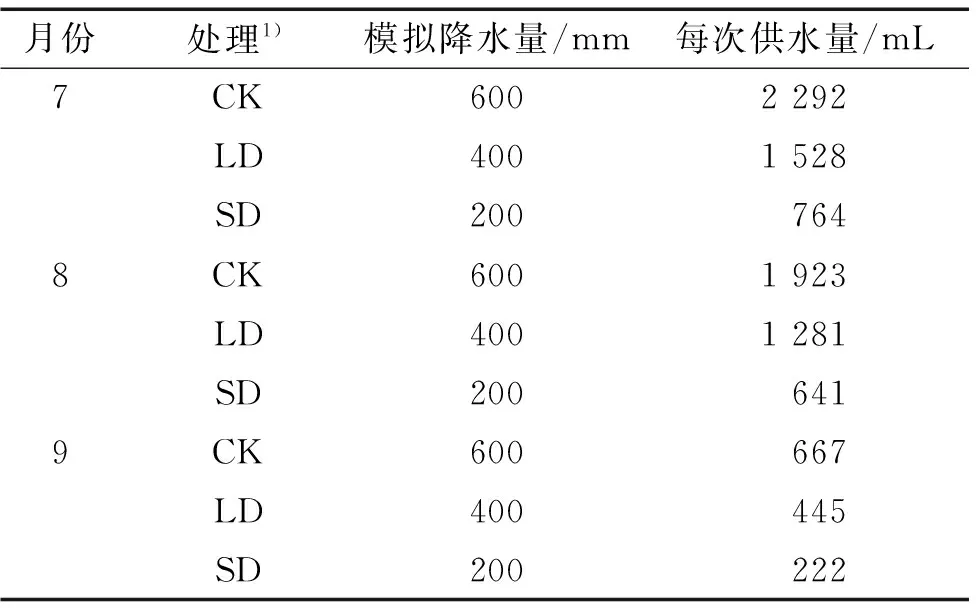
表1 水分供给试验设计方案
1.4 酶活性、MDA和脯氨酸含量的测定
SOD活性测定采用NBT光化还原法[13],SOD酶活性以抑制NBT光化还原的50% (将NBT的还原抑制到对照一半时所需的酶量)为1个酶活性单位(U);POD活性釆用愈创木酚法[14]测定,每30 s记录1次,光密度以每分钟内D470 nm升高0.01为1 U;CAT活性采用紫外吸收法[13]测定,每30 s记录1次,以每分钟内D240 nm下降0.1为1 U; MDA含量采用硫代巴比妥酸(TBA)比色法[15]测定;脯氨酸含量采用酸性茚三酮法[14]测定。
1.5 升麻素苷和5-O-甲基维斯阿米醇苷总含量的测定
防风根粉碎,过30目筛,精密称取0.2 g样品,加入0.4 mol·L-1[C3MIM]Br 4 mL,在超声频率50 kHz,40 ℃条件下提取5 min,滤液采用Agilent 1260高效液相色谱仪测定升麻素苷和5-O-甲基维斯阿米醇苷的总含量,色谱柱Eclipse XDB-C18(2.1 mm×150 mm×3.5 μm),柱温30 ℃,检测波长254 nm,采用甲醇溶液洗脱:甲醇体积分数在0~9 min内由30%缓慢增加到45%,在9~11 min内由45%缓慢增加到90%;流速0.7 mL·min-1。根据峰面积计算防风根中升麻素苷和5-O-甲基维斯阿米醇苷的含量之和。
1.6 数据处理
采用Microsoft Excel 2013和DPS 12.01统计软件对数据进行整理和分析,采用Duncan’s法进行多重比较。
2 结果与分析
2.1 干旱胁迫对防风叶片酶活性、MDA和脯氨酸含量的影响
2.1.1 SOD活性 防风叶片SOD对干旱胁迫反应敏感,其受干旱影响变化见图1A,不同水分处理下SOD活性均呈现出先升高后降低趋势,其中SD处理SOD活性快速增加,在8月15日达到最大值,是CK的1.24倍,而LD与CK处理下SOD增加的趋势较为平缓,在8月31日达到最大值,是CK的1.04倍,说明干旱胁迫下, SOD活性的增加能够帮助植物更有效地清除自由基。方差分析表明, 在2者达到最大值时, LD、SD与CK均达到极显著差异水平(P<0.01)。随着处理时间的延长,各处理下SOD活性开始下降,但是降低趋势各不相同,CK的下降趋势最为平缓,而LD、SD处理下SOD急剧下降,2者在9月30日SOD酶活性均低于对照,说明长时间干旱胁迫使防风叶片SOD活性降低,不能有效地帮助植物把过多的自由基清除。
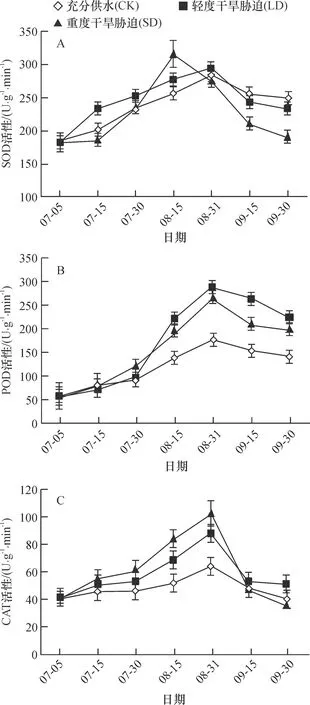
图1 不同干旱胁迫处理下防风叶片酶活性的变化
2.1.2 POD活性 由图1B可知各处理下POD活性均呈现先上升后下降的趋势,均在8月31日达到最高水平,此时LD和SD处理的POD活性分别达到CK的1.64和1.51倍。方差分析表明,在三者达到最大值时,LD、SD与CK均达到极显著差异水平(P<0.01),说明干旱胁迫初期POD活性增加以抵抗干旱胁迫对防风造成的氧化伤害。随着干旱胁迫的持续,重度干旱胁迫下的POD活性急剧下降,而对照和轻度干旱胁迫的下降趋势较为平缓,LD、SD的POD活性在9月30日均高于CK,说明长时间干旱胁迫会对防风叶片的抗氧化能力造成伤害,POD清除自由基能力下降。
2.1.3 CAT活性 由图1C可看出各水分处理下CAT活性与SOD、POD活性变化趋势基本一致。试验初期,3种处理下CAT上升趋势较为平缓,在7月30日后快速增加并在8月31日达到最大值,SD和LD处理的CAT活性分别是对照的1.92和1.64倍。方差分析表明,在三者达到最大值时,LD、SD与CK均达到极显著差异水平(P<0.01),说明防风叶片在遭受干旱胁迫初期,CAT活性增加以抵抗自由基对防风的氧化伤害。随着处理时间的延长,3种处理下的CAT活性均显著下降,在9月30日3种处理的CAT活性大小顺序为:LD>CK>SD,说明长时间的干旱胁迫会降低CAT活性, 重度干旱胁迫下防风叶片抗氧化能力衰退最大。
2.1.4 MDA含量 丙二醛是植物受到逆境胁迫时膜脂过氧化作用的最终产物,干旱胁迫下防风叶片丙二醛积累越多,表明组织的保护能力越弱[16]。由图2A可知,不同水分处理下MDA含量均呈现上升趋势,方差分析表明,8月31日SD、LD与CK差异极显著(P<0.01),在9月30日,SD和LD的MDA含量分别是对照的1.53和1.07倍,各处理间达到极显著差异水平,表明干旱胁迫下防风叶片MDA含量增加,膜系统受到破坏。
2.1.5 游离脯氨酸含量 由图2B可知,在防风整个生长期内,各水分处理下脯氨酸含量变化趋势大致相同,均呈先升高后降低的趋势。试验初期,各处理的脯氨酸含量相差不大,随着处理时间增加,除CK外,其他干旱胁迫处理的脯氨酸含量迅速积累升高,在8月15日达到峰值,SD和LD处理的脯氨酸含量分别达到对照的1.77和1.75倍,差异极显著(P<0.01)。8月15日之后,脯氨酸含量快速下降,并且在9月15日后SD、LD的脯氨酸含量均低于对照,达到极显著差异水平。表明脯氨酸在前期抵御干旱胁迫时起重要渗透调节作用。
2.2 干旱胁迫对防风药材品质的影响
不同供水量对防风有效成分的影响见图2C。试验初期,各处理2种色原酮(升麻素苷和5-O-甲基维斯阿米醇苷)总含量相差不大,随着处理时间增加,7月15日之前各处理2种色原酮总含量均迅速增加,之后CK呈现比较平缓的升高趋势,而LD和SD处理2种色原酮总含量继续增加,在8月15日达到峰值,SD的2种色原酮总含量达到CK的1.42倍,差异显著(P<0.05);随后LD和SD处理2种色原酮总含量开始下降,到9月15日,各处理间差异不显著(P>0.05)。
2.3 防风酶活性、渗透调节物质和2种色原酮含量的相关分析
表2显示了不同水分处理下防风各种酶活性、渗透调节物质和2种色原酮总含量的相关关系。CK处理的SOD活性与POD活性极显著正相关,与CAT活性显著正相关;SOD、POD活性、MDA含量与2种色原酮总含量呈显著正相关关系。LD处理的SOD活性与CAT活性、2种色原酮总含量呈极显著正相关关系;POD活性与MDA含量呈显著正相关。SD处理的SOD活性分别与CAT活性、脯氨酸含量、2种色原酮总含量呈显著正相关。逆境能够促进中药材次生代谢产物的积累,2种色原酮总含量与SOD活性相关系数大小为LD>SD>CK,说明防风叶片SOD对干旱胁迫反应较其他酶敏感。
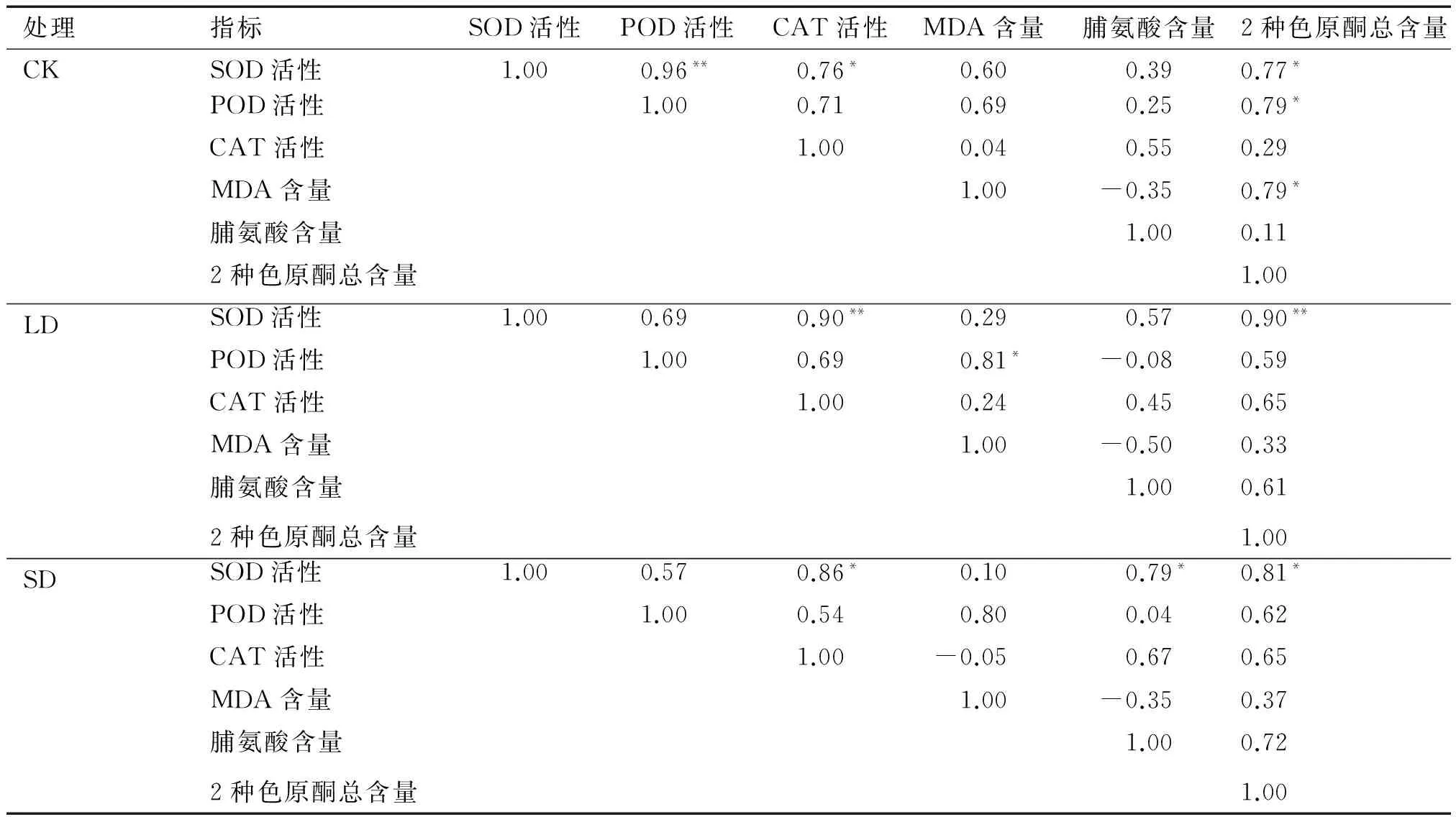
表2 不同干旱胁迫下酶活性、渗透调节物质含量和2种色原酮总含量的相关关系1)
3 讨论与结论
在正常的条件下,植物体内SOD、POD和CAT三者彼此协调。而在逆境胁迫下,植物体内活性氧产生和清除的平衡遭到破坏,活性氧自由基增加,当活性氧自由基浓度超过一定阈值时,就会影响植物的正常生长。植物需动员整个防御系统以抵抗氧化伤害,而防御系统中SOD、POD和CAT的活性高低就成为控制伤害的决定因素[17],也能较好地反映植物对逆境的适应能力[18-19]。本研究中,试验初期,防风叶片SOD、POD、CAT 3种酶活性均增加,说明在植物遭受干旱胁迫时,保护酶会迅速增加以清除植物体内过多的自由基,防风叶片通过自身保护酶活性变化来保护其内部组织,减轻植株因土壤水分减少引起的损伤,降低对细胞膜的膜脂过氧化水平,并增强了防风生长后期对干旱的抵抗力。这与杨再强等[20]对番茄保护酶的研究结果一致。随胁迫历时延长,不同水分处理、不同酶类型的表现不同,SD处理的SOD活性在8月15日达到最高,超过其他2个处理;LD处理的POD活性在8月31日达到最高,且超过其他2个处理;SD处理的CAT活性在8月31日达到最高,且超过其他2个处理。不同水分处理、不同酶活性的增长速度以及达到高峰的时间不同,说明防风在长时间遭受干旱胁迫的时候,单一的抗氧化酶并不足以防御植物的氧化胁迫,只有保护酶之间协同作用,才能共同抵抗干旱胁迫诱导的对植物的氧化伤害,并且提高防风适应干旱胁迫的能力。在试验后期,不同水分处理防风保护酶活性下降,可能是因为SOD、POD和CAT是植物抵抗干旱的第1层保护系统,当干旱发生在早期时,该系统在保护植株免受干旱导致的氧化损伤方面起着重要作用[21]。而在植物长时间遭受干旱胁迫时,植物单靠SOD、POD和CAT活性的变化不足以保护植株免受干旱的损伤,必须启动其他抗干旱适应系统以保护细胞的正常机能,以适应干旱环境,并完成其生命进程[22]。
丙二醛(MDA)含量高低和细胞质膜透性变化是反映细胞膜脂过氧化作用强弱和质膜破坏程度的重要指标[23]。本研究中,MDA 作为活性氧积累而导致膜伤害的膜脂过氧化产物, 其含量随着试验时间的延长不断增加,在后期(8月31日之后),其含量变化与保护酶SOD、POD和CAT 活性的变化呈相反趋势,在轻度干旱胁迫及充分供水条件下MDA含量的上升幅度较小,而重度干旱胁迫下MDA含量增加达到了极显著水平,上升幅度大,说明防风保护酶活性的下降与MDA积累密切相关,可能互为因果,即一方面由于SOD、POD和CAT活性下降,使有害自由基积累超过了伤害的阈值,直接或间接启动膜脂过氧化反应,使MDA的含量增加[24-25];另一方面,随着MDA的积累反过来又抑制了保护酶的活性,进一步促使膜系统受损加重[25]。这与张盼盼等[26]对干旱胁迫下糜子Panicummiliaceum叶片MDA含量的研究结果一致。
植物在适应干旱逆境条件的进化过程中逐渐形成了相应的生理调节机制,其中渗透调节作用是重要的生理反应[27-28]。本研究中,试验初期,脯氨酸含量迅速增加,中期达到最大,说明植株遭受干旱胁迫时,脯氨酸含量迅速增加以提高细胞液浓度,降低细胞渗透势,保持了渗透平衡,以达到保持植物水分的作用。试验后期脯氨酸含量下降,可能与生长后期防风植株衰老及干旱胁迫加重,影响自身调节能力有关。
有效成分含量是衡量中药材品质的重要标准,试验初期,各处理下2种色原酮总含量相差不大,随着处理时间增加,各处理下2种色原酮总含量随着干旱胁迫程度不同而呈现不同的增加趋势。CK处理的2种色原酮总含量呈现平缓增加趋势;而LD和SD处理2种色原酮总含量先呈迅速增加趋势,之后开始下降,并且2种色原酮总含量的大小是SD>LD>CK,这与作者先前的研究结果一致[29],即升麻素苷和5-O-甲基维斯阿米醇苷含量随供水量的减少呈增加趋势。说明干旱胁迫能够刺激植物组织中次生代谢产物的产生[30]。各处理2种色原酮总含量与SOD活性相关系数大小为LD>SD>CK,说明防风叶片SOD对干旱胁迫反应较其他酶活性敏感。因此,在防风栽培过程中,适当控制土壤水分可促进叶片保护酶活性、渗透调节物质含量的提高,有利于防风植株健壮生长并提高有效成分含量,从而提高防风的中药品质,这是防风节水栽培技术的重要措施之一,本研究结果为防风保护酶系统与抗旱机制的研究提供了理论依据。
[1] 山仑. 旱地农业技术发展趋向[J]. 中国农业科学, 2002, 35(7): 848- 855.
[2] CHAVES M M, OLIVEIRA M M. Mechanisms underlying plant resilience to water deficits: Prospects for water-saving agriculture[J]. J Exp Bot, 2004, 55(407): 2365-2384.
[3] MOCORD J M. Superoxide dismutase: An enzymic function for erythrocuprein[J]. Biol Chem, 1969, 244(22): 6049- 6055.
[4] BARTOLI C G, GMEZ F, MARTNEZ D E, et al. Mitochondria are the main target for oxidative damage in leaves of wheat (TriticumaestivumL.)[J]. J Exp Bot, 2004, 55(403): 1663-1669.
[5] WU Y X, TIEDEMANN A V. Physiological effects of azoxystrobin and epoxiconazole on senescence and the oxidative status of wheat[J]. Pestic Biochem Phys, 2001, 71(1): 1-10.
[6] LASCANO H R, MELCHIORRE M N, LUNA C M, et al. Effect of photooxidative stress induced by paraquat in two wheat cultivars with differential tolerance to water stress[J]. Plant Sci, 2003, 164(5): 841- 848.
[7] 周磊, 李松, 郭传龙, 等. PEG模拟干旱处理条件下2种大豆的抗旱机制比较[J]. 扬州大学学报(农业与生命科学版), 2013, 34(3): 54- 60.
[8] 孙晶波. 防风药材化学成分及其与根际土壤中无机元素含量的相关性研究[D]. 长春:吉林农业大学, 2013.
[9] 李轶雯. 不同产地防风药材的质量评价研究[D]. 长春:吉林农业大学, 2011.
[10]韩忠明, 王云贺, 林红梅, 等. 吉林不同生境防风夏季光合特性[J]. 生态学报, 2014, 34(17): 4874- 4881.
[11]韩忠明, 王云贺, 韩梅, 等. 高速逆流色谱分离纯化防风中升麻素苷和5-O-甲基维斯阿米醇苷[J]. 分析化学, 2009, 37(11): 1679-1682.
[12]韩忠明, 杨荣艳, 王云贺, 等. 超声波提取防风色原酮的研究[J]. 时珍国医国药, 2008, 19(12): 3035-3037.
[13]西北农业大学植物生理生化教研室. 植物生理实验指导[M]. 西安: 陕西科学技术出版社, 1987: 51-55.
[14]李合生. 植物生理生化试验原理和技术[M]. 北京: 高等教育出版社, 2000: 258-260.
[15]郑炳松. 现在植物生理生化研究技术[M]. 北京: 气象出版社, 2006.
[16]桑子阳, 马履一, 陈发菊. 干旱胁迫对红花玉兰幼苗生长和生理特性的影响[J]. 西北植物学报, 2011, 31(1): 109-115.
[17]JING Y W, HUANG B R. Drought and heat stress injury to two cool-season turfgrasses in relation to antioxidant metabolism and lipid peroxidation[J]. Crop Sci, 2001, 2(41): 436- 442.
[18]孙一荣, 朱教君, 康宏樟. 水分处理对沙地樟子松幼苗膜脂过氧化作用及保护酶活性影响[J]. 生态学杂志, 2008, 27(5): 729-734.
[19]李霞, 焦德茂, 戴传超. 转PEPC基因水稻对光氧化逆境的响应[J]. 作物学报, 2005, 31(4): 408- 413.
[20]杨再强, 刘朝霞, 韩秀君, 等. 水分胁迫对番茄保护酶活性及果实产量的影响[J]. 东北农业大学学报, 2014(3): 40- 45.
[21]陈坤明, 宫海军, 陈国仓, 等. 春小麦不同发育阶段抗氧化系统对田间缓慢干旱的响应[J]. 西北植物学报, 2003, 23(9): 1497-1505.
[22]葛体达, 隋方功, 白莉萍, 等. 长期水分胁迫对夏玉米根叶保护酶活性及膜脂过氧化作用的影响[J]. 干旱地区农业研究, 2005, 23(3): 18-23.
[23]陈少裕. 膜脂过氧化与植物逆境胁迫[J]. 植物学通报, 1989, 6(4): 211-217.
[24]战秀梅, 韩晓日, 杨劲峰, 等. 不同施肥处理对玉米生育后期叶片保护酶活性及膜脂过氧化作用的影响[J]. 玉米科学, 2007, 15(1): 123-127.
[25]陈展宇, 李大勇, 刘国宁, 等. 不同产量水平大豆叶片保护酶活性的比较[J]. 西北农林科技大学学报(自然科学版), 2012, 40(3): 99-103.
[26]张盼盼, 冯佰利, 王鹏科, 等. 干旱条件下糜子叶片衰老与保护酶活性变化[J]. 干旱地区农业研究, 2010, 28(2): 99-103.
[27]宋吉轩, 李金还, 刘美茹, 等. 油菜素内酯对干旱胁迫下羊草渗透调节及抗氧化酶的影响研究[J]. 草业学报, 2015, 24(8): 93-102.
[28]CABUSLAY G S, ITO O, ALEJAR A A. Physiological evaluation of responses of rice (OryzasativaL.) to water deficit[J]. Plant Sci, 2002, 163(4): 815- 827.
[29]韩忠明, 王云贺, 赵淑杰, 等. 不同供水量对防风生长发育和品质的影响[J]. 华南农业大学学报, 2009, 30(3): 4-7.
[30]阎秀峰. 植物药用成分的环境调控[M]∥黄璐琦,郭兰萍.中药资源生态学研究. 上海: 上海科学技术出版社, 2006.
【责任编辑 庄 延 李晓卉】
Effect of drought stress on leaf protective enzyme activities, contents of osmoregulation substances and quality of Saposhnikovia divaricata
HAN Zhongming, XU Miaomiao, WANG Yunhe, ZHANG Tao, HAN Mei, YANG Limin
(College of Chinese Medicinal Materials, Jilin Agricultural University/Key Laboratory for Ecological Restoration and Ecosystem Management of Jilin Province, Changchun 130118, China)
【Objective】 To investigate the physiological mechanisms of drought adaptation and protective enzyme system ofSaposhnikoviadivaricataunder drought stress. 【Method】 Three levels of water supply including full irrigation (CK), light drought stress(LD) and severe drought stress (SD) treatments were set up for annualS.divaricata. Effects of drought stress on leaf protective enzyme activities, contents of osmoregulation substances and total content of two chromones (prim-O-glucosylcimifugin and 5-O-methylvisammioside) ofS.divaricatawere studied. 【Result】The activities of superoxyde dismutase (SOD), peroxidase (POD), catalase (CAT), and proline content under different water treatments increased during early test stage,reached peak during middle stage and then decreased. Malondialdehyde (MDA) content under different water treatments increased throughout the entire test period. The total contents of two chromones under different water treatments all increased at early stage, reached peak during middle stage and then decreased for LD and SD treatments, while slowly increased during both middle and late stage for CK treatment. Changes in the activities of SOD, POD and CAT, the contents of osmoregulation substances, and the total contents of two chromones for LD and SD treatments were higher compared to CK, and the peak values of these measurements for LD and SD treatments were also higher compared to CK. There were significant correlations between CAT activity, the total content of two chromones and SOD activity under different water treatments.【Conclusion】Appropriately imposing drought stress in the cultivation ofS.divaricatacan increase protective enzyme activities and the contents of osmoregulation substances ofS.divaricataleaves, which is beneficial forS.divaricatagrowth and can increase the total content of two chromones.
Saposhnikoviadivaricata; drought stress; protective enzyme; proline; MDA; chromone
2016- 02- 18 优先出版时间:2016-10-24
韩忠明(1979—), 男, 副教授, 博士, E-mail: hanzm2008@126.com
国家自然科学基金(31300270); 吉林省科技发展计划项目(20130522048JH); “十二五”吉林省教育厅科学技术研究规划项目(2015205)
Q945.78
A
1001- 411X(2016)06- 0091- 07
优先出版网址:http://www.cnki.net/kcms/detail/44.1110.s.20161024.1041.016.html
韩忠明, 胥苗苗, 王云贺, 等.干旱胁迫对防风叶片保护酶活性、渗透调节物质含量及药材品质的影响[J].华南农业大学学报,2016,37(6):91- 97.
