不同供磷浓度对杉木苗根系和盆栽土壤的影响
2016-12-08韦如萍胡德活郑会全王润辉
韦如萍, 胡德活, 晏 姝, 郑会全, 王润辉
(广东省森林病虫害生物防治重点实验室/广东省林业科学研究院, 广东 广州 510520)
不同供磷浓度对杉木苗根系和盆栽土壤的影响
韦如萍, 胡德活, 晏 姝, 郑会全, 王润辉
(广东省森林病虫害生物防治重点实验室/广东省林业科学研究院, 广东 广州 510520)
【目的】研究不同供磷浓度下盆栽杉木Cunninghamialanceolate苗根系形态和生理响应机制及土壤养分和微生物变化规律。【方法】设置缺磷(P0)、正常供磷(P1)及高浓度供磷(P2)3个处理,测定不同供磷处理盆栽杉木苗根系形态和生理指标及土壤养分和微生物数量的时间动态。【结果】处理第30天时,P0植株地上部和整株干物质累积量最小,而根系干物质累积量和根冠比最大,分别是P1的2.07和5.37倍,差异显著;处理第15天时,P0根系磷吸收率最低而利用率最高,第30天时,其根系磷吸收率为P1的43.18%,而磷利用率为P1的231.59%;根系表面积和根尖数随处理时间增加呈增长趋势,第30天时,P0根系表面积为3.46 cm2,根尖数为56个,显著高于P1、P2处理;磷处理期间,酸性磷酸酶、超氧化物歧化酶活性和丙二醛含量均以P0最高,并与P1、P2差异显著;较之P1、P2处理,P0的土壤碱解氮明显升高,有效磷严重匮乏,pH、速效钾和阳离子交换量变化不大,酸性磷酸酶活性显著增强,真菌数量则有所降低。【结论】较之正常和高浓度供磷处理,缺磷胁迫导致杉木苗根系干物质累积量增加,根冠比增大,根系表面积和根尖数随胁迫时间延长而增大和增多;缺磷处理根系磷吸收率下降而利用率提高,根系的酸性磷酸酶、超氧化物歧化酶活性和丙二醛含量显著增大,同时盆栽土壤酸性磷酸酶活性显著增强,碱解氮含量明显增加,有效磷含量匮乏且真菌数量最少,表明缺磷处理对杉木苗根系生长及土壤养分和微生物数量影响显著。
杉木; 幼苗; 根系; 低磷胁迫; 盆栽; 土壤养分
磷作为植物所必须的大量矿质元素,被认为是植物生命过程中各种生理代谢活动的重要参与者,对植物生长发育有着重要的作用[1]。研究表明,长期施用磷肥已使大多数农业土壤成为巨大的磷库,但能被植物吸收利用的有效磷含量仅为1 μmol·L-1左右,远不能满足植物对磷的需求,进而引发了土壤“遗传学缺磷”的严重问题[2]。磷素在土壤中的移动性较差,其扩散距离仅为1~2 mm,因此在植物生长发育过程中,很容易造成根际土壤磷的亏缺[3]。根系是植物吸收营养元素的主要器官,也是对养分胁迫最敏感的部位。研究表明,低磷胁迫条件下,根系的形态结构与其活化和利用土壤难溶性磷的能力具有密切关系[4-5]。严小龙等[6]研究还发现,根系形态的生长与外界环境有着密切的关系。在低磷环境下,植物根系会在形态和生理上发生适应性变化,如主根生长受到抑制,侧根和根毛增加[7],根系分布变浅,根冠比增大,根系有机酸分泌量增多等[8]。杉木Cunninghamialanceolate是重要的速生工业用材,也是我国南方商品林基地建设的重要支撑。我国南方大部分土壤为酸性红壤和赤红壤,土壤有效磷严重缺乏,已成为限制植物优质高产的重要因素之一[9]。加强重要造林树种以磷效率为主的营养遗传改良,增加土壤磷素的生物有效性,对解决土壤有效磷缺乏和提高人工林生产力具有重要作用[10]。梁霞等[11]研究了低磷胁迫下不同杉木无性系磷素特性,表明杉木无性系可通过增强叶片及根际酸性磷酸酶的活性来适应环境磷缺乏。俞元春等[12]研究了缺磷胁迫下不同种源杉木苗根系有机酸的分泌,指出缺磷胁迫下杉木苗根系有机酸的分泌量显著增加,主要为草酸和酒石酸。陈智裕等[13]分析了低磷胁迫下杉木家系幼苗生长特性与内源激素的关系,表明缺磷胁迫使幼苗根系的脱落酸含量显著增加,而细胞分裂素显著降低。在分子遗传学方面则报道了低磷胁迫下耐低磷杉木基因型差异蛋白质组的研究[14]。已有的研究主要集中在形态、生理及分子方面,且多为单一时间点的测定结果,而对低磷胁迫下不同时间维度里,杉木根系形态、生理的动态变化及其对生长介质的影响鲜见报道。本文研究了低磷胁迫下,杉木无性系幼苗在不同时期的干物质分配情况、根系形态特征、磷素吸收利用能力、保护酶活性及栽培土壤养分和微生物含量等变化情况,以期为进一步阐明杉木无性系应对低磷环境的响应机制以及磷高效杉木品种选育技术提供参考依据。
1 材料与方法
1.1 试验地概况
试验地位于广州市天河区,东经113°25′,北纬23°14′,属南亚热带季风气候,年均气温21.8 ℃,年均降雨量1 725 mm,年均蒸发量1 603.5 mm,平均相对湿度79%,平均日照1 960 h,无霜期大于340 d。
1.2 供试材料
杉木无性系4号组培容器苗,苗龄6个月,平均苗高8.50 cm,平均地径0.23 cm。
1.3 试验设计
在塑料大棚内采用土培盆栽法开展试验。育苗容器上口直径22.5 cm,底部直径10.5 cm,高15.5 cm。育苗土壤打碎过筛后,在0.117 6 MPa、122 ℃条件下高压蒸气灭菌20 min,然后装盆备用。2015年7月8日,选择无病虫害、长势一致的苗木上盆栽植。栽植时统一修剪苗木根系,保留长度为3.0 cm左右。每盆栽植1株苗木,设置3个处理,随机区组排列,3次重复,每重复30株苗。在改良Hoagland’s营养液配方[15]的基础上,以KH2PO4为磷源,配置3种不同磷浓度的营养液,即P0(0 mmol·L-1KH2PO4,1.0 mmol·L-1KCl)、P1(1.0 mmol·L-1KH2PO4)、P2(2.0 mmol·L-1KH2PO4),苗木定植15 d后,每天傍晚浇灌1次营养液,每次30 mL·株-1,连续浇灌1个月,试验期间不施放其他肥料,其他田间管理措施保持一致。自浇灌营养液当天起,每隔5 d,各处理随机选取3株苗木(3次生物学重复)进行各项指标测定。
1.4 测定方法
1.4.1 植株生物量和含磷量测定 每个植株分成根、茎、叶3部分,经105 ℃杀青30 min,70 ℃烘干至恒质量,分别称量各部位干物质质量;根系无机磷含量采用磷钼蓝比色法测定,全磷含量采用钒钼黄比色法测定[16]。
1.4.2 根系形态参数测定 清洗后截取完整根系,利用(Microtek)ScanMaker i800 Plus进行根系扫描,然后运用万深LA-S植物根系分析系统获取根系形态指标。
1.4.3 酸性磷酸酶(ACP)活性测定 参照Mc Lachlan等[17]的方法进行,清洗根系后即刻取样测定。
1.4.4 超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量测定 清洗根系后即刻取样测定,SOD活性测定采用氯化硝基四氮唑蓝光化还原法,MDA含量测定采用硫代巴比妥酸法[18]。
1.4.5 土壤养分含量测定 土壤经高压蒸气灭菌后,取1 kg混合土样(CK)进行第一次养分测定;在浇灌营养液30 d时进行第2次取样,即随机选取各处理3个盆栽土壤混合均匀后取1 kg土样测定。养分指标为土壤pH、碱解氮、有效磷、速效钾、阳离子交换量、酸性磷酸酶活性、真菌量,参照鲍士旦[19]的土壤农化分析方法测定。
1.5 数据分析
采用SAS统计软件对数据进行统计分析。干物质累积量、磷素吸收率和利用率计算公式如下[11]:
干物质累积量=收获时生物量-初始生物量;以开始浇营养液当天的生物量为初始生物量。
根系磷素吸收率=根系总的磷素吸收量/根系生物量。
根系磷素利用率=根系总干物质累积量/根系总的磷吸收量。
2 结果与分析
2.1 不同供磷浓度对植株干物质累积量分配的影响
由表1可知,地上部干物质累积量除P0处理外,均随时间延长而增长;第15天起,P0处理地上部干物质累积量显著低于P1、P2处理,第30 天时,P0处理仅为P1处理的38.52%,P1、P2处理间差异不显著。3个处理的根系干物质累积量随时间延长而增长,其中P0处理增长幅度最大,P1处理最小,自第20天起,P0处理明显高于P1、P2处理,第30天时,分别是P1、P2处理的2.07和1.94倍。整株干物质累积量的变化趋势与地上部相似,第15天起,P0处理显著低于P1、P2处理,第30 天时,P0处理为P1处理的68.29%,P1、P2处理间差异不明显。根冠比在第5—30天内,P0处理均明显高于P1、P2处理,第30天时,P0处理分别为P1、P2处理的5.37和5.14倍;P1、P2处理自第10天起,根冠比波动较小,分别在0.208~0.261和0.225~0.321之间变动。

表1 不同供磷浓度植株的干物质分配1)
2.2 不同供磷浓度对根系磷吸收率和利用率的影响
由图1可知,根系磷吸收率在3个处理间的变化有所不同,自第15天起,P0处理根系磷吸收率最低,P1处理最高,此后差距逐渐明显,第30天时,P0处理1 mg根系干物质的总磷含量为0.002 7 mg,仅为P1、P2处理的43.18%和51.56%,差异显著(P<0.05),P1、P2处理间差异不明显。由图2可知,3个处理根系磷利用率随时间增加变化不同,其中P0从第15天起在3个处理间根系磷利用率最高,第30 天时,1 mg磷可产生370.42 mg根系干物质,分别是P1、P2处理的231.59%和193.95%,差异显著(P<0.05);P1、P2处理在第5—30 天时呈降低趋势,第30天时,1 mg磷可分别产生159.94和190.98 mg根系干物质。
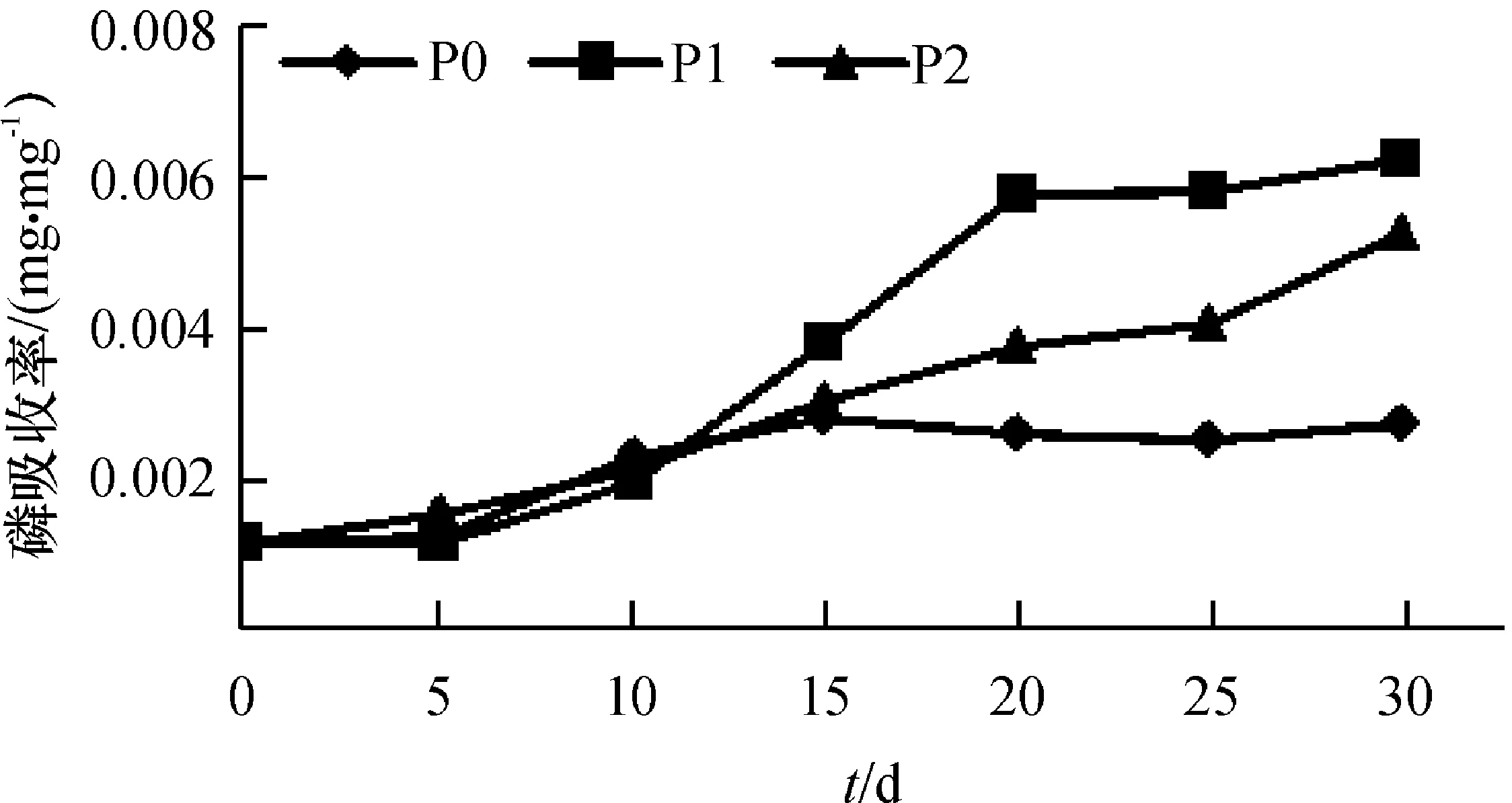
图1 不同供磷浓度下的根系磷吸收率
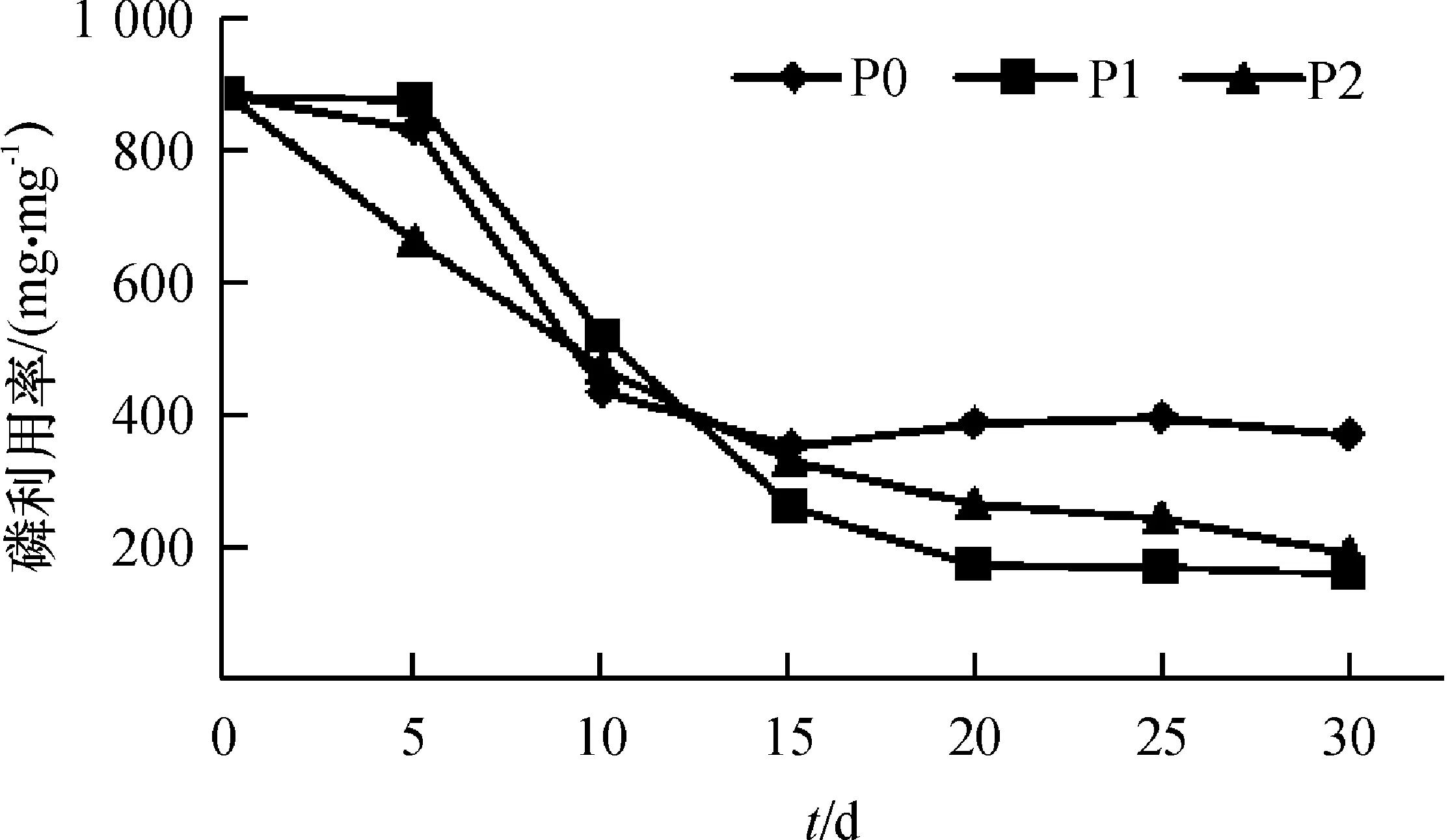
图2 不同供磷浓度下的根系磷利用率
2.3 不同供磷浓度对根系形态参数的影响
根系与土壤接触的有效面积越大吸收能力越强[1,4]。由图3可知,根系表面积随时间增加呈增长趋势,其中P0处理的根系表面积最大,第20—30 天时为2.95~3.46 cm2,显著高于其余2个处理(P<0.05);P1、P2处理在各时期均相差不明显,第20—30 天时,为1.94~2.98 cm2。根的伸长、对水分和养料的吸收等都发生于根尖区域。由图4可知,根尖数随时间增加呈增长趋势,自第10 天起P0处理的根尖数最多,第15—30 天时,根尖数为48~56个,显著高于其余2个处理(P<0.05);P1、P2处理在各时期相差不明显,第30 天时,根尖数分别为46和48个。
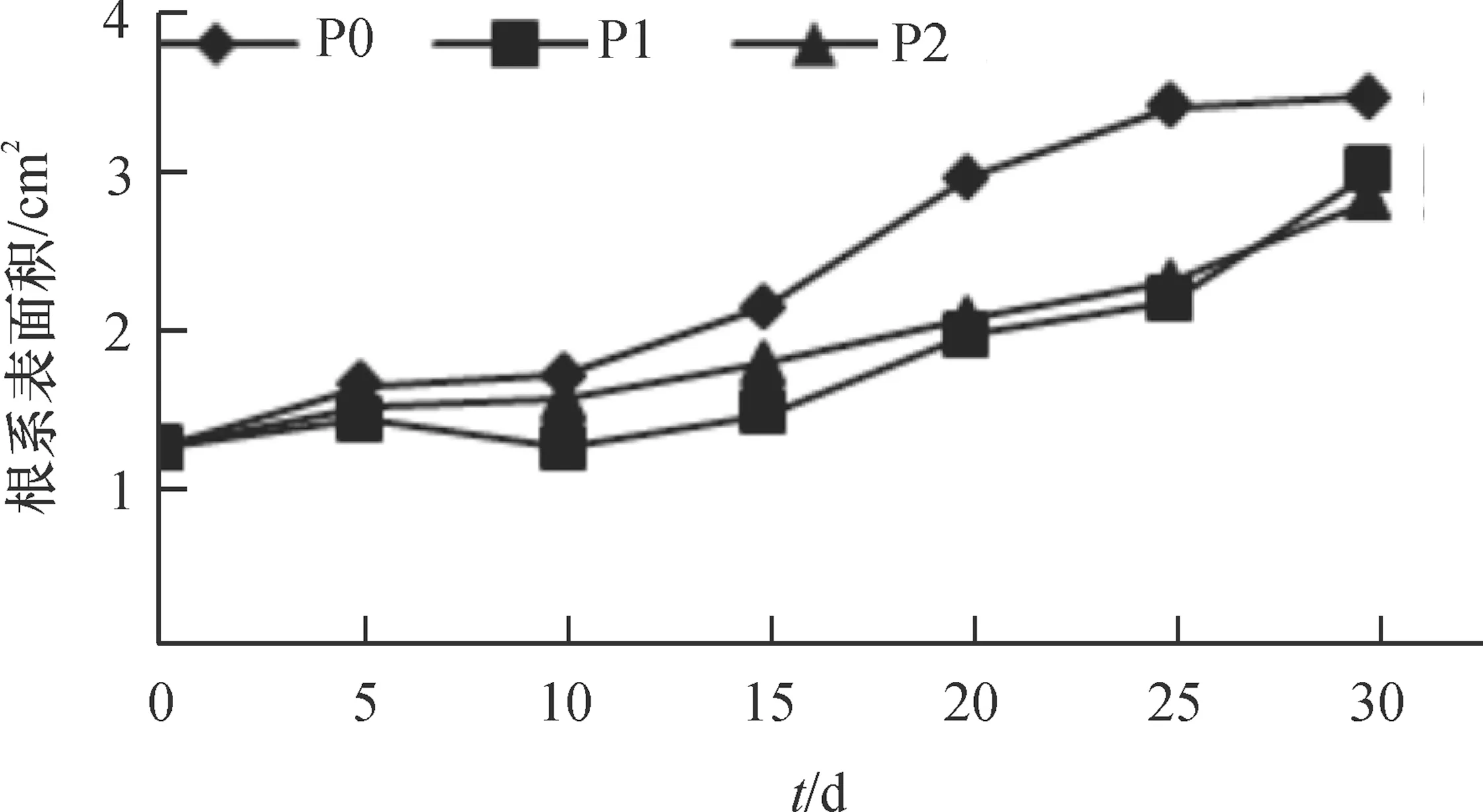
图3 不同供磷浓度下的根系表面积
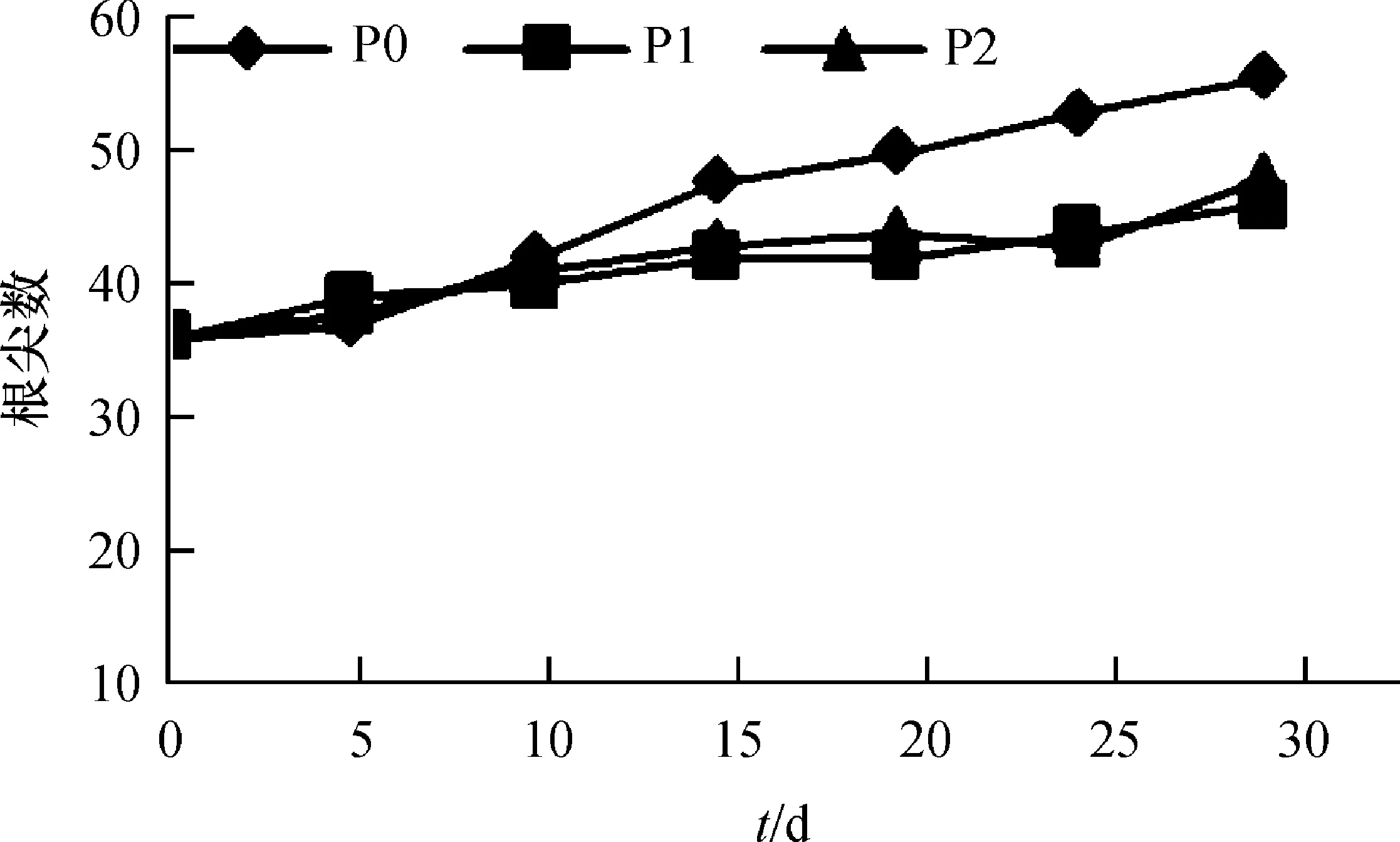
图4 不同供磷浓度下的根尖数
2.4 不同供磷浓度对根系生理指标的影响
酸性磷酸酶(ACP)活性与植物体中磷素丰缺状况有密切联系[20]。由图5可知,随时间增加3个处理根系ACP活性有不同程度的提高,其中P0处理最高,第5 天时已显著高于其余2个处理(P<0.05),第30天时达最大值,为2.77 U·g-1;P1、P2处理在供磷期间根系ACP活性变化趋势相似,第30天时,其活性分别为1.54和1.76 U·g-1,差异不明显。超氧化物歧化酶(SOD)是植物体内高效清除自由基的酶类之一。由图6可知,随时间延长根系SOD活性在3个处理间的变化不尽相同,第10—30天时P0处理最高,为14.79~17.23 U·g-1,显著高于其余2个处理(P<0.05);P1处理在第10—30天呈逐渐下降趋势,第30 天时为10.35 U·g-1;P2处理呈波浪式变化,第20—30天时其值在P0、P1之间变化。丙二醛(MDA)是植物膜脂过氧化反应的重要产物。由图7可知,随时间延长,P0处理根系MDA含量最高,并呈逐渐上升趋势,第15—30 天时,MDA浓度为 0.45~0.48 μmol·g-1,显著高于P1、P2处理(P<0.05);P1、P2处理根系MDA含量总体变化不大,第15—30天时,MDA浓度为0.36~0.39μmol·g-1,两者差异不明显。
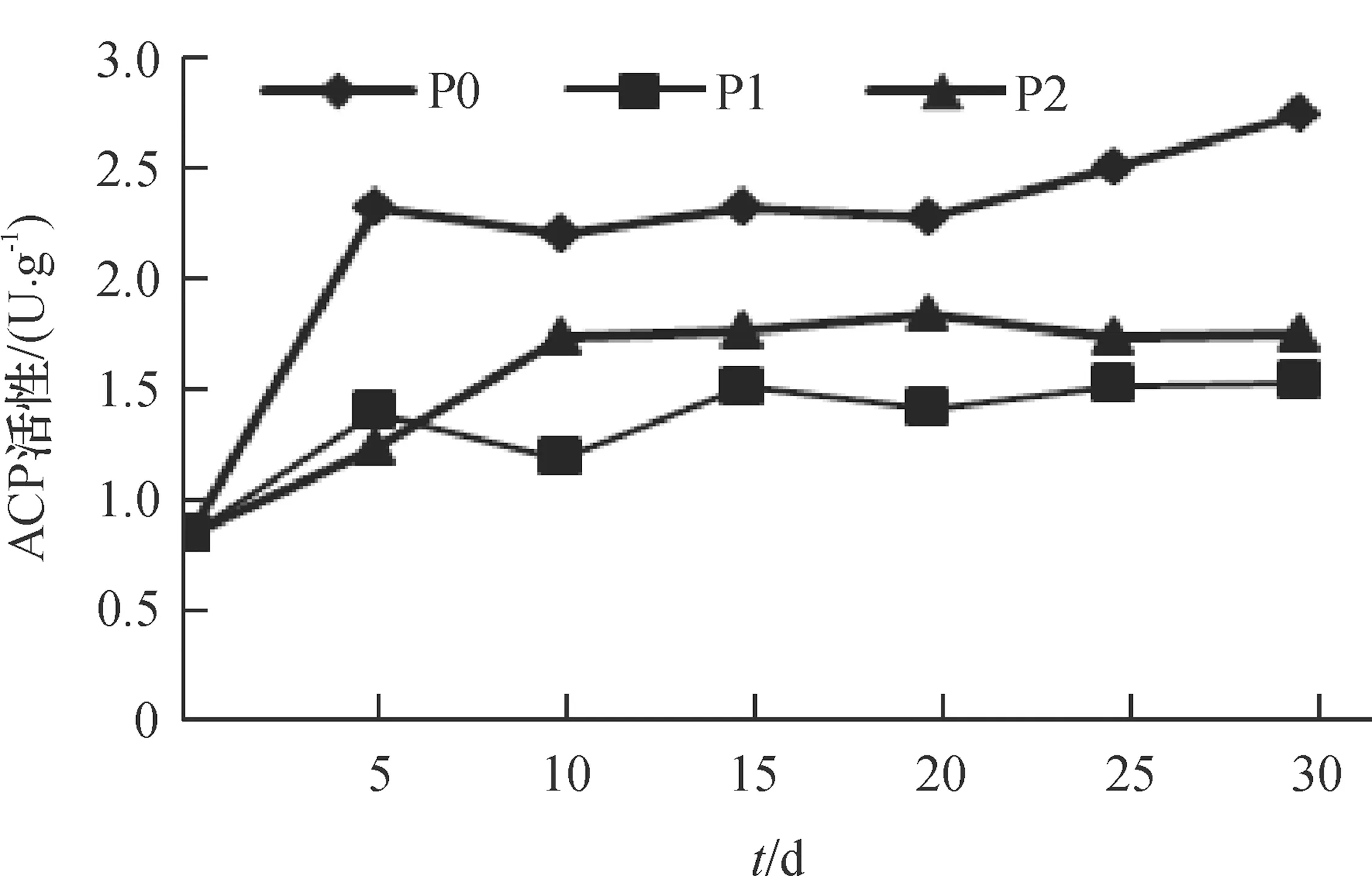
图5 不同供磷浓度下根系ACP活性
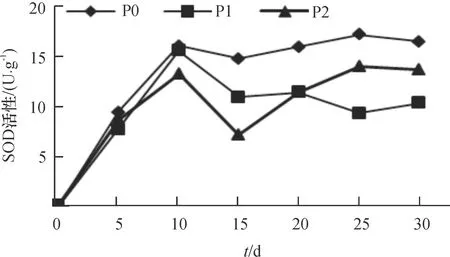
图6 不同供磷浓度根系SOD活性
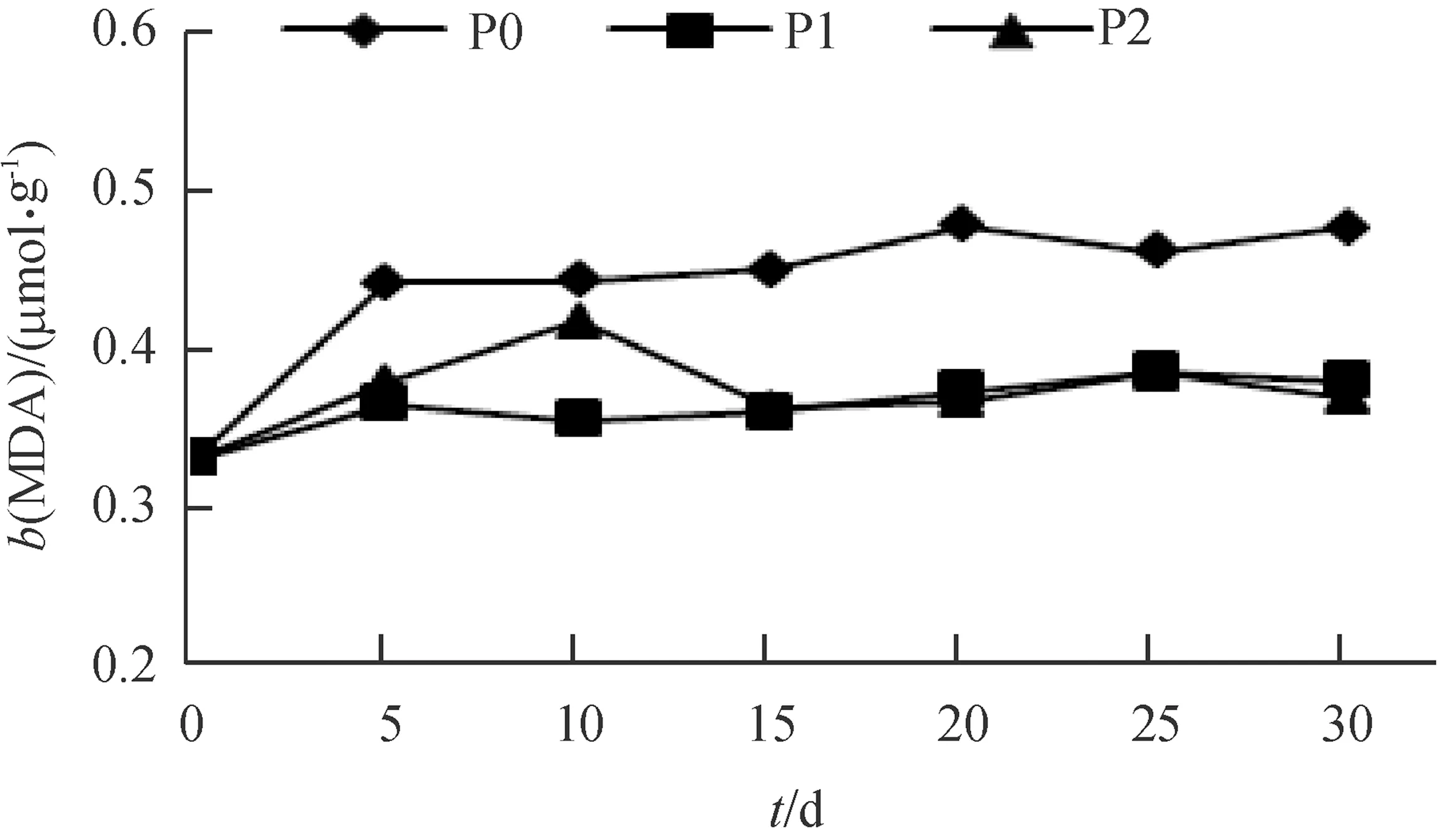
图7 不同供磷浓度根系MDA含量
2.5 不同供磷浓度对盆栽土壤养分及微生物的影响
土壤养分作为土壤肥力的内部表征,其变化反应了土壤管理措施的改变。土壤微生物学特性(土壤酶活性和土壤微生物量)亦与土壤质量密切相关[21]。由表2可知,第30天时,3个处理的土壤pH无明显差异,但较之供磷处理前略有降低。土壤碱解氮质量分数大小排序为P0>P1>P2>CK,P0处理为94.33 mg·kg-1,分别是P1、P2的110.78%和137.91%。土壤有效磷质量分数排序为P2>P1>P0>CK,P0处理分别为P1、P2处理的15.61%和3.15%,差异显著。土壤速效钾质量分数和阳离子交换量在P0、P1、P2处理间差异不显著,但较之供磷处理前均有显著提高。3个处理的土壤酸性磷酸酶活性在第30 天时显著高于供磷处理前,大小排序为P0>P1>P2>CK,P0处理分别为P1、P2处理的189.25%和245.12%。土壤真菌数量排序为P1>P2>P0>CK,其中P0处理仅为P1处理的66.5%,差异显著。
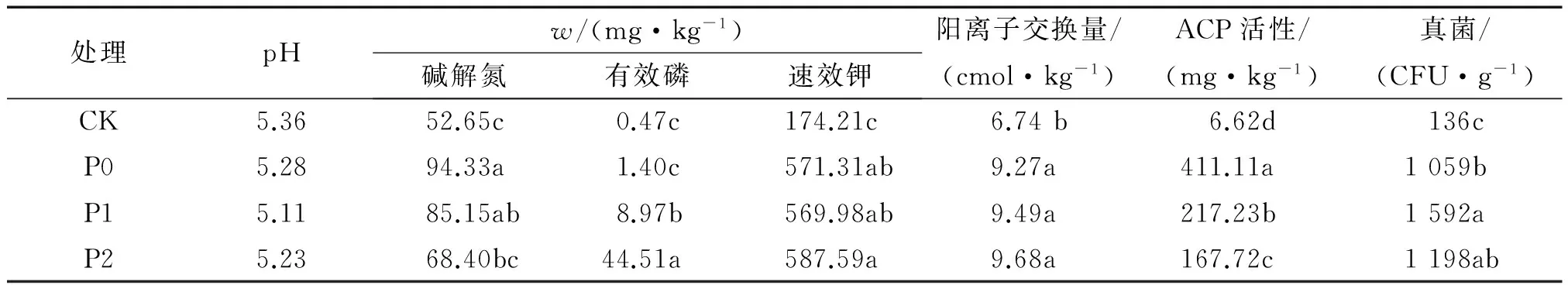
表2 不同供磷浓度盆栽土壤养分情况1)
3 讨论与结论
植物最佳的生长和繁殖状态有赖于磷元素的充足供应。当经受磷饥饿并引起体内含磷量低于生理临界含磷量时,会诱发植物各种形态和生理上的应答变化[2]。本研究表明,适当的供磷浓度有利于杉木苗整株干物质的累积,但P0处理形成低磷胁迫,极大地影响了杉木苗干物质在地上部和根系之间的分配,导致根系干物质累积量较正常供磷处理明显增加,而地上部干物质累积量则相对减少,进而使根冠比增大,并随着胁迫时间延长这种趋势越明显。这可能与低磷胁迫促进了植株光合产物更多地向根系运输[1],以优先保证根系的生长使其拥有更强大的磷素吸收能力有关。这与马尾松[10]、水稻[7]、大豆[9]等的磷素营养研究结果相似。但由于林木生长周期较长,本研究观测时间仅为1个月,因此低磷胁迫条件下,反映植株干物质分配情况的重要指标根冠比能否作为杉木苗响应低磷胁迫的形态指标还有待进一步商榷。
在不同供磷浓度下,杉木苗根系表现出磷效率的差异。低磷处理下,杉木苗根系的磷吸收率呈下降的趋势,但随处理时间延长,磷利用率有不断提高的趋势。表明低磷胁迫下,提高磷利用率可能也是杉木苗的一种应对机制,这与梁霞等[11]的研究结果相似。
植物对磷的吸收是一个主动吸收过程。在缺磷条件下,根系的形态和构型将发生明显改变[4- 8]。本研究表明,低磷处理下,杉木苗根系表面积和根尖数都随处理时间延长呈增长趋势。根系的这种形态适应有利于其与外部环境的接触,从而有效增强磷的吸收能力,可以看成是植物对低磷胁迫采取主动适应的一种表现[1,4- 8]。有研究表明,氮、磷、钾等营养元素的缺乏会导致植物生长调节剂在大豆植株体内的重新分布,进而引起根系构型的改变[22-23],同时,磷酸盐、硫酸盐和硝酸盐等这类营养元素本身可作为信号物质改变根系细胞分裂和分化的分子机制,从而从分子水平上影响根系构型[23]。
ACP是植物体内参与磷代谢的主要酶类之一,它可通过水解磷酸酯类释放无机磷酸来完成磷元素在体内的循环[11,20]。ACP是植物受到低磷环境诱导而分泌的酶类,缺磷愈严重,其活性越高,磷重复利用越快,这是植物适应或抗逆的一种表现[24]。本研究表明,低磷处理下,杉木苗根系ACP活性明显升高,这有利于植株体内有机磷的重复利用,同时也可能促进了根系ACP的分泌,增加根系对外部环境磷素的吸收。低磷处理对杉木苗根系膜脂过氧化和保护酶系统也有影响,它使根系MDA含量增加、SOD活性提高,引起了杉木苗根系活性氧的积累和膜脂过氧化作用的加剧,对细胞膜系统造成了一定损害,同时又增强了根系保护酶系统的活性,减轻膜脂过氧化,使两方面达到一个动态平衡[25]。由此可知,根系ACP活性、MDA含量及SOD活性的变化可能是杉木苗响应低磷环境的生理机制之一。
本研究表明,磷肥对改善土壤养分及土壤微生物学特性有显著影响。较之正常供磷处理,低磷胁迫处理(P0)的土壤碱解氮含量明显增加、有效磷含量严重匮乏、pH和速效钾含量及阳离子交换量变化不大、酸性磷酸酶活性显著增强、真菌含量则明显减少。磷与作物吸收氮营养元素有密切关系。如大豆植株体内总氮含量和磷积累均随营养液中磷水平的增加而增加,缺磷胁迫将抑制大豆对氮素的吸收和利用[26],这可能是导致磷胁迫处理盆栽土壤中碱解氮含量较多的原因之一,但其机理有待深入研究。在酸性土壤中,有效磷含量小于15 mg·kg-1表示土壤有效磷不足。本研究显示,施磷肥可显著提高土壤有效磷含量,但长期大量施用磷肥是否会引起土壤磷素的大量富集以及土壤酸化等问题还需谨慎对待。张建国等[27]研究表明,在氮、磷不足条件下,施磷量的增加可使1年生杉木苗土壤全磷、有效磷、速效钾含量及pH增加,施磷肥可促进光合产物由根向茎、叶转移,对苗木生长具有促进作用。阳离子交换量是评价土壤保肥能力的重要指标,但在酸性土壤中,P0、P1和P2这3个不同供磷浓度对土壤阳离子交换量的影响差异不显著,原因尚不明确。土壤微生物和土壤酶是土壤养分和有机质形成和积累的重要因素[28]。张桂玲[28]研究表明,土壤真菌数量和酸性磷酸酶活性分别与土壤碱解氮、速效钾和有机质含量呈显著正相关,与速效磷含量呈负相关。本研究显示,缺磷胁迫下,土壤酸性磷酸酶活性显著增强,土壤碱解氮含量也明显提高,这可能是盆栽土壤响应低磷胁迫较敏感的微生物和养分指标,在今后的研究中应给予更多的关注。
[1] 张淼,赵书岗,耿丽平,等. 缺磷对不同作物根系形态及体内养分浓度的影响[J]. 植物营养与肥料学报,2013,19(6):577-585.
[2] 邢国芳,郭平毅. 植物响应低磷胁迫的功能基因组研究进展[J]. 生物技术通报, 2013,29(7):1- 6.
[3] 孙红英. 低磷和铝毒对杉木幼苗若干生理过程的影响[D]. 福州:福建农林大学, 2010.
[4] 王树起,韩晓增,李晓慧,等. 缺磷胁迫下的大豆根系形态特征研究[J]. 农业系统科学与综合研究, 2010, 26(2): 192-196.
[5] 梅辉坚. 杉木生物量分配及根系可塑性对异质供磷的响应[D]. 福州:福建农林大学,2011.
[6] 严小龙,廖红. 植物根构型特性与磷吸收效率[J]. 植物学通报, 2000,17(6):511-519.
[7] 黄荣,孙虎威,刘尚俊,等. 低磷胁迫下水稻根系的发生及生长素的响应[J]. 中国水稻科学, 2012,26(5):563-568.
[8] 周国权. 磷空间有效性影响拟南芥根构型的生理与分子机制[D]. 广州:华南农业大学, 2008.
[9] 乔振江,蔡昆争,骆世明. 低磷和干旱胁迫对大豆植株干物质积累及磷效率的影响[J]. 生态学报, 2011,31(19):5578-5587.
[10]杨青. 马尾松感知异质低磷胁迫的根构型和磷效率研究[D]. 北京:中国林业科学研究院, 2012.
[11]梁霞,刘爱琴,马祥庆,等. 磷胁迫对不同杉木无性系酸性磷酸酶活性的影响[J]. 植物生态学报, 2009,33(1):54-59.
[12]俞元春,余健,房莉,等. 缺磷胁迫下马尾松和杉木苗根系有机酸的分泌[J]. 南京林业大学学报(自然科学版), 2007,31(2):9-12.
[13]陈智裕,鹏飞,邹显花,等. 低磷胁迫下杉木幼苗生长特性与内源激素的关系[J]. 林业科学, 2016,52(2):57- 66.
[14]赵中华,刘爱琴,吴鹏飞,等. 低磷胁迫下杉木针叶蛋白的提取与表达差异分析[J].福建林学院学报, 2014,34(3):203-207.
[15]张福锁. 环境胁迫与植物根际营养[M]. 北京:中国农业出版社, 1998.
[16]中华人民共和国农业部. 植物中氮、磷、钾的测定:NY/T2017—2011 [S]. 北京:中华人民共和国农业部, 2011.
[17]MC LACHLAN K D, ELLIOTT D E, MARCO D G D, et al. Leaf acid phosphatase isozymes in the diagnosis of phosphorus status in field grown wheat[J]. Aust J Agric Res, 1987,38(1):1-13.
[18]陈建勋,王晓峰. 植物生理学实验指导[M]. 广州:华南理工大学出版社, 2002:68-74.
[19]鲍士旦.土壤农化分析[M].3版. 北京:中国农业出版社, 2000:70- 83.
[20]张丽梅,郭再华,张琳,等. 缺磷对不同耐低磷玉米基因型酸性磷酸酶活性的影响[J]. 植物营养与肥料学报, 2015,21(4):898-910.
[21]郭萍,文庭池,董玲玲,等. 施肥对土壤养分含量、微生物数量和酶活性的影响[J]. 农业现代化研究, 2011,32(3):362-366.
[22]JOES L B, ALFREDO C R, LUIS H E. The role of nutrient availability in regulating root architecture[J]. Curr Opin Plant Biol, 2003,6(3):280-287.
[23]曾秀成,王文明,罗敏娜,等. 缺素培养对大豆营养生长和根系形态的影响[J]. 植物营养与肥料学报, 2010,16(4):1032-1036.
[24]刘渊,李喜焕,孙星,等. 磷胁迫下大豆酸性磷酸酶活性变化及磷效率基因型差异分析[J]. 植物遗传资源学报, 2012,13(4):521-528.
[25]印莉萍,黄勤妮,吴平. 植物营养分子生物学及信号转导 [M]. 2版. 北京:科学出版社, 2006.
[26]王树起,韩晓增,严君,等. 缺磷胁迫对大豆根系形态和氮磷吸收积累的影响[J]. 土壤通报, 2010,41(3):644- 650.
[27]张建国,盛炜彤,熊有强,等. 施肥对盆栽杉木苗土壤养分含量的影响[J]. 林业科学, 2006,42(4):44-50.
[28]张桂玲. 秸秆和生草覆盖对桃园土壤养分含量、微生物数量及土壤酶活性的影响[J]. 植物生态学报, 2011,35(12):1236-1244.
【责任编辑 李晓卉】
Effect of phosphorus concentration on Cunninghamia lanceolate seedling roots and potting soil
WEI Ruping, HU Dehuo, YAN Shu, ZHENG Huiquan, WANG Runhui
(Guangdong Provincial Key Laboratory of Bio-Control for the Forest Disease and Pet/Guangdong Academy of Forestry, Guangzhou 510520, China)
【Objective】 To demonstrate the morphological and physiological response ofCunninghamialanceolateroots, and the variation of nutrient and microorganism contents in potting soil under phosphorus (P) deficiency.【Method】Three treatments including P deficiency (P0), normal concentration P (P1) and high concentration P (P2) were applied to pottedC.lanceolateseedlings. The temporal dynamics of root phenotype and physiology, as well as the nutrient and number of microbes of the potting soil were measured.【Result】 After 30 days treatment, P0 had the least accumulations of shoot and whole plant dry mass, and the highest accumulation of root dry mass and root/shoot ratio, which were 2.07 and 5.37 times of those of P1, respectively. Starting from day 15, the root P uptake rate of P0 had been the lowest while P utilization rate had been the highest. At day 30, the root P uptake and utilization rates for P0 were 43.18% and 231.59% of those for P1, respectively. Root surface area and root tip number increased with the increase of treatment time, and were 3.46 cm2and 56 respectively for P0 at day 30, significantly higher compared to P1 and P2. During the entire treatment process, acid phosphatase, SOD activities and MDA content of P0 were significantly higher compared to P1 and P2. Compared with P1 and P2 treatments, P0 had obviously higher content of soil alkali hydrolysable nitrogen, serious shortage in available P, minor differences in pH, available K and cation exchange capacity, significant increase in acid phosphatase activity, and decrease in the number of fungi.【Conclusion】P deficiency(P0) treatment led to increase in root dry mass accumulation and root/shoot ratio, increase in root surface area and root tip number with the increase of stress time, decrease in P uptake rate but increase in P utilization rate, and significant increase in root acid phosphatase, SOD activities and MDA content. In addition, acid phosphatase activity of the potting soil significantly increased, alkali solution nitrogen content obviously increased, available P content was in serious shortage and fungi content was the least for P0 compared to other treatments. Therefore, P deficiency has significant effect on root growth, as well as nutrient and number of microbes of potting soil.
Cunninghamialanceolate; seedling; root; P deficiency; pot culture; soil nutrient
2016- 01- 18 优先出版时间:2016-10-24
韦如萍(1978—),女,研究员,硕士,E-mail: wrpgx@163.com;通信作者:胡德活(1962—),男,研究员,硕士,E-mail: hudehuo@163.com
国家重点研发计划项目(2016YFD0600301); 广东省科技厅公益研究与能力建设项目(2016B020201002)
Q945.12
A
1001- 411X(2016)06- 0077- 07
优先出版网址:http://www.cnki.net/kcms/detail/44.1110.s.20161024.1041.012.html
韦如萍, 胡德活, 晏 姝, 等.不同供磷浓度对杉木苗根系和盆栽土壤的影响[J].华南农业大学学报,2016,37(6):77- 83.
