电离辐射反应中PML调控CXCR4的表达
2016-12-08楼炜姚婉楼敏铭刘斌宋宜
楼炜 姚婉 楼敏铭 刘斌 宋宜
电离辐射反应中PML调控CXCR4的表达
楼炜姚婉楼敏铭刘斌宋宜
目的 观察电离辐射反应中,肺癌细胞中受辐射感应分子早幼粒细胞白血病蛋白(PML)表达影响的信号分子,探讨PML是否参与调控辐射诱导的肿瘤转移过程。方法 本实验采用特异性靶向PML的siRNA构建PML敲低表达细胞模型,钴-60辐照,而后用康成公司的基因表达谱芯片检测获得差异表达基因,经聚类分析挖掘与细胞间通讯、肿瘤转移有重要相关性的基因,进一步用反转录实时定量多聚酶链反应法(RT-qPCR)和蛋白质免疫印记法(WB)进行验证。结果 应用基因表达谱芯片比较检测电离辐射反应中受PML影响的基因,筛选获得在非小细胞肺癌侵袭转移中发挥重要作用的C-X-C细胞因子受体4(CXCR4)在PML敲低表达的非小细胞肺癌A549细胞中表达显著上调;RT-qPCR和WB进一步在mRNA和蛋白水平验证PML敲低细胞中CXCR4的表达增高。结论 在肺癌侵袭转移中发挥重要功能的CXCR4基因的表达受辐射感应分子PML的调控。
早幼粒白血病蛋白 C-X-C细胞因子受体4 电离辐射 转移
肺癌是当前世界范围内发生率和致死率最高的恶性肿瘤[1]。临床上除部分Ⅰ期非小细胞肺癌(NSCLC)患者采用单纯手术治疗外,其余各期NSCLC和小细胞肺癌(SCLC)患者多采取综合治疗策略。放射治疗是肺癌治疗的重要手段之一[2],但近年的临床及实验室研究数据显示当前采用的放射治疗策略尚存在一些不足[3]。细胞在长期进化过程中形成的DNA损伤反应防御机制通过激活细胞周期检查点、损伤修复、凋亡及非凋亡性死亡等细胞学反应维护细胞基因组稳定性,防止肿瘤发生[4]。早幼粒细胞白血病蛋白(PML)是细胞中的亚核多蛋白复合体PML核体的核心分子[5-6]。作者借助分子生物学研究方法,采用基因芯片技术,探讨PML是否参与调控辐射诱发的肿瘤转移。
1 材料与方法
1.1细胞培养、转染及辐射条件 A549细胞系(人非小细胞肺腺癌)由军事医学科学院基础医学研究所邵宁生实验室提供。细胞培养采用RPMI Medium 1640完全培养基(添加10%胎牛血清),于37℃、5% CO2恒温培养箱中培养。细胞转染前1d(约18h)将细胞计数后接种于六孔板内,控制细胞密度使其转染时的汇合率为70%~80%。将干涉序列1.5μl(20μmol/L)与转染试剂(Polyplus)4.5μl置于100μl不含血清和抗生素的RPMI Medium 1640培养液中,轻柔混匀后室温静置20min,而后加入用双无培养液预洗过的细胞共孵育,此时干涉序列的终浓度为30nmol/L,6h后更换含10%胎牛血清的完全培养基。转染使用的干涉序列合成自吉玛公司,具体如下:非特异序列转染对照组:siNC ense:UUCUCCGAACGUGUCACGUTT antisense:ACGUGACACGUUCGGAGAATT;特异性靶向PML序列组:siPML sense:GCAUCUACUGCCGAGGAUGTT antisense:CAUCCUCGGCAGUAGAUGCTT;辐射条件:钴-60(Cobalt 60) 放射源,辐射剂量率为100.96 cGy/ min,辐射剂量10Gy。
1.2基因芯片检测试剂及仪器 芯片检测均交上海康成生物芯片有限公司备制实施。具体包括采用NanoDrop ND-1000进行样本RNA定量、变性琼脂糖凝胶电泳监测RNA完整性,而后用Invitrogen公司的双链DNA合成试剂盒(Superscript ds-cDNA synthesis kit)将RNA反转录为双链DNA,采用NimbleGen公司的DNA标记试剂盒(one-color DNA labeling kit)完成DNA的标记,继而使用NimbleGen公司的芯片杂交和洗脱缓冲液试剂盒(NimbleGen Hybridization System and NimbleGen wash buffer kit)进行芯片的杂交并洗脱非特异结合,最后通过Axon GenePix 4000B芯片扫描装置(Molecular Devices Corporation)扫描芯片杂交结果。
2 结果
2.1建立PML敲低表达A549细胞模型 为研究DNA损伤感应分子PML是否参与调控电离辐射诱发的肿瘤转移机制,首先通过转染特异性靶向PML基因的siRNA序列构建PML敲低表达A549人非小细胞肺腺癌细胞模型。通过反转录定量PCR和蛋白质免疫印迹法分别在mRNA和蛋白水平验证了PML敲低表达细胞模型构建成功。
2.2基因芯片检测及数据分析 在干涉序列转染后48h,以放射性同位素钴-60辐照对照组(NCsi)和PML敲低组(PMLsi)细胞,辐照后24h收集细胞,提取总RNA进行质量检测(见图1),继而送康成公司完成mRNA芯片检测和数据分析。其中,差异表达基因的GO数据库聚类分析依据相关生物学过程(biological-process)、细胞组分(cellular-component)以及分子功能(molecular-function)对基因进行功能描述及分类。结果显示:辐照后,大量参与细胞间通讯及信号传递的分子的表达在PML敲低的细胞中出现上调。共筛选发现有939个基因的mRNAs增高>2倍,按GO数据库聚类分析后依据分子功能(MF)对基因进行分类。表1中列出的为基因富集度最高的前5类功能及其代表基因。可见上调数量最多的前几类分子功能均为具有细胞间及细胞内信号转导功能的基因。而能够正调控肺癌细胞辐射后增殖、迁移能力的重要细胞趋化因子受体CXCR4基因反复出现其中(见表1)。

图1 PML基因敲低细胞表达谱的基因芯片检测分析。样本RNA的变性琼脂糖凝胶电泳(1 Ncsi组,2 Ncsi+IR组,3 PMLsi组,4 PMLsi+IR组)

表1 辐照后PML敲低表达肺癌细胞中mRNA表达上调高于对照细胞的基因功能分类表
2.3PML敲低表达的A549细胞在电离辐射后CXCR4的表达 分析表达组芯片数据,CXCR4在辐照后的PML敲低组细胞中的表达显著增加。重新转染、辐照、收集细胞,通过RT-qPCR反转录定量PCR(见图2)和蛋白质免疫印迹(见图3)检测在mRNA和蛋白水平证实A549细胞中,PML的敲低表达导致趋化因子受体CXCR4表达上调。

图2 qRT-PCR检测细胞中的CXCR4基因mRNA表达情况图3 蛋白免疫印迹检测细胞中的CXCR4蛋白表达情况
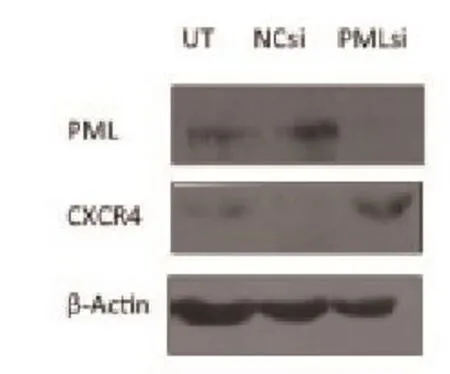
图2 qRT-PCR检测细胞中的CXCR4基因mRNA表达情况图3 蛋白免疫印迹检测细胞中的CXCR4蛋白表达情况
3 讨论
手术、放疗、化疗是当前治疗恶性肿瘤的三大主要手段。随着放射生物学和精准放疗设备的不断发展,放射治疗在临床肿瘤治疗中的应用越来越广泛,大约有60%的肿瘤患者会在不同治疗阶段接受放疗。但近年来研究报道显示电离辐射在抑制肿瘤细胞增殖并诱发肿瘤细胞凋亡性或非凋亡性死亡的同时,还能够激活细胞内的其他信号转导网络,其会直接或间接地改变存活细胞的活性及所处微环境,使得存活肿瘤细胞的侵袭、转移能力发生改变,并有可能导致放疗诱发的肿瘤转移,影响肿瘤放疗的预后[7]。有关电离辐射诱发肺癌细胞侵袭迁移能力增强的现象国内外均已有大量研究报道,提示该过程的分子调控机制对临床放疗策略选择及优化具有重要价值[8]。
CXCR4是已知的肿瘤组织中表达最普遍的趋化因子受体,在二十余种不同类型的肿瘤组织中的表达均异常增高。更重要的是,CXCR4的表达量还与患者的预后密切关联。CXCR4及其配体的激活既能促进肿瘤细胞增殖抗凋亡,又能通过调节肿瘤细胞表面粘附分子的表达和活性诱导促进肿瘤发生侵袭转移。本资料结果显示,PML负调控肿瘤细胞内趋化因子CXCR4的表达,在通过分子生物学手段使得PML表达功能不足的情况下,受照后存活肺癌细胞中CXCR4的mRNA和蛋白表达水平均显著增高。由于条件所限,本研究采用的肿瘤细胞辐照模型为单次辐照模型,尽管其引发的生物学效应与临床放疗类似(诱发肿瘤细胞周期阻滞、灾变、凋亡),但照射剂量及形式与临床多次分割辐照不同。因此,在今后的研究中还需进一步结合临床样本对PML与CXCR4的相关性进行更深入的研究讨论。
本研究对PML的功能进行研究时采用的是敲低表达细胞中全部PML基因的A549细胞辐照模型。通过此模型发现PML参与调控肿瘤细胞辐射反应中CXCR4的表达。由于人类细胞中PML基因存在>7个的变体,远多于其他种属的细胞,且各PML变体的功能各有不同,故今后的研究中还需进一步构建各个PML变体的表达载体,进一步开展针对不同变体的深入功能研究。
PML在发现之初即被归为抑癌分子,能及时感应细胞中发生的DNA损伤,而后通过p53依赖和p53非依赖的途径激活细胞周期检查点、激活损伤修复,维持细胞的基因组稳定性,从而抗肿瘤发生。本资料结果表明PML还能够抑制肿瘤细胞中侵袭转移相关分子CXCR4的表达,进一步扩展了对PML抗肿瘤功能的认识。PML作为胞内亚核结构-PML核体(PML-NBs)的核心分子,其对CXCR4的调控有多种可能。PML既可能通过其下游的明星分子p53影响CXCR4的转录[9],也可能通过与HDAC等遗传调控蛋白的结合而调节CXCR4基因表达[10]。现有研究已证实特异性的CXCR4抑制剂具有抗肿瘤作用[11],故进一步深入研究PML调控CXCR4表达的分子机制及和受PML调控的其他细胞间通讯及信号转导分子将有望为研发肿瘤治疗新靶标提供指导。
[1]Reboul FL.Radiotherapy and chemotherapy in locally advanced non-small cell lung cancer: preclinical and early clinical data. Hematol Oncol Clin North Am,2004,18(1): 41-53.
[2]Mullins K.Stereotactic body radiotherapy for earlystage nonsmall cell lung cancer: when and why is it appropriate therapy? J Adv Pract Oncol,2015,6(4): 351-354.
[3]高敏,张俊红,周云峰,等.X线照射人肺腺癌细胞后侵袭和转移能力变化及机制探讨.中国放射肿瘤学杂志,2013,22(2):163-166.
[4]Goldstein M,Kastan MB.The DNA damage response:implications for tumor responses to radiation and chemotherapy. Annu Rev Med,2014,66(1):129-143.
[5]Kurki S,Latonen L,Laiho M.Cellular stress and DNA damage invoke temporally distinct Mdm2,p53 and PML complexes and damagespecific nuclear relocalization. J Cell Sci,2003,116(Pt 19): 3917-3925.
[6]Salomoni P,Pandolfi PP.The role of PML in tumor suppression. Cell, 2002,108(2):165-170.
[7]Feys L,Descamps B,Vanhove C,et al.Radiation-induced lung damage promotes breast cancer lung-metastasis through CXCR4 signaling. Oncotarget,2015,6(29):26615-26632.
[8]Zhou YC,Liu JY,Li J,et al.Ionizing radiation promotes migration and invasion of cancer cells through transforming growth factorbeta-mediated epithelial-mesenchymal transition.Int J Radiat Oncol Biol Phys,2011,81(5):1530-1537.
[9]Bao-Lei T,Zhu-Zhong M,Yi S,et al.Knocking down PML impairs p53 signaling transduction pathway and suppresses irradiation induced apoptosis in breast carcinoma cell MCF-7. J Cell Biochem, 2006, 97(3):561-71.
[10]Wu WS,Vallian S,Seto E,et al.The growth suppressor PML represses transcription by functionally and physically interacting with histone deacetylases. Mol Cell Biol,2001,21(7):2259-2268.
[11]Burger JA,Stewart DJ,Wald O,et al.Potential of CXCR4 antagonists for the treatment of metastatic lung cancer.Expert Rev Anticancer Ther,2011,11(4):621-630.
Objective To explore the role of PML in irradiation-induced tumor metastasis,and its down-stream targets involved in this process. Methods PML-knock-down cells were obtained by transfection of specific siRNAs. Total RNAs were isolated from cells after irradiation,and gene expression profiles were analyzed by DNA microarray(NimbleGen Human Gene Expression Microarrays). We evaluated the mRNA expression of PML and CXCR4 with reverse transcription real-time polymerase chain reaction(RT-qPCR). Western-blot examination to examine PML and CXCR4 protein expression was also carried out. Results DNA microarray analysis showed that CXCR4 gene expression was increased in PML-knock-down cells. The microarray data of CXCR4 mRNA levels were further validated using RT-qPCR. Increased CXCR4 protein levels in PML-knock-down cells were successfully confirmed correspondingly. Conclusions Decreased CXCR4 expression may be one of the mechanisms in PML-mediated irradiation-induced tumor metastasis.
PML CXCR4 Irradiation Metastasis
浙江省中医药科技计划项目(2014ZB059),北京市自然科学基金课题(7152134)
310005 浙江中医药大学附属第三医院(楼炜)100850军事医学科学院放射与辐射医学研究所(姚婉楼敏铭 刘斌 宋宜)
1.3芯片数据处理及分析 芯片扫描图像导入NimbleScan软件(版本2.6)进行数据分析。该软件对导入数据行均一化处理后分别生成探针文件和检测基因文件,而后将检测基因文件导入Agilent GeneSpring GX软件(version 11.5.1)分析,选取表达水平改变>2倍的基因进行进一步的信号途径分析和GO分析。
1.4反转录实时定量多聚酶链反应(RT-qPCR) 在A549细胞转染后72h(其中一组48h 10Gy照射)提取细胞中的总RNA。步骤按照Trizol reagent总RNA提取试剂(康为世纪公司)说明进行。取1μg总RNA按照反转录试剂(ToYoBo公司)公司提供的标准操作过程反转录为cDNA。cDNA模板的定量PCR扩增采用Agilent Technologies Stratagene M×3000p系统,以SYBR Green dye为荧光染料。为确保各处理组间mRNA的等量性,实验以GAPDH为内参。取1μl的cDNA作模板,混合10μl 2×UltraSYBR Mixture(with ROX)(康为世纪公司)及1 μl的引物(5μM)使总反应体系为20μl。QPCR扩增第一步95℃,10min,第二步95℃,15s和60℃,1min,共设定45个循环。

1.5蛋白质免疫印迹(Western-blot) RIPA全细胞裂解液(分子克隆)裂解细胞、蛋白定量,取适量蛋白样品进行电泳(SDS-PAGE)。电泳后凝胶中的蛋白以180 mA恒流转移至硝酸纤维素膜上。5%的脱脂奶粉/TBST缓冲液室温封闭1h或4℃过夜;一抗PML(购自Santa公司)、CXCR4(购自NOVUS公司)均以1∶500稀释,Actin(购自Bioworld公司)以1∶2000稀释,室温孵育2h或4℃过夜,TBST洗膜3次,每次10min;辣根过氧化物酶标记二抗(购自三箭生物公司)以1∶2000稀释,室温反应1h,TBST洗膜3次,10min/次。加入显色底物(Millipore)室温孵育2min,暗室显影。
