成像流式细胞仪检测细胞自噬水平研究*
2016-12-07时景仁郭向华王珊珊乔录新张玉林陈德喜
时景仁,郭向华,王珊珊,刘 凯,乔录新,张玉林,陈德喜
(首都医科大学附属北京佑安医院/北京市肝病研究所,北京 100069)
·论 著·
成像流式细胞仪检测细胞自噬水平研究*
时景仁,郭向华,王珊珊,刘 凯,乔录新,张玉林,陈德喜△
(首都医科大学附属北京佑安医院/北京市肝病研究所,北京 100069)
目的 采用新型成像流式细胞仪量化检测细胞自噬水平,完善自噬检测手段。方法 用绿色荧光蛋白(GFP)-微管相关蛋白轻链3(LC3)表达质粒转染Huh7细胞和H1299细胞,并进行24 h饥饿处理,诱导自噬发生,分别用荧光显微镜拍照、蛋白免疫印迹法和成像流式细胞术3种方法检测细胞自噬水平。用IDEAS软件对成像流式细胞术的细胞自噬结果进行量化分析。结果 荧光显微镜显示,Huh7细胞比H1299细胞中的自噬斑点少;蛋白免疫印迹法显示,与H1299细胞比较,Huh7细胞LC3-Ⅱ与LC3-Ⅰ比例较低,但2种方法均不能获得通量统计数据。成像流式细胞仪结果显示细胞自噬图像,2种细胞的GFP-LC3质粒转染效率基本一致(25.2%和27.6%);比较两者发生高水平自噬(LC3斑点数目为6个以上)的细胞比例,Huh7细胞仅为9.0%,显著少于H1299细胞(26.2%)。结论 采用新型成像流式细胞仪检测细胞自噬,兼具量化分析和成像的优点,能弥补荧光显微镜和蛋白免疫印迹法的不足,是一种更优秀的自噬检测方法。
自噬; 成像流式细胞仪; 微管相关蛋白轻链3
自噬是指细胞为维持自身稳态,将细胞质内物质运输到溶酶体内,进行分解代谢的一种重要保守过程[1]。自噬参与了机体众多的生理和病理过程,如炎性反应、衰老、肿瘤、神经变性、心血管疾病及感染等[2]。检测细胞自噬水平是科研工作中的重要部分。目前传统的自噬检测技术并不完美:在电子显微镜下能够直接观察到细胞的自噬状态,但需要专业技术人员进行操作;微管相关蛋白轻链3(LC3)是自噬体的标志物[3],用荧光显微镜检测和计算LC3斑点数目存在主观性强、统计计算方法待规范等问题;蛋白免疫印迹法需要与荧光显微镜成像相结合才能准确判定细胞自噬活性;流式细胞术检测自噬虽然具有高通量的特点,但缺乏图像数据佐证[4]。笔者采用新型成像流式细胞仪,对Huh7细胞和H1299细胞的自噬水平进行检测,将流式细胞术的高通量数据处理能力与细胞成像相结合,对自噬检测手段进行完善。现报道如下。
1 资料与方法
1.1 一般资料 人肝癌细胞系Huh7和人肺癌细胞系H1299由本实验室保存。
1.2 仪器与试剂 DMEM培养基购自上海Hyclone公司;胎牛血清、胰酶、青链霉素购自美国Gibco 公司;绿色荧光蛋白(GFP)-LC3质粒由美国南加州大学欧竞雄教授惠赠;聚氰基丙烯酸正丁酯(BCA)法蛋白水平测定试剂盒购自北京康为世纪基因有限公司;所用仪器为德国Merck公司的ImageStreamX MarkⅡ成像流式细胞仪和日本Nikon公司80i荧光显微镜。
1.3 方法
1.3.1 细胞培养与处理 将Huh7细胞和H1299细胞按照5×104/mL分别接种在24孔细胞培养板中,用含10%胎牛血清的DMEM培养基,以5%CO2、37 ℃的条件进行培养。待细胞贴壁后,转染GFP-LC3质粒,24 h后换用无血清培养基培养细胞,进行饥饿处理24 h;同时设立正常培养细胞作为对照。
1.3.2 荧光显微镜和蛋白免疫印迹法检测细胞自噬 细胞经过饥饿处理24 h后,采用荧光显微镜观察GFP-LC3 荧光斑点并拍照。同时,收集细胞于高盐蛋白裂解液中,4 ℃裂解20 min后,全速离心收集上清液,即为所提细胞总蛋白。BCA法蛋白水平测定按照试剂盒说明书进行。收集的细胞进行蛋白免疫印迹分析,电化学发光法(ECL)检测蛋白的表达,X 线胶片曝光。
1.3.3 成像流式细胞仪检测细胞自噬 细胞经过饥饿处理24 h后,用胰酶进行消化并离心收集,经磷酸盐吐温缓冲液(PBST)清洗细胞2次后,重悬在含1%胎牛血清、0.1%叠氮钠的PBS溶液中,上机检测,每个标本收集5 000个事件。仪器设置如下:488 nm激光功率为10 mW;758 nm激光功率为0.55 mW;成像放大40倍。
1.4 统计学处理 采用仪器配置的IDEAS软件进行数据分析处理。
2 结 果
2.1 荧光显微镜检测细胞自噬 与正常培养的细胞比较,经过饥饿处理后,细胞出现显著的自噬斑点。Huh7细胞与H1299细胞比较,其饥饿产生的自噬斑点相对较少,见图1。
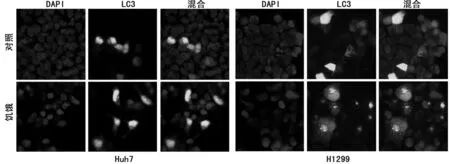
图1 荧光显微镜检测细胞自噬
2.2 蛋白免疫印迹法检测细胞自噬 与正常培养的细胞比较,经过饥饿处理后,细胞LC3-Ⅱ与LC3-Ⅰ的比例显著增高。Huh7细胞与H1299细胞比较,LC3-Ⅱ的产生较少,细胞LC3-Ⅱ与LC3-Ⅰ的比例较低,见图2。

图2 蛋白免疫印迹法检测细胞自噬
2.3 成像流式细胞仪圈门策略 成像流式细胞仪所记录的每一事件均可从IDEAS软件中获得相应的图像,每一事件用图像左上角的标号进行区别标注,图像左侧展示21个H1299细胞在明场和488 nm激光通道的图像。为了方便对自噬水平和发生自噬的细胞进行统计分析,圈门时,首先选定聚焦清晰的细胞,接着在聚焦清晰群中再圈定单个细胞,然后从单个细胞群中选取转染GFP-LC3质粒成功的GFP阳性细胞,最后对GFP阳性细胞中存在不同自噬斑点个数的细胞进行计数处理,见图3。笔者在本试验中设定了3种细胞群,其自噬斑点个数分别为:0个(无自噬);1~5个(低水平自噬);6个及以上(高水平自噬)。每个标本记录5 000个细胞,有效细胞数目约为1 000个。
2.4 计数LC3斑点 为了定量某个细胞中LC3斑点的数目,软件中采用斑点计数性能。斑点计数性能通过发现图像中显著高于区域背景的荧光信号来鉴别斑点,再采用点的适当大小和纵横比确定斑点,以克服高背景荧光和非特异染色干扰。一旦判定方式确定,斑点计数性能就能自动对图像中的斑点进行准确计数统计。斑点计数范围,横坐标表示细胞中自噬斑点的数目,纵坐标表示细胞频次,即含有某个自噬斑点的细胞数量,见图4A;每种数目范围的斑点图像,每个斑点数目选取5个细胞图像作为代表,见图4B。
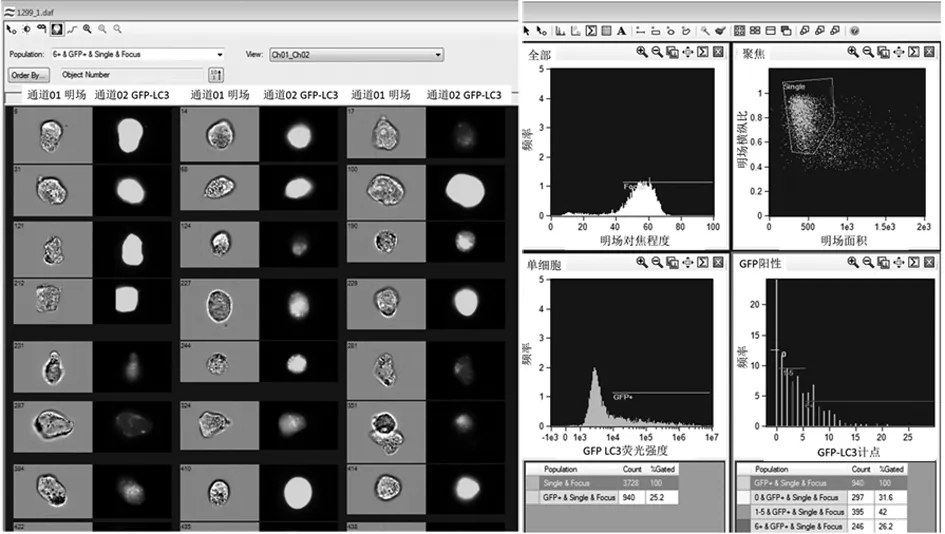
图3 成像流式细胞仪检测细胞自噬的圈门策略
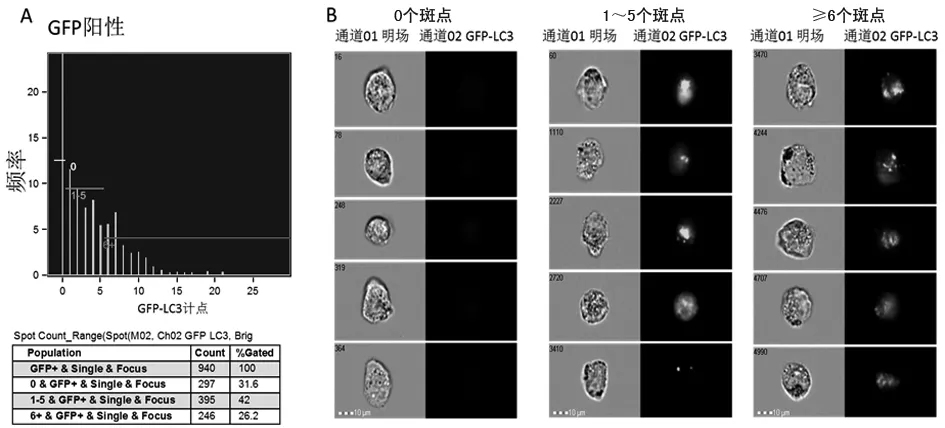
图4 含有不同斑点数目的细胞图像
2.5 GFP-LC3质粒转染效率及具有不同LC3斑点数目的细胞比例 经过饥饿处理后,Huh7和H1299细胞均有不同程度的自噬产生。Huh7细胞转染GFP-LC3质粒成功的细胞有27.6%,具有LC3斑点数目为0个、1~5个和6个及以上的细胞比例分别为:25.1%、65.9%和9.0%,见图5A;H1299细胞转染GFP-LC3质粒成功的细胞有25.2%,具有LC3斑点数目为0个、1~5个和6个及以上的细胞比例分别为31.6%、42.0%、26.2%,见图5B。
2.6 量化分析比较Huh7和H1299细胞的自噬水平 GFP-LC3质粒对于2种细胞的转染效率基本相同;与Huh7细胞比较,H1299细胞发生低水平自噬(LC3斑点数目为1~5个)的细胞比例较少,而发生高水平自噬(LC3斑点数目为6个以上)的细胞比例显著增多。见表1。

表1 量化分析比较Huh7和H1299细胞的自噬水平[n(%)]
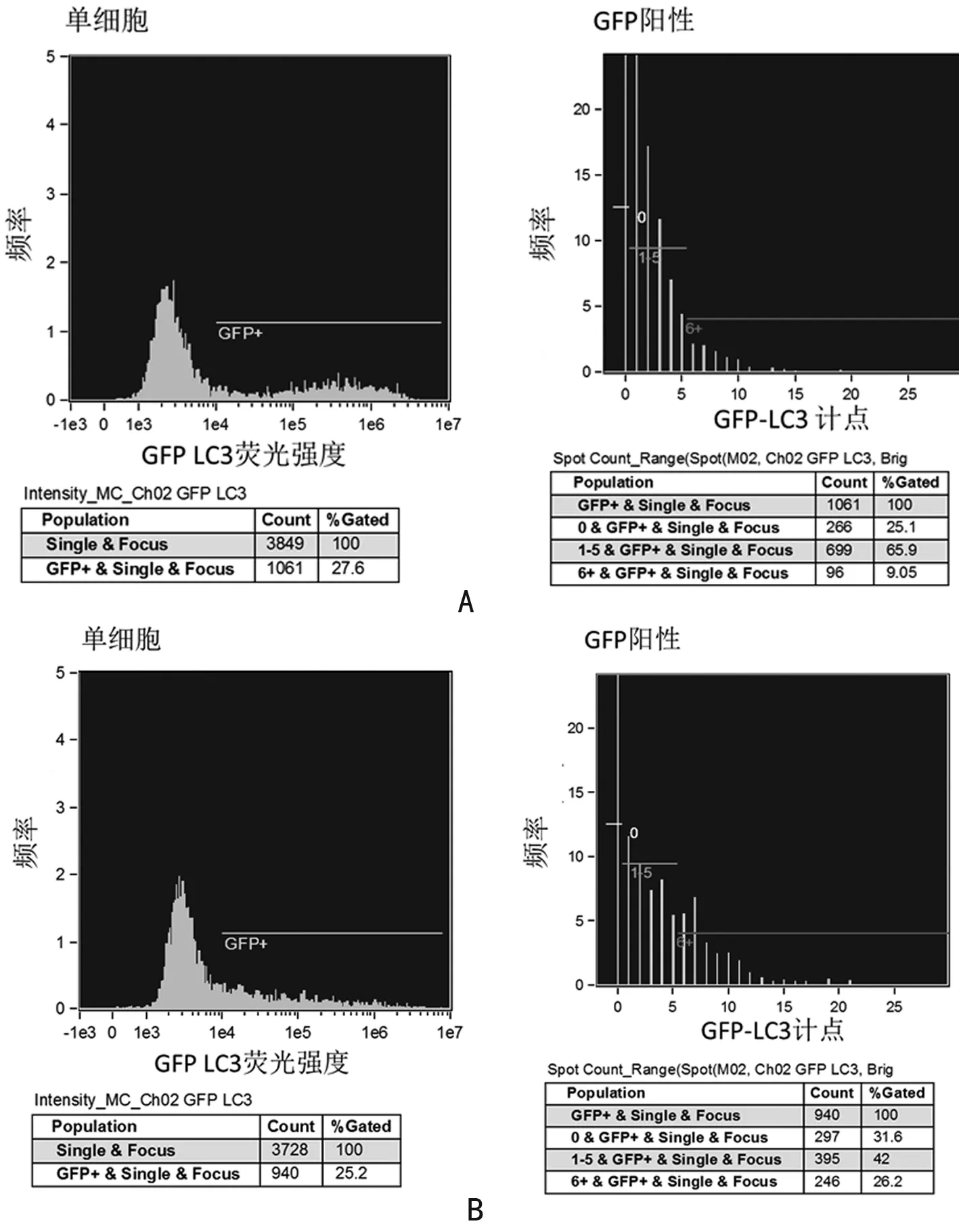
图5 GFP-LC3质粒转染效率以及具有不同LC3斑点数目的细胞比例
3 讨 论
自噬(本研究中指大自噬)可被营养饥饿、应激、缺氧、活性氧物质及Toll样受体激活剂等诱导发生[5]。自噬开始后,细胞质中形成1个新月形状的双层膜结构(即吞噬泡或者分离膜),其中包绕着错误折叠的蛋白质、受损细胞器或者再循环的细胞质成分等。吞噬泡的膜继续延伸封闭部分细胞质,形成完全闭合的双层膜囊泡(即自噬体)。自噬体通过与溶酶体融合而形成自噬溶酶体,自噬体中的物质在自噬溶酶体中被酸性水解酶降解。LC3是自噬体的1个标志物。新合成的LC3蛋白经加工后成为LC3-Ⅰ,位于细胞质中。随后LC3-Ⅰ与磷脂酰乙醇胺(PE) 连接,通过泛素化样酶促反应成为LC3-Ⅱ,与自噬体的内膜和外膜均结合,自噬体内膜的LC3-Ⅱ在自噬溶酶体中被降解而进入再循环[6]。
目前,LC3的合成率、LC3-Ⅰ到LC3-Ⅱ的转化率和LC3通量是检测细胞自噬的通用指标[4]。检测方法包括:(1)采用电子显微镜检测LC3的亚细胞定位、计算LC3斑点。(2)采用荧光显微镜观察转染GFP-LC3细胞的内源性LC3或者GFP-LC3定位。(3)通过蛋白免疫印迹法检测LC3-Ⅰ向LC3-Ⅱ的转变。但是,上述方法均不理想。用电子显微镜评估自噬体的数量需要相关专家,使得研究者们更广泛地使用荧光显微镜评估自噬体,然而,其缺点在于:自噬体数目的判定存在一定主观性,定量方法和对LC3斑点的定义标准均需要制订统一标准;细胞内源性LC3或GFP-LC3如果过度表达或与其他有聚集倾向的蛋白共表达,会产生非特异GFP-LC3聚集物,不能与真正的自噬体区分[7]。蛋白免疫印迹法检测LC3-Ⅱ的量一般与自噬体数量相关,但有报道指出,即使自噬体和自噬通量受到抑制,仍可检测到LC3-Ⅱ[8-9]。因此,蛋白免疫印迹法需要与荧光显微镜下检测GFP-LC3的方法或其他形态学方法相结合,以评估细胞的自噬活性。此外,操作复杂、耗时长、结果不稳定和仅能半定量也是此传统方法的缺点。
传统流式细胞术能快速高通量分析大量细胞,并获得细胞群体的各种统计数据,但细胞在散点图上只表示为1个点,而不是真实的细胞图像,因此无法进行基于图像信息的统计学分析。采用荧光显微镜能够观察基于图像分析的试验,记录图像,然后采用图像分析软件对数据进行分析,但显微镜能够观察的细胞数量非常有限,很难提供细胞群体的量化与统计数据;手动分析数据耗费大量人力和时间;受试验人员的主观因素影响,试验结果的稳定性较差。量化成像分析流式细胞仪是近年来发展应用的新型流式细胞仪[10]。它将流式细胞术的高通量分析与荧光显微成像的形态学分析相结合,对通过流动室的细胞逐个采集图像,并采用图像分析软件对每个细胞图像的形态学参数进行量化分析,不仅可提供基于流式分析的细胞群统计数据,还可获得各种细胞形态学、细胞结构和亚细胞信号分布的量化成像信息。
目前,国际上已有多个关于采用新型流式细胞仪对自噬进行检测的报道[11-13],笔者在本研究中采用成像流式细胞仪对细胞自噬活性进行检测。GFP-LC3质粒转染Huh7和H1299细胞效率基本一致,但2种细胞发生自噬的水平有较大差别。H1299细胞有更多自噬斑点产生,这与细胞系背景不同有关。成像流式细胞术获得的结果与荧光显微镜观察结果、蛋白免疫印迹结果基本一致,但前者检测自噬的方法明显优于后两者。高通量的数据处理能力优于荧光显微镜;每个细胞能获得相应的荧光图像,可直观看到自噬斑点的存在,在此方面成像流式细胞术优于蛋白免疫印迹法。国内目前对于成像流式细胞仪的使用还处于起步阶段,笔者希望通过本试验建立细胞自噬检测新方法,并加以推广应用,助力科研工作。
[1]Rautou PE,Mansouri A,Lebrec D,et al.Autophagy in liver diseases[J].J Hepatol,2010,53(6):1123-1134.
[2]Levine B,Mizushima N,Virgin HW.Autophagy in immunity and inflammation[J].Nature,2011,469(7330):323-335.
[3]Huang R,Liu W.Identifying an essential role of nuclear LC3 for autophagy[J].Autophagy,2015,11(5):852-853.
[4]Klionsky DJ,Abdalla FC,Abeliovich H,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy,2012,8(4):445-544.
[5]Yang Z,Klionsky DJ.Eaten alive:a history of macroautophagy[J].Nat Cell Biol,2010,12(9):814-822.
[6]Romao S,Munz C.LC3-associated phagocytosis[J].Autophagy,2014,10(3):526-528.
[7]Mizushima N,Yoshimori T,Levine B.Methods in mammalian autophagy research[J].Cell,2010,140(3):313-326.
[8]Hosokawa N,Hara T,Kaizuka T,et al.Nutrient-dependent mTORC1 association with the ULK1-Atg13-FIP200 complex required for autophagy[J].Mol Biol Cell,2009,20(7):1981-1991.
[9]Hara T,Takamura A,Kishi C,et al.FIP200,a ULK-interacting protein,is required for autophagosome formation in mammalian cells[J].J Cell Biol,2008,181(3):497-510.
[10]Zuba-Surma EK,Ratajczak MZ.Analytical capabilities of the ImageStream cytometer[J].Methods Cell Biol,2011,102:207-230.
[11]Calle C,Joubert PE,Law HK,et al.Simultaneous assessment of autophagy and apoptosis using multispectral imaging cytometry[J].Autophagy,2011,7(9):1045-1051.
[12]Altman BJ,Jacobs SR,Mason EF,et al.Autophagy is essential to suppress cell stress and to allow BCR-Abl-mediated leukemogenesis[J].Oncogene,2011,30(16):1855-1867.
[13]Phadwal K,Alegre-Abarrategui J,Watson AS,et al.A novel method for autophagy detection in primary cells:impaired levels of macroautophagy in immunosenescent T cells[J].Autophagy,2012,8(4):677-689.
Disscution of autophagy detection by imaging flow cytometer*
SHIJingren,GUOXianghua,WANGShanshan,LIUKai,QIAOLuxin,ZHANGYulin,CHENDexi△
(BeijingYouanHospitalAffiliatedofCapitalMedicalUniversity/BeijingInstituteofHepatology,Beijing100069,China)
Objective To detect autophagy levels in the cells by a novel imaging flow cytometer,and to improve the detection methods of autophagy.Methods GFP-LC3 plasmid was transfected into Huh7 or H1299 cells,respectively,followed by starvation for 24 hours in order to induce autophagy.Autophagy levels in the cells were detected by three ways:fluorescence microscopy,western blotting and imaging flow cytometry.Quantified analysis of cellular autophagy data from the imaging flow cytometer was performed by IDEAS software.Results Fluorescence microscopy showed that the numbers of autophagy spot in Huh7 cells were less than that in H1299 cells.The results of western blotting also indicated that compared with H1299 cells,the ratio of LC3-Ⅱ and LC3-Ⅰ in Huh7 cells were lower distinctly.Whereas both of two methods couldn′t obtain quantitative data.The imaging flow cytometer not only displayed the autophagic cellular images,but also demonstrated that only 9.0% of Huh7 cells exhibited over 6 LC3 spots(high autophagic levels),markedly less than the same population of H1299 cells(26.2%).While GFP-LC3 plasmid transfection rates of the two kind of cells were similar(25.2% and 27.6%).Conclusion The novel imaging flow cytometer has the advantages of combination of quantitative data analysis and fluorescent imaging as well as could compensate the shortcomings of fluorescence microscopy and western blotting.It is more excellent to detect autophagy by imaging flow cytometer.
autophagy; imaging flow cytometer; microtubule associated protein light chain 3
国家自然科学基金资助项目(81361120401,81371399,81272266);首都卫生发展科研专项项目(首发2014-1-1151);肿瘤侵袭和转移机制研究北京市重点实验室开放课题(2015ZLQX05);北京市肝病研究所科研课题(BJIH-01602)。
时景仁,女,主治医师,主要从事肝病与自噬相关性方面的研究。
△通讯作者,E-mail:dexichen@ccmu.edu.cn。
10.3969/j.issn.1673-4130.2016.21.001
A
1673-4130(2016)21-2949-04
2016-02-28
2016-05-05)
