丙泊酚诱导LPS刺激的树突细胞向调节性树突细胞分化的研究
2016-12-07王桂岭刘庆阳徐凯智
王桂岭 刘庆阳 徐凯智
河北省衡水市第四人民医院麻醉科 河北衡水 053000;①北京煤炭总医院; ②华北理工大学唐山工人医院
丙泊酚诱导LPS刺激的树突细胞向调节性树突细胞分化的研究
王桂岭 刘庆阳①徐凯智②
河北省衡水市第四人民医院麻醉科 河北衡水 053000;①北京煤炭总医院;②华北理工大学唐山工人医院
①目的 探讨丙泊酚(Propofol)诱导脂多糖(LPS)刺激的树突细胞(DC)向分泌白细胞介素(IL)-10的树突细胞亚群-CD11clowCD45RBhighDC分化。②方法 采用磁珠分选技术获得C57BL/6小鼠脾脏树突细胞,将提取的DC分为6个组,分别加入同体积的生理盐水(NS组),LPS 1μg/mL(L组),LPS 1μg/mL+5μg/mL丙泊酚(P1组)、LPS 1μg/mL+10μg/mL丙泊酚(P2组)、LPS 1μg/mL +20μg/mL丙泊酚(P3组) 后进行培养24小时,分别用流式细胞仪检测各组细胞表面分子CD40、CD80、CD86、I-a/e的表达情况,采用ELISA法检测培养液中IL-10的含量。③结果 与NS组相比,L组DC表面分子CD40、CD80、CD86和I-a/e的表达均明显增强(P<0.05),同时IL-10的分泌升高;而与L组相比,较大剂量丙泊酚能显著降低DC表面分子CD80、CD40和I-a/e的表达并增强CD86的表达及IL-10的分泌(P<0.05),且一定的剂量效应关系。④结论 丙泊酚可能通过介导IL-10的分泌促进DC向CD11clowCD45RBhighDC方向分化从而抑制早期炎症反应。
丙泊酚 树突细胞 调节性树突细胞 免疫抑制
树突细胞(Dendritic cell,DC)是一种骨髓来源的淋巴细胞亚群,是已知体内功能最强、惟一能活化静息T细胞的专职抗原提呈细胞,是启动、调控和维持免疫应答的中心环节,是沟通固有免疫应答和适应性免疫应答的重要桥梁细胞[1,2]。目前有研究证明DC已成为免疫治疗的靶点细胞[3]。调节性DC(CD11clowCD45RBhighDC)是DC功能的新代表,其与传统DC的区别在于低表达CD11c和共刺激分子CD80、CD86和MHC-II类分子,高表达CD45RB,激活后分泌高水平的白细胞介素(IL)-10[4],从而抑制过度炎症反应实现负向免疫调控,是一种新发现的具有负向免疫功能的不成熟树突细胞亚群。脓毒症(sepsis)是目前ICU病房及术后并发症引起患者死亡的主要原因之一,有研究证实脓毒症与免疫功能紊乱有关[5]。脂多糖(Lipopolysaccharide,LPS)是革兰阴性杆菌细胞外膜的重要组成成分,是引起全身性炎症反应综合征(systermic inflammatory response syndrome,SIRS)或者脓毒症等疾病的主要启动因子[6]。丙泊酚(2,6-二异丙基苯酚)是一种静脉注射短效麻醉剂,在麻醉诱导、维持以及镇静方面广泛应用。近年来发现丙泊酚除了麻醉效应之外还具有许多非麻醉作用[7],其中包括免疫调节作用。但是其具体的免疫调节机制尚不清楚。本实验体外用LPS刺激细胞模拟脓毒症机体模型,通过对比观察,拟从树突细胞亚群分化角度探索丙泊酚的免疫调节作用,从而为临床进一步应用丙泊酚提供充分的理论支持。
1 材料与方法
1.1 主要试剂 胶原酶D购自于美国Sigma公司;RPMI1640培养液(包含羟乙基哌嗪乙磺酸,谷氨酰胺,青霉素和链霉素),磷酸盐缓冲液(PBS)和灭活的胎牛血清均购自于中国北京索来宝生物科技有限公司;小鼠淋巴细胞分离液购自于挪威Axis-shield公司;Fc阻断剂:纯化Rat anti-mouse CD16/CD32 (FcγIII/II-R抗体);生物素标记的小鼠树突状细胞富集复合物(Bioinylated Mouse Dendritic Cell Enrichment Cocktail)、异硫氰酸荧光素(FITC)标记抗小鼠CD80和异硫氰酸荧光素(FITC)标记抗小鼠MHC II购自于美国BD生物技术公司;DC阴选试剂盒购自美国BD公司;小鼠微磁珠购自于德国Miltenyi Biotec GmbH公司;脂多糖(LPS,1μg/mL)购自于美国Sigma公司;丙泊酚注射液(2,6-二异丙酚,200mg/支)购自于北京费森尤斯卡比医药有限公司。
1.2 方法
1.2.1 小鼠脾脏单个核细胞的制备。细胞室外将小鼠断颈处死后右侧卧位固定,剪开腹部皮肤留取脾脏置于加有PBS的平皿中, PBS冲洗2次,去除脾脏表面被膜移至220目金属滤网上,破碎脾脏并用无菌注射器活塞反复研磨,吸取细胞液注入离心管,1500r/min离心5分钟,弃上清,加入适量无菌PBS制成1mL细胞悬液后,沿着管壁小心加入到含有2mL淋巴细胞分离液的上层,3000r/min离心15分钟,去上清吸取中层液装入另一洁净离心管,加适量PBS冲洗后1500r/min离心5分钟,弃上清,加1mL PBS重悬后计数使细胞浓度在10×106/mL~20×106/mL进行下游实验。
1.2.2 磁珠分选获得脾脏树突细胞。将制备好的单个核细胞悬液,在每1×106个细胞中加入0.25μg的小鼠Fc阻滞剂纯化抗小鼠CD16/CD32单克隆抗体,在冰上孵育15分钟。添加生物素标记的富集小鼠树突状细胞抗体混合物(Bioinylated Mouse Dendritic Cell Enrichment Cocktail),按照每1×106个细胞中添加5μL的标准加入相应体积,之后将试管放在冰上冰浴15分钟。冰浴结束之后向细胞中加入至少10倍体积的1×BD IMagTM缓冲液,用吸管反复吹打混匀,对细胞进行洗涤以便去除过剩的生物素标记抗体,之后在4℃、1000r/min离心7分钟,弃去上清液。再次重悬细胞,显微镜下进行细胞计数,调整细胞浓度,将细胞浓度提高到20×106/mL~80×106/mL,按照每1×106个细胞添加5μL的标准加入相应体积的磁珠,充分混匀之后冷藏30分钟。把混合细胞转移到12×75mm的磁珠分选专用圆底试管中,放到磁珠分选仪上(水平位置),计时6~8分钟。计时结束之后,用无菌吸管吸取上清液至新的无菌圆底分选试管中重复一次实验,显微镜下采用细胞计数板进行细胞计数。
1.2.3 IL-10水平的检测。用含10%胎牛血清RPMI 1640完全培养液重悬DC,调整细胞密度为1×106/mL。如果浓度低于1×106/mL,则将细胞悬液再次离心7分钟,1500r/min 7分钟,弃上清并再次重悬细胞,使细胞的终浓度达到预定浓度后接种于96孔板,分别加入等体积的生理盐水,LPS 1μg/mL,LPS 1μg/mL+丙泊酚5、10、20μg/mL,每组设3复孔,CO2培养箱孵育24小时后收集上清液,采用ELISA法测定上清液中IL-10水平。
1.2.4 流式细胞仪检测DC表面标记物表达。将孵育24小时的树突细胞,连同孵育液一起加到洁净离心管中,1500r/min离心5分钟后弃上清,加入100μL PBS重悬离心后沉淀细胞,细胞计数板计数调整细胞密度为2×105/mL。加入Fc阻断剂1μL,4℃孵育15分钟后分别加入5μL CD11c-APC、CD45RB-PE、CD40-FITC、CD80-FITC、CD86-FITC、I-a/e-FITC,避光孵育15分钟后,用流式细胞仪检测相关标记物。
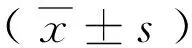
2 结果
2.1 流式细胞仪对小鼠脾脏DC细胞亚群鉴定 分别用CD11c-APC和CD45RB-PE抗体对上述分选方法获得的DC进行标染后流式细胞仪分析鉴定,结果如下图1、2所示,树突状细胞被分为CD11chighCD45RBlowDCs(R2)、CD11clowCD45RBlowDCs(R3)和CD11clowCD45RBhighDCs(R4)三群。本次实验采用磁性分选方法获得的DC通过流式细胞仪检测纯度大于85%。

图1
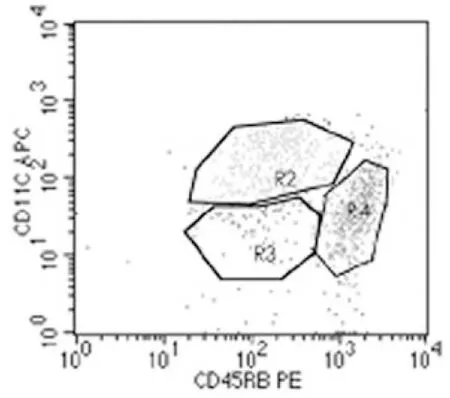
图2
图1表示的是DC流式散点图,其中纵坐标SSC-H代表侧向角,横坐标FSC-H代表前向角;图2表示以CD11c与CD45RB抗体为标志对DC标染后进行分群定义的流式细胞图。
2.2 IL-10分泌水平的改变 与NS组相比较,L组的IL-10水平明显升高(P<0.05);与L组相比较,丙泊酚刺激24小时后, P1、P2、P3组IL-10水平均显著高于L组(P<0.05),且P3组>P2组>P1组,差异均有统计学意义(P<0.05)。提示IL-10的水平与丙泊酚的浓度呈现出一定的剂量效应关系(r=0.035,P<0.05),见表1。

表1 各组IL-10水平表达变化
2.3 各组DC表面分子及受体分子表达的比较 流式细胞仪结果显示,与NS组相比较,L组的CD40、CD80、CD86、I-a/e分子的表达水平升高,差异有统计学意义(P<0.05);而丙泊酚各组表面分子表达水平大多有统计学差异(P<0.05)。与L组相比较,P1组CD40、CD80、CD86、I-a/e分子的表达水平差异不大,而P2、P3组CD40、CD80、CD86、I-a/e分子的表达水平较L组差异显著,即较大剂量的丙泊酚能显著上调DC表面分子CD86的表达(P<0.05),同时大大减少表面分子CD40、CD80及受体分子I-a/e的表达(P<0.05),见表2。
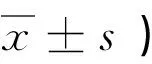
表2 各组DC表面蛋白分子表达变化(平均荧光强度,
2.4 各组CD11ChighCD45RBlowDC和CD11ClowCD45RBhighDC比例变化 根据流式细胞仪数据显示,与NS组比较,L组CD11chighCD45RBlowDC比例明显升高(P<0.05),CD11clowCD45RBhighDC比例变化不明显;而P1、P2和P3组的CD11clowCD45RBhighDC比例明显升高(P<0.05)。与L组相比较, P2和P3组的CD11clowCD45RBhighDC比例明显升高(P<0.05),P3组CD11chighCD45RBlowDC比例明显降低(P<0.05)。由此可见实验剂量为20μg/mL的丙泊酚明显降低了CD11chighCD45RBlowDC的比例(P<0.05),同时升高了CD11clowCD45RBhighDC的比例(P<0.05),见表3。
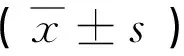
表3 各组中CD11chighCD45RBlowDC和CD11clowCD45RBhighDC比例变化
3 讨论
丙泊酚除了具有镇静、催眠、麻醉作用外还具有抗炎和免疫调节的特性[7]。脓毒症通常伴有各脏器的严重损害,病死率较高,尤其是在危重症患者中尤为严重。脓毒症的病因有很多,例如严重的感染、创伤和重大的手术应激等。脓毒症早期通常表现为无法控制的过度炎症反应,对机体产生严重的损害[8]。DC作为专业的抗原呈递细胞,可以将吞噬细胞捕获的抗原呈递给T细胞,引发炎症反应[9],还能够通过分泌细胞因子和趋化因子调节炎症反应[10,11]。DC虽然是参与固有性免疫系统的重要细胞成分,却能够通过传递抗原特异性信号启动适应性免疫反应[12]。无论是在固有性免疫应答还是适应性免疫应答中DC都发挥着不可替代的作用[13],是二者之间的纽带和桥梁。临床研究发现死于脓毒症的患者体内DC的数量明显低于非脓毒症患者[14]。此外,脓毒症患者外周血中DC表面分子如MHC II类分子表达下降,同时分泌的IL-12也相应下降[15]。可见DC的数量和免疫功能与脓毒症的发生发展和预后有重要联系。因此,明确丙泊酚对DC的影响对危重患者尤其是脓毒症患者合理应用丙泊酚具有重要的参照意义。
LSP是革兰阴性菌的主要成分,是脓毒症和感染性休克的主要原因,其作用跨度较宽,从促进炎症反应的发生到引发机体急性损伤性反应。本实验体外用一定浓度的LPS刺激DC观察其亚型比例及IL-10分泌量的变化,以探讨丙泊酚能否通过提高调节性DC的比例从而抑制脓毒症早期炎症反应。从诱导DC向调节性DC分化角度阐述丙泊酚发挥免疫抑制的可能机制,实验结果显示丙泊酚对DC的分化和免疫功能存在影响,表现为抗炎作用,可以辅助免疫负向调节剂作用于脓毒症早期以对抗机体过度炎症反应:一方面通过下调细胞表面CD40、CD80和I-a/e分子的表达在一定程度刺激小鼠脾CD11clowCD45RBhighDC活化;另一方面增强DC分泌IL-10的能力。孔圆等[16]研究发现CD4+T细胞活化既需要TCR识别DC表面的MHC-II分子提供第一信号,又需要T淋巴细胞的CD28与DC表面的相应配基分子CD80、CD86相结合发出的第二信号。本实验中可以得出丙泊酚能诱导DC细胞向CD11clowCD45RBhighDC方向转化,低水平表达的CD80和MHC-II使细胞内的信号传导被中断,T细胞不能充分被激活,从而诱导免疫抑制。但我们不能够断定丙泊酚的这种抗炎作用是否对机体有利,还需要添加体内实验进行深入探讨其确切的作用机制。
[1] 闫静静,张晓燕.树突细胞的特征及其生物学功能的研究进展[J].微生物与感染,2012,7(2):126-131
[2] Liu QY,Yao YM,Yan YH,et al.High mobility group box 1 protein suppresses T cell-mediated immunity via CD11clowCD45RBhighdendritic cell differentiation[J].Cytokine,2011,54(2):205-211
[3] 孟冉冉,张 宁,张跃伟,等.树突状细胞免疫治疗恶性肿瘤的研究现状[J].医学综述,2013,19(7):1214-1216
[4] Gröbner S,Lukowski R,Autenrieth I.B,et al.Lipopolysaccharide induces cell volume increase and migration of dendritic cells[J].Microbiology and Immunology,2014,58:61-67
[5] 董月青,姚咏明.脓毒症中细胞免疫紊乱的机制[J].中国危重病急救医学,2004,16(10):636-638
[6] Crawford JH,Yang S,Zhou M,et al.Down-regulation of hepatic CYP1A2 plays an important role in inflammatory responses in sepsis[J].Crit Care Med,2004,32(2):502-508
[7] 林兰英,林财珠.丙泊酚对老年术后早期认知功能与炎症因子的影响[J].临床麻醉学杂志,2011,27(3):254-256
[8] Valencia J,Martínez VG,Hidalgo L,et al.Wnt5a signaling increases IL-12 secretion by human dendritic cells and enhances IFN-γ production by CD4+T cells[J].Immunol Lett,2014,162:188-99
[9] Fallarino F,Pallotta MT,Matino D,et al.LPS-conditioned dendritic cells confer endotoxin tolerance contingent on tryptophan catabolism[J]. Immunobiology,2015,220:315-321
[10] Iwasaki A,Medzhitov R.Regulation of adaptive immunity by the innate immune system[J].Science,2010,327(5963):291-295
[11] Hespel C,Moser M.Role of inflammatory dendritic cells in innate and adaptive immunity[J].Eur J Immunol,2012,42(10):2535-2543
[12] Ko HJ,Chang SY.Regulation of intestinal immune system by dendritic cells[J].Immune Netw,2015,15(2):1-8
[13] Miwa S,Nishida H,Tanzawa Y,et al.TNF-αand tumor lysate promote the maturation of dendritic cells for immunotherapy for advanced malignant bone and soft tissue tumors[J].Plos One,2012,7(12):1-8
[14] Peng M,Ye JS,Wang YL,et al.Posttreatment with propofol attenuates lipopolysaccharide-induced up-regulation of inflammatory molecules in primary microglia[J].Inflamm Res,2014,63:411-418
[15] Pastille E,Didovic S,Brauckmann D,et al.Modulation of dendritic cell differentiation in the bone marrow mediates sustained immunosuppression after polymicrobial sepsis[J].J Immunol.2011,186(2):977-986
[16] 孔 圆,江 滨.树突状细胞与血液肿瘤的免疫治疗[J].中国综合临床,2003,19(11):965-966
(2016-03-11 收稿)(张爱国 编辑)
The effect of propofol induced by LPS stimulation differentiation of dendritic cells to regulatory dendritic cells
WANGGuiling,LIUQingyang,XUKaizhi
(TangshanGongrenHospitalAffiliatedtoNorthChinaUniversityofScienceandTechnology,Tangshan063000,China)
Objective To explore the possibility of propofol on promoting DC to CD11clowCD45RBhighDC subsets which produce IL-10.Methods Purification of splenic DCs cells in C57BL/6 mice were administrated by magnetic beads sorting.Then,these splenic DCs cells were divided into six groups:the NS group,LPS 1μg/mL(L group),LPS 1μg/mL+Propofol 5μg/mL (P1 group)、LPS 1μg/mL+Propofol 10μg/mL(P2 group)、LPS1μg/mL+Propofol 20μg/mL(P3 group).Cultured after 24 hours,flow cytometry was used to determine expressions of DC surface molecules including CD40,CD80,CD86,I-a/e in six groups.IL-10 levels in DC culture supernatants were determined by sandwich enzyme-linked immunosorbent assays (ELISA).Results Compared with the results of the NS group,the expression of CD40,CD80,CD86,I-a/e as well as IL-10 secretion level was increased in the L group.Compared with the results of the L group,propofol could markedly decrease the expression of CD80、CD40 and I-a/e while enhancing the expression of CD86 as well as IL-10 secretion level.Besides,the enhancement of IL-10 secretion level hinges upon the rise of propofol concentration.Conclusion Propofol can inhibit the early inflammatory response by promoting DC to CD11clowCD45RBhighDCs differentiation and adjusting the secretion of IL- 10.
Propofol.Dendritic cells.Regulatory dendritic cells.Immunity
国家自然科学基金面上项目(编号:81272140)。
王桂岭(1987-),女,硕士研究生,住院医师。研究方向:脓毒症免疫与器官保护 。
徐凯智。
R614.1 R392.5
A
2095-2694(2016)05-341-05
