RP-HPLC法测定人血浆中齐拉西酮质量浓度
2016-12-06李熙梁
李熙梁
(云南省大理州第二人民医院,云南大理 671000)

·论 著·
RP-HPLC法测定人血浆中齐拉西酮质量浓度
李熙梁
(云南省大理州第二人民医院,云南大理 671000)
目的 建立用反相高效液相色谱(RP-HPLC)法测定人血浆中齐拉西酮质量浓度的办法。方法 以AcclaimTM120 C18反相柱(250 mm×4.6 mm,5 μm)为色谱柱,流动相为0.2%三乙胺-甲醇(15∶85);流速:1.1 mL/min;柱温:35 ℃;检测波长:230 nm,以乙酸乙酯为萃取剂。结果 齐拉西酮在8.0~300.0 ng/mL质量浓度范围内,其质量浓度与峰面积呈良好线性关系;齐拉西酮低、中、高质量浓度(8.0、80.0、350.0 ng/mL)相对回收率均大于95%;提取回收率均大于90%。日内、日间相对标准偏差均低于10%(n=5)。分析方法的检测限为5.0 ng/mL;齐拉西酮的曲线方程:Y=1.193X+0.013,r=0.999 7(n=7)。结论 该法灵敏、简单、准确、快速,可用于临床齐拉西酮血药浓度的监测。
色谱法,高压液相; 血药浓度; 齐拉西酮
随着对药品质量的愈益重视和我国自主创新药物研制的迫切需要,色谱分析已成为最为重要的方法,且为现代药学发展提供了适时而有效的辅佐和动力。齐拉西酮(ziprasidone)是一种目前最新型的非典型的抗精神病药物,其结构与吩噻类或丁酰苯类抗精神病药物不同,临床应用越来越广泛。有研究表明,其抗精神分裂症作用可能是通过对D2和5-羟色胺(5-HT2)受体的拮抗作用来发挥的,对其他相似亲和力受体的拮抗作用可能是导致其他治疗作用和不良反应的原因[1]。齐拉西酮口服的绝对生物利用度为60%,血浆蛋白结合率大于99%,主要经肝脏充分代谢,约20%经尿液排泄,66%经粪便排泄[2]。齐拉西酮的有效治疗窗为50~20 ng/mL,中毒警戒值为400 ng/mL[3],种族、年龄和性别对齐拉西酮药代动力学均无影响。因此,在临床应用中实施个体化用药,有必要对其进行治疗药物监测,尽量减少药物不良反应,避免医疗事故的发生。为研究齐拉西酮在人体内的药代动力学,本研究选择地西泮为内标,建立简单、快速的反相高效液相色谱(RP-HPLC)法测定患者血浆齐拉西酮质量浓度,适用于临床对齐拉西酮血药浓度的测定及人体药动学研究。
1 材料与方法
1.1 仪器 高效液相色谱仪[美国Ultimati3000包括在线脱气机、自动进样器、二极管阵列紫外检测器(DAD)、自动调配器、可调柱温恒温箱和变色龙色谱化学工作站]、XK96-A旋涡混合器(姜堰市新康医疗器械有限公司)、梅特勒电子分析天平(瑞士AL204-IC)、湘仪TDZ5-WS高速离心机、MTN-2800W氮吹仪、MILLI-Q超纯水仪等。
1.2 药品与试剂 >99.4%齐拉西酮对照品(中国生物制品研究所,批号:100853-201405),内标为大于99.6%地西泮(中国食品药品检定研究院,批号:100142-201308)。甲醇(美国迪马公司)色谱级,>99.0%三乙胺(江苏强盛功能化学股份有限公司制造,批号:20131121),提取剂为大于99.5%乙酸乙酯(江苏强盛功能化学股份有限公司,批号:20130315)。水为超纯水,其他试剂均为分析纯。
1.3 方法
1.3.1 对照品与内标 用精确到0.01 mg的电子天平准确称取齐拉西酮10.0 mg,用甲醇与纯净水溶解并定容至10 mL棕色容量瓶中,于冰箱4 ℃放置保存。实验时稀释成所需质量浓度的齐拉西酮对照品溶液。用精确到0.01 mg的电子天平准确称取地西泮2.5 mg,用甲醇与纯净水溶解并定容至10 mL棕色容量瓶中,制成质量浓度为250 ng/mL的工作内标液并放于冰箱4 ℃保存。
1.3.2 色谱条件 色谱柱为美国赛默飞世尔科技公司生产的AcclaimTM120 C18反相柱(250 mm×4.6 mm,5 μm);流动相为0.2%三乙胺-甲醇(15∶85);流速:1.1 mL/min;柱温:35 ℃;检测波长:230 nm;灵敏度为0.01 AUFS,不对称度为0.99,塔板数平均为1万以上,相对标准差为0.62%。
1.3.3 标本处理 取800 μL标本血浆于5 mL尖底离心管中,准确加入250 ng/mL内标液20 μL,窝旋振荡5 s,再加1.2 mL乙酸乙酯,窝旋振荡3 min,于8 000 r/min的专用离心机内离心10 min。转移全部上清液于2.0 mL尖底离心管中,用40 ℃氮吹仪吹干。进样前加入40 μL流动相混匀溶解,吸取20 μL于内插管中,由仪器自动进样分析。
1.3.4 制作标准曲线 在7个5 mL尖底离心管中分别加入相同体积不同质量浓度齐拉西酮对照品20 μL,再加空白血浆800 μL,窝旋振荡5 s,使血浆药物质量浓度分别为8.0、16.0、32.0、64.0、128.0、256.0、350.0 ng/mL。然后按“1.3.3”项处理后经HPLC分析,测得齐拉西酮峰面积Ai、内标峰面积As,以Ai/As值为横坐标(X),以血浆标本所对应各点齐拉西酮质量浓度为纵坐标(Y)绘制标准曲线。经加权最小二乘法线性回归。
1.3.5 回收率及精密度 取齐拉西酮低、中、高质量浓度(8.0、80.0、350.0 ng/mL)含药血浆标本,经色谱分析仪工作站自动计算结果。齐拉西酮低、中、高质量浓度的峰面积与标准曲线所对应点的峰面积之比为相对回收率;而与相同质量浓度未经提取获得的色谱峰面积之比为提取回收率。同时在1 d内重复5次和1周内重复5次测定其质量浓度,计算日内、日间误差及方法回收率。
1.3.6 标本稳定性 按标准曲线方法分别配制低、中、高质量浓度(8.0、80.0、350.0 ng/mL)3组18个标本(双样平行测定),分别在室温(20~24 ℃)放置4、6 h,-20 ℃冻存24 h及-20 ℃冻存1、3周后进行色谱分析。
1.3.7 标本的质控 按标准曲线方法分别配制低、中、高质量浓度(8.0、80.0、350.0 ng/mL)36个血浆标本(每质量浓度12份)置-20 ℃冻存备用,此即为质控标本。批次实验中同时检测质控标本,如果中、高质量浓度相对回收率为85%~110%,低质量浓度为80%~120%,即可认为仪器运转正常,否则须检查整个检测流程及进行仪器原因分析。
2 结 果
2.1 齐拉西酮标准曲线 经加权最小二乘法线性回归得齐拉西酮8.0~300.0 ng/mL的标准曲线。曲线回归方程:Y=1.193X+0.013,r=0.999 7(n=7);当信噪比:S/n=3,权重系数W=1/X2时齐拉西酮的检测限可达5.0 ng/mL。
2.2 回收率及精密度 齐拉西酮相对回收率大于95%,提取回收率大于90%。并满足生物标本分析要求。见表1。
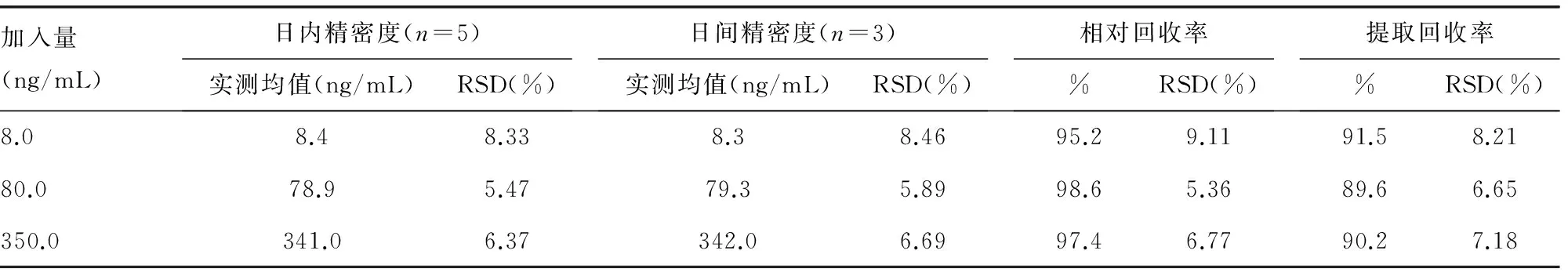
表1 齐拉西酮日内、日间精密度及回收率(n=5)
*:RSD中文为相对标准偏差。
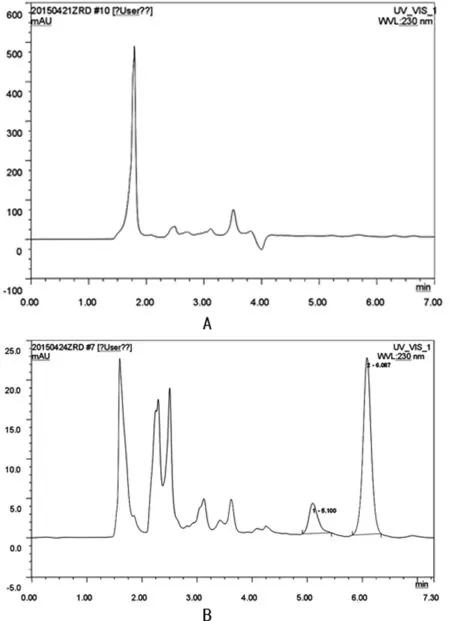
A:空白血浆;B空白血浆、齐拉西酮对照品、内标(地西泮);1:齐拉西酮;2:内标(地西泮)。
图1 齐拉西酮的高效液相色谱图
2.3 方法学的专属性 在本实验条件下空白血浆、齐拉西酮标准品血浆及内标物经RP-HPLC法测定得到的色谱图见图1。齐拉西酮和内标物的色谱峰能完全分离,无明显的内生杂质峰干扰,可见本法具有较高的专属性。齐拉西酮和内标物的保留时间分别为5.100、6.087 min。
2.4 标本稳定性 经检测未见冻存标本药物的损耗和降解。
3 讨 论
齐拉西酮人体药代动力学性质无人种差异,主要药理活性来自原型,口服齐拉西酮后经胃肠道吸收良好,分布广泛,6~8 h达血浆峰浓度,1~3 d达到稳态血浓度[4],因此,20~80 mg口服每天2次能够满足治疗需要[5-6]。
齐拉西酮在180~400nm的波长范围内进行紫外扫描,发现在230nm处有一最大吸收峰,而且溶剂峰和其他杂质的干扰较少,故选择230nm为检测波长。齐拉西酮的血药浓度检测方法国内外已有报道[7-8]。另外在实验中使用乙酸乙酯一次性提取,提取率达到要求,且乙酸乙酯经济、实惠,该法萃取效率较高且稳定,萃取物以用甲醇复溶后取上清液进样,进样20μL即可满足实验要求。虽然齐拉西酮血药浓度与患者临床用药剂量呈显著正相关,但从患者病历资料来看也存在一定程度的个体差异,治疗剂量不一定适用于所有患者,应密切监控其血药浓度,做到用药剂量科学化和个体化。齐拉西酮单药物的TDM国内外已有报道,相比之下,本研究所建立的方法,简化了标本处理过程,具有操作简单、成本低、精密度好和回收率高等特点,能批量进行治疗药物的监测,适用于药物分析实验和临床药代动力学研究。
[1]Allqvist A,Miura J,Bertilsson L,et al.Inhibition of CYP3A4 and CYP3A5 catalyzed metabolism of alprazolam and quinine by ketoconazole as racemate and four different enantiomers[J].Eur J Clin Pharmacol,2007,63(2):173-179.
[2]杨广声,钱东丽.盐酸齐拉西酮片[J].中国新药杂志,2006,15(23):2081-2082.
[3]Hiemke C,Baumann P,Bergemann N,et al.AGNP Consensus Guidelines for Therapeutic Drug Monitoring in Psychiatry:Update 2011[J].Pharmacopsychiatry,2011,44(6):195-235.
[4]徐德峰,宓为峰,李玲芝,等. 齐拉西酮临床研究进展[J].中国临床药理学杂志,2014,30(1):63-65.
[5]李华芳,沈一峰,葛庆华,等.盐酸齐拉西酮在中国健康志愿者中的药代动力学研究[J].上海精神医学,2006,18(4):222-225.
[6]隋忠国,毕晓林,荆凡波.新型非典型抗精神病药--齐拉西酮的临床应用进展[J].中国药房,2009,20(5):385-387.
[7]陈清霞,吕永丰,黄伟侨,等.高效液相色谱法测定人血浆中齐拉西酮浓度[J].海峡药学,2009,21(2):69-71.
[8]刘伟忠,陈清霞,莫玉泉,等.反相高效液相色潽法同时测定人血浆齐拉西酮与阿立哌唑浓度[J].医药导报,2011,30(8):1000-1003.
Determination of the concentration of ziprasidone in human plasma by using RP-HPLC
LiXiliang
(TheSecondPeople′sHospitalofDaliPrefecture,Dali,Yunnan671000,China)
Objective To develop a method for determining the concentration of ziprasidone in human plasma by using HPLC.Methods The drug concentration of plasma was analyzed in a reverse phase HPLC system C18column(250 mm×4.6 mm,5 μm);mobile phase consisted of 0.2% ammonium triethyamine-methanol(15∶85);the flow rate was1.1 mL/min;the column temperature was 35°C.The detection wavelength was at 230 nm.Ethyl acetate was used as extracting solvent.Results A good linearity range was 8.0-300.0 ng/mL concentration of ziprasidone in plasma.The average recoveries of ziprasidone in low,middle and high concentrations(8.0,80.0,350.0 ng/mL) over 95% respectively;the extraction recovery over 90%.The intra-day and inter-day variation(RSD)was less than10%(n=5).The minimum detectable concentration of ziprasidone was 5 ng/mL.The regression equation wasY=0.089 9X+0.021 5.r=0.999 7(n=7).Conclusion The method is fast,accurate,,sensitive and simple for clinical monitoring of ziprasidone in plasma.
chromatography,high pressure liquid; plasma concentration; ziprasidone
李熙梁,男,主管检验技师,主要从事治疗药物监测的研究。
10.3969/j.issn.1673-4130.2016.02.024
A
1673-4130(2016)02-0202-03
2015-07-28)
