不同环境来源的洋葱伯克氏菌对人体健康的风险评估*
2016-12-06黄旭倩
方 媛, 李 璇, 黄旭倩
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
不同环境来源的洋葱伯克氏菌对人体健康的风险评估*
方 媛, 李 璇, 黄旭倩
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
对来源于不同环境的41株洋葱伯克氏菌进行了毒力基因检测及致病性研究.4个毒力基因(BCESM,cblA,cepR和cepI)被从数量不等的菌株中扩增到,从而认定了10个风险性较高的菌株;通过苜蓿和生菜模型致病性测定,发现不同来源的很多菌株表现出对苜蓿和生菜不同程度的致病力.所研究的洋葱伯克氏菌株大部分被认定对人体健康存在风险.
洋葱伯克氏菌;人体条件致病菌;毒力;致病性;风险分析
洋葱伯克氏菌(Burkholderiacepacia)是引起洋葱酸皮病的病原细菌,但后来发现该细菌具有不寻常的多样性,至今已发现17个不同的基因型,并建立了不同的新种,又称之为洋葱伯克氏菌群(Burkholderiacepaciacomplex),简称Bcc[1].
洋葱伯克氏菌是一种革兰氏阴性杆菌,广泛分布于水体、植物根围土壤、医院等环境中,在环境中发挥了重要的作用,不仅能降解土壤中的残留农药、净化污水,还可以促进植物生长,抑制植物病原微生物生长.作为植物根围促生细菌,能显著促进玉米、小麦和水稻等农作物生长并提高其产量.但同时,洋葱伯克氏菌又是一类人体条件致病菌、植物冰核细菌、植物致病菌,存在极大的变异潜能[2].洋葱伯克氏菌在医院环境中常污染自来水、体温表、喷雾器、血管、导尿管和静脉输液剂等,可引起多种感染病,如败血症、肺炎、心内膜炎和伤口感染[3];更为严重的是,还可使感染囊性肺纤维化(cystic fibrosis,CF)患者引起“洋葱伯克氏综合症”,死亡率增加10%左右,甚至致死[4].洋葱伯克氏菌于20世纪90年代曾在英国、加拿大等囊性肺纤维化病人中传播并大面积流行,导致多人死亡.在我国也有洋葱伯克氏菌引起医院病人感染的相关报道,且近年来呈上升趋势[5-9].随着各基因型被从病人体内和自然环境中分离得到,很多研究者认为,自然环境对医学致病菌发挥着“天然储存库”的功能[2].洋葱伯克氏菌一些毒力因子及致病基因不断被发掘出来,目前已发现4个与致病性相关的基因,即BCESM,cblA,cepR和cepI基因[10-13].关于洋葱伯克氏菌不同种的感染性和致病性的研究在各种致病模型上广泛展开,其中小鼠、线虫、蜡蛾幼虫及生菜叶梗、拟南芥、苜蓿都是研究洋葱伯克氏菌致病性的主要致病模型[14-18],但在一定程度上存在差异性.
洋葱伯克氏菌作为有益菌在农业及环境领域具有很大的应用前景,但作为植物致病菌和人体条件致病菌,应用不当会给农作物生产和人体健康带来极大的影响.因此,本文根据对洋葱伯克氏菌致病基因的分子生物学检测,并结合该菌群在苜蓿和生菜叶梗模型上的毒力测定,从而评估了这些菌株是否对人体健康存在潜在的威胁.这对于洋葱伯克氏菌株的安全应用具有重大意义.
1 材料与方法
1.1 供试菌株
本研究所用的菌株为实验室现有的41株洋葱伯克氏菌,分别来源于医院、植物根围土壤、水体及植物病原菌,具体见表1.
1.2.1 PCR扩增
对所有供试菌株分别进行了4个毒力基因(即:BCESM,cblA,cepI和cepR)的检测.

表1 供试洋葱伯克氏菌代表性菌株
PCR反应体系总体积为20 μL,包括1×PCR缓冲液(含2 mmol/L MgCl2),2 U Taq DNA聚合酶,200 μmol/L dNTP,8 pmol引物,2 μL DNA提取液.BCESM和cblA扩增引物见文献[10-11].cepI和cepR扩增引物自己设计,cepI-F:5′-TCACGAGGAAGGGCGGTTGC-3′,cepI-R:5′-CGAACGTCACGCCGATCAACT-3′,长度为418 bp;cepR-F:5′-GTACCGCTGCCCGTTTCGA-3′,cepR-R:5′-CGACCGCCTGGACCTTGTT-3′,长度为540 bp.所有基因的特异性引物由上海英俊生物公司合成.
PCR扩增在BIO-RAD C1000扩增仪上进行.反应程序为:94 ℃预变性3 min后94 ℃ 1 min,63 ℃(BCESM)/60 ℃(cblA)/61 ℃(cepI)/62 ℃(cepR)退火1 min,72 ℃ 2 min,共30个循环,最后72 ℃延伸10 min.扩增产物进行1%琼脂糖凝胶电泳检测.
1.2.2 基因克隆及序列分析
PCR产物经切胶回收、连接和转化,通过筛选得到重组质粒(试剂及步骤由Axygen试剂盒提供).将所获得的重组质粒送上海英俊生物公司测序,获得的基因序列通过BLAST搜索和比对,以验证毒力基因的正确性.
1.3 洋葱伯克氏菌在苜蓿模型上的毒力研究
基于以上种种现实窘境,现在的我对交朋友这种事情已经越来越没有兴趣,就像朱文的小说《我们的牙,我们的爱情》里写的那样:“我还是决定今后不再结交新朋友了。我要把现在的朋友都变成老朋友,把现在的老朋友都变成更为醇厚的陈年老酿,供我在岁月的角落里时不时地独自抿上一小口,这样就够了。”
将过夜培养洋葱伯克氏菌悬液用针刺方式对苜蓿幼苗进行接种,具体步骤见文献[17].
1.4 洋葱伯克氏菌在生菜模型上的毒力研究
取新鲜且消毒的生菜叶片,将过夜培养洋葱伯克氏菌悬液接种于生菜叶梗经针刺而产生伤口的部位,具体步骤见文献[18].
2 结果与分析
2.1 4个毒力基因的检测
2.1.1 毒力基因BCESM的检测和验证
对41株待测洋葱伯克氏菌的DNA进行PCR扩增,结果表明,A8,Y5,279,292,227和317这6个菌株在1 418 bp处有清晰条带,如图1所示.其中,Y5和A8的测序结果经过BLAST比对,发现2个基因片段均与B.cenocepacia流行性菌株标记(BCESM)表现出98%的相似性,充分验证了这6个菌株中存在毒力基因BCESM.
有研究表明,BCESM基因与洋葱伯克氏菌的流行性密切相关[10],暗示了这6个菌株的风险性较高.本研究在来源于医院、水和土壤的洋葱伯克氏菌株中均检测到了BCESM毒力基因,这一发现与前人的研究结果[10]一致,进一步支持了“自然环境是医院致病菌的天然储存库”的观点.

M:DL2000 marker;1-21:Y3,Y4,A8,PE27,Y5,301,J5,Y7,Y20,LMG1222,Y10,279,Y16,292,227,317,Y17,Y2,Y12,Y14图1 洋葱伯克氏菌致病基因BCESM的PCR扩增电泳结果
2.1.2 毒力基因cblA的检测和验证
对41株待测洋葱伯克氏菌的DNA进行PCR扩增,结果表明所有菌株在555 bp处均未产生清晰条带,说明这些菌株不存在毒力基因cblA.cblA基因在基因组中发挥着编码洋葱伯克氏菌鞭毛蛋白亚基的功能,由它编码的鞭毛被称为“天线鞭毛”,可使菌体黏附于呼吸器官[11].无cblA基因的菌株被认为难以黏附人体,从而缺乏致病力.因此,本研究未发现具有强黏附能力的菌株.
2.1.3 毒力基因cepI和cepR的检测和验证
对41株待测洋葱伯克氏菌的DNA进行PCR扩增,结果表明,有35个菌株(LMG1222,Y1,Y2,Y3,Y4,Y5,Y6,Y7,Y8,Y9,Y10,Y11,Y12,Y14,Y17,Y20,J5,292,297,301,318,317,A8,CK-5,R456,TG68,PG11,Bca0902,S9,PW26,PW99,PG56,Bca0901,TG40和PW61)在418 bp处有清晰条带(见图2).Y1,Y20和J5的测序结果经过BLAST比对,与数据库中洋葱伯克氏菌的cepI基因相似性都在97%以上,说明这35个菌株含有毒力基因cepI.
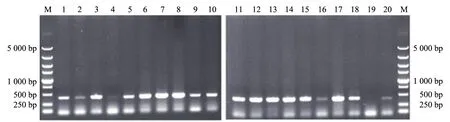
M:DL5000 marker;1-20:PW99,318,Y6,M8,PG56,Y8,Bca0901,TG40,PW61,Y1,CK-5,Y9,R456,TG68,PG11,Bca0902,Y11,S9,Y10,PW26图2 洋葱伯克氏菌致病基因cepI的PCR扩增电泳结果
对41株洋葱伯克氏菌的DNA进行PCR扩增的结果表明,318,M8,PG11,PW61和TG68这5个菌株在540 bp处有清晰条带(见图3).318和PG11的测序结果经过BLAST比对,与数据库中洋葱伯克氏菌的cepR基因的相似性在87%以上,说明这5个菌株含有毒力基因cepR.
cepI基因和cepR基因被认为与细菌的群体感应(quorum sensing,QS)有关.群体感应系统由一个AHL合成酶和一个转录调控因子组成,cepI编码AHL合成酶,cepR能够编码群体感应系统的转录因子[12].具有群体感应功能的细菌能大量富集从而产生众多胞外毒素,因此,群体感应系统被发现是很多革兰氏阴性细菌的毒力因子,如Pseudomonasaeruginosa[12].有研究表明,洋葱伯克氏菌株的cepR突变体在BHI培养基上不具备产蛋白酶的活性,并且酯酶的活性也降低了45%[12],例如cepI突变体菌株对洋葱的致病性大大降低[13],充分说明这2个基因和洋葱伯克氏菌的致病性相关.本研究从35个供试菌株中检测出cepI基因;从5株供试菌株中检测出cepR基因;从318,PG11,PW61和TG68菌株中同时检出cepI和cepR基因,因此,这4个洋葱伯克氏菌株具备产生毒性和致病性的能力,为高风险性菌株.

M:DL5000 marker;1-20:CK-5,Y8,M8,PW99,PG11,PW61,PW26,PG56,TG68,TG40,Y1,Y6,Y11,Bca0901,Bca0902,318,Y9,R456,S9,J100图3 洋葱伯克氏菌致病基因cepR的PCR扩增电泳结果
2.2 洋葱伯克氏菌对苜蓿幼苗的毒力表现
苜蓿幼苗接种细菌7 d后,发病的幼苗表现出接种点周围黄化、长斑和萎蔫的症状,而对照和不发病的幼苗则表现出良好的健康状态.通过对不同来源的菌株在苜蓿幼苗上的毒力观察,大部分菌株,包括来源于医院的Y8,Y10,Y5,Y17,Y12,Y14,Y11,Y2和Y16菌株,来源于土壤的292,318,301,317,297和227菌株,来源于水中的A8,J5,PW26,PW56,S9,PG11,PW99,M8和PW61菌株,以及来源于植物病原菌中的LMG1222和Bca0902菌株,都表现出较强的致病性,使苜蓿幼苗萎蔫、子叶蜷缩,接种针刺周围枯黄(见图4中b),甚至出现病斑(见图4中c).仅来源于医院的Y4菌株、来源于水中的CK-5菌株和来源于植物病原菌的Bca0901菌株对苜蓿幼苗的致病性较弱,或者没有致病性(见图4中d).

a:接种生理盐水的阴性对照;b:接种301的幼苗;c:接种Y11的幼苗;d:接种Y4的幼苗图4 洋葱伯克氏菌株在苜蓿幼苗上的致病症状
当前,植物侵染模型被认为是一种有效的研究动物致病细菌的分子致病机制的手段,采用植物模型和动物致病细菌的突变体可以较容易地筛选病菌的毒力因子[19].近年来有研究通过比较相同洋葱伯克氏菌致病菌在苜蓿模型和琼脂珠大鼠模型的毒力,表明苜蓿可以作为评估洋葱伯克氏菌毒力因子侵染的模型[17].由此推断,本研究中能引起苜蓿发病的菌株均能产生导致人类致病的相关毒力因子,为风险性菌株.
2.3 洋葱伯克氏菌对生菜叶片的毒力表现
本实验对37个洋葱伯克氏菌株进行了生菜叶片的毒力测定,其中:15株来源于医院,8株来源于土壤根围,11株来源于水体,3株为植物病原菌.
生菜接种洋葱伯克氏菌4 d后,叶片接种区域大部分出现不同程度的褐色水渍状病斑.以接种生理盐水作为阴性对照,根据生菜叶梗的溃烂斑,可将洋葱伯克氏菌对生菜的致病性分为严重致病、中等致病、轻微致病及不致病4个等级.严重致病是指细菌接种于生菜4 d后形成面积较大的褐色斑块(见图5中d);中等致病的菌株接种于生菜4 d后,接种部位变褐且褐斑轻微扩散(见图5中c);轻微致病的菌株可使接种部位变褐,但褐斑不扩展(见图5中b);不致病菌株接种后接种部位不变色(见图5中a).

a:接种生理盐水的阴性对照;b:轻微致病症状;c:中等致病症状;d:严重致病症状图5 洋葱伯克氏菌株在生菜叶片上的致病症状
医院来源的15个洋葱伯克氏菌株中:Y9,Y1,Y5,Y14,Y4,Y12,Y2和Y20表现出强致病毒力,生菜接种部位在接种后形成面积较大的褐色水渍状斑;Y10和Y3在生菜上表现为中等毒力,即接种于生菜4 d后,接种部位变褐且水渍状褐斑有轻微扩散现象;Y11株对生菜轻微致病,可使接种部位变褐,但褐斑不扩展;Y17,Y16,Y8和Y6对生菜不致病.
根围土壤来源的8个洋葱伯克氏菌株中:279对生菜表现强致病性,在接种于生菜叶片4 d后形成面积较大的褐色水渍状斑;301,318和227在生菜上表现为中等致病性,接种部位出现水渍状褐斑且轻微扩散;317,R456,297和292对生菜有轻微致病性,接种部位虽变褐,但褐斑不扩展.
水体来源的11个洋葱伯克氏菌株中:PG11,PG56,PW61和J100对生菜致病毒力强;M8和A8在生菜叶片上的毒力表现为中等;其余洋葱伯克氏菌株J5,PW99,S9,PW26和CK-5对生菜无致病毒力.
作为植物病原菌的3个洋葱伯克氏菌株中:LMG1222表现为对生菜的强致病毒力菌株,生菜接种后产生较大褐色水渍状斑;Bca0901表现为对生菜的中等毒力菌株;仅Bca0902在接种于生菜4 d后,叶片上无褐色病斑出现,即表现为对生菜不具有致病性.
Ibrahim等[18]的研究发现,采用生菜叶梗模型及拟南芥模型与大鼠模型的结果高度一致,并且生菜叶梗模型操作方便,适用于大规模洋葱伯克氏菌株致病力的评估.因此,生菜叶梗模型可取代苜蓿作为新的植物侵染模型.本研究结果表明,任何来源的洋葱伯克氏菌株都有对人体致病的风险.所有检测菌株中,73%的菌株表现出对生菜不同程度的致病毒力.其中:来源于医院、土壤根围的菌株具有严重致病性的比例较大,分别为53.3%和50.0%;相比较其他3种来源的菌株,从水体中分离得到的洋葱伯克氏菌株具有严重致病性的菌株比例较低;3株植物病原菌中也有2株在生菜模型上显示出毒力,说明植物病原菌也对人类健康存在风险,这一发现也支持了文献[20]的研究结果,该研究中发现医学强致病菌B.cenocepacia能引起香蕉尖腐病.不过,由于本实验中样本数量有限,也无法具体说明哪种来源的洋葱伯克氏菌对人体健康的风险相对较高或者较低.
3 结 论
1)在所研究的41株洋葱伯克氏菌中,有6个菌株(A8,Y5,279,292,227和317)检出毒力基因BCESM,4个菌株(318,PG11,PW61和TG68)同时检出毒力基因cepI和cepR,但是它们之间并不重合,即共有10个菌株为高风险性的洋葱伯克氏菌.
2)在洋葱伯克氏菌对苜蓿幼苗的毒力表现实验中,发现来源于医院的Y8,Y10,Y5,Y17,Y12,Y14,Y11,Y2和Y16,源于土壤的292,318,301,317,297和227,来源于水中的A8,J5,PW26,PW56,S9,PG11,PW99,M8和PW61,以及来源于植物病原菌的LMG1222和Bca0902,均表现出较强的致病性,促使苜蓿幼苗萎蔫、子叶蜷缩,接种针刺周围枯黄,甚至长斑.这些菌株均对致病模型有致病性,说明都具有一定的风险.
3)在洋葱伯克氏菌对生菜叶片的毒力测定实验中,不同来源的菌株皆表现出对生菜有不同程度的致病力,其中来源于医院的Y9,Y1,Y5,Y14,Y4,Y12,Y2和Y20,来源于土壤根围的279,来源于水中的PG11,PG56,PW61和J100,以及洋葱病原菌LMG1222,均表现出很强的致病性.说明这些洋葱伯克氏菌对人体健康的风险都比较高.
本研究表明,环境中分离到的洋葱伯克氏菌大部分都是风险菌株.因此,从人体健康安全角度出发,不建议继续利用洋葱伯克氏菌活菌.
[1]De Smet B,Mayo M,Peeters C,et al.Burkholderiastagnalissp. nov. andBurkholderiaterritoriisp. nov.,two novelBurkholderiacepaciacomplex species from environmental and human sources[J].Int J Syst Evol Microbiol,2015,65(7):2265-2271.
[2]Parke J L,Gurian-Scherman D.Diversity of theBurkholderiacepaciacomplex and implications for risk assessment of biological control strains[J].Annu Rev Phytopathol,2001,39:225-258.
[3]Ki H K,Kim S H,Han S W,et al.A case of native valve endocarditis caused byBurkholderiacepaciawithout predisposing factors[J].BMC Infect Dis,2011,11:114.
[4]Folescu T W,Da Costa C H,Cohen R W F,et al.Burkholderiacepaciacomplex:clinical course in cystic fibrosis patients[J].BMC Pulmonary Medicine,2015,15:158.
[5]黄朝晖,袁凤京,王华生.洋葱综合征患者终末消毒方法[J].中华医院感染学杂志,2005,15(4):380.
[6]董爱英,尚秀娟.洋葱伯克霍尔德菌医院感染的调查[J].中华医院感染学杂志,2013,23(17):4281-4283.
[7]徐颖,熊秀梅,蔡文红,等.新生儿重症监护病房洋葱伯克霍尔德氏菌感染临床分析[J].疾病防治,2015,21(6):83-85.
[8]吕琳,宋诗铎,王玉宝,等.应用recA-RFLP调查洋葱伯克霍尔德菌医院血流感染暴发[J].中国感染控制杂志,2007,6(4):219-223.
[9]潘新娣,施前锋.重症监护病房洋葱伯克霍尔德菌的分布及耐药性分析[J].全科医学临床与教育,2013,11(4):454-455.
[10]Mahenthiralingam E,Simpson D A,Speert D P.Identification and characterization of a novel DNA marker associated with epidemic strains ofBurkholderiacepaciarecovered from patients with cystic fibrosis[J].J Clin Microbiol,1997,35:808-816.
[11]Richardson J,Stead D E,Coutts R H A.Incidence of thecblAmajor subunit pilin gene amongBurkholderiaspecies[J].FEMS Microbiology Letters,2001,196(1):61-66.
[12]Lewenza S,Conway B,Greenberg E P,et al.Quorum sensing inBurkholderiacepaciaidentification of theluxRIhomologscepRI[J].J Bacteriol,1999,181(3):748-756.
[13]Sokol P A,Sajjan U,Visser M B,et al.The CepIR quorum-sensing system contributes to the virulence ofBurkholderiacenocepaciarespiratory infections[J].Microbiol-Sgm,2003,149:3649-3658.
[14]Chu K K,MacDonald K L,Davidson D J,et al.Persistence ofBurkholderiamultivoranswithin the pulmonary macrophage in the murine lung[J].Infect Immun,2004,72:6142-6147.
[15]Cardona S T,Wopperer J,Eberl L,et al.Diverse pathogenicity ofBurkholderiacepaciacomplex strains in theCaenorhabditiseleganshost model[J].FEMS Microbiology Letters,2005,250:97-104.
[16]Seed K D,Dennis J J.Development ofGalleriamellonellaas an alternative infection model for theBurkholderiacepaciacomplex[J].Infect Immun,2008,76:1267-1275.
[17]Bernier S P,Silo-Suh L,Woods D E,et al.Comparative analysis of plant and animal models for characterization ofBurkholderiacepaciavirulence[J].Infect Immun,2003,71(9):5306-5313.
[18]Ibrahim M,Tang Q,Shi Y,et al.Diversity of potential pathogenicity and biofilm formation amongBurkholderiacepaciacomplex water,clinical,and agricultural isolates in China[J].World J Microb Biot,2012,28:2113-2123.
[19]Prithiviraj B,Weir T,Bais H P,et al.Plant models for animal pathogenesis[J].Cell Microbiol,2005,7(3):315-324.
[20]Lee Y A,Shiao Y Y,Chao C P.First report ofBurkholderiacepaciaas a pathogen of banana finger-tip rot in Taiwan[J].Plant Dis,2003,87:601-601.
(责任编辑 薛 荣)
The risk assessment about different environmental sources ofBurkholderiacepaciabacteria on human health
FANG Yuan, LI Xuan, HUANG Xuqian
(CollegeofChemistryandLifeSciences,ZhejiangNormalUniversity,Jinhua321004,China)
The risks of forty-oneBurkholderiacepacia(Bcc) strains isolated from different environmental sources had been assessed through detection of virulence genes and research on pathogenic model. There were four virulence genes (BCESM,cblA,cepR andcepI) been detected from a variable number of strains, 10 of them were identified as high-risk strains. In addition, most of strains of different sources showed different degrees of virulence on alfalfa and lettuce. Therefore, most Bcc strains were considered as risky strains to human health.
Burkholderiacepacia; opportunistic human pathogen; virulence; pathogenicity; risk analysis
10.16218/j.issn.1001-5051.2016.04.012
2016-03-07;
2016-03-15
浙江省重中之重学科“生物学”开放基金资助项目(ZC323015001)
方 媛(1983-),女,湖北宜昌人,博士.研究方向:植物病理学.
Q945.8
A
1001-5051(2016)04-0430-06
