基于多肽识别基团的荧光探针及其对食品中氰化物的检测
2016-12-05周彬彬汪霞丽王芳斌张继红程云辉郝远强
周彬彬 汪霞丽 王芳斌 张继红 杨 滔 程云辉 郝远强
(1. 湖南省食品质量监督检验研究院,湖南 长沙 410117;2. 长沙理工大学化学与生物工程学院,湖南 长沙 410114;3. 商丘师范学院化学化工学院,河南 商丘 476000)
基于多肽识别基团的荧光探针及其对食品中氰化物的检测
周彬彬1汪霞丽1王芳斌1张继红1杨 滔1程云辉2郝远强3
(1. 湖南省食品质量监督检验研究院,湖南 长沙 410117;2. 长沙理工大学化学与生物工程学院,湖南 长沙 410114;3. 商丘师范学院化学化工学院,河南 商丘 476000)
食品;氰化物;多肽;荧光探针;检测
氰化物是严重危害食品安全的剧毒化合物,能与细胞线粒体内高铁细胞色素氧化酶结合,生成氰化高铁细胞色素氧化酶,从而失去传递氧的作用,造成人体组织缺氧窒息,引起组织衰竭以至机体死亡[1]。研究[2]表明:口服氰化钠、氰化钾的致死量为1~2 mg/kg,口服氢氰酸致死量为0.7~3.5 mg/kg。氰酸盐是氰化物的主要存在形式,被大量应用于电镀、冶炼等行业,造成环境的污染,从而产生食品安全隐患。另外,含菜豆亭碱的四季豆、五色豆等豆类,以及含氰甙的竹笋、苦杏仁、木薯及其相关制品等食品中也含有氰化物,能引起急性中毒[3]。因此,食品中氰化物的检测是一项重要的安全检测指标,也是一项常规检测指标。
在现行国家标准中,氰化物的检测通常采用分光光度法,以吡啶—巴比妥酸、异烟酸—吡唑酮、异烟酸—巴比妥酸等作为显色体系。但该法针对不同的样品需采取不同的处理方法,实际工作中若采用相同的试剂处理样品对检测结果影响很大,且该法前处理操作较复杂,部分样品毒性较大[4-7]。近年来,学者们研究了色谱法、光谱法、离子色谱—脉冲安培检测法、银明胶络合法、电化学法、硝酸银滴定法、及快速检测试纸条法等在氰化物检测方面的应用,这些技术与传统的分光光度法相比,都具备各自特有的优势。如色谱法和光谱法灵敏度更高,试剂用量少[1];离子色谱—脉冲安培检测法线性范围宽、检出限低[8];银明胶络合法选择性好[9];电化学法操作简便[10];硝酸银滴定法重现性好。然而,这些方法都存在耗时较长,影响因素较多、对检测人员素质要求高等问题。且色谱法、离子色谱—脉冲安培法仪器较贵,电化学法、硝酸银滴定法易受食品中复杂成分的干扰。因而这些方法都没能在食品中氰化物检测方面受到广泛推广应用。另外,现有的氰化物试纸条检测方法虽然具备现场快速定性的优点[11],但是,其目前的灵敏度不足以达到世界卫生组织对饮用水中氰化物含量检测浓度的规定[12],且当其针对食品中氰化物进行检测的时候,又易受到食品中其它复杂成分的干扰。
荧光探针法,因其具有高选择性、高灵敏度、反应速度快等特点,在食品安全检测方面被广泛应用[13-15]。近年来,荧光探针法在氰化物的检测方面,也展现出了潜在的优势[16-17],研究者们设计了荧光探针分子对水中的氰化物进行了检测,都展现出了较高的灵敏度和选择性。但目前用于氰化物检测的荧光探针分子往往存在水溶性较差,不利于实际应用等问题,而且大部分都是基于人工合成的识别基团,因此带来探针分子合成繁琐以及生物相容性不好等问题。已有研究[18]表明,将多肽与香豆素结合而得到的荧光探针分子展现出了很好的生物相容性和水溶性。
本研究设计将香豆素(Coumarin, C)骨架与甘氨酸-甘氨酸-组氨酸三肽(Gly-Gly-His,GGH)缩合得到荧光探针分子(C-GGH),此探针的生色团为香豆素结构,识别基团为GGH三肽。利用探针分子识别基团与Cu2+络合形成复合物(命名为C-GGH-Cu2+)使荧光淬灭,而复合物C-GGH-Cu2+在CN-的存在下,通过CN-与Cu2+的络合形成更加稳定的络合物,体系荧光又得到恢复的原理,从而实现对食品中氰化物的快速检测。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂
甘氨酸、组氨酸、DIC、HOBt:分析纯,吉尔生化上海有限公司;
硫酸铜、7-二乙胺基香豆素-3羧酸:分析纯,上海安耐吉化学有限公司;
用于干扰性试验的其它阴离子四丁基铵盐类:分析纯,萨恩化学技术(上海)有限公司;
用于合成的有机溶剂:分析纯,天津大茂化学试剂厂;
1.1.2 样品的采集
研究过程中的食物样本为本单位监督抽检过程中所抽取的样品,检验过程中发现氰化物含量较高的样品,留样进行本试验研究;部分种类样品采取加标方式。
1.2 仪器与设备
荧光分光光度计:F-2500型,日本日立公司;
核磁共振谱仪:AMX-400型,瑞士Bruker公司;
高分辨质谱仪:LCQ Fleet型,美国Thermo-Fisher公司;
紫外可见分光光度计:UV2450型,日本岛津公司;
高效液相色谱仪:6AD型,日本岛津公司。
1.3 方法
1.3.1 GGH三肽的合成 GGH三肽的合成照参文献[19],利用HOBt和DIC通过标准的多肽液相合成法来合成,合成产率为67%。
1.3.2 C-GGH荧光探针的合成 将7-二乙胺基香豆素-3-羧酸(522 mg,2 mmol)室温条件下加入DMF(10 mL)中,搅拌下加入DIC (2 mmol),HOBt ( 2 mmol)活化反应1 h。将含有三肽GGH (538 mg,2 mmol)的DMF(10 mL)溶液缓慢滴入到上述反应液中,继续室温搅拌反应3 h。待反应结束后,向最终反应液中加入冰乙醚(80 mL),析出黄色沉淀。在冷冻条件下高速离心并收集沉淀产物。用高效液相色谱分离纯化粗产物,得到黄色固体产物789 mg (收率:77%)。
1.3.3 产物表征 核磁共振氢谱(1H-NMR)表征:共振频率为500 MHz,D2O重水作为溶剂,TMT作为内标物,室温进行扫描。质谱(ESI-MS)表征:采用电喷雾离子源(ESI)形式,选择正离子模式,扫描范围为从100~1 000m/z。
1.3.4 氰化物的检测 将合成的荧光探针分子C-GGH (1.0 μmol/L)溶解于水体系的HEPES缓冲溶液中(pH=10.0)中,加入等浓度的铜离子(1.0 μmol/L)混合得到C-GGH-Cu2+溶液。然后分别加入含不同浓度氰化物的溶液后均匀混合,测试络合物探针溶液的荧光光谱,以溶液在470 nm处的荧光发射值对氰根离子浓度作图。作为对照,食物样品中的氰化物含量参考GB/T 5009.48—2003、GB/T 5009.36—2003和GB/T 8538—2008中规定的检测方法进行检测并比较。
2 结果与分析
2.1 C-GGH荧光探针分子的合成与表征
C-GGH荧光探针分子的合成路线见图1。7-二乙胺基香豆素-3-羧酸上的羧基适合标准的多肽缩合反应,可与氨基酸或多肽的氨基缩合。但考虑到香豆素的位阻效应可能会影响到下一步反应的产率,本研究中先合成GGH三肽,再与7-二乙胺基香豆素-3-羧酸缩合。另一方面,为了避免缩合过程中出现GGH三肽分子内或自身分子间反应的情况,合成过程中先将7-二乙胺基香豆素-3-羧酸活化,再采取将GGH溶液缓慢滴入到活化反应液中的方式,整个滴加过程控制在2.5~3.0 h。
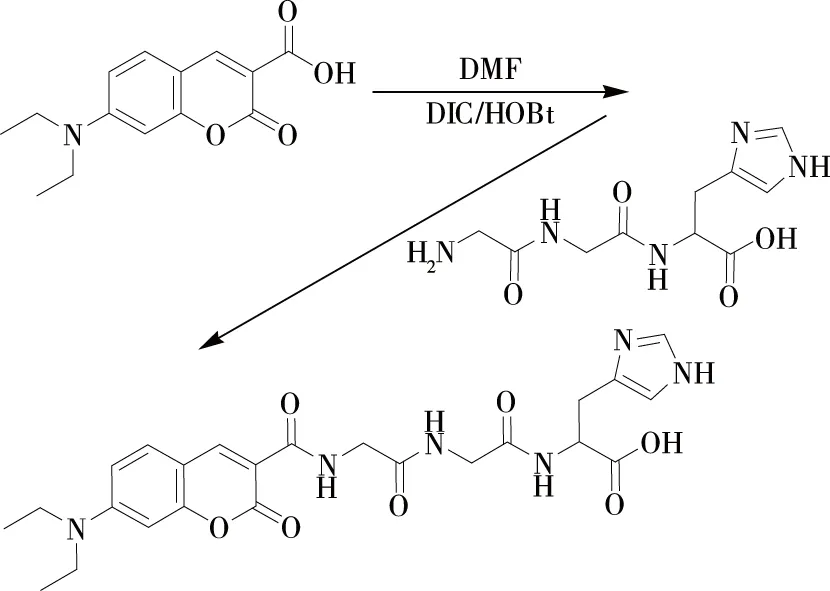
图1 C-GGH 合成路线
液相法合成以后,向反应液中加入冰乙醚析出固体,再用高效液相分离提纯,得到纯度90%以上的C-GGH。然后通过质谱对探针分子进行表征,(HRMS:m/z, calcd for [M+H]+513.209 2; found 513.208 9),表征结果与理论值吻合。进一步的核磁表征也对合成产物进行了证实(见图2),1H NMR (400 Hz, D2O):δ8.49 (dd,J=20.3, 3.2 Hz, 1H), 7.89 (s, 1H), 7.22~7.12 (m, 1H), 6.93 (d,J=8.9 Hz, 1H), 6.36 (d,J=8.1 Hz, 1H), 6.00 (s, 1H), 4.66~4.61 (m, 2H), 3.94 (s, 2H), 3.78 (d,J=34.7 Hz, 2H), 3.28~3.02 (m, 6H), 0.95 (t,J=6.6 Hz, 6H)。质谱和核磁的表征结果说明,通过以上所述合成路线及合成方法顺利得到了C-GGH探针分子。
2.2 C-GGH-Cu2+在氰化物作用下的荧光变化
将C-GGH (1.0 μmol/L)溶解于水体系的HEPES缓冲溶液中,加入不同浓度的Cu2+(硫酸铜形式)后测试荧光光谱,发现当Cu2+浓度达到等物质的量时,C-GGH荧光基本猝灭。因此研究中选择将1.0 μmol/L的C-GGH加入等浓度的Cu2+混合得到C-GGH-Cu2+探针溶液。然后分别加入不同浓度的氰根离子后均匀混合,测试络合物探针溶液的荧光光谱,结果如图3所示,随着不同浓度氰根离子的加入,络合物探针溶液的荧光逐渐恢复,当氰根离子的浓度达到探针分子浓度30倍时,荧光强度恢复到最大值。以溶液在470 nm处的荧光发射值对氰根离子浓度作图见图4,发现氰根离子浓度在0.15~15.00 μmol/L时,两者之间呈现良好的线性关系。检测限为0.015 μmol/L。根据GB 2757—2012、GB 2715—2005和GB 8537—2008规定,氰化物在蒸馏酒与配制酒中的限量值为8.0 mg/L(以HCN计,折算酒精度为100%),粮食中氰化物限量值为0.015 mg/kg,自来水中限量值为0.05 mg/L,矿泉水中限量值为0.01 mg/L,以限量值要求最高的矿泉水计算,矿泉水中氰化物的限量值折算为摩尔浓度后为0.385 μmol/L,远远高于检测限,说明该荧光探针分子的灵敏度足以满足食品中氰化物的检测。
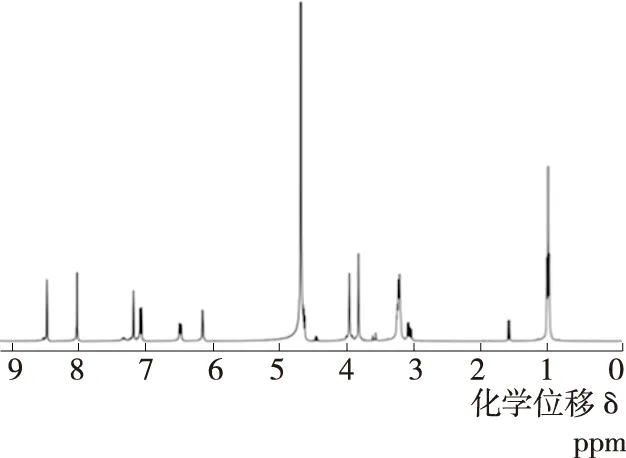
图2 C-GGH 核磁表征结果

图3 1 μmol/L的C-GGH-Cu2+在不同浓度氰化物作用下的荧光变化
Figure 3 Fluorescence titration of C-GGH-Cu2+(1.0 μmol/L) with CN-(0, 0.2, 0.5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, and 30 μmol/L)
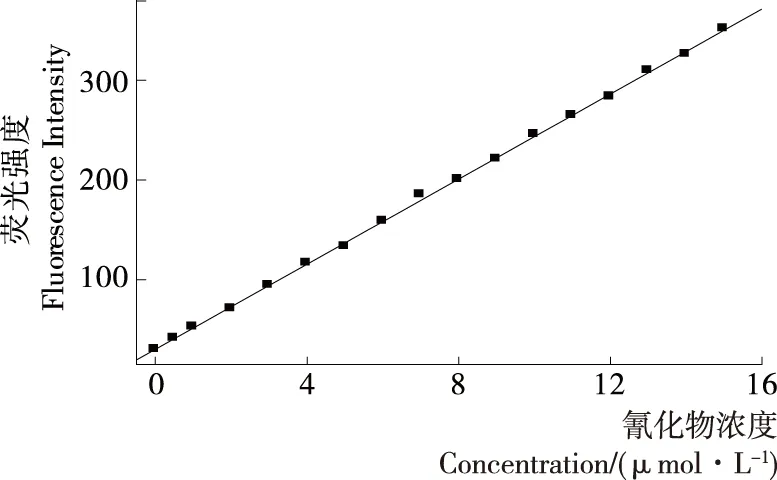
图4 C-GGH-Cu2+对氰化物检测的标准曲线
Figure 4 Dose-dependent luminescence response of C-GGH-Cu2+(1.0 μmol/L) to CN-
2.3 C-GGH-Cu2+对氰根离子的选择性
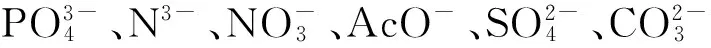

图5 C-GGH-Cu2+对不同阴离子的响应图Figure 5 Fluorescence changes of C-GGH-Cu2+ (1.0 μmol/L) upon the addition of various anions
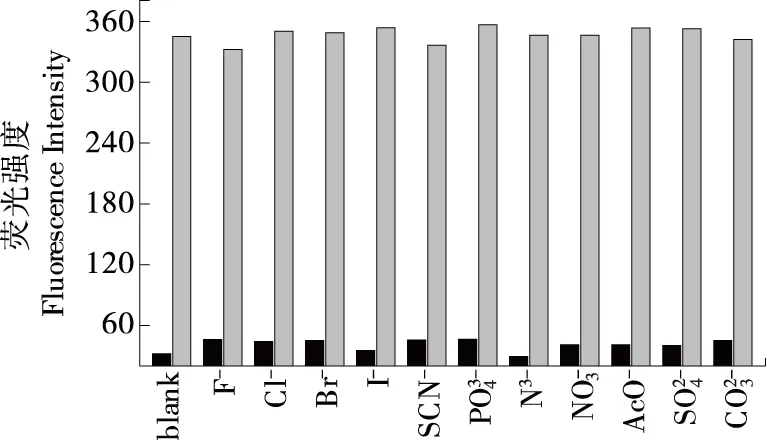
图6 不同阴离子的竞争检测结果图
Figure 6 Fluorescence responses of C-GGH-Cu2+at 478 nm in the presence of diferent anions (15.0 μmol/L) (black bars), followed by addition of CN-(15.0 μmol/L) (gray bars)
2.4 C-GGH-Cu2+对实际样品的检测
以上研究证明C-GGH-Cu2+探针对氰化物的检测具有很高的灵敏度和选择性,但食物样品成分复杂,因此,本研究选取了酒、面粉、水等较易出现氰化物含量超标的食物样品作为代表,将该荧光探针法与国标(GB/T 5009.48—2003、GB/T 5009.36—2003、GB/T 8538—2008)检测方法进行对比研究,以确定该方法的准确度。由表1可知,本研究的荧光探针方法与以上国际方法相比,在对配制酒中氰化物检测上,误差率为2%~3%,对白酒的误差率更低,仅为1.11%,可能因为白酒的成分相对配制酒更简单,另外配制酒一般都带颜色,对检测结果也会稍有影响。面粉、自来水、矿泉水的误差率相对稍微高点,分别为6.45%,4.81%,8.33%,原因主要为该类食品中氰化物的含量非常低,但即使有略高的误差值,其结果也完全不会影响到对食品中氰化物含量的判定。因此,从表1中的对比研究数据可以确定,本研究中的荧光探针方法能准确检测食品中氰化物的含量,其准确度与国标(GB/T 5009.48—2003、GB/T 5009.36—2003、GB/T 8538—2008)检测方法一致。
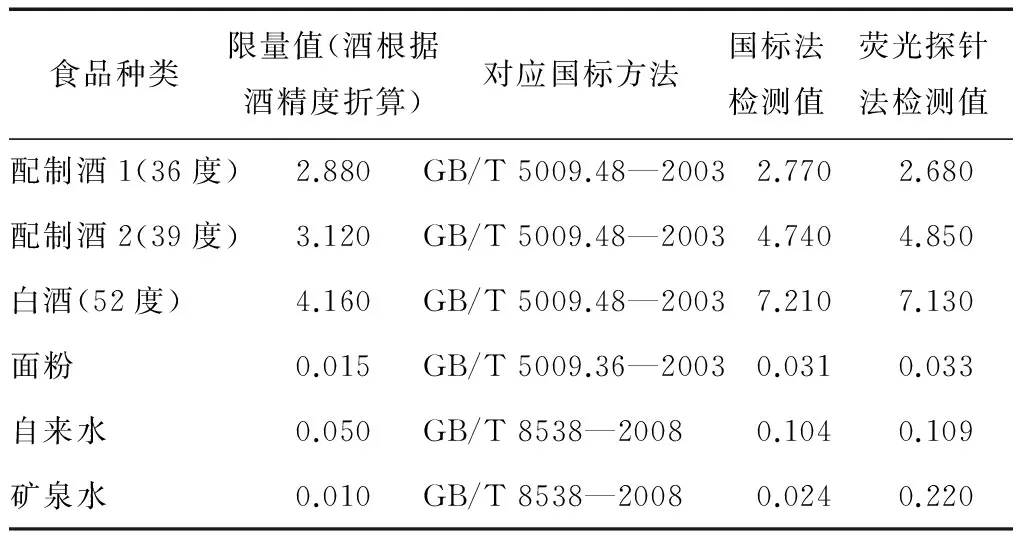
表1 荧光探针对实际样品的检测
3 结论
本研究以甘氨酸、组氨酸、7-二乙胺基香豆素-3-羧酸为原料,采用标准多肽合成法成功合成了水溶性好的荧光探针分子C-GGH,该探针分子与等物质量的Cu2+作用形成C-GGH-Cu2+,荧光猝灭,新形成的C-GGH-Cu2+络合物随着氰化物的加入荧光又逐渐恢复。研究结果发现C-GGH-Cu2+对氰化物表现出了高灵敏度和高选择性,经对实际食物样品中氰化物进行检测,证明该方法的准确度与国标(GB/T 5009.48—2003、GB/T 5009.36—2003、GB/T 8538—2008)检测方法一致。该法与现有常用的食品中氰化物检测方法相比,具有简单、快捷、低毒性等优势,因此,该方法在食品中氰化物的快速检测方面具有较大的潜在应用价值。
[1] 邸玉敏, 朱军, 常靖, 等. 氰化物检测方法研究进展[J]. 理化检验: 化学分册, 2011, 47(12): 1 491-1 494.
[2] 黄光照, 汪德文, 马丽霞. 法医毒理学[M]. 北京: 人民卫生出版社, 2004: 17, 48.
[3] 邓绍平, 邝嘉萍, 钟伟祥, 等. 香港食用植物中氰化物含量及加工过程对其含量的影响[J]. 中国食品卫生杂志, 2008, 20(5): 428-430.
[4] 于高磊. 氰化物检测中的样品前处理方法分析[J]. 科学资讯, 2015, 19(17): 69-70.
[5] 詹为民, 沈兆欣, 鲍静. 氰化物检测中显色液溶剂的替代分析[J]. 环境工程, 2015(S1): 1-3.
[6] 骆胜超. 对氰化物检测中样品前处理方法的探讨[J]. 公共卫生与预防医学, 2006, 17(3): 138-139.
[7] 黄小焕, 陶晓薇, 余全忠, 等. 酱香型白酒中氰化物含量测定方法的改进[J]. 酿酒科技, 2015(8): 65-70.
[8] 叶梅, 吴文林, 郭靓, 等. 离子色谱-脉冲安培检测法快速测定配制酒中的氰化物[J]. 食品科学, 2016, 37(8): 192-195.[9] 吁继承. 用银明胶络合剂测定酒中氰化物[J]. 食品科学, 1989(1): 42-44.
[10] 周裕敏, 田衎, 张萍. 流动注射安培法测定水中总氰化物[J]. 理化检验: 化学分册, 2014, 50(10): 1 317-1 318.
[11] 杨俊, 陈亿展, 孟令兵, 等. 氰化物纸片快速测定食品中的氰化物[J]. 中国卫生检验杂志, 2012, 22(10): 2 325-2 327.
[12] GIURIATI C, CAVALLI S, GORNI A, et al. Ion chromatographic determination of sulfide and cyanide in real matrices by using pulsed amperometric detection on a silver electrode[J]. Journal of Chromatography A, 2014, 1 023(1): 105-112.
[13] 王书源, 李忠海, 付湘晋, 等. 高荧光CdTe量子点荧光探针测定Cu2+[J]. 食品与机械, 2015, 31(2): 125-129.
[14] 李玉美, 班睿, 谢兵, 等. 量子点在食品安全检测中的应用研究[J]. 江苏农业学报, 2015, 31(1): 222-230.
[15] 李萌立, 李忠海, 李节, 等. 量子点荧光探针技术在食源性致病菌检测中的应用[J]. 食品与机械, 2013, 29(5): 241-244.
[16] AL-SABHA T N, AL-KAREMY NM. The use of 7,7`,8,8`-tetracyanoquinodimethane for the spectrophotometric determin-ation of some primary amines application to real water samples[J]. Journal of Analytical Methods in Chemistry, 2013, 2 013(1): 1-8.
[17] LA Ming, HAO Yuan-qiang, WANG Zhao-yang, et al. Selective and sensitive detection of cyanide based on the displacement strategy using a water-soluble fluorescent probe[J]. Journal of Analytical Methods in Chemistry, 2016, 2016(1): 1-6.
[18] HAO Yuan-qiang, CHEN Wan-song, Wang Li-qiang. A retrievable, water-soluble and biocompatible fluorescent probe for recognition of Cu(II) and sulfide based on a peptide receptor[J]. Talanta, 2015, 143(23): 307-314.
[19] ZHOU Bin-bin, LI Chun-lan, LIU You-nian, et al. Ferrocene tripeptide Gly-Pro-Arg conjugates: synthesis and inhibitory effects on alzheimer’s Aβ1-42 fibrillogenesis and Aβ-induced cytotoxicity in vitro[J]. Bioorganic & Medicinal Chemistry, 2013, 21 (11): 395-402.
[20] GEE H-C, LEE C-H, JEONGY-H, et al. Highly sensitive and selective cyanide detection via Cu2+complex ligand exchange[J]. Chem. Commun., 2011, 47(43): 11 963-11 965.
[21] JUNG H S, HAN J H, KIMZ H, et al. Coumarin-Cu(II) ensemble-based cyanide sensing chemodosimeter[J]. Org. Lett. , 2011, 13 (19): 5 056-5 059.
Devise and synthesis of fluorescent probe for cyanide detection in food based on a peptide receptor
ZHOUBin-bin1WANGXia-li1WANGFang-bin1ZHANGJi-hong1YANGTao1CHENGYun-hui2HAOYuan-qiang3
(1.HunanInstituteofFoodQualitySupervisionInspectionandResearch,Changsha,Hunan410117,China; 2.SchoolofChemistryandBiologicalEngineering,ChangshaUniversityofScienceandTechnology,Changsha,Hunan410114,China; 3.CollegeofChemistryandChemicalEngineering,ShangqiuNormalUniversity,Shangqiu,Henan476000,China)
food; cyanide; peptide; fluorescent probe; detection
国家自然科学基金项目(编号:U1404215,31171627,31071523);湖南省食品药品监督管理局食品药品安全科技项目(编号:湘食药科R201516)
周彬彬,男,湖南省食品质量监督检验研究院工程师,博士。
程云辉(1964-),女,长沙理工大学教授,博士。
E-mail: chengyh6488@sina.com
2016—08—31
10.13652/j.issn.1003-5788.2016.10.010
