从日本进境邮寄物中截获伤残短体线虫
2016-12-05闫世艳高文娜李倞平张继军
闫世艳, 陈 艳, 边 勇, 高文娜, 简 恒, 李倞平, 张继军
1北京农学院,北京102206;2中国农业大学,北京100193;3北京出入境检验检疫局,北京100026
从日本进境邮寄物中截获伤残短体线虫
闫世艳1,2, 陈 艳1*, 边 勇3*, 高文娜3, 简 恒2, 李倞平3, 张继军3
1北京农学院,北京102206;2中国农业大学,北京100193;3北京出入境检验检疫局,北京100026
【背景】2015年北京出入境检验检疫技术中心植物实验室从日本邮寄进境的鸡爪槭中检出一种短体线虫。【方法】通过采用形态学鉴定、rDNA序列测定及系统进化分析,对该线虫进行鉴定。【结果】将该线虫的形态特征和测计值与已知种群比较,与Pratylenchusvulnus最为接近;系统进化分析表明,其rDNA-ITS区序列特征与P.vulnus序列相似度为99%;系统发育树表明,其与P.vulnus聚为一组,证实该线虫为伤残短体线虫P.vulnus。【结论与意义】伤残短体线虫是一种重要的植物寄生线虫,我国进出境检疫部门曾多次从入境货物中检出该线虫,但从入境邮寄物中检中尚属首次。
邮寄物检疫; 伤残短体线虫; 鸡爪槭; rDNA-ITS; 系统发育; 鉴定
短体属Pratylenchussp.线虫又称根腐线虫,是一种寄生于植物根部的内寄生线虫,已报导的该属线虫有近百种,多数能寄生多种植物,可造成作物根系大面积腐烂和坏死(Castillo & Vovlas,2007)。近年来,我国口岸曾多次从进境观赏植物中截获咖啡短体线虫P.coffeae、穿刺短体线虫P.penetrans、朱顶红短体线虫P.hippeastri等(刘筱嘉等,2013; 马以桂等,2003; 叶为民等,1998),可见短体线虫传入我国的风险很高。随着网上购物、网上交易等新型贸易方式的发展,越来越多的商品通过邮件以及快递的形式进入我国,国际邮件已逐渐成为外来有害生物和外来物种传入的重要渠道。1966年,南京动植物检疫局首次从荷兰邮寄进境的郁金香种球中检出检疫性有害生物——鳞球茎茎线虫Ditylenchusdipsaci(kühn) Filijev(万晓泳等,2012)。近几年不断有新的检疫性有害生物从邮寄进境的植物中被检出,其中包括大量检疫性线虫,由于其个体微小,不易被发现,因此具有较高的检疫风险。
近日,北京出入境检验检疫局对日本邮寄进境的鸡爪槭AcerpalmatumThunb.盆栽样品进行检疫时,分离到一种短体属线虫。该虫数量较多,通过显微镜观察、形态测量、rDNA-ITS区序列扩增、测序比对分析,鉴定为伤残短体线虫P.vulnus,这是我国首次从入境邮寄物中截获该线虫。
1 材料与方法
1.1 样品来源
鸡爪槭盆景系从日本邮寄入境时被截获,其根部带有介质。
1.2 线虫分离
采用贝曼漏斗法(谢辉,2000):取一个连接乳胶管的漏斗,下部用止水夹控制胶管关闭,漏斗内注入700 mL清水,用纱布将根部及介质包好后缓慢置于漏斗中,使水浸透,25 ℃左右静置24 h后,用凹面皿接取分离液10 mL,体视显微镜镜检。
1.3 形态学鉴定
在洁净的载玻片上滴一滴无菌水,用挑针在体式显微镜下挑取形态大小大致相同的线虫置于载玻片上,在酒精灯火焰上来回移动加热几秒钟至线虫死亡,盖上盖玻片,用凡士林涂抹四周封片(刘维志,2004)。将载玻片置于光学显微镜下,对线虫的整体形态及内部构造仔细观察,同时测量及拍照,最后随机选取5条线虫使用Deman公式进行形态测试(Reddy,1983)
1.4 线虫的分子鉴定
1.4.1 单条线虫DNA的提取 参照王金成等(2012)和王江岭等(2011)的方法并适当改进,取洁净的载玻片,滴一滴无菌水,将线虫挑入无菌水中漂洗3次后挑入内置5 μL 10×PCR-buffer的200 μL PCR管中,加入10 μL ddH2O,置于离心机离心120 s后,于-80 ℃冰箱中存放30 min,取出后用液氮冷冻PCR管底1 min,重复冻融过程2~3次,然后迅速转移到85 ℃水浴锅中加热2 min,使细胞充分裂解,向管中加入1 μL的蛋白酶 K(1 mg·mL-1),置于PCR仪中56 ℃温浴30 min以降解脱氧核糖,95 ℃加热10 min,使蛋白酶K失活,最后将PCR管置于离心机12000 r·min-1离心120 s, 离心后取上清液用于PCR扩增。
1.4.2 PCR扩增 采用引物对上游ITS1:5′-TTGATTACGTCCCTGCCCTTT-3′和下游ITS2:5′-GCTGCGTTCTTCATCGAT-3′(王扬等,2007)进行扩增。
PCR的反应体系50 μL,包括10×PCR-buffer5 μL,5 U·μL-1TaqDNA 0.25 μL,10 mmol·L-1dNTP 1μL,10 μmol·L-1上下游引物各3 μL,线虫粗提取液5 μL,加入纯水定容至50 μL。PCR反应程序参照Maafietal. (2003)的方法,94 ℃预变性4 min,94 ℃ 40 s,52 ℃ 1 min,72 ℃ 1.5 min,36个循环,最后72 ℃保温8 min,使反应物充分延伸。
1.4.3 PCR产物的检测、测序及序列分析 取5 μL PCR产物于1.5%的琼脂糖凝胶电泳20 min,采用凝胶成像系统成像,观察电泳结果,拍照并记录,如条带清晰明显即送至北京天一辉远公司测序。将测序结果做BLAST相似性比对,从比对结果中选取同源性较高的13种短体属线虫的rDNA-ITS区序列进行系统发育分析, 选取美洲剑线虫XiphinemaamericanumCobb的部分ITS序列作为外群(outgroup)对照。通过软件MEGA 4.0对所测序列以及下载的短体线虫ITS序列进行比对分析,选用临接法(neighbor-joining)距离模型构建系统发育树并做自展检验(bootstrap)以获得分支的支持率,自展检验重复抽样次数1000次(陈晓玲等,2009)。
2 结果与分析
2.1 形态学鉴定
在显微镜下观察鸡爪槭中分离出的线虫形态(图1),雌虫虫体细长,唇区有3条环纹,口针发达,长15~18 μm;基球宽圆形,中食道球卵形,较窄,排泄孔位于食道与肠交界处相对的位置;食道腺从腹面以一长叶状覆盖肠的前端,侧区具4条侧线。V值80%~82%, 尾锥形,尾尖亚锐尖。见少量雄虫。
2.2 形态测计值
从日本进境邮寄鸡爪槭中分离的短体线虫,形态特征和测计值与Doucet & Lax (1997)和Loofetal. (1985)的描述最为接近(表1)。故初步将其定为伤残短体线虫。
2.3 rDNA-ITS区序列特征
经过PCR扩增、测序(魏亚东等,2013),通过比对,除去18S和28S,得到大小为800 bp的2条序列,将序列与NCBI数据库中的序列比对后发现,这2条线虫的ITS序列与编号为FR692321.1、LC030340.1、FR692320.1、JQ003990.1的P.vulnus序列相似度为99%。系统发育树也可看出,该线虫与P.vulnus聚为一组(图2),与其他线虫差异明显。综合上述形态学及所分子水平的分析结果,将截获的短体线虫鉴定为伤残短体线虫。
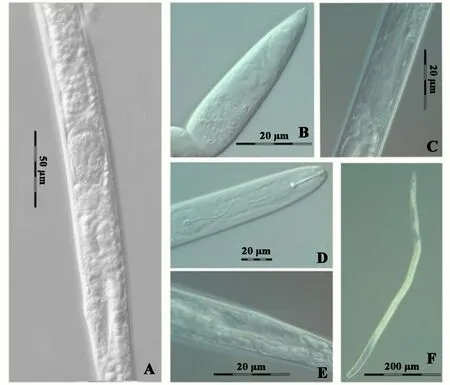
图1 鸡爪槭上截获的短体线虫雌虫显微照片

样本Sample数量NumberL(mm)abb'cc'VSt(μm)本试验Thisresearch50.66~0.7031.2~38.35.8~6.44.3~5.117.3~20.42.3~2.680~8215~18已报道种群ⅠReportedpopulationⅠ①800.43~0.6124.9~37.34.7~7.03.2~5.216.2~25.12.0~3.077~8414~16已报道种群ⅡReportedpopulationⅡ②140.47~0.7227.8~37.65.7~7.7-18.4~24.7-77~8213~19
①参见Doucet & Lax (1997);②参见Loofetal. (1985);L=体长;a=体长/最大体宽;b=体长/体前端至食道与肠连接处的距离;b′=体前端至食道腺末端的距离;c=体长/尾长;c′=体长/肛门处体宽;V=体前端至阴门的距离×100/体长; St=口针。
①refer to Doucet & Lax (1997);②refer to Loofetal. (1985); L=Body length; a=Body length/maximum body width; b= Body length/the distance from body front to esophagus and intestines junction; b′=The distance of body front to the end of the esophagus gland; c= Body length/tail length; c′= Body length/anus body width; V=The distance of body front to vulva×100/body length. St=Stylet.
3 讨论
由于短体线虫形态差异大,且一种样品中可能存在多种短体线虫,因此鉴定时必须选取大量样本(顾建锋等,2013)。随着分子技术的发展,以核糖体ITS、18S rRNA、28S rRNA-D2D3区序列作为分子标记在短体线虫的鉴定中起到了重要的作用,分类鉴定也从形态学鉴定发展为形态学和分子生物技术相结合(王金成等,2012)。本研究通过形态特征及测量值初步将截获的线虫鉴定为伤残短体线虫,为确保准确性,通过构建系统发育树进一步确认。
伤残短体线虫目前主要分布在美国、欧洲、澳大利亚、古巴、埃及等地,在我国云南省曾有报道。该线虫寄主范围广泛、易迁移,且世代短、繁殖快,对植物危害严重,在田间可引起病株地上部叶片发黄、植株矮小,受害严重时造成死苗、缺苗、断垄等现象。伤残短体线虫曾为我国三类检疫性有害生物(中华人民共和国农业部,1993),2007年我国发布《中华人民共和国进境植物检疫性有害生物名录》,将全部短体线虫非中国种列为检疫对象(刘刚,2007)。由于该线虫在我国一些地区已有分布,按照名录规定,已不属于我国对外检疫性有害生物,但鉴于伤残短体线虫的危害性,目前仍属我国官方管制的非检疫性有害生物(RNQP)。
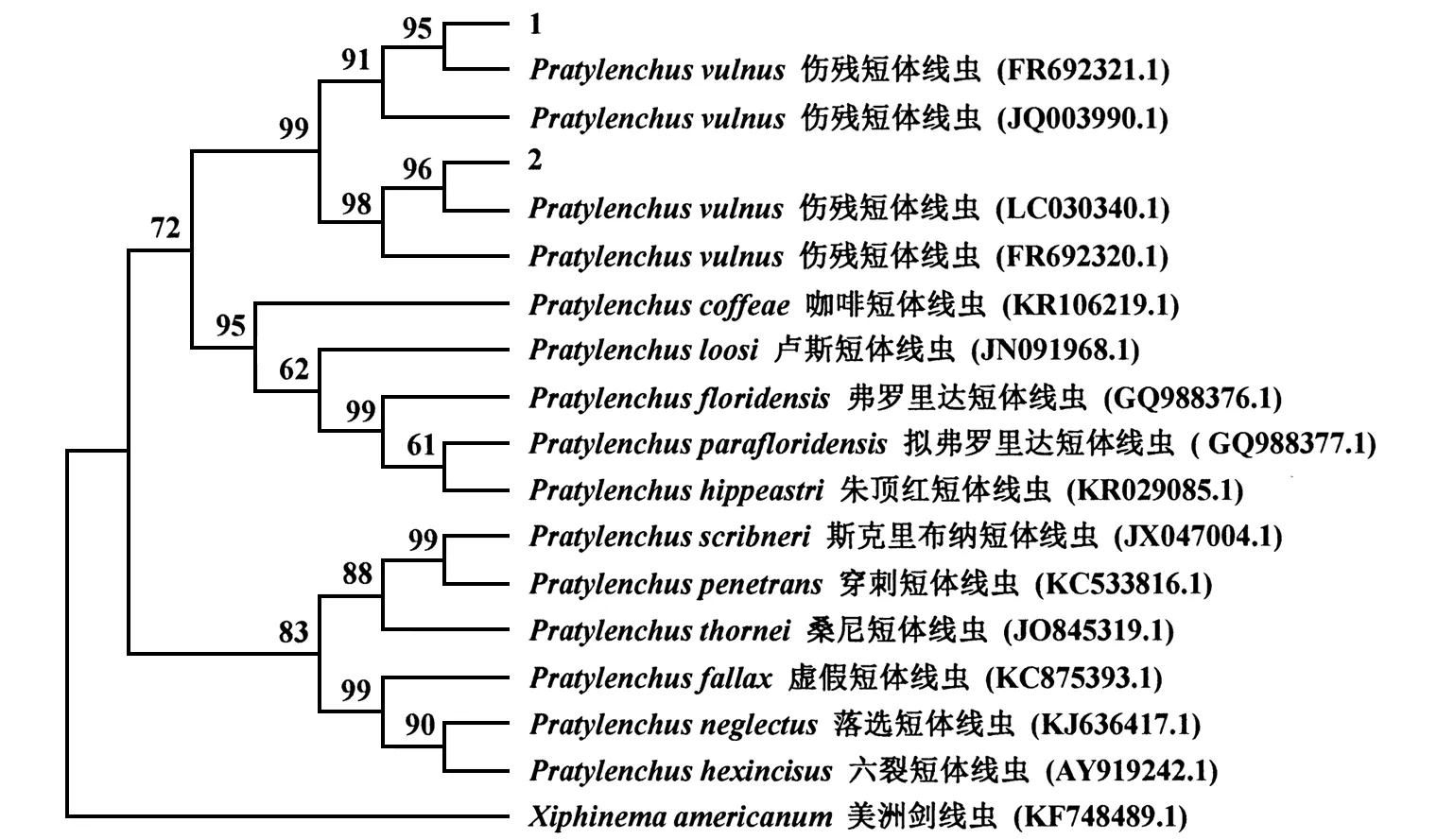
图2 基于rDNA ITS 区序列的临接法(NJ)构建系统发育树
本研究通过形态学与分子生物学相结合的方法弥补了伤残短体线虫传统形态鉴定的不足,为其他种类线虫的单条分子鉴定提供了参考,对线虫的检疫鉴定工作具有重要意义。
陈晓玲, 陈永红, 张洪玲, 武目涛, 钟国强, 方羽生, 2009. 咖啡短体线虫分子鉴定. 植物检疫, 23(2): 7-9.
顾建锋, 王江岭, 何洁, 陈先锋, 2013. 4种常见短体线虫形态特征比较鉴别. 植物检疫, 27(6): 69-71.
刘刚, 2007. 《中华人民共和国进境植物检疫性有害生物名录》发布. 农药市场信息 (13): 38-39.
刘维志, 2004. 植物线虫志. 北京: 中国农业出版社.
刘筱嘉, 陈吴建, 武扬, 2013. 我国首次截获朱顶红短体线虫. (2013-03-22)[2016-02-17]. http:∥www.aqsiq.gov.cn/zjxw/dfzjxw/dfftpxw/201303/t20130322_348217.htm.
马以桂, 刘 鹏, 崔铁军, 2003. 天津口岸在日本牡丹苗中截获穿刺短体线虫. 植物检疫, 17(4): 197.
万晓泳, 王允荣, 李晓庆, 柯俊凡, 2012. 浅谈邮包中的植物产品检疫. 商场现代化 (31): 43.王金成, 魏亚东, 顾建锋, 张瑞丰, 黄国明, 王暄, 李红梅, 孙建华, 2012. 基于核糖体ITS区和28S rRNA D2~D3区的短体线虫系统发育研究. 动物分类学报, 37(4): 687-693.
王江岭, 张建成, 顾建锋, 2011. 单条线虫DNA提取方法. 植物检疫, 25(2): 32-35.王扬, 李娅琼, 浦卫琼, 胡先奇, 喻盛甫, 2007. 云南省柑桔根际短体线虫种类的鉴定. 华中农业大学学报, 26(6): 775-779.魏亚东, 容万韬, 赵立荣, 王金成, 黄国明, 郭京泽, 孙建华, 2013. 五种短体线虫DNA 条形码鉴定方法. 华北农学报, 28(6): 136-139.
谢辉, 2000. 植物线虫分类学. 合肥: 安徽科学技术出版社.叶为民, 陈雪娇, 李一农, 李建生, 邹子兴, 1998. 从进口天堂小鸟种苗中截获咖啡短体线虫. 中国进出境动植检 (3): 20.
中华人民共和国农业部, 1993. 中华人民共和国农业部颁布的《危险性病、虫、杂草名录》和《禁止进境物名录》. 植物检疫, 1: 1-5.
Castillo P and Vovlas N, 2007.Pratylenchus(NematodaPratylenchidae):Diagnosis,Biology,PathogenicityandManagement(NematologyMonographsandPerspectives). Leiden, The Netherlands: Brill Academic Publisers.Doucet M E and Lax P, 1997. Caracterizacioon de una población y un aisladodePratylenchusvulnusAllen et Jensen, 1951 (Nematoda: Tylenchida) provenientes de la Provincia de Córdoba. Argentina.NematologiaMediterranea, 25: 287-298.
Loof P A A, 1985.Pratylenchusscribneri∥Muller R, Gooch P S, Siddiqi M R and Hunt D J.CIHDescriptionsofPlantParasiticNematodes. St Albans, UK: Commonwealth Agricultural Bureaux, 8: 4.
Maafi Z T, Subbotin S A and Moens M, 2003. Molecular identification of cyst-forming nematodes (Heteroderidae) from Iran and a phylogeny based on ITS-rDNA sequences.Nematology, 5(1): 99-111.
Reddy P P, 1983.PlantNematology. New Delhi: Pratibha Printing Press.
(责任编辑:郭莹)
Root-lesion nematode,Pratylenchusvulnus, on imported mails from Japan
Shi-yan YAN1,2, Yan CHEN1*, Yong BIAN3*, Wen-na GAO3,Heng JIAN2, Jing-ping LI3, Ji-jun ZHANG3
1BeijingUniversityofAgriculture,Beijing102206,China;2ChinaAgricultureUniversity,Beijing100193,China;3BeijingEntry-ExitInspectionandQuarantineBureau,Beijing100226,China
【Background】 In 2015,onePratylenchuspopulation was collected in the roots and growing media ofAcerpalmatumimported from Japan by plant quarantine lab of Beijing entry-exit inspection and quarantine bureau, China. 【Method】 In the study the population was identified by morphological measurements, rDNA sequence and phylogenetic analysis. 【Result】 Comparing the morphological characteristics and measurements with known species, the nematode is phylogenetically close toPratylenchusvulnus, accroding to the sequence of rDNA-ITS region with 99%. The results confirmed that this population wasP.vulnus. 【Conclusion and significance】P.vulnusis an important plant parasitic nematodes that has been intercepted from the entry of goods many times by our entry-exit inspection and quarantine departments, but it is the first time in the mail quarantine.
mail quarantine;Pratylenchusvulnus;Acerpalmatum; rDNA-ITS; phylogenetic analysis; identification
2016-03-01 接受日期(Accepted): 2016-05-06
北京市教委2015年度科研计划项目(KM201510020004); 国家质检总局科技计划项目(2015IK023)
闫世艳, 女, 硕士研究生。 研究方向: 植物病理学。 E-mail: 1636824522@qq.com
*通讯作者(Author for correspondence), 陈艳, E-mail: cheny@bua.edu.cn; 边勇, E-mail: biany@bjciq.gov.cn
10. 3969/j.issn.2095-1787.2016.04.010
