白花丹参水提物对糖尿病大鼠心肌损伤的影响及机制
2016-12-05宋晓黄东辉郭征东李菁唐先格
宋晓,黄东辉,郭征东,李菁,唐先格
(泰山医学院附属医院,山东泰安271000)
白花丹参水提物对糖尿病大鼠心肌损伤的影响及机制
宋晓,黄东辉,郭征东,李菁,唐先格
(泰山医学院附属医院,山东泰安271000)
目的 观察白花丹参水提物对糖尿病大鼠心肌损伤的治疗作用,探讨其作用机制。方法 选取健康雄性Wistar大鼠72只,随机选出12只作为空白对照组;余60只以高糖、高脂饮食喂养并尾静脉注射链脲佐菌素建立糖尿病模型。选取48只造模成功的大鼠随机均分为四组,分别为白花丹参低剂量组,灌胃给予白花丹参15 g/(kg·d);白花丹参高剂量组,灌胃给予白花丹参30 g/(kg·d);吡格列酮组灌胃给予吡格列酮 10 mg/(kg·d);模型组灌胃给予等量生理盐水;均连续给药4周。各组于末次给药后禁食12 h,检测空腹血糖(FPG),采用ELISA试剂盒检测瘦素(Leptin)、脂联素(APN)、TNF-α、IL-6;处死大鼠取心肌组织进行HE染色,显微镜下观察心肌组织病理变化。结果 模型组FPG及血清Leptin、TNF-α、IL-6水平均高于其他各组,血清APN水平均低于其他各组;白花丹参低剂量组及高剂量组FPG均高于吡格列酮组;白花丹参高剂量组血清APN水平高于吡格列酮组和低剂量组,血清Leptin、TNF-α、IL-6水平均低于吡格列酮组和低剂量组;各指标组间比较P均<0.01。模型组心肌细胞排列迂曲紊乱,细胞坏死及炎细胞浸润,细胞间成纤维细胞及胶原纤维增生;与模型组比较,吡格列酮组、白花丹参低剂量组心肌细胞排列相对整齐,局部可见心肌纤维互相融合;白花丹参高剂量组心肌细胞排列整齐,偶见细胞坏死及少量炎细胞浸润。结论 白花丹参水提物对糖尿病大鼠心肌损伤有治疗作用;抑制体内炎症反应可能是其作用机制。
糖尿病;白花丹参;瘦素;脂联素;肿瘤坏死因子α;白细胞介素6
糖尿病是一种慢性代谢紊乱性疾病,心肌损伤是其常见并发症。其发生机制主要为氧化应激、脂肪炎症因子增多、糖基化终末产物形成等。白花丹参是丹参的变种,主产于泰山,具有很强的抗脂质过氧化、清除自由基、调节血脂和血糖等作用[1],目前已经用于防治冠心病、脑血管病和外周血管病等,但其对糖尿病心肌损伤影响的报道较少。2014年10月~2015年3月,本研究观察了白花丹参水提物对糖尿病大鼠心肌损伤的影响,现分析结果并探讨其作用机制。
1 材料与方法
1.1 材料 健康雄性Wistar大鼠(20141112号)72只,体质量200~220 g,购自山东鲁抗公司实验动物中心。白花丹参,产自莱芜苗山白花丹参种植基地。白花丹参水溶性提取物:称取白花丹参根适量,切片后加蒸馏水浸泡2 h,加热煮沸,开始用强火,沸腾后改用文火,保持微沸30 min,搅拌,趁热过滤,留取滤液;药渣再加蒸馏水同法煮沸30 min,过滤,留取滤液;合并滤液,经旋转蒸发仪浓缩,加蒸馏水稀释至所需浓度,灌封,4 ℃冰箱保存备用。链脲佐菌素(STZ),购自北京博爱科贸有限责任公司,用0.1 mol/L(pH 4.5)枸橼酸钠缓冲液稀释,浓度为10 g/L,随用随配。吡格列酮,购自成都宇洋高科技发展有限责任公司。瘦素(Leptin)、脂联素(APN)、TNF-α、IL- 6检测试剂盒(ELISA法)均购自北方生物技术研究所。
1.2 模型制作及处理 72只大鼠均适应性喂养7天,禁食12 h,自由饮水。随机选出12只作为空白对照组,标准饲料喂养。余60只制备糖尿病模型:高脂饲料(2.5%胆固醇、10%猪油、20%蔗糖、1%胆酸盐、66.5%常规饲料)喂养1个月;一次性尾静脉注射STZ 10 g/L(35 mg/kg)作用72 h;尾尖取血,检测血糖。将血糖≥16.7 mmol/L大鼠确定为糖尿病模型成功[2]。共造模成功55只,选取48只随机均分为模型组、白花丹参低剂量组、白花丹参高剂量组、吡格列酮组,其余备用。白花丹参低剂量组及高剂量组分别灌胃给予白花丹参15、30 g/(kg·d),吡格列酮组灌胃给予吡格列酮 10 mg/(kg·d),模型组灌胃给予等量生理盐水,均连续给药4周。1.3 相关指标观察 各组于实验的第4周末在末次给药后禁食12 h,断尾采血,检测空腹血糖(FPG);留取血液样本5 mL,室温下静置30 min,3 000 r/min离心15 min,取血清,采用ELISA试剂盒检测Leptin、APN、TNF-α、IL-6。处死大鼠,取心肌组织,常规切片,行HE染色,显微镜下观察心肌组织病理变化。

2 结果
2.1 各组FPG及血清Leptin、APN、TNF-α、IL-6水平比较 给药第4周末,模型组FPG及血清Leptin、TNF-α、IL-6水平均高于其他各组,血清APN水平均低于其他各组;白花丹参低剂量组及高剂量组FPG均高于吡格列酮组;白花丹参高剂量组血清APN水平高于吡格列酮组和低剂量组,血清Leptin、TNF-α、IL-6水平均低于吡格列酮组和低剂量组,各指标组间比较P均<0.01。见表1。
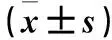
表1 各组血清FPG、leptin、APN、TNF-α、IL-6水平比较
注:与模型组比较,*P<0.01;与吡格列酮组比较,△P<0.01;与白花丹参低剂量组相比,#P<0.01。
2.2 各组心肌组织病理学变化 空白对照组心肌结构清晰,肌纤维无断裂,心肌细胞排列整齐。模型组心肌细胞边界模糊,排列迂曲紊乱,细胞核浓缩、深染、呈不规则状;心肌细胞间成纤维细胞及胶原纤维增生,间隙增宽,存在不同程度的细胞坏死及炎细胞浸润。与模型组比较,吡格列酮组、白花丹参低剂量组心肌细胞排列相对整齐,局部可见心肌纤维互相融合,可见嗜酸性变的心肌纤维呈多灶性分布,间隙略增宽;白花丹参高剂量组心肌细胞排列整齐,间隙略增宽,偶见细胞坏死及少量炎细胞浸润。
3 讨论
近年研究发现,炎症反应参与了糖尿病的发生。2型糖尿病(T2DM)患者体内高糖状态可诱导多种炎症相关因子水平明显升高,导致体内慢性炎症的长期存在,与胰岛素抵抗、内皮功能障碍、细胞凋亡、动脉粥样硬化等密切相关,参与糖尿病及其并发症如糖尿病心肌损伤的发生、发展[3,4]。
TNF-α是一种多效的炎症因子,主要由单核细胞、巨噬细胞和T细胞产生,急性期可通过诱导纤维化、诱导机体氧化应激反应、损伤肾脏上皮细胞和肾小球基底膜(GBM),进而促进糖尿病肾病的发生[5]。研究发现,TNF-α参与糖尿病心肌损伤的发生,其可与心肌细胞膜TNF-α受体结合形成信号转导复合物,激活丝裂原蛋白激酶,诱导细胞死亡[6];TNF-α亦可引起心肌间质胶原纤维堆积、胶原蛋白沉积、间质纤维化等[7]。IL-6主要由免疫活性细胞、脂肪细胞和肌肉细胞产生,可促进纤维蛋白原、纤溶酶原激活物抑制因子1(PAI-1)和CRP分泌,促进炎症反应和胰岛素抵抗的发生,被认为是T2DM发病的独立危险因素[8]。高糖状态促进IL-6分泌,进而刺激血管内皮因子释放,使平滑肌细胞过度增生,内皮通透性增强,血管受损,促进动脉硬化的发生、发展;IL-6亦可诱导成纤维细胞增殖,产生大量血小板源性生长因子,增加血管阻力,促进心肌损伤的发展。
APN是一种由脂肪细胞分泌的特异蛋白质,在脂肪组织中高表达,在血浆中其浓度亦相对较高,具有抗炎、抗动脉粥样硬化和增加胰岛素敏感性等作用。流行病学调查发现,血浆APN浓度降低是T2DM发生的独立危险因素[9],APN被认为是一种糖尿病的保护性因子[10]。糖尿病心肌病患者血清APN水平较正常组明显下降,且与糖基化终末产物(AGEs)水平呈负相关[11],提示APN参与了糖尿病心肌损伤的发生。Leptin是由脂肪细胞分泌的一种肽类激素。正常水平的Leptin具有抑制食欲、减少食物摄入、增加能量代谢等作用,亦可对抗心肌纤维化、抑制心脏左心室重构等[12]。有研究证明, T2DM患者由于Leptin抵抗,外周Leptin相对不足,导致脂质在心肌细胞沉积,损伤心肌细胞;高Leptin血症可使交感神经活性增强,加重心脏负荷和心肌细胞代谢紊乱,亦可通过上调交感神经活性,导致心脏负荷加重和脂肪氧化增加,促进糖尿病心肌病变的发生[13]。
丹参的有效成分主要为脂溶性的菲醌类衍生物和水溶性的酚酸类成分,其水溶性成分具有较好的降糖、调脂、改善血流变等作用。白花丹参主要含有酚酸类、黄酮类及多种微量元素,具有普通丹参的药理作用,其丹参酮ⅡA的含量是普通丹参的两倍,隐丹参酮、丹酚酸以及微量元素的含量比普通丹参高出数倍。目前,白花丹参已经广泛用于防治冠心病、脑血管病和外周血管病等;近年来采用传统工艺与现代技术相结合的方法精制成的白花丹参茶,可降低胆同醇、高血压,预防血栓及冠心病等。
本研究结果显示,空白对照组心肌结构正常;模型组在高血糖环境下,心肌结构损伤严重,吡格列酮组、白花丹参各治疗组心肌细胞损伤均轻于模型组,而以高剂量组最轻,说明白花丹参水提物、吡格列酮均可减轻高糖对心肌的损伤。模型组血清Leptin、TNF-α、IL-6水平均高于其他各组,血清APN水平均低于其他各组,说明脂肪炎症因子的紊乱是促进糖尿病心肌损伤的发生、发展的因素之一。白花丹参高剂量组血清APN水平高于吡格列酮组和低剂量组,血清Leptin、TNF-α、IL-6水平均低于吡格列酮组和低剂量组,吡格列酮组和低剂量组之间无明显差异,说明白花丹参水提物可有效抑制TNF-α、IL-6、Leptin分泌,促进APN分泌,减轻糖尿病大鼠的慢性炎症反应,进而抑制细胞凋亡、胶原纤维堆积、间质纤维化、平滑肌过度增生、心肌细胞脂质沉积等,延缓糖尿病心肌损伤发生、发展,且随剂量增加效果更加明显。
综上所述,白花丹参水提物可抑制糖尿病大鼠心肌损伤的发生,抑制体内炎症反应可能是其作用机制。
[1] 李大伟,夏青,夏作理.白花丹参对高脂血症大鼠血脂和血糖的调节作用[J].时珍国医国药,2007,4(18):794-795.
[2] 郭啸华,刘志红,李恒,等.高糖高脂饮食诱导的2型糖尿病大鼠模型及其肾病特点[J].中国糖尿病杂志,2002,10(5):290-294.
[3] Yudkin JS. Insulin resistance and the metabolic syndrome-or the pitfalls of epidemiology[J]. Diabetologia, 2007,50(8):1576-1586.
[4] Kajitani N, Shikata K, Nakamura A, et al. Microinflammation is a common risk factor for progression of nephropathy and atherosclerosis in Japanese patients with type2 diabetes[J]. Diabetes Res Clin Pract, 2010,88(2):171-176.
[5] Zhang B, Ramesh G, Norbury CC, et al. C13isplatin-induced nephrotoxicity is mediated by tumor necrosis factor-alpha produced by renal parenchymalcells[J]. Kidney Int, 2007,72(1):37-44.
[6] Grunenfelder J, Nminiati D, Murata S, et al. Up regulation of Bcl-2 through hyperbaric pressure transfection of TGF-β1: ameliorates is chemi-areperfusion injury in rat cardiac allo-Grafts[J]. J Heart Lung Transplant, 2004,21(2):244-250.
[7] Sun Y, Zhang J, Zhang JQ, et al. Local angiotensin Ⅱ and transforming growth factor-beta1 in renal fibrosis of rats[J]. Hypertension, 2004,35(5):1078-1084.
[8] Joachim S, Anja K, Matthias M, et al. Inflammatory cytokine and the risk to develop type 2 diabetes. Result of the prospective population based European prospective investigation into cancer and nutrition-otsdam study[J]. Diabetes, 2003,52(3):812.
[9] Gonon AT, Widegren U, Bulhak A, et al. Adiponectin protects againstmyocardial ischaemia-reperfusion injury via AMP-activated proteinkinase, Akt, and nitric oxide[J]. Cardiovasc Res, 2008,78(1):116-122.
[10] Tsai WC, Lin CC, Chen JY, et al. Association of adiponectin with procollagentype Ⅰ carboxyterminal propeptide in non-diabetic essential hypertension[J]. Blood Press, 2008,17(4):233-238.
[11] Li J, Su S, Zong X. Analysis of the association between adiponectin, adiponectin receptor 1 and diabetic cardiomyopathy[J]. Exp Ther Med, 2014,7(4):1023-1027.
[12] Lieb W, Sullivan LM, Araqam J, et al. Relation of serum leptin with cardiac mass and left atrial dimension in individuals >70 years of age[J]. Am J Cardiol, 2009,104(4):602-605.
[13] Bell DSH.Use of beta blockers in patients with diabete.Endocrinologist, 2003(13):116-123.
·作者·编者·读者·
携手《山东医药》 共创品牌形象
《山东医药》创刊于1957年,是山东省卫生厅主管的医学类学术期刊,国内外公开发行。本刊是中国学术期刊综合评价数据库来源期刊,是广大医务人员进行学术交流的主要阵地,在全国有较大影响。本刊注重理论与实践相结合,医药学术研究与医疗临床实践相结合,面向广大医疗单位及医药科研与生产单位。欢迎各级各类卫生单位和医疗器械、医用软件等生产单位与《山东医药》合作,宣传管理经验,树立品牌形象。
联系电话:0531-88957404
山东省高等学校科技计划项目(J12LL03)。
黄东辉(E-mail: ahuang1115@126.com)
10.3969/j.issn.1002-266X.2016.36.012
R587.1
A
1002-266X(2016)36-0040-03
2015-11-05)
