液相色谱-质谱法测定茜草中芦西丁含量
2016-12-05浦益琼丁越王冰张若曦张彤
浦益琼,丁越,王冰,张若曦,张彤
上海中医药大学,上海 201203
液相色谱-质谱法测定茜草中芦西丁含量
浦益琼,丁越,王冰,张若曦,张彤
上海中医药大学,上海 201203
目的运用液相色谱-质谱法测定茜草药材中芦西丁的含量。方法采用Agilent 1290HPLC-G6460三重四级杆质谱仪,在ESI-离子模式下选择离子监测,色谱分离采用Agilent Eclipse Plus C18RRHD色谱柱(2.1 mm×50 mm,1.8 µm),以0.1%甲酸-乙腈(70∶30)为流动相,柱温30 ℃,流速0.4 mL/min,进样量2 µL。结果芦西丁在0.005 2~2.64 ng范围内呈良好线性关系(r=0.999 9),80%、100%、120%浓度水平的加样回收率为94.80%~100.94%(平均97.17%,RSD=6.16%),方法重复性及精密度均良好。结论本研究建立的方法灵敏、准确,重复性好,适用于茜草中芦西丁的含量测定,可用于茜草药材中该成分的限度检查。
茜草;芦西丁;液相色谱-质谱联用
茜草为茜草科植物茜草Rubia cordifolia L.的干燥根及根茎,主产于我国东北、华北、西北和四川及西藏等地,春、秋二季采挖,除去泥沙,干燥。其性寒,味苦,归肝经,常用于吐血、衄血、崩漏、外伤出血、瘀阻经闭、关节痹痛、跌仆肿痛。茜草的主要成分为蒽醌及其苷类化合物,还含有萘醌类、萜类、己肽类、多糖类等其他化学成分,其药理作用主要包括止血、抗血小板聚集、升白细胞、镇咳祛痰、抗菌、抗癌等。据文献报道,茜草科Rubiaceae茜草属Rubia植物广泛分布于欧洲、亚洲、美洲和南美洲的热带及温带地区,全球约有70种,我国有其中的12种以上[1]。其中,除了被现行《中华人民共和国药典》收录的茜草Rubia cordifolia L.外,另一品种欧茜草R. tinctorum L.亦在我国可见[2],分布于新疆及喜马拉雅地区,在国内被称为新疆茜草,以根作为茜草收购使用。在现代医药应用中,欧茜草常被作为通便剂或一种温和的镇静剂,用于治疗肾结石和膀胱结石,以及月经不调或泌尿系统紊乱等症[3-7],是用于治疗肾结石的药物“消石素”(德国产)处方中的主药,但由于欧茜草中含有芦西丁,有较强的致基因突变、细胞转化及DNA结合作用,因此美国FDA已明确将其列为禁用药物。
目前,针对茜草中相关有害成分的研究报道较少,2015年版《中华人民共和国药典》一部“茜草”项下的含量测定中只规定了大叶茜草素和羟基茜草素的含量测定方法,未涉及其他物质的定量分析内容。本研究采用液相色谱-质谱法(LC-MS),以芦西丁作为指标成分,对茜草Rubia cordifolia L.进行测定,探索完善该药材的质量标准,提高用药安全性和有效性,提高茜草制剂的质量。
1 仪器与试药
Agilent 1290高效液相色谱仪,Agilent公司;G6460三重四级杆质谱仪,Agilent公司;Eclipse Plus C18RRHD色谱柱(2.1 mm×50 mm,1.8 µm),Agilent公司;SK5200H高频超声波清洗器,上海科导超声仪器有限公司;FA1004N电子天平,上海精宏科学仪器有限公司。
芦西丁对照品(纯度≥98%),德国Phytolab公司;色谱纯乙腈,Merck公司;其他试剂均为分析纯,国药集团化学试剂有限公司。15批茜草饮片均购于饮片公司,产地分别为陕西、安徽、山西、河南,经上海中医药大学教学实验中心中药鉴定实验室鉴定为茜草科植物茜草Rubia cordifolia L.的干燥根和根茎。
2 方法与结果
2.1色谱条件与系统适用性
2.1.1液相色谱条件Agilent Eclipse Plus C18RRHD色谱柱(2.1 mm×50 mm,1.8 µm),流动相为0.1%甲酸-乙腈(70∶30),柱温30 ℃,流速0.4 mL/min,进样量2 µL。
2.1.2质谱条件离子源:ESI;MS1/MS2加热器温度:100 ℃;干燥气温度:350 ℃;干燥气流量:10.0 L/min;雾化气压力:40.0 psi;毛细管电压:3500 V;监测离子通道:251.1/223.3;驻留时间:200 ms;Fragmentor电压:90 V;碰撞能量:15 V;极性:Negative。
2.1.3系统适用性试验在上述检测条件下,芦西丁对照品及茜草饮片供试品溶液多反应监测色谱图见图1、图2。
2.2线性关系考察
取浓度为1.32 µg/mL的芦西丁对照品溶液作为母液,依次适当倍数稀释,得到0.002 6~1.32 µg/mL一系列对照品溶液,按“2.1”项下检测条件,测定MS的响应值(子离子峰面积),结果显示,以碎片离子峰(m/z=251.1)积分面积为纵坐标,芦西丁对照品的浓度为横坐标,绘制标准曲线,得回归方程Y=33 236X+64.344,r=0.999 9。结果表明,芦西丁在0.005 2~2.64 ng范围内与峰面积呈良好的线性关系。
2.3精密度试验
取不同浓度的芦西丁对照品溶液3份,其浓度分别为0.165、0.020 63、0.002 58 µg/mL,按“2.1”项下检测条件进行测定,分别连续测定5次,记录所得子离子峰的峰面积。结果显示,该3个浓度样品的峰面积分别为5315.4、678.4、80.8,RSD分别为3.06%、4.45%、4.83%,精密度良好。
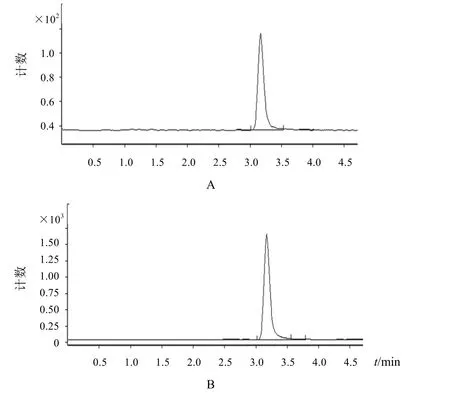
图1 芦西丁对照品LC-MS图

图2 茜草饮片供试品LC-MS图
2.4供试品溶液的溶剂选择
分别取茜草饮片粉末(批号110903,过四号筛)约0.2 g,平行6份,精密称定,置具塞锥形瓶中,分别精密加入80%乙醇10 mL(3份)和甲醇溶液10 mL(3份),密塞,称定质量,放置过夜后,超声处理(频率53 kHz,功率200 W)30 min,放冷,再称定质量,用80%乙醇补足减失的质量,摇匀,用0.45 µm微孔滤膜过滤,即得供试品溶液。
按“2.1”项下检测条件进行测定,用外标法将所得响应值与对照品对照,计算药材粉末中芦西丁的含量。结果显示,以80%乙醇、甲醇为提取溶剂制备的样品中芦西丁含量分别为0.004 06%、0.004 60%,RSD分别为2.85%、4.62%,因此选择甲醇作为超声溶剂。
2.5重复性试验
取茜草饮片粉末(批号110903)约0.2 g,精密称定,以甲醇为溶剂,按“2.4”项下方法制备供试品溶液,按“2.2”项下检测条件进行测定,平行5份,用外标法将所得响应值与对照品对照,计算药材粉末中芦西丁的含量。结果显示,该5份样品的芦西丁平均含量为0.004 52%,RSD=4.18%,表明本方法重复性良好。
2.6加样回收率试验
取茜草饮片粉末(批号110903)约0.1 g,共9份,精密称定,每份样品粉末中加入芦西丁对照品适量,再按“2.4”项下方法制备样品溶液,按“2.1”项下检测条件进行测定,用外标法将所得响应值与对照品对照,分别计算加样回收率。结果见表1。

表1 茜草中芦西丁加样回收率试验
2.7检测限与定量限
采用信噪比法确定检测限与定量限,用LC-MS测定茜草中芦西丁时,定量限为1.73 ng/mL(S/N=10),检测限为0.52 ng/mL(S/N=3)。
2.8样品含量测定
分别取茜草饮片粉末约0.2 g,精密称定,置具塞锥形瓶中,精密加入甲醇溶液10 mL,密塞,称定质量,放置过夜,超声处理30 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,用0.45 µm微孔滤膜过滤,即得供试品溶液,按“2.1”项下检测条件测定,结果见表2。

表2 样品含量测定结果
3 讨论
本研究最初尝试用HPLC-UV法测定茜草饮片中芦西丁的含量,结果显示,该法的定量限为8 µg/mL,高于实际药材供试品溶液中芦西丁含量,因此无法作为该成分的定量检测手段。此后采用LC-MS法,该法的定量限为1.73 ng/mL,检测灵敏度大大提高,经方法学考察确认,可作为茜草药材中芦西丁含量测定方法的专属手段。
不同基原中药的化学成分有时品种差异不大,国外对某些药材品种的有毒成分的研究值得引起药学工作者的重视,检测毒性成分是否同样存在于同类中药材中并将其定量,对于中药的安全用药及扩大中药材的应用范围具有重要的指导意义。
[1] 王升启,马立人.茜草属药用植物的化学成分及生物活性[J].军事医学,1991(4):254-259.
[2] 陈四保,冯瑞芝,陈碧珠,等.茜草属药用植物的研究Ⅰ.中药茜草的原植物与国内资源[J].天然产物研究与开发,1991,3(4):7-15.
[3] WESTENDORF J, POGINSKY B, MARQUARDT H, et al. The genotoxicity of lucidin, a natural component of Rubia tinctorum L., and lucidinethylether, a component of ethanolic Rubia extracts[J]. Cell Biol Toxicol,1988,4:225-239.
[4] KAWASAKI Y, GODA Y, YOSHIHIRA K, et al. The mutagenic constituents of Rubia tinctorum[J]. Chem Pharm Bull,1992,40(6):1504-1509.
[5] YASUI Y, TAKEDA N. Identification of a mutagenic substance in Rubia tinctorum L.(madder) root, as lucidin[J]. Muta Res,1983, 121:185-190.
[6] FRANTISEK M, IVANA K, ALEXANDER J. Mutagenicity of natural anthraquinones from Rubia tinctorum in the drosophila wing spot test[J]. Planta Med,2001,67:127.
[7] WESTENDORF J, PFAU W, SCHULTE A. Carcinogenicity and DNA adduct formation observed in ACI rats after long-term treatment with madder root, Rubia tinctorum L.[J]. Carcinogenesis,1998,19:2163-2168.
Content Determination of Lucidin in Rubiae Radix et Rhizoma by LC-MS
PU Yi-qiong,DING Yue, WANG Bing, ZHANG Ruo-xi, ZHANG Tong
(Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China)
Objective To develop a LC-MS method for the content determination of lucidin in Rubiae Radix et Rhizoma. Methods Agilent 1290 HPLC and G6460 Mass were used for quantification in MRM mode under ESI-. chromatography was performed on a Agilent Eclipse Plus C18RRHD column (2.1 mm × 50 mm, 1.8 µm) at 30 ℃using acetonitrile-0.1% formic acid in water at the flow rate of 0.4 mL/min. The injection volume was 2 µL. Results Good linearity was obtained from concentration of lucidin among the range of 0.005 2–2.64 ng (r= 0.999 9). Recoveries at different concentrations (80%, 100%, 120%) were between 94.80% and 100.94% (AVE=97.17%, RSD=6.16%). Good reproducibility and precision were also achieved. Conclusion The new developed LC-MS method is sensitive, accurate and with good repeatability, which is suitable for the content determination of lucidin in Rubiae Radix et Rhizoma. It can be used in the limit detection of lucidin in Rubiae Radix et Rhizoma.
Rubiae Radix et Rhizoma; lucidin; LC-MS
10.3969/j.issn.1005-5304.2016.12.023
R284.1
A
1005-5304(2016)12-0096-03
上海市科学技术委员会科研计划项目(11DZ1971500);上海市卫生局青年科研项目(20124Y002)
张彤,E-mail:zhangtdmj@hotmail.com
(2015-12-28)
(2016-01-20;编辑:陈静)
