利用微藻生产单不饱和脂肪酸——棕榈油酸
2016-12-04周文俊刘天中
汪 辉 周文俊 刘天中
(中国科学院青岛生物能源与过程研究所藻类生物技术中心,青岛 266101)
利用微藻生产单不饱和脂肪酸——棕榈油酸
汪 辉 周文俊 刘天中
(中国科学院青岛生物能源与过程研究所藻类生物技术中心,青岛 266101)

汪辉,中国科学院青岛生物能源与过程研究所副研究员,硕士生导师。从事微藻生物技术研究,研究方向为微藻代谢工程改造与规模培养工艺优化。
E-mail:wanghui@qibebt.ac.cn

刘天中,研究员,博士生导师。现任中国科学院青岛生物能源与过程研究所藻类生物技术中心主任,中国科学院生物燃料重点实验室副主任。研究方向为藻类生化工程。主要研究领域为:①微藻能源工程,包括产能微藻种的选育与性状评价、微藻大规模培养工艺、微藻高效培养光生物反应器、微藻油脂的提取与精制、微藻生物柴油制备、微藻能源技术集成与工艺放大;②微藻环境工程,包括生活和工业废水的微藻处理、燃煤废气二氧化碳的固定利用;③微藻高值产品工程,包括微藻色素、微藻蛋白、微藻多糖等的产业化关键技术。
E-mail:liutz@qibebt.ac.cn
棕榈油酸(C16:1Δ9)具有重要的营养和医药价值,进行相应产品的开发已是势在必行。目前棕榈油酸主要来源于生物合成。大田栽培的普通油料作物中棕榈油酸含量很低,而棕榈油酸含量高的野生植物存在资源少的问题,因此利用棕榈油酸含量高且能够规模培养的微藻来进行棕榈油酸的生产已成为生物技术和可再生资源研究的一个热点领域。文章介绍了棕榈油酸的原料来源,并结合笔者实验室对黄丝藻棕榈油酸的研究,综述了微藻棕榈油酸的优势及其合成途径,最后初步展望了微藻棕榈油酸研究的发展方向。
棕榈油酸(C16:1Δ9)是一种由16个碳原子组成且含1个双键的ω-7单不饱和脂肪酸,在营养、医药和工业上具有重要的应用价值。棕榈油酸能够降低C-反应蛋白(CRP)的水平,通过减少炎症降低心脏疾病、中风的风险;增加细胞膜的流动性,降低血液中低密度脂蛋白胆固醇(LDL)含量,减少血管中粥样硬化斑块形成而造成的阻塞血管,从而防止心律失常和减少高血压等。另外,棕榈油酸已被证明能提高人体对胰岛素的敏感性,对糖尿病、代谢综合征有效,且没有明显的副作用。目前,美国几个大型生物制药公司(Innovix Pharm公司、Tersus Pharmaceuticals生物制药公司)和营养品公司(Source Naturals公司、New Chapter公司、Sibu Beauty公司),以及丹麦的Pharma Nord公司等都在大力开发棕榈油酸为主的ω-7脂肪酸的保健产品及医药制剂,部分产品已成功上市。在工业上,棕榈油酸可直接用于高效生产工业需求量较大的辛烯。我国人口快速老龄化,患糖尿病、高血脂症等代谢综合征人口数量增长迅速,将产生对棕榈油酸为主的ω-7脂肪酸的保健产品及医药制剂的巨大需求。同时,棕榈油酸因其是单不饱和脂肪酸,具有非常好的抗低温和抗氧化特性,适于制取优质生物柴油。
鉴于棕榈油酸等ω-7脂肪酸在人类健康、医药上的独特价值以及可作为再生资源的重要性,有关棕榈油酸生物合成的研究日渐增多。现结合笔者研究团队对微藻棕榈油酸的研究,从棕榈油酸的原料来源、微藻棕榈油酸的优势及微藻棕榈油酸合成途径3个方面介绍利用微藻生产保健用不饱和脂肪酸——棕榈油酸的最新研究进展,以期为未来微藻棕榈油酸产品的开发提供理论基础。
1 棕榈油酸的原料来源
迄今,棕榈油酸大多来源于生物合成。目前,野生植物是棕榈油酸产品的主要原料,如New Chapter公司、Pharma Nord公司和Sibu Beauty公司等,都选择从沙棘果(Hippophae rhamnides. L)中提取分离棕榈油酸。沙棘的种子中仅含4.4%的棕榈油酸,但其果肉中则可积累24.9%的棕榈油酸7。沙棘果肉的油脂可分馏成液相(20%)和固相,液相可富集53%的棕榈油酸8。另外,原产于亚马逊雨林、南美洲和中美洲热带地区的木质藤本植物——猫爪草(Doxantha unguiscati)种子含有64%的棕榈油酸9。另一种热带植物——澳洲坚果(Macadamia integrifolia)的棕榈油酸含量为30%。然而,在这些高积累ω-7脂肪酸的野生植物中,绝大多数因种子小、产量低和地理分布窄等原因,不能像普通油料作物那样进行大规模种植和商业化生产。
大田栽培的大豆等油料作物种子的主要成分包括棕榈酸(C16:0)、硬脂酸(C18:0)、油酸(C18:1)和亚油酸(C18:2),而仅含微量的棕榈油酸(<2%)510,难以满足人类食用和工业的需求(表1)。近些年人们发现一些酵母细胞(Rhodotorula glutinis、Cryptococcus podzolicus、Trichosporon porosum、Pichia segobiensis)能够积累超过20%的油脂,其脂肪酸组分与大田作物的成分相似1112。
2 微藻生产棕榈油酸的优势

表1 几种典型油料作物的脂肪酸组成及含量
AKAZAWA Y, CAZANAVE S, MOTT J L, et al. Palmitoleate attenuates palmitate-induced Bim and PUMA up-regulation and hepatocyte lipoapoptosis. J Hepatol, 52(4): 586-593.
MISRA A, SINGHAL N, KHURANA L. Obesity, the metabolic syndrome, and type 2 diabetes in developing countries: role of dietary fats and oils. J Am Coll Nutr, 2010, 29(3Suppl):289S-301S.
CAO H, GERHOLD K, MAYERS J R, et al. Identification of a lipokine, a lipid hormone linking adipose tissue to systemic metabolism. Cell, 2008, 134(6):933-944.
RYBAK A, MEIER M A R. Acyclic diene metathesis with a monomer from renewable resources: control of molecular weight and one-step preparation of block copolymers. Chem Sus Chem, 2008, 1(6): 542-547.
○
CAO Y J, LIU W, XU X, et al. Production of free monounsaturated fatty acids by metabolically engineered Escherichia coli. Biotechnology for Biofuels, 2014, 7(1):59.
■
KNOTHE G. Biodiesel derived from a model oil enriched in palmitoleic acid, Macadamia nut oil. Energy Fuel, 2010, 24(3):2098-2103.
↓
YANG B, KALLIO H P. Fatty acid composition of lipids in sea buckthorn (Hippophae rhamnoides L.) berries of different origins. J Agric Food Chem, 2001, 49(4): 1939-1947.
→
GUTIERREZ L F, BELKACEMI K. Palmitoleic acid enrichment of seabuckthorm (Hippophae rhamnoides L.) pulp oil by crystallization process. Sep Sci Technol, 2008, 43: 2003-2022.
↑
VICKERY J F. The fatty acid composition of the seed oils of proteaceae: a chemotaxonoimc study. Phytochemistry, 1971, 10: 123-130.
←
IMKE L, LADISLAV H, THOMAS F, et al. Fatty acid profiles and their distribution patterns in microalgae: a comprehensive analysis of more than 2000 strains from the SAG culture collection. BMC Plant Biology, 2011, 11(11):124.
微藻具有生化合成脂肪酸的能力,被作为一些珍贵脂肪酸的新来源而受到广泛重视(表2)。其中,某些微藻细胞内的棕榈油酸比例可达20%~30%,部分微藻的棕榈油酸可以超过总脂肪酸的50%。如蓝藻中的颤藻(Oscillatoria sp.)细胞可积累高达54.5%的棕榈油酸13,真眼点藻纲(Eustigmatophyceae)的大真眼点藻(Eustigmatos magnus)和波氏真眼点藻(Eustigmatos polyphem)中棕榈油酸的含量能占到细胞内总脂肪酸含量的39.6%~57.8%。中国科学院青岛生物能源所微藻生物技术团队首次发现了黄藻门的黄丝藻(Tribonema sp.)具有高含油(>50%干重)、高含棕榈油酸(>50%总脂肪酸)的特性~。不同于其他单细胞微藻,黄丝藻是一种节状多细胞组成的丝状体,藻丝长度最大可达3mm,这种大尺寸的丝状体结构赋予了其具有可在大规模培养下抵抗轮虫等原生动物的污染以及可经济采收等优良的工业应用性状,因而更适于通过大规模培养来生产棕榈油酸。
¦
B E O P O U L O S A, N I C A U D J M, GAILLARDIN C. An overview of lipid metabolism in yeasts and its impact on biotechnological processes. Applied Microbiology and Biotechnology, 2011, 90(4):1193-1206.
 ̄
LIU Y, KOH C M, JI L. Bioconversion of crude glycerol to glycolipids in Ustilago maydis. Bioresource Technology, 2011, 102(4): 3927-3933.
¬
MASTUNAGA T, TAKEYAMA H, MIURA Y, et al. Screening of marine cyanobacteria for high palmitoleic acid production. FEMS Microbiol Lett, 1995, 133(1-2): 137-141.
£
吴桂秀, 高保燕, 周芷薇, 等. 高、低氮浓度对2株真眼点藻的生长和油脂积累的影响. 微生物学通报, 2015, 42(8):1442-1452.
¢
中国科学院青岛生物能源与过程研究所.一种制备黄丝藻生物油的方法及由其制备的黄丝藻生物油:201310034308.3[P]. 2013-01-29.
WANG H, JI B, WANG J F, et al. Growth and biochemical composition of filamentous microalgae Tribonema sp. as potential biofuel feedstock. Bioprocess Biosyst Eng, 2014, 37(12): 2607-2613.
中国科学院青岛生物能源与过程研究所. 一株新型黄丝藻及其培养与应用:201510415879.0[P]. 2015-07-15[2016-01-27]. http://cpquery.sipo. gov.cn/txnQueryOrdinaryPatents.do?selectkey:shenqingh=2015104158790&selectkey:zhuanlimc=&select-key:shenqingrxm=&selectkey:zhuanlilx=&select-key:shenqingr_ from=&select-key:shenqingr_to=&inner-flag:opentype=window&inner-flag:flowno=1453875387135.
CHISTI Y. Biodiesel from microalgae. Biotechnolgoy Advance, 2007, 25(3): 294-306.
ᅵ
RICHMOND A. Handbook of microalgal culture: biotechnology and applied phycology. Blackwell, 2004.
ᅴ
HU Q, SOMMERFELD M, JARVIS E, et al. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances. Plant J, 2008, 54(4): 621-639.
ᅳ
THELEN J J, OHLROGGE J B. Metabolic engineering of fatty acid biosynthesis in plants. Metab Eng, 2002, 4(1): 12-21.
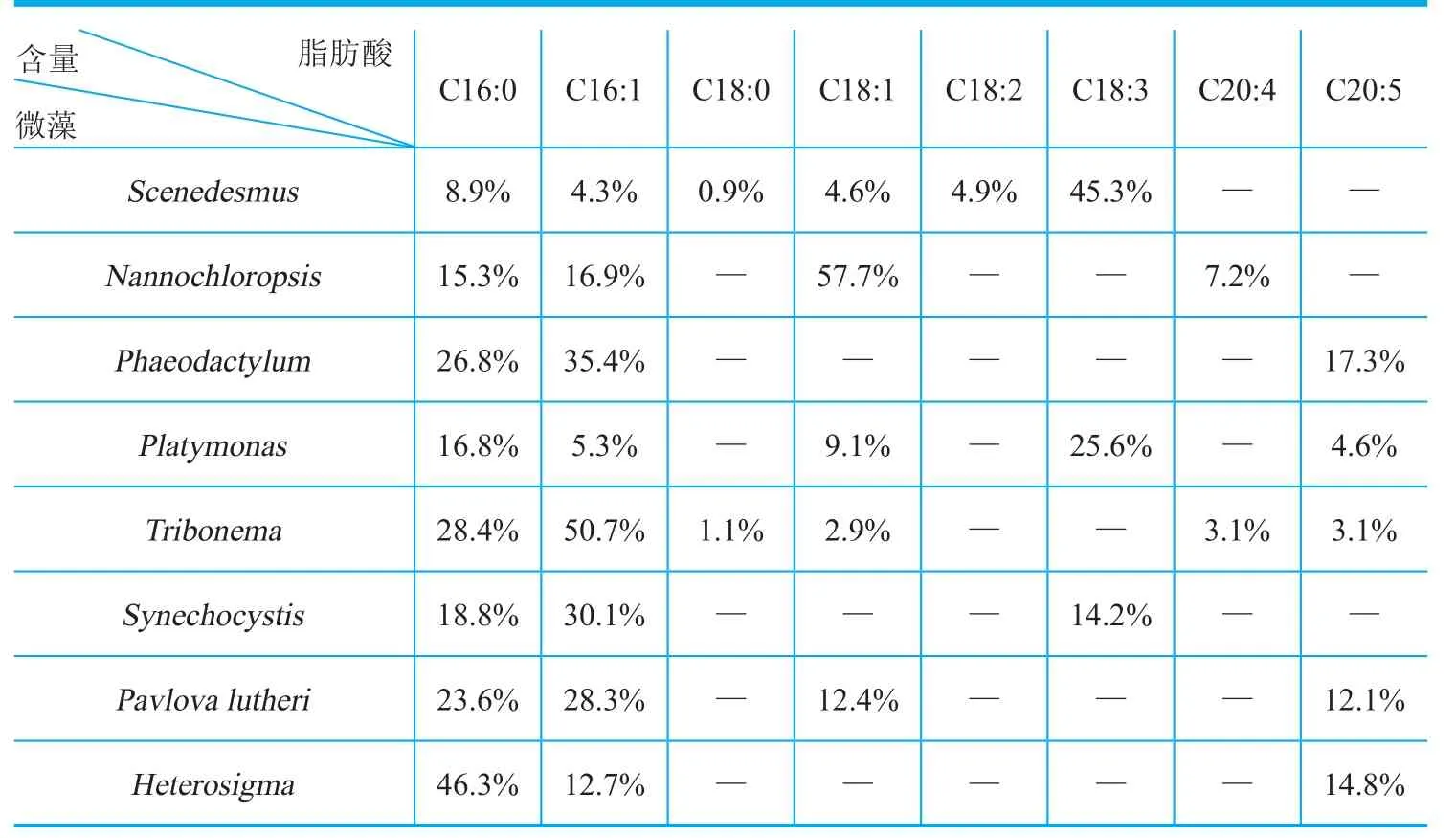
表2 不同种类微藻的脂肪酸组成及含量
相对于其他传统油料资源,利用微藻来生产包括棕榈油酸在内的珍贵脂肪酸具有多方面优势。①一般微藻的总脂含量可达干重质量的20%~50%,如油质绿藻在正常和外界胁迫情况下的平均总脂含量分别为25.5%和45.7%。②微藻具有生物量大、生物周期短的特点。③微藻种类繁多,广泛分布在淡水和海水中,因此可用海水培养,能耐受一些极端环境,不占用耕地。④微藻能够吸收并利用工农业生产中排放出的大量CO2和氮化物,还可利用废水中氮、磷等,具有固碳减排效应。⑤某些微藻能够利用葡萄糖、醋酸钠等有机碳源,可以在短时间内积累大量的生物质,这为建立微藻高值化合物的大规模快速生产奠定了基础。
3 棕榈油酸在微藻细胞内的生物合成途径
目前,笔者课题组对黄丝藻转录组进行了高通量测序,在获得大量基因序列的基础上进行了功能注释,发现了在脂肪酸合成和降解中的编码相关酶的转录本,结合KEGG比对结果,首次构建出黄丝藻棕榈油酸的生物合成途径。微藻细胞内棕榈油酸的生物合成与高等植物相似,以酰基载体蛋白(acyl carrier protein,ACP)形式开始于叶绿体(图1)。乙酰辅酶A羧化酶(ACC)催化乙酰辅酶A和HCO3
-生成丙二酰辅酶A (malonyl-CoA),然后在丙二酰CoA-ACP酰基转移酶(MAT)的催化下转化为丙二酰-ACP(malonyl-ACP)。在随后的脂肪酸碳链延伸反应中丙二酰-ACP作为碳供体与酰基-ACP发生一系列由酮酰基-ACP合酶(KAS)催化完成的缩合反应。第一个缩合反应由β-酮酰基-ACP合酶Ⅲ(KASⅢ)催化并生成四碳产物,然后β-酮酰基-ACP合酶Ⅰ(KASⅠ)催化生成六碳到十六碳的不同碳链长度的产物。在质体中合成的C16:0-ACP代谢有不同分支:一是酯酰-ACP硫酯酶(FAT)将16C脂肪酸侧链从ACP上切割下来,形成游离的16C脂肪酸(即棕榈酸),从质体中转出;二是C16:0-ACP在酯酰-Δ 9-ACP去饱和酶(ACP-Δ9D)催化下生成棕榈油酸-ACP(C16:1Δ9-ACP),之后在FAT作用下从ACP上分离,转出质体;三是C16:0-ACP在β-酮酰基-ACP合酶Ⅱ(KASⅡ)作用下延长为硬酯酰-ACP(C18:0-ACP)。

图1 微藻细胞内棕榈油酸的生物合成途径
从质体中转运出来的C16:1Δ9以及C16:0在位于质体外膜的酰基-CoA合成酶(ACS)作用下,形成C16:1Δ9-CoA和C16:0-CoA。这些脂肪酰基CoA从质体转运到细胞质的内质网上,与磷脂结合形成C16:1Δ9-PC和C16:0-PC。C16:0-PC在位于内质网的CoA-Δ9D催化下转化为C16:1Δ9-PC。C16:1Δ9-PC在一系列酰基转移酶的作用下,转入3-磷酸甘油(3PG)分子形成三酰基甘油酯(TAG)。最后,疏水性的TAG聚集在内质网脂质双层膜结构的脂酰基区域,这些富含TAG的脂酰基区域形成“脂质凸起”,进而从内质网膜分离出来成为油体。
4 研究展望
综上所述,基于ω-7脂肪酸,尤其是棕榈油酸在医药保健等方面的重要应用价值,进行相应产品的开发已是势在必行。鉴于大田栽培的普通油料作物中棕榈油酸含量较低,而棕榈油酸含量高的野生植物又存在资源量少的问题,利用微藻将是解决棕榈油酸生产资源的新途径。微藻黄丝藻油脂和棕榈油酸含量高,如果能够实现黄丝藻生产棕榈油酸的规模化生产,将可以解决棕榈油酸的资源问题,从而为开发糖尿病、高血脂症等老龄化疾病的医药保健制剂提供重要原料基础。
同时,随着基因工程技术的发展,加深对微藻尤其是黄丝藻棕榈油酸合成代谢途径以及关键酶基因的认识,挖掘有价值的基因元件,使得我们可以利用基因工程手段来调控普通油料作物种子脂肪酸的代谢途径、改变脂肪酸的组成,从而提高油料作物的油脂含量,丰富功能脂肪酸的组成,改善油脂品质,为生产优质、廉价的食用或工业用棕榈油酸生化产品奠定基础。
10.3969/j.issn.1674-0319.2016.02.003
