氨基酸团簇及磷脂在蒙脱石表面的电子传递计算模拟研究*
2016-12-03董发勤孙仕勇郭玉婷霍婷婷
周 青,董发勤,边 亮,孙仕勇,郭玉婷,4,霍婷婷
(1. 西南科技大学 环境与资源学院,四川 绵阳 621010;2. 固体废物处理与资源化教育部重点实验室,四川 绵阳 621010;3. 中国科学院 新疆理化技术研究所,乌鲁木齐 830011;4. 西南科技大学 生命科学与工程学院,四川 绵阳 621010)
氨基酸团簇及磷脂在蒙脱石表面的电子传递计算模拟研究*
周 青1,2,董发勤2,边 亮3,孙仕勇1,2,郭玉婷2,4,霍婷婷2
(1. 西南科技大学 环境与资源学院,四川 绵阳 621010;2. 固体废物处理与资源化教育部重点实验室,四川 绵阳 621010;3. 中国科学院 新疆理化技术研究所,乌鲁木齐 830011;4. 西南科技大学 生命科学与工程学院,四川 绵阳 621010)
分子模拟以其在分子尺度上的可视性已成为界面作用研究的一项重要手段。本文通过分子动力学研究氨基酸团簇及磷脂分子与可吸入颗粒物蒙脱石的吸附来模拟蒙脱石进入人体后与人体细胞膜膜蛋白及磷脂分子的相互作用过程。另外在计算体系中加入重金属离子Cr(Ⅲ)、Cr(Ⅵ)、Cd(Ⅱ)、Pb(Ⅱ)以了解其对该过程的影响。模拟结果证明,氨基酸和磷脂均与蒙脱石具有较好的亲和性,但氨基酸强于磷脂。重金属离子则起到了促进作用。通过密度泛函理论研究作用前后分子的电子结构发现,相互作用过程中存在以蒙脱石为供体、氨基酸和磷脂为受体的电子传递。
蒙脱石;氨基酸;磷脂;分子模拟;重金属离子;电子传递
0 引 言
大气颗粒物污染日趋严重,大气颗粒物被吸入人体后会刺激巨噬细胞、呼吸道上皮细胞等产生自由基[1]。具有强氧化性的自由基由于含有未偶电子,不仅可以使细胞膜的不饱和脂肪酸发生脂质过氧化,而且可以攻击膜蛋白,核酸等生物分子使之发生链内或链间交联、断裂,从而引起细胞的氧化损伤,甚至凋亡[2-6]。研究发现,颗粒的成分及比表面积与其诱导产生细胞氧化损伤的能力有直接关系[3-4]。
作为大气颗粒物矿物成分的一种[4, 7],蒙脱石的片层具有极高的横纵比(约500)和比表面积(约800 m2/g)[8]。尽管关于蒙脱石粉尘的致病案例早有报道,其致病机理的研究却并不多见[9-11]。然而,由于在自然条件下蒙脱石层带负电且有可交换的层间阳离子,其与生物分子如氨基酸、蛋白质、脂多糖等的相互作用研究相对较多,尤其是蒙脱石吸附氨基酸、蛋白质[12-15]。一定程度上,蒙脱石和氨基酸以及蛋白质的相互作用是其二者亲和力的一种反映,研究二者的吸附作用对于研究蒙脱石致病机理有一定的帮助。氨基酸、蛋白质、磷脂等生物分子在蒙脱石表面的吸附普遍认为由离子交换、静电作用、氢键、范德华力等完成的[14]。
近年来,随着计算模拟技术的发展,分子动力学模拟已广泛应用于生物大分子结构-功能关系的研究中,而应用于矿物与生物大分子的交互作用的较少[13, 16]。本文建立蒙脱石模型以及由多肽(谷氨酸、甘氨酸、丝氨酸、精氨酸)以及磷脂单分子层组成的细胞膜模型。通过计算机模拟二者在Cr(Ⅲ)、Cr(Ⅵ)、Cd(Ⅱ)、Pb(Ⅱ) 4种重金属离子影响下的相互作用[17],以获得二者的形变以及二者的电子传输机制等相关信息。通过分子模拟,从分子视角在一定程度上洞悉蒙脱石粉尘被吸入肺泡之后与人体细胞细胞膜的相互作用,以期为粉尘的致病机理提供一定的参考。
1 计算模拟方法
模拟计算软件采用的是Materials Studio(Accelrys, USA)。采用分子力学建立谷氨酸(Glu)、甘氨酸(Gly)、丝氨酸(Ser)、精氨酸(Arg) 4种氨基酸团簇和磷脂(Phospholipid)等生物分子(BM)团簇模型[18](详见表1)及蒙脱石(MMT)模型[19]。

表1 生物分子模型的基本参数
蒙脱石对4种氨基酸团簇的吸附位点及吸附量通过巨正则蒙脱卡洛计算获得。计算步数为10 000 000步,计算方法采用的是Metropolis法,采用Universal力场,运动方程由Verlet算法整合[20]。
随后采用Universal力场进行分子动力学弛豫。先NPT系综后NVT系综,弛豫时间均为1 000 ps,步长设为1 fs,温度设为310 K,压力为标准大气压0.1 MPa。长程静电作用计算采用Atom-based方法,短程范德华作用计算采用Ewald & group方法。弛豫过程中温度采用Nose-Hoover热浴调节,压力由Berendsen恒压器调节[21]。
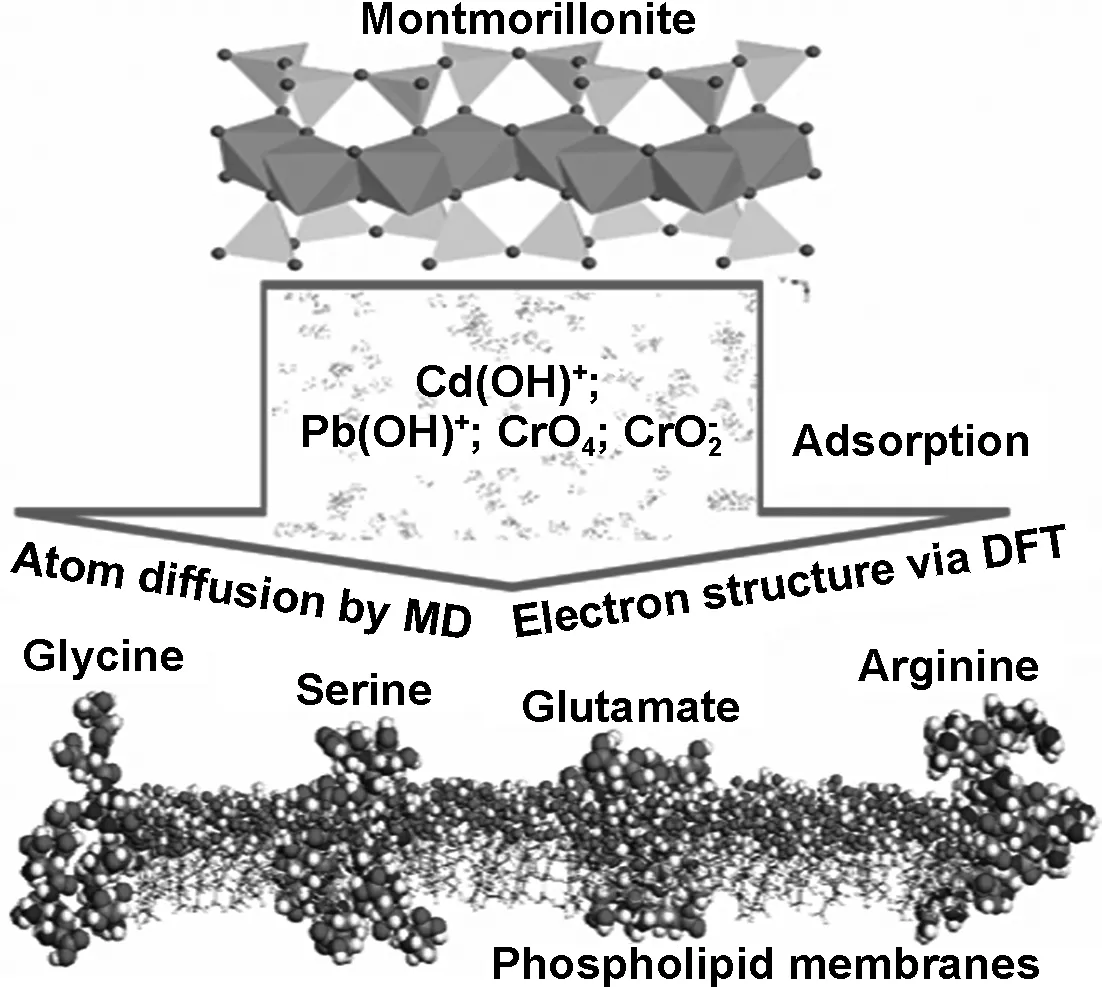
图1 模拟计算过程图示
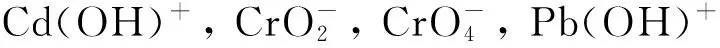
最后利用密度泛函理论(DFT)进行量化计算。采用Perdew-Burke-Ernzerhof(PBE)广义梯度近似(GGA)交换泛函计算生物分子与矿物结构之间的电子传递[22]。平面波截断能量收敛为500 eV,采用3×3×3的k点抽样在布里渊区内进行倒易空间积分。整个计算过程如图1所示。
2 结果讨论
2.1 相互作用强弱及相互作用位点
蒙脱石与生物分子的亲和性实际上表示为生物分子在蒙脱石表面的吸附。吸附作用的强弱在数值上表现为吸附能的不同,吸附能的计算公式为Eadsorption=E(adsobate+substrate)-Eadsorption-Esubstrate。吸附能为负值表示吸附行为是自发进行的,吸附后体系整体能量降低且体系稳定,吸附过程是放热的。吸附能的绝对值越大,表明吸附作用越强烈,蒙脱石与生物分子的相互作用也就越明显。
本文采用蒙脱卡洛计算得到了蒙脱石吸附生物分子的吸附能及吸附后生物分子的变形能,计算结果如表2所示。结果显示,蒙脱石与5种生物分子之间的吸附能皆为负值,说明蒙脱石与5种生物分子均存在较强相互作用。其中,蒙脱石对4种氨基酸团簇的作用强于磷脂分子,4种氨基酸团簇则大体一致。较强的相互作用则导致生物分子较大的形变,数值上表达为变形能的绝对值较大,稍后将结合键能及扭转能的变化综合讨论。
表2 蒙脱石吸附生物分子的吸附能与变形能(kJ/mol)
Table 2 Adsorption and deformation energy of biomolecules on montmorillonite surface (kJ/mol)

能量PhospholipidGlySerGluArg吸附能-2052.56-2549.35-2549.97-2542.67-2552.49变形能-2185.72-2673.44-2670.71-2661.77-2668.83

2.2 相互作用前后生物分子的能量变化
生物分子的形变更加具体地反映为键能、扭转能等的变化。本文不仅计算了包括键能、扭转能在内的价键能,还计算了包括静电作用能以及范德华能在内的非键合能,具体与图3所示。由图3可以看出,相似结构的生物分子的价键能与分子的原子数呈一定的正相关。与蒙脱石作用后,5种生物分子的键能及扭转能均升高。由于蒙脱石分子对生物分子界面原子的作用,使得生物分子不得不缩短键长以加强对表层原子的束缚,生物分子的键能相应变大。同理,由于蒙脱石的作用,紧缚的生物分子柔性减弱,键角旋转、扭转以及面外弯曲能力较弱,扭转能升高。重金属离子的存在则加强了蒙脱石与生物分子的作用,键能和扭转能进一步升高。值得一提的是,在重金属离子的协同作用下,个别生物分子的键能竟达873.80 kJ/mol。
与价键能相比,非键合能的变化显得似乎没有规律可循。不同于价键能,非键合能的变化是生物分子内、生物分子与生物分子之间以及生物分子与蒙脱石之间作用叠加的结果。总的来看,长程静电作用强于短程范德华作用,即在相互作用过程中,静电作用力起主导作用。磷脂与Gly体系以范德华引力为主,其它生物分子体系以范德华斥力为主;磷脂与谷氨酸体系以静电斥力为主,其它生物分子体系以引力为主。
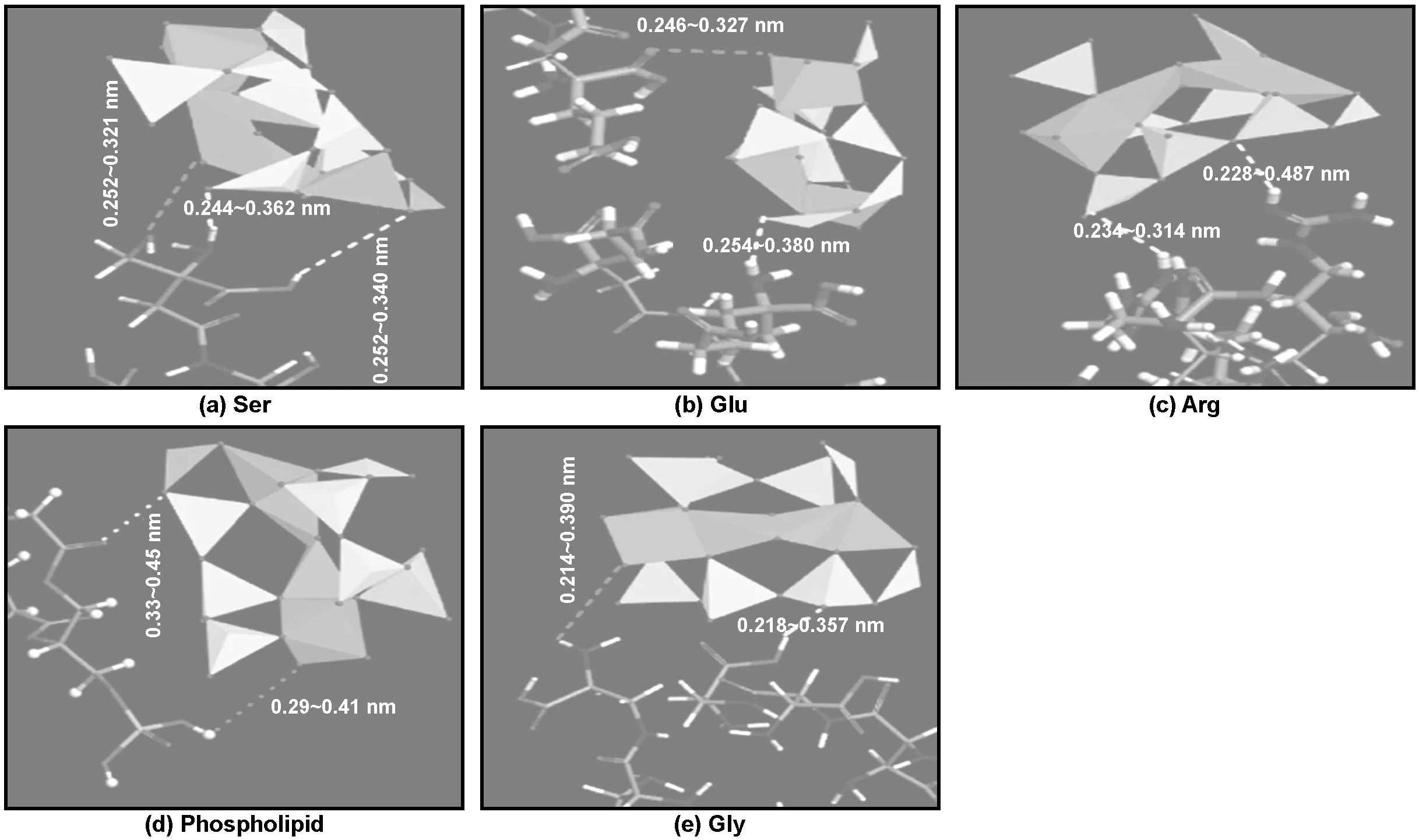
图2 分子动力学弛豫之后蒙脱石与生物分子相对位置图

图3 生物分子相互作用前后体系的能量变化
2.3 蒙脱石与生物分子之间的电子传递
确定了相互作用基团后,采用DFT理论进行量子化学计算,得到了相互作用前后体系分子的电子结构,从而得到二者之间的电子传递情况。
分子的表面电势是分子轨道及电子密度的反映,通过绘制分子的表面电势等高线图,可以定性地了解电子的传递方向,电势低的区域的有相对自由的电子,而电势高的区域则表示该区域对电子存在较强的吸引力,电势越高,得电子能力也就越强。从图4可以看出,蒙脱石整体势能较低,其中侧面边缘的硅氧四面体的Si原子区域存在明显的负值区,这主要是由于边缘的Si的外层电子p轨道上的两个电子未参与成键。未成键的孤对电子由于没有键的束缚,能量又处于最高、次高,易于偏向电子受体,从而从蒙脱石分子中失去。而生物分子的外层密布着高电势区,这主要是由于外层H原子的电子由于受到内层原子吸引,几乎向外裸露的H原子核有较强的吸引电子的能力。总之,从趋势上,蒙脱石易于失去电子,而生物分子易于得到电子。
为进一步定量地了解二者之间的电子传递,根据量化计算结果,对蒙脱石与生物分子的作用基团进行Mulliken布局分析。Mulliken电荷是原子周围电子密度高低的直接反映,电荷越高,电荷密度越低。Mulliken电荷的分子结果如表3所示,蒙脱石的Al、Si原子在作用后,电子密度变低,其中Al的变化尤为明显;氧原子的电子密度增高。氨基酸—NH2和—COOH的电子密度增高。磷脂分子酯基—COO—电子密度增高,而亲水端上—H2PO4的电子密度反而变低。

图4 蒙脱石与生物分子的表面电势等值线图

作用基团作用前作用后PhospholipidGlySerGluArg蒙脱石Al1.5602.2292.2732.4032.2132.252Si2.0152.0682.1802.3362.3512.460O(四面体)-0.995-1.194-1.187-1.310-1.221-1.303O(八面体)-0.923-1.204-1.209-1.373-1.275-1.269氨基酸—NH2-0.102~-0.109—-0.173-0.158-0.139-0.119—COOH-0.481~-0.372—-0.527-0.659-0.572-0.648磷脂—COO—-0.279-0.366—————H2PO40.3460.418————
与表面电势显示的趋势较为一致,蒙脱石主要为电子供体,而生物分子为电势受体,磷脂的亲水基团—H2PO4除外。只是不同的是蒙脱石最大的电子供体为Al而非Si,这主要是因为孤对电子只在蒙脱石片层的侧面Si原子中存在,而且Al的电子吸引能力比Si弱。Al、Si原子的电子经由表层O原子传递给生物分子的作用基团,故蒙脱石表层氧原子的电子密度也有所增高。通过对磷脂作用基团—H2PO4的单个原子进行布局分析发现P原子为主要的电子供体(电荷由2.110 e升高为2.316 e)。由于重金属离子是以蒙脱卡洛方法加入计算体系,以场的形式存在,其不存在电子得失,但重金属离子加强了蒙脱石及生物分子的极化,并在传递过程中起到介导作用。
3 结 论
(1) 通过分子模拟计算发现蒙脱石在静电力为主的作用力下,与蛋白质和磷脂分子通过—NH2、—COOH、—H2PO4、—COO—相互作用,且蛋白质的作用强于磷脂。在蒙脱石的作用下,生物分子发生较大的形变,键能增强,柔性变低。重金属离子的存在则加强了该过程,发挥了协同作用。
(2) 通过对相互作用后体系的电子结构计算发现蒙脱石与生物分子的活性基团之间发生了以蒙脱石的Al、Si为供体、生物分子为受体的电子传递。
[1] Nel A, Xia T, Madler L, et al. Toxic potential of materials at the nanolevel [J]. Science, 2006, 311(5761): 622-627.
[2] Ciencewicki J, Trivedi S, Kleeberger S R. Oxidants and the pathogenesis of lung diseases [J]. J Allergy Clin Immun, 2008, 122(3): 456-468.
[3] Dick C A J, Singh P, Daniels M, et al. Murine pulmonary inflammatory responses following instillation of size-fractionated ambient particulate matter [J]. Journal of Toxicology and Environmental Health-Part A, 2003, 66(23): 2193-2207.
[4] Ghio A J, Carraway M S, Madden M C. Composition of air pollution particles and oxidative stress in cells, tissues, and living systems [J]. J Toxicol Env Heal B, 2012, 15(1): 1-21.
[5] Gonzalez-Flecha B. Oxidant mechanisms in response to ambient air particles [J]. Molecular aspects of medicine, 2004, 25(1-2): 169-182.
[6] Imrich A, Ning Y Y, Lawrence J, et al. Alveolar macrophage cytokine response to air pollution particles: oxidant mechanisms [J]. Toxicology and applied pharmacology, 2007, 218(3): 256-264.
[7] Menendez I, Perez-Chacon E, Mangas J, et al. Dust deposits on La graciosa island (canary islands, spain): texture, mineralogy and a case study of recent dust plume transport [J]. Catena, 2014, 117: 133-144.
[8] Gu C, Liu C, Johnston C T, et al. Pentachlorophenol radical cations generated on Fe(Ⅲ)-montmorillonite initiate octachlorodibenzo-p-dioxin formation in clays: density functional theory and fourier transform infrared studies [J]. Environmental Science & Technology, 2011, 45(4): 1399-1406.
[9] Gibbs A R, Pooley F D. Fuller's earth (montmorillonite) pneumoconiosis [J]. Occupational and Environmental Medicine, 1994, 51(9): 644-646.
[10] Elmore A R, Andersen F A, Pan C I R E. Final report on the safety assessment of aluminum silicate, calcium silicate, magnesium aluminum silicate, magnesium silicate, magnesium trisilicate, sodium magnesium silicate, zirconium silicate, attapulgite, bentonite, fuller's earth, hectorite, kaolin, lithium magnesium silicate, lithium magnesium sodium silicate, montmorillonite, pyrophyllite, and zeolite [J]. Int J Toxicol, 2003, 22: 37-102.
[11] Fujimoto K, Muller N L, Kato S, et al. Pneumoconiosis in rush mat workers exposed to clay dye "sendo" dust: clinical, radiologic, and histopathologic features in seven patients [J]. Chest, 2004, 125(2): 737-743.
[12] Kolman K, Makowski M M, GOLRIZ A A, et al. Adsorption, aggregation, and desorption of proteins on smectite particles [J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2014, 30(39): 11650-11659.
[13] Assifaoui A, Huault L, Maissiat C, et al. Structural studies of adsorbed protein (betalactoglobulin) on natural clay (montmorillonite) [J]. Rsc Adv, 2014, 4(105): 61096-61103.
[14] Yu W H, Li N, Tong D S, et al. Adsorption of proteins and nucleic acids on clay minerals and their interactions: a review [J]. Applied Clay Science, 2013, 80-81: 443-452.
[15] Tran A T T, James B J. A study the interaction forces between the bovine serum albumin protein and montmorillonite surface [J]. Colloid Surface A, 2012, 414: 104-114.
[16] Liu X D, Lu X C, Meijer E J, et al. Atomic-scale structures of interfaces between phyllosilicate edges and water [J]. Geochim Cosmochim Ac, 2012, 81: 56-68.
[17] Wang M, Deng Y Q, Dong F Q, et al. Speciation analysis of cadmium in dust fall about northern China towns [J]. Asian J Chem, 2013, 25(13): 7522-7526.
[18] Bian L, Xu J B, Song M X, et al. Designing perovskite BFO(111) membrane as an electrochemical sensor for detection of amino acids: a simulation study [J]. Journal of Molecular Structure, 2015, 1099: 1-9.
[19] Viani A, Gualtieri A F, Artioli G. The nature of disorder in montmorillonite by simulation of X-ray powder patterns [J]. American Mineralogist, 2002, 87(7): 966-975.
[20] Joshi P, Shewale V, Pandey R, et al. Site specific interaction between ZnO nanoparticles and tryptophan: a first principles quantum mechanical study [J]. Physical Chemistry Chemical Physics, 2011, 13(2): 476-479.
[21] Costa D, Tougerti A, Tielens F, et al. DFT study of the adsorption of microsolvated glycine on a hydrophilic amorphous silica surface [J]. Physical Chemistry Chemical Physics, 2008, 10(42): 6360-6368.
[22] Almora-Barrios N, Austen K F, De Leeuw N H. Density functional theory study of the binding of glycine, proline, and hydroxyproline to the hydroxyapatite (0001) and (0110) surfaces [J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2009, 25(9): 5018-5025.
[23] Ramos M E, Huertas F J. Adsorption of glycine on montmorillonite in aqueous solutions [J]. Applied Clay Science, 2013, 80-81: 10-7.Electron transition of amino acids clusters and phospholipid on montmorillonite surface: a simulation research
2. Key Laboratory of Solid Waste Treatment and Resource Recycle,
Southwest University of Science and Technology, Mianyang 621010, China;
3. Xinjiang Technical Institute of Physics and Chemistry, Chinese Academy of Sciences,
Urumqi 830011, China;
4. School of Life Science and Engineering, Southwest University of Science and Technology,
Mianyang 621010, China)
ZHOU Qing1,2,DONG Faqin2,BIAN Liang3,SUN Shiyong1,2,GUO Yuting2,4,HUO Tingting2
(1. School of Environment and Resources, Southwest University of Science and Technology,Mianyang 621010, China;
Molecular simulation has been an important tool in the study of interface interaction due to its visibility at the scale of molecular. To simulate the interaction between montmorillonite and cell membrane, the adsorption of the amino acids clusters and phospholipids on montmorillonite surface was studied by molecular dynamics simulation. Moreover, the heavy metal ions Cr(Ⅲ), Cr(Ⅵ), Cd(Ⅱ), Pb(Ⅱ) was added into the calculation system to acquire its effect on the adsorption process. The results showed that amino acids and phospholipids both had good affinity with montmorillonite. However, amino acids were stronger than phospholipids. Heavy metal ions then played a synergistic role. The electron transition between montmorillonite and the biomolecules was found by the calculation of electronic structure with Density Fuctional Theory. During the process, montmorillonite acted as donor and the biomolecules acceptors.
montmorillonite; amino acids; phospholipid; molecular simulation; heavy metal ion; electron transition
1001-9731(2016)04-04129-05
国家重点基础研究发展计划资助项目(2014CB846003);国家自然科学基金重点资助项目(41130746,41472310)
2015-12-06
2016-03-05 通讯作者:董发勤,E-mail: fqdong@swust.edu.cn
周 青 (1990-),男,河南信阳人,在读硕士,师承董发勤教授,从事环境矿物学研究。
X513;O561
A
10.3969/j.issn.1001-9731.2016.04.026
