高效氯氰菊酯急性暴露中斑马鱼相关酶活性和基因表达变化
2016-12-02王丽张耘泽耿歌秦婷婷刘德立熊丽
王丽,张耘泽,耿歌,秦婷婷,刘德立,熊丽
华中师范大学生命科学学院 湖北省遗传调控与整合生物学重点实验室,武汉 430079
高效氯氰菊酯急性暴露中斑马鱼相关酶活性和基因表达变化
王丽,张耘泽,耿歌,秦婷婷,刘德立,熊丽*
华中师范大学生命科学学院 湖北省遗传调控与整合生物学重点实验室,武汉 430079
高效氯氰菊酯广泛地应用于农业生产及日常生活中的害虫防治,但对水生生物却毒性极高。为探究高效氯氰菊酯对斑马鱼的急性毒性,以总超氧化物歧化酶(总SOD)、过氧化氢酶(CAT)和乙酰胆碱酯酶(AChE)活性以及相关的基因表达量变化为检测指标,研究其对斑马鱼成鱼的影响。急性毒性试验结果显示,高效氯氰菊酯对斑马鱼属剧毒物质,斑马鱼的急性中毒症状为身体蜷曲、抽搐,鳃盖扇动加快,游动能力减弱,间歇性出现无规律急速游动和撞壁行为。酶活测定结果显示,斑马鱼组织中总SOD、CAT和AChE活性与高效氯氰菊酯呈现低浓度诱导、高浓度抑制的剂量效应关系;相关基因表达量的检测结果显示,高效氯氰菊酯会诱导斑马鱼肝脏、肠和脑中Sod1、Cat以及Ache的mRNA表达上调。研究表明,高效氯氰菊酯的神经毒性和氧化损伤共同造成了斑马鱼的中毒甚至死亡。
高效氯氰菊酯;斑马鱼;急性毒性;氧化损伤
Received 14 October 2015 accepted 16 February 2016
高效氯氰菊酯(beta cypermethrin)是一种拟除虫菊酯类杀虫剂。其生物活性较高,具有触杀和胃毒作用,广泛地应用于农业生产及日常生活中的害虫防治。它对哺乳动物和鸟类毒性较低,但是对水生生物却有着极高毒性。农田施用的高效氯氰菊酯或其制剂可经灌溉或雨水淋洗进入水体,从而对水生环境产生长期不良影响[1-2]。
高效氯氰菊酯为两对外消旋体混合物,其顺反比约为2:3,是氯氰菊酯的高效异构体,其药效比氯氰菊酯高近一倍[3]。其疏水性使其很容易被鱼鳃吸收。另外,鱼体内缺乏水解菊酯的酶,因此拟除虫菊酯在鱼体内的代谢主要靠氧化作用[4]。拟除虫菊酯对鱼类的毒性作用包括:破坏组织器官、损害神经系统和免疫系统、影响繁殖和发育等[5-6]。徐永学[7]研究发现斑马鱼胚胎暴露于高效氯氰菊酯中96 h后,斑马鱼胚胎出现色素沉积减少、心包囊肿等畸形,说明高效氯氰菊酯农药对斑马鱼胚胎具有严重的毒害作用;麻冬梅等[8]用高效氯氰菊酯亚致死浓度处理鲤鱼21 d后,鲤鱼脑、鳃、肝和骨骼肌肉中代谢酶活性、RNA和蛋白质质量比都逐渐下降;Wei和Yang[9-10]将克氏原螯虾暴露于高效氯氰菊酯中96 h后,鳃和肝胰脏中活性氧(ROS)含量上升,SOD和CAT活性降低,丙二醛(MDA)含量和蛋白羰基含量增加,出现鳃丝肿胀,层状上皮细胞坏死,肝胰脏出现肾小管管腔扩大甚至退化。
已有的研究大多集中在污染物对斑马鱼胚胎的发育毒性,很少有研究毒物对斑马鱼成鱼的毒性作用。关于高效氯氰菊酯对斑马鱼成鱼的急性毒性研究也比较少。本研究以成年斑马鱼为研究对象,以不同组织器官中抗氧化酶活性及相关基因的表达量变化为指标,研究高效氯氰菊酯对斑马鱼的急性毒性作用,为系统的评估高效氯氰菊酯对斑马鱼的毒性作用提供依据。
1 材料与方法(Materials and methods)
1.1 实验材料
实验用斑马鱼购于武汉市某水族馆。成鱼,雌雄均有,健康且规格大体一致,体长(3.9±0.5) cm,体重(0.42±0.12) g,暴露前在实验条件下驯化1周以上。实验用水为曝气自来水。饲养密度为1 g·L-1(即每升水容纳1 g斑马鱼),水温(25±1) ℃,光暗比14 h:10 h。每天投喂饲料并清除排泄物,实验前一天开始禁食。
高效氯氰菊酯原药购于武汉健源化工有限公司,纯度95%以上。染毒时先用丙酮配成1 g·L-1的母液,再将母液稀释成所需浓度。实验中保证各个处理中助溶剂浓度均不超过0.1 mL·L-1[11]。
1.2 实验方法
半致死浓度实验设计参照《水生生物毒性试验方法》[11]。根据预实验按等对数间距设置8个暴露浓度,分别为3.00、4.05、5.40、7.20、9.60、12.60、16.80和22.50 μg·L-1,另设1个空白对照组和1个溶剂对照组(22.50 μL·L-1,最大浓度处理中助溶剂浓度)。每个处理组10尾鱼,设3个重复。每天定时换液。记录24 h、48 h、72 h、96 h的累积死亡数,运用概率单位法计算半数致死浓度(LC50)。
抗氧化酶活性测定:根据计算出的LC50选取高效氯氰菊酯浓度(2、4、6、8 μg·L-1)作为实验浓度,另设置1个空白对照组,每个处理3个重复。开始暴露处理后,每隔24 h取1次样,到96 h时终止试验,每个处理取2条鱼,取样后立刻冷冻麻醉,解剖分别取斑马鱼整个头部、内脏团和躯干,用预冷的pH 7.5磷酸缓冲液(PBS)充分匀浆,4 ℃冷冻离心(12 000 r·min-1)25 min后取上清液,用于酶活的测定。酶活测定用试剂盒购自南京建成生物工程研究所。
抗氧化酶相关基因表达量的测定:暴露处理同上。暴露开始后,每隔24 h取1次样,到96 h时实验结束。每个处理取5条鱼,解剖取斑马鱼的肝脏、肠和脑后,液氮速冻。用无RNase的研磨棒快速研磨,trizol法提取总RNA。纯化后用NanoDrop100微量紫外分光光度计检测RNA质量和浓度。检测结果显示,A260/A280介于1.8~2.0之间,A260/A230大于2.0,RNA纯度和浓度均达到要求。利用TaKaRa反转录试剂盒将定量的RNA反转获得cDNA,以cDNA为模板进行实时荧光定量PCR。荧光定量所用仪器为Bio-RAD CFX96。试剂为SYBR Green PCR master mix。程序为95 ℃预变性3 min,然后3步反应,依次为95 ℃变性20 s,60 ℃退火20 s,72 ℃延伸20 s,进行42个循环,于每个循环的第3步即72 ℃、20 s后收集荧光信号,熔解曲线65 ℃到95 ℃,间隔0.5 ℃,每5 s读取1次荧光信号。所有基因序列来自GenBank,引物信息见表1。
1.3 数据分析
实验结果应用Excel和SPSS 17.0软件分析,数据采用one-way ANOVA进行方差分析,随后采用Tukey’s HSD进行显著性检验(P < 0.05表示差异显著;P < 0.01表示差异极显著)。
2 研究结果(Results)
2.1 高效氯氰菊酯对斑马鱼的急性毒性效应
染毒后观察斑马鱼的中毒症状后发现,实验中助溶剂对照组未出现斑马鱼死亡,而高浓度的高效氯氰菊酯即刻引起斑马鱼身体蜷曲,抽搐,鳃盖扇动加快,游动能力减弱并沉至缸底,偶尔出现急速游动和撞壁行为。1 h内出现死亡。暴露于低浓度高效氯氰菊酯经相对较长时间后,部分斑马鱼也会出现上述症状,但是程度较轻。
由表2可知,高效氯氰菊酯对斑马鱼的24 h、48 h、72 h、96 h半致死浓度(LC50)分别为10.30 μg·L-1、9.33 μg·L-1、8.26 μg·L-1、7.82 μg·L-1。根据表3的鱼类毒性分类标准[12],高效氯氰菊酯对斑马鱼属于极高毒物质。
2.2 高效氯氰菊酯对斑马鱼不同组织中抗氧化酶及乙酰胆碱酯酶活性的影响
图1结果显示,斑马鱼暴露于2 μg·L-1高效氯氰菊酯后,其躯干、头部、内脏团的总SOD活性在各个时间点均极显著增加;4 μg·L-1暴露组斑马鱼躯干总SOD活性在24 h、48 h、72 h时与对照相比极显著降低;24 h时,4 μg·L-1和6 μg·L-1暴露组斑马鱼内脏团总SOD活性均显著增加。

表1 实时荧光定量所用引物序列
注:β-Actin, Sod1, Cat的引物序列引自Liu等[25]。
Note: The primer sequences ofβ-Actin,Sod1,Catwere referred to Liu et al[25].
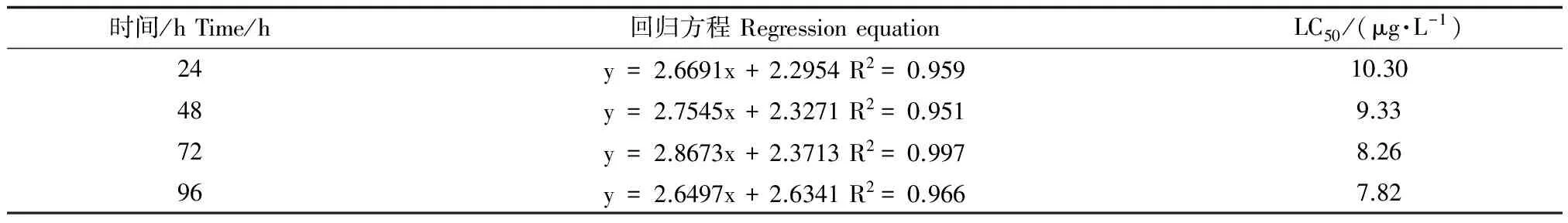
表2 高效氯氰菊酯对斑马鱼的急性毒性
注:回归方程中x为浓度对数,y为概率单位。
Note:x stands for logarithm of concentrations and y stands for probit in the regression equation.

表3 鱼类急性毒性分类标准
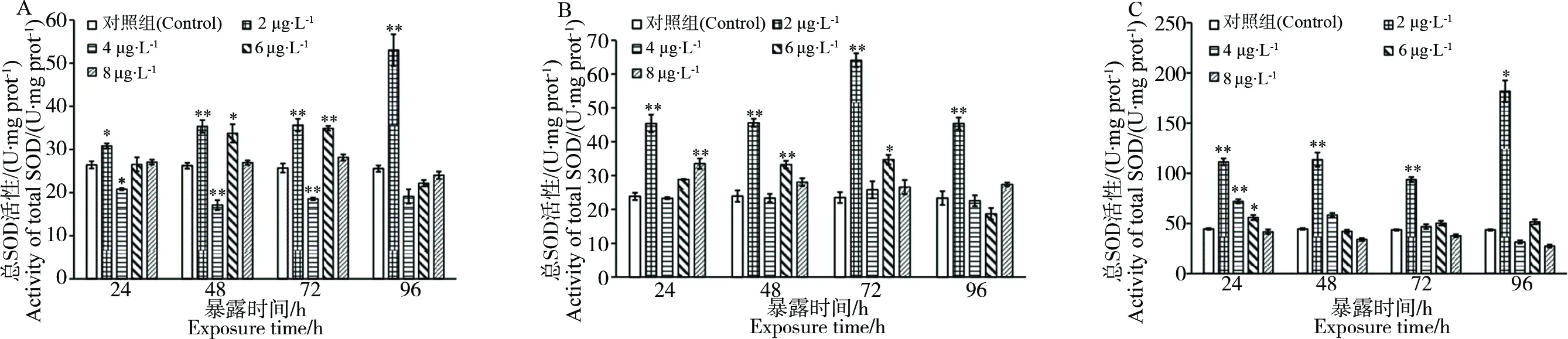
图1 高效氯氰菊酯暴露后斑马鱼躯干(A)、头部(B)和内脏团(C)的总SOD活性注:* P<0.05;** P<0.01。Fig. 1 Total SOD activity of zebrafish trunk (A), head (B) and visceral mass (C) after beta cypermethrin exposureNote:* P<0.05; ** P<0.01.
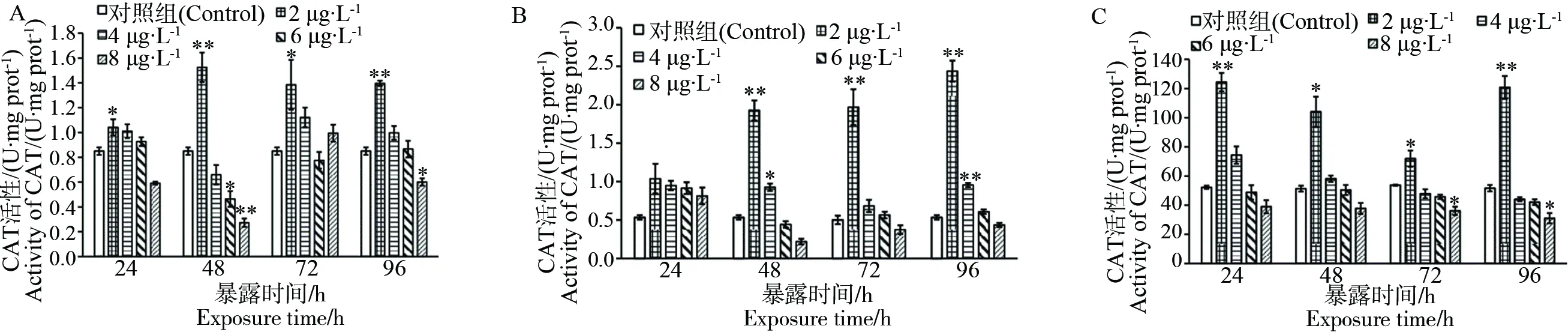
图2 高效氯氰菊酯暴露后斑马鱼躯干(A)、头部(B)和内脏团(C)的CAT活性注:* P<0.05;** P<0.01。Fig. 2 CAT activity of zebrafish trunk (A), head (B) and visceral mass (C) after beta cypermethrin exposureNote:* P<0.05; ** P<0.01.

图3 高效氯氰菊酯暴露后斑马鱼躯干(A)、头部(B)和内脏团(C)的AChE活性注:* P<0.05;** P<0.01。Fig. 3 AChE activity of zebrafish trunk (A), head (B) and visceral mass (C) after beta cypermethrin exposureNote: * P<0.05; ** P<0.01.
图2结果显示,2 μg·L-1高效氯氰菊酯暴露后,斑马鱼躯干(图2A)的CAT活性有显著增加,4 μg·L-1和6 μg·L-1暴露组几乎无显著变化。24 h和48 h时,8 μg·L-1暴露组的CAT活性和对照组相比显著降低。斑马鱼头部(图2B)在2 μg·L-1和4 μg·L-1暴露组48 h、72 h、96 h时的CAT活性与对照组相比有显著增加。斑马鱼内脏团(图2C)在2 μg·L-1暴露后的各个时间点的CAT活性都极显著增加,8 μg·L-1暴露组在72 h和96 h时的CAT活性相对于对照组显著降低。
图3结果显示,2 μg·L-1高效氯氰菊酯暴露后,斑马鱼躯干AChE活性极显著增加,斑马鱼头部AChE活性没有明显变化,斑马鱼内脏团48 h、72 h、96 h时AChE活性极显著增加;4 μg·L-1、6 μg·L-1暴露组斑马鱼躯干中除了72 h AChE活性有显著降低外,其余时间点无显著变化,斑马鱼头部72 h、96 h时AChE活性相对于对照组显著降低;8 μg·L-1暴露组躯干中AChE活性各个时间点均无显著变化;4μg·L-1、6 μg·L-1、8 μg·L-1暴露24 h时斑马鱼内脏团AChE活性均显著降低。

图4 高效氯氰菊酯暴露后斑马鱼肝脏(A)、肠(B)、脑(C)中Sod1的mRNA表达量注:* P<0.05;** P<0.01。Fig. 4 Relative Sod1 mRNA expression of zebrafish liver (A), gut (B) and brain (C) after beta cypermethrin exposureNote: * P<0.05; ** P<0.01.
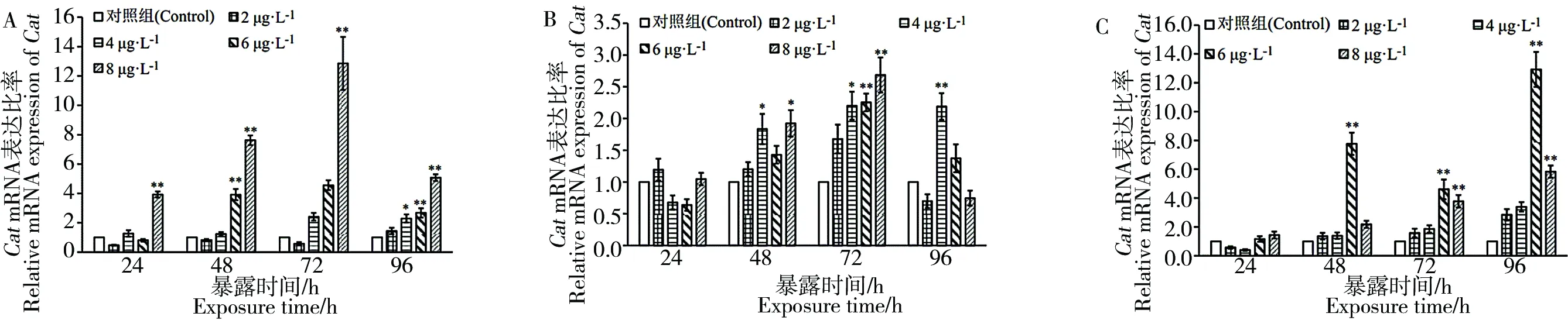
图5 高效氯氰菊酯暴露后斑马鱼肝脏(A)、肠(B)、脑(C)中Cat的mRNA表达量注:* P<0.05;** P<0.01。Fig. 5 Relative Cat mRNA expression of zebrafish liver (A), gut (B) and brain (C) after beta cypermethrin exposureNote: * P<0.05; ** P<0.01.
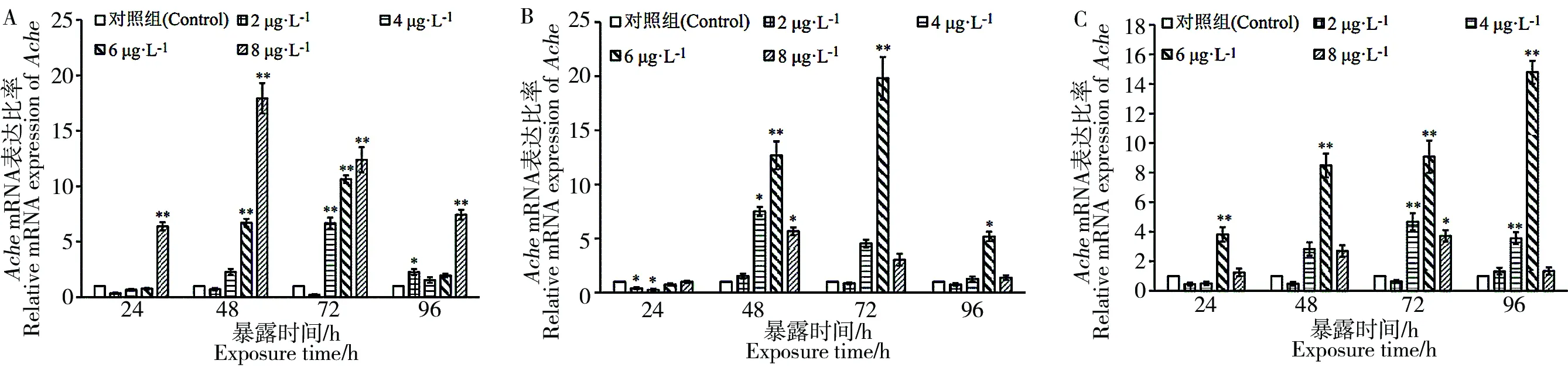
图6 高效氯氰菊酯暴露后斑马鱼肝脏(A)、肠(B)、脑(C)中Ache的mRNA相对表达量注:* P<0.05;** P<0.01。Fig. 6 Relative Ache mRNA expression of zebrafish liver (A), gut (B) and brain (C) after beta cypermethrin exposureNote: * P<0.05; ** P<0.01.
2.3 高效氯氰菊酯对斑马鱼抗氧化酶及乙酰胆碱酯酶相关基因表达量的影响
图4结果显示,高效氯氰菊酯暴露后,斑马鱼肝脏组织中(图4A),2 μg·L-1暴露组96 h时,Sod1的基因表达与对照相比极显著上调,4 μg·L-1暴露组各个时间点与对照相比均没有显著变化,6 μg·L-1暴露组从48 h开始有极显著上调,而8 μg·L-1暴露组,肝脏Sod1表达量在各个时间点都有极显著上调。斑马鱼肠组织中(图4B),2 μg·L-1暴露组在72 h时Sod1基因有极显著上调,4 μg·L-1暴露组在48 h和72 h时有显著上调,6 μg·L-1暴露组在24 h时Sod1表达下调,72 h开始表达上调,8 μg·L-1暴露组48 h时Sod1表达上调;斑马鱼脑组织中(图4C),2 μg·L-1、4 μg·L-1、8 μg·L-1暴露组96 h Sod1表达量与对照相比明显上调;6 μg·L-1暴露组从48 h开始表达明显上调。
图5结果显示,高效氯氰菊酯暴露后,斑马鱼肝脏组织(图5A),2 μg·L-1、4 μg·L-1、6 μg·L-1暴露组,除了4 μg·L-1的96 h和6 μg·L-1的48 h、96 h Cat表达量明显上调外,其余的Cat的表达量均无明显变化;8 μg·L-1暴露组,各时间点肝脏中Cat表达量与对照组相比均明显上调;肠组织中(图5B),暴露24 h时,各个暴露浓度组Cat表达量均无明显变化;2 μg·L-1暴露组Cat表达量没有明显变化;4 μg·L-1暴露组在48 h之后Cat表达量明显上调;6 μg·L-1和8 μg·L-1暴露组均在72 h时Cat表达量明显上调;脑组织中(图5C),2 μg·L-1和4 μg·L-1暴露组,Cat表达量与对照相比均无明显变化;6 μg·L-1暴露组Cat表达量48 h开始出现明显上调;8 μg·L-1暴露组72 h开始出现明显上调。
图6结果显示,高效氯氰菊酯暴露后,斑马鱼肝脏(图6A)在暴露24 h时,8 μg·L-1暴露组Ache表达量显著上调,其他暴露浓度组无明显变化;48 h时,6 μg·L-1和8 μg·L-1暴露组有显著上调;72 h时,4 μg·L-1、6 μg·L-1和8 μg·L-1暴露组均有显著上调;而暴露96 h时,2 μg·L-1和8 μg·L-1暴露组Ache表达上调,其余无明显变化。肠组织中(图6B),2 μg·L-1、4 μg·L-1高效氯氰菊酯暴露24 h时,Ache表达量出现显著下调;暴露48 h时,4 μg·L-1、6 μg·L-1和8 μg·L-1暴露组Ache表达量和对照相比明显上调;72 h和96 h时,仅6 μg·L-1暴露组Ache表达量明显上调。脑组织中(图6C),暴露24 h和48 h时,仅6 μg·L-1暴露组Ache表达量有明显上调;暴露72 h时,4 μg·L-1、6 μg·L-1、8 μg·L-1暴露组Ache表达量均有显著上调;96 h时,4 μg·L-1和6 μg·L-1暴露组Ache表达量明显上调。
3 讨论(Discussion)
高效氯氰菊酯属于Ⅱ型拟除虫菊酯农药,结构中含有α-氰基。这使得它的神经毒性远高于不含α-氰基的Ⅰ型拟除虫菊酯农药[13]。在本实验中,成年斑马鱼暴露于高效氯氰菊酯后,出现身体蜷曲,抽搐,鳃盖扇动加快,游动能力减弱等症状。间歇性出现无规律急速游动和撞壁行为。这是典型的神经中毒症状[14]。这些中毒的斑马鱼在转移到清水中后,症状会逐渐减轻直至恢复正常。半致死浓度实验结果显示,高效氯氰菊酯原药对斑马鱼的96 h半致死浓度为7.816 μg·L-1,远远小于1 mg·L-1。根据鱼类急性毒性标准,高效氯氰菊酯原药对斑马鱼属于剧毒类物质。
在研究污染物的致毒机理中,人们发现许多外源性化学物质是通过产生大量活性氧,从而诱发机体多种损伤的。而这些产生活性氧的污染物的暴露,对体内抗氧化作用的酶有诱导作用[15]。超氧化物歧化酶(SOD)是生物体内重要的抗氧化酶,是一类敏感的分子生态毒理学指标。它可以催化超氧阴离子与氢离子反应生成过氧化氢,从而解除活性氧对机体的损伤。许多研究表明,当生物体受到轻度逆境胁迫时,SOD活性往往升高;而在重度逆境胁迫下,SOD活性通常降低,使生物体内积累过量的活性氧,从而导致生物体的损伤[16]。在本文的研究结果中,低浓度(2 μg·L-1)高效氯氰菊酯暴露后,斑马鱼躯干、头部、内脏团各个组织中总SOD活性均有显著性升高。这一结果与Beaumont和Newman[17]以及唐学玺和张培玉[16]的研究结果相似。Stebbing[18]认为毒物在低浓度下出现的这种补偿现象是其在低毒情况下的刺激反应。他把这一现象称为“毒物兴奋效应”;除了4 μg·L-1高效氯氰菊酯暴露24、48、72 h时躯干中总SOD活性出现了显著降低,相对高浓度的高效氯氰菊酯暴露之后对斑马鱼组织中总SOD活性的抑制作用不是很明显。
过氧化氢酶(CAT)催化H2O2分解为H2O与O2,使得H2O2不至于与O2在铁螯合物作用下反应生成非常有害的·OH,在减轻活性氧自由基对机体细胞的氧化损伤方面起着重要作用。在本研究结果中,低浓度的高效氯氰菊酯(2 μg·L-1)暴露后,斑马鱼躯干、头部、内脏团均出现CAT活性显著升高的现象,这一结果符合“毒物兴奋效应”;在高浓度高效氯氰菊酯(6 μg·L-1、8 μg·L-1)暴露初期(24 h、48 h),斑马鱼躯干CAT活性显著下降,可能是由于躯干的细胞在接触到高浓度高效氯氰菊酯后造成了部分损伤,而暴露后期(72 h、96 h)CAT活性又恢复到正常水平。这可能是由于未损伤的细胞提高CAT活性补偿了受损细胞的部分;斑马鱼头部在4 μg·L-1高效氯氰菊酯暴露后CAT活性有显著上升的趋势(毒物兴奋效应)而躯干和内脏团没有,且高浓度(6 μg·L-1、8 μg·L-1)暴露后头部CAT活性无明显变化而躯干和内脏团有显著下降的趋势。出现这种不同可能与头部眼、脑、鳃等重要器官对高效氯氰菊酯的毒性响应有关。具体的原因还有待进一步研究。斑马鱼内脏团在8 μg·L-1高效氯氰菊酯暴露72 h和96 h时CAT活性显著下降,而在24 h和48 h时无明显变化。这一现象与躯干正好相反。可能的原因是:斑马鱼内脏团不是直接接触高效氯氰菊酯,因而高效氯氰菊酯对细胞的损伤作用也相对延迟。
乙酰胆碱酯酶(AChE)具有羧肽酶和氨肽酶的活性,能使乙酰胆碱(ACh)水解成胆碱和乙酸,在神经传导中起着关键作用。AChE活性的测定是评价水生动物对于神经毒剂化合物暴露/效应的有效手段[19]。AChE上有有机磷与氨基甲酸酯类化合物的作用位点,在监测工作中被认为是有机磷和氨基甲酸酯类污染的重要检测指标[20-21]。本研究发现,斑马鱼中AChE活性对高效氯氰菊酯也有一定响应,在躯干和内脏团中表现了低浓度(2 μg·L-1)刺激效应,高浓度的高效氯氰菊酯暴露后也表现出了对AChE活性的抑制作用。但不同的组织出现这种抑制作用的时间点不一样。如对躯干和头部AChE活性的抑制主要出现在暴露的初期(24 h、48 h),而对内脏团AChE活性的抑制主要在暴露后期(72 h、96 h)出现。这种差异可能与接触到污染物的时间先后有关。已有研究证明拟除虫菊酯类农药一般不抑制胆碱酯酶。它是通过延缓Na+通道关闭而使去极化时间延长导致重复放电[22]。而在本研究中,高浓度的高效氯氰菊酯亦对AChE活性有抑制作用。这种作用干扰了斑马鱼体内乙酰胆碱的降解,使乙酰胆碱与神经后膜的乙酰胆碱受体的作用无法正常终止,也可能造成斑马鱼长期处于神经兴奋状态[23],从而表现出实验中所观测到的抽搐、蜷曲等神经中毒症状。因此,高效氯氰菊酯对斑马鱼的神经毒性可能存在多种作用机制。
生物机体在受到外界刺激后,机体在基因水平、蛋白水平、细胞水平、组织水平等方面均会有响应[24],用以减轻或适应该刺激。但是,酶活性的变化受多种因素(如生物种类、污染物类别、剂量、时效等)的影响,有时对外界刺激表现出的效应关系比较复杂多变。因此,近些年有许多研究通过检测相关基因的表达水平来监控化学污染物的潜在毒性机制。Liu等[25]研究PCB126对斑马鱼的发育毒性、氧化损伤及相关基因表达的影响时发现,一定浓度的PCB126会引起斑马鱼胚胎中Sod1和Cat mRNA表达上调;Jin等[26]研究毒死蜱对斑马鱼早期生命阶段的毒性作用时发现,一定浓度的毒死蜱会诱导斑马鱼Cu/Zn-Sod、Mn-Sod、Cat的基因表达上调;而Wu等[27]的研究却发现斑马鱼胚胎暴露于一定浓度的四溴双酚A(TBBPA)时,Cu/Zn-Sod、Cat的mRNA表达下调。在本文的研究结果中,相对高浓度(8 μg·L-1)的高效氯氰菊酯暴露24 h后即可诱导斑马鱼肝脏、肠和脑中Sod1和Cat的mRNA表达,相对较低浓度(2 μg·L-1、4 μg·L-1、6 μg·L-1)的高效氯氰菊酯暴露72 h、96 h后也会诱导这些基因的表达上调。这一结果与Liu等[25]和Jin等[26]的结果类似。这说明高效氯氰菊酯能引起斑马鱼的氧化损伤,高浓度的高效氯氰菊酯暴露后,斑马鱼机体在短时间内会做出反应,即上调表达Sod1和Cat等抗氧化酶相关基因来减弱这种氧化损伤;而低浓度的高效氯氰菊酯暴露在短时间内对斑马鱼机体的损伤还未能引起基因水平的变化。经过一段时间后,斑马鱼体内的毒物积累,也能诱导抗氧化基因的表达上调。斑马鱼肝脏、肠、脑中Ache的mRNA表达量与高效氯氰菊酯也存在与Sod1、Cat类似的剂量效应关系。这说明高效氯氰菊酯的确会影响斑马鱼的乙酰胆碱酯酶,从而影响神经递质的传递。
从时间序列上看,斑马鱼在低浓度高效氯氰菊酯急性暴露后,总SOD、CAT、AChE活性均升高,且随暴露时间的延长活性升高的幅度呈增大的趋势。而高浓度的高效氯氰菊酯暴露后,酶活性随时间的变化趋势就变得复杂。在基因表达方面,斑马鱼在低浓度高效氯氰菊酯急性暴露时,Sod1、Cat、Ache的mRNA表达先是无明显变化,然后随着暴露时间的延长逐渐出现上调,而高浓度的高效氯氰菊酯暴露后,Sod1、Cat、Ache的mRNA表达均上调,且随着暴露时间的延长上调倍率呈现先增加后减少的趋势。暴露后期基因上调倍率的减少可能是损伤细胞逐渐增加造成的。基因水平的这种变化趋势或许正是使高浓度高效氯氰菊酯暴露后酶活性随时间变化变得复杂的原因。从酶活性和相关基因表达与高效氯氰菊酯暴露的时间-效应关系来看,在96 h的急性暴露期内,高效氯氰菊酯对斑马鱼的毒害作用并没有随着暴露时间的延长而减弱。
高效氯氰菊酯暴露后斑马鱼体内抗氧化酶活性及相关基因表达的变化说明高效氯氰菊酯对斑马鱼造成了氧化损伤。这表明斑马鱼的中毒甚至死亡是由神经毒性和氧化损伤共同造成的。斑马鱼抗氧化酶活性和相关基因的表达均可以作为生物标记物来监测水生生态系统中的高效氯氰菊酯污染。但是,它们分别表现出了不同的剂量-效应和时间-效应关系。这两对效应关系不尽相同的原因可能是基因表达成蛋白并表现出酶活性还受许多复杂因素(如蛋白修饰、辅酶因子等)的影响以及基因表达对外界刺激的响应相对延迟。
致谢:感谢中科院武汉水生生物研究所张永安研究员和卢小兵博士对实验的帮助。
[1] 金美青, 刘维屏. SPs对鱼类的毒性作用研究进展[C]. 第四届全国环境化学学术大会论文集(上册), 南京, 2007: 253-254
[2] 尹伊伟, 王朝晖, 林小涛, 等. 拟除虫菊酯农药对水生生物的影响及其防护措施[J]. 广州环境科学, 2000, 15(1): 9-13
Yin Y W, Wang Z H, Lin X T, et al. Effects of pyrethroid pesticides on aquatic ecosystem and studies on their protection countermeasure [J]. Guangzhou Environmental Sciences, 2000, 15(1): 9-13 (in Chinese)
[3] 毛阿敏. 高效氯氰菊酯对克氏原鳌虾免疫毒性的研究[D]. 太原: 山西大学, 2013: 5-6
Mao A M. Effects of beta-cypermethrin on immunotoxicity of Procambarus clarkia [D]. Taiyuan: Shanxi University, 2013: 5-6 (in Chinese)
[4] 罗曾玲, 龚擎红, 肖海群, 等. 拟除虫菊酯杀虫剂对鱼类毒性作用的研究进展[J]. 江西水产科技, 2011(2): 45-48
Luo Z L, Gong Q H, Xiao H Q, et al. Review of toxic effects to fish of pyrethroid insecticides [J]. Jiangxi Fishery Sciences and Technology, 2011(2): 45-48 (in Chinese)
[5] Anadòn A, Martínez-Larraaga M R, Martínez M A. Use and abuse of pyrethrins and synthetic pyrethroids in veterinary medicine [J]. The Veterinary Journal, 2009, 182: 7-20
[6] Prusty A K, Meena D K, Mohapatra S, et al. Synthetic pyrethroids (type II) and freshwater fish culture: Perils and mitigations [J]. International Aquatic Research, 2015(7): 163-191
[7] 徐永学. 高效氯氰菊酯对斑马鱼胚胎发育的毒性影响[D]. 北京: 中国农业科学院, 2012: 11-16
Xu Y X. Toxicity effect on embryo development of zebrafish for insecticide beta-cypermethrin [D]. Beijing: Chinese Academy of Agricultural Science, 2012: 11-16 (in Chinese)
[8] 麻冬梅, 段红英, 吴旭东, 等. 高效氯氰菊酯对鲤鱼的生化指标影响研究[J]. 安全与环境学报, 2007, 7(6): 9-12
Ma D M, Duan H Y, Wu X D, et al. Toxicity stress of beta-cypermethrin on carp [J]. Journal of Safety and Environment, 2007, 7(6): 9-12 (in Chinese)
[9] Wei K Q, Yang J X. Oxidative damage induced by copper and beta-cypermethrin in gill of the freshwater crayfish Procambarus clarkia [J]. Ecotoxicology and Environmental Safety, 2015, 113: 446-453
[10] Wei K Q, Yang J X. Oxidative damage of hepatopancreas induced by pollution depresses humoral immunity response in the freshwater crayfish Procambarus clarkii [J]. Fish & Shellfish Immunology, 2015, 43(2): 510-519
[11] 周永欣, 章宗涉. 水生生物毒性试验方法[M]. 北京: 农业出版社, 1989: 1-20
[12] 魏复盛. 水和废水监测分析方法(第四版)[M]. 北京: 中国环境科学出版社, 2002: 728
[13] Kaviraj A, Gupta A. Biomarkers of type II synthetic pyrethroid pesticides in freshwater fish [J]. BioMed Research International, 2014(9): 928063
[14] 贺锡雯, 吕京. 有机磷类和拟除虫菊酯类农药的神经毒作用机理[J]. 中国药理学与毒理学杂志, 1997, 11(2): 89-90
He X W, Lv J. The neurotoxic mechanism of organophosphorus and pyrethroid pesticides [J]. Chinese Journal of Pharmacology and Toxicology, 1997, 11(2): 89-90 (in Chinese)
[15] 徐立红, 张甬元, 陈宜瑜. 分子生态毒理学研究进展及其在水环境保护中的意义[J]. 水生生物学报, 1995, 19(2): 171-185
Xu L H, Zhang Y Y, Chen Y Y. The advances of molecular ecotoxicology and its significance in water environment protection [J]. Acta Hydrobiologica Sinica, 1995, 19(2): 171-185 (in Chinese)
[16] 唐学玺, 张培玉. 蒽对黑鲪超氧化物歧化酶活性的影响[J]. 水产学报, 2000, 24(3): 217-220
Tang X X, Zhang P Y. Effects of anthracene on activity of superoxide dismutase in Sebastodes fuscescens [J]. Journal of Fisheries of China, 2000, 24(3): 217-220 (in Chinese)
[17] Beaumont A R, Newman P B. Low levels of tributyltin reduce growth of marine microalgae [J]. Marine Pollution Bulletin, 1986, 17(10): 457-461
[18] Stebbing A R D. Hormesis—The stimulation of growth by low levels of inhibitors [J]. Science of the Total Environment, 1982, 22(1): 213-234
[19] Cajaraville M P, Bebianno M J, Blasco J, et al. The use of biomarkers to assess the impact of pollution in coastal environments of the Iberian Peninsula: A practical approach [J]. Science of the Total Environment, 2000, 247: 295-311
[20] Dembele K, Haubruge E, Gaspar C. Concentration effects of selected insecticides on brain acetylcholinesterase in the common carp (Cyprinus carpio) [J]. Ecotoxicology and Environmental Safety, 2000, 45(1): 49-54
[21] Bakry N M, Osman K A, El-Aswad A F, et al. Biomonitoring of pesticide contamination from the pesticide industry [J]. Egyptian Society of Toxicology, 2001, 24: 107-111
[22] Narahashi T. Neurotoxicology of Insecticides and Pheromones [M]. Springer US, 1979: 211-243
[23] 贾秀英, 董爱华. Cd, Cr(Ⅵ)及其复合污染对鲫鱼脑组织乙酰胆碱酯酶活性的影响[J]. 农业环境科学学报, 2003, 22(3): 337-339
Jia X Y, Dong A H. Cd, Cr(Ⅵ) single and combined pollution on acetycholinesterase activity in brain of Carassius auratus [J]. Journal of Agro-Environment Science, 2003, 22(3): 337-339 (in Chinese)
[24] 蔡中华, 陈艳萍, 周进, 等. 生物标志物(Biomarkers)在海洋环境监测中的研究与进展[J]. 生命科学, 2012, 24(9): 1035-1044
Cai Z H, Chen Y P, Zhou J, et al. Research and progress of biomarkers in marine environmental field [J]. Chinese Bulletin of Life Sciences, 2012, 24(9): 1035-1044 (in Chinese)
[25] Liu H, Nie F H, Lin H Y, et al. Developmental toxicity, oxidative stress, and related gene expression induced by dioxin-like PCB 126 in zebrafish (Danio rerio) [J]. Environmental Toxicology, 2014. DOI: 10.1002/tox.22044
[26] Jin Y X, Liu Z Z, Peng T, et al. The toxicity of chlorpyrifos on the early life stage of zebrafish: A survey on the endpoints at development, locomotor behavior, oxidative stress and immunotoxicity [J]. Fish & Shellfish Immunology, 2015, 43: 405-414
[27] Wu S M, Ji G X, Liu J N, et al. TBBPA induces developmental toxicity, oxidative stress, and apoptosis in embryos and zebrafish larvae (Danio rerio) [J]. Environmental Toxicology, 2015. DOI: 10.1002/tox.22131
Variations of Relevant Enzyme Activities and Genes Expressions in Zebrafish under Acute Exposure to Beta Cypermethrin
Wang Li, Zhang Yunze, Geng Ge, Qin Tingting, Liu Deli, Xiong Li*
Hubei Key Laboratory of Genetic Regulation and Integrative Biology, College of Life Science, Central China Normal University, Wuhan 430079, China
Beta cypermethrin is widely used in agricultural production and pest control in daily life. However, it is highly toxic to aquatic organisms. To explore the acute toxic effects of beta cypermethrin to zebrafish, the activity of total superoxide dismutase (total SOD), catalase (CAT), acetylcholin esterase (AChE), and related gene expression were measured after the exposure of beta cypermethrin. The results of acute tocixity test showed that beta cypermethrin is highly toxic to zebrafish, the symptoms of poisoning include curling, tic, faster flapping of operculum, weaker swimming ability, intermittent appearance of irregular fast moving and striking behaviour. The enzymatic activity of total SOD, CAT, and AChE in zebrafish increased in low dose of beta cypermethrin and decreased in high dose. The results of related gene expression showed that beta cypermethrin up-regulated the mRNA expression of Sod1, Cat, Ache in zebrafish liver, gut, and brain. All the results indicate that the combination effect of neurotoxicity and oxidative damage lead to the toxication even death of zebrafish.
beta cypermethrin; zebrafish; acute tocixity; oxidative damage
国家自然科学基金项目(No.31071653,31371893);中央高校基本科研业务费专项项目(No.CCNU12A02001)
王丽(1992-),女,硕士研究生,研究方向为分子毒理学,E-mail: waw934356@sina.com;
*通讯作者(Corresponding author), E-mail: xionglily@mail.ccnu.edu.cn
10.7524/AJE.1673-5897.20151014004
2015-10-14 录用日期:2016-02-16
1673-5897(2016)4-146-09
X171.5
A
简介:熊丽(1968—),女,环境科学博士,副教授,主要研究方向为分子生态毒理学和污染生物化学,发表学术论文40余篇。
王丽, 张耘泽, 耿歌, 等. 高效氯氰菊酯急性暴露中斑马鱼相关酶活性和基因表达变化[J]. 生态毒理学报,2016, 11(4): 146-154
Wang L, Zhang Y Z, Geng G, et al.Variations of relevant enzyme activities and genes expressions in zebrafish under acute exposure to beta cypermethrin [J]. Asian Journal of Ecotoxicology, 2016, 11(4): 146-154 (in Chinese)
