高频超声波及其在食品工业中的降解改性研究进展
2016-12-02王丹丽马晓彬王文骏邹明明刘东红
王丹丽,马晓彬,王文骏,邹明明,丁 甜,刘东红,2,*
(1.浙江大学生物系统工程与食品科学学院,浙江 杭州 310058;2.浙江大学馥莉食品研究院,浙江 杭州 310058)
高频超声波及其在食品工业中的降解改性研究进展
王丹丽1,马晓彬1,王文骏1,邹明明1,丁 甜1,刘东红1,2,*
(1.浙江大学生物系统工程与食品科学学院,浙江 杭州 310058;2.浙江大学馥莉食品研究院,浙江 杭州 310058)
超声波根据频率的不同可以分为低频超声波和高频超声波两类。高频超声波相比于低频超声波,其空化效应有所不同。高频超声波能产生大量活性自由基,有独特的降解改性效果,在食品工业中有很大的应用潜力。但目前对于这一方面的应用研究还没有系统的总结。本文简要综述了超声波的作用原理,并扩充了高频超声波在分子降解改性领域中的应用。由高频超声波的作用机理出发,综述了目前国内外食品领域中高频超声波降解改性不同物质的研究进展及其优势。高频超声波技术不仅能对分子产生降解效果,对分子中的一些基团及其性质也有一定改性效果。同时,将高频超声波对多聚物分子降解改性机理方面的研究进行了归纳整理,以期为高频超声波在大分子物质降解改性方面的应用提供理论基础。
高频超声波;降解;改性;空化效应;自由基
超声波是指超出人耳听力范围的机械波(频率>20 kHz),其中又将频率较高的一类(频率>100 kHz)称为高频超声波(图1)。目前超声波设备的频率一般在20 kHz~10 MHz的范围内[1-3]。作为一种先进的食品加工技术,超声波有着作用温和、针对性强的特点,大量应用于食品及其他领域,具有很大发展前景。根据超声波的频率、功率不同,又可将超声波分为两类:高功率低频超声波和低功率高频超声波。其中高功率低频超声波(频率在20~100 kHz之间)也被称作功率超声波,在食品加工中有着广泛应用,如促进乳化、破坏细胞、灭菌灭酶、软化肉类和物质改性等[4-5]。低功率高频超声波(其频率主要集中于100 kHz~10 MHz)不仅在医学诊断中应用较多,并且已广泛应用于食品理化性质的分析检测,如硬度、成熟度、糖分、酸度等[6]。

图1 超声波频率分布图Fig. 1 Ultrasound frequency range

表1 高频超声波在食品加工中的应用情况Table 1 Application of high frequency ultrasound in food processing
高频超声波有着不同于低频超声波的化学效应和物理效应,能产生大量的活性自由基,由此对多聚物产生降解改性作用。将超声波作用于在水溶液中的氧化反应时,高频超声波比低频超声波更加节能[13]。在一定条件下随着频率的上升,实际超声功率和输入功率之比增大,即转换效率提高,高频超声波能达到更高的声化学效率[14-15]。
目前,超声波频率对多聚物降解效果的影响还没有一个定论。另外,高频降解的速率也不单单受频率的影响,还受分子结构、溶解体系等因素的影响。因此研究高频超声波的降解机理是一个十分有意义的工作。本文综述了高频超声波对食品中一些物质的降解作用的研究情况,并将其机理方面的研究进行了归纳分析。
1 超声波作用机制
超声波对液态系统的影响源于其空化效应,其机理如下:超声波在液体介质中传播时存在一个正负压强的交变周期,对介质分子产生交替的压缩和拉伸作用[16]。当声波能量足够大时,液体介质发生断裂,产生空穴、形成微泡,微泡进一步膨胀成为空化气泡。随着超声波的传播,有些气泡会重新溶解于液体介质中,有些则随着超声波的变化而逐渐长大,达到临界半径后发生溃陷、破裂。空化气泡这种一系列的现象就称为空化效应[17]。有研究认为超声空化作用是依赖于预先存在于介质中的核而形成的[18-19]。在空化气泡运动和破裂过程中,释放出大量能量,从而导致局部温度和压力的升高(每个气体微泡中心的温度可高达4 300 K,压力可达到1 000 个大气压),产生强大的机械冲击和大量活性自由基,还伴随着荧光的产生[20]。
许多研究证实,在某些条件下,水分子被分裂形成H·和·OH。在其他物质存在的情况下,还会形成另外一些活性基团,如·OOH、O·和H2O2等[21-23]。产生的自由基会进行重组或者与气泡内腔内气态物质反应,或者进入溶液中作为氧化剂和其他物质发生反应,从而产生氧化、改性等作用[24]。这对化合物的热解反应、超临界水氧化以及自由基氧化反应都有促进作用。而空化气泡在振荡或破裂时形成的高速微射流会对溶液产生剪切力,造成物质结构的改变。这种以超声波促进的化学反应都称为声化学反应。
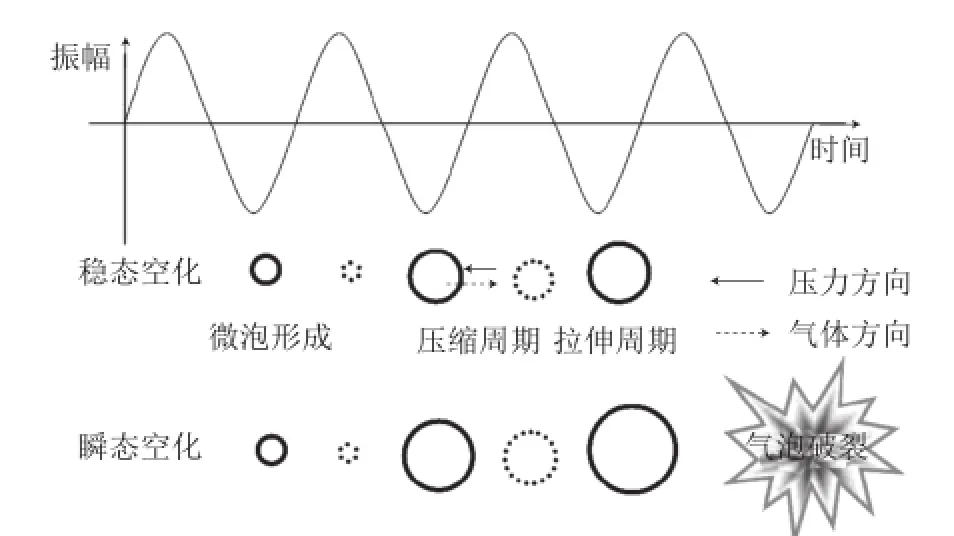
图2 超声波产生的稳态空化与瞬态空化效应[27]Fig. 2 Stable cavitation and transient cavitation induced by ultrasound[27]
超声波频率对空化气泡的性质和运动情况都有很大影响,气泡半径随频率的增加而减小[25-26]。Sun Dawen等[27]根据超声波频率的不同提出了稳态空化和瞬态空化两个概念。指出在几十千赫兹的低频率时产生的空化现象属于瞬态空化。该过程中空化气泡扩大迅速,在达到临界尺寸后破裂,释放大量能量,局部产生瞬时高温高压和微射流,对介质产生机械影响。稳态空化则存在于高频的声波中。该过程中空化气泡随超声波的传播不断被压缩和拉伸,体积慢慢增大,但不会达到临界尺寸,空化气泡不会破裂,因此稳态空化更加温和(图2)。在空化气泡不断振荡的过程中,液体介质中形成涡流,同时能量在空化气泡表面聚集。其对介质产生化学性影响而非机械性影响,主要通过·OH、H2O2的形成来实现。由于这些作用,超声波处理对物质的物理、化学性质都有所影响,能对一些多聚物分子产生降解改性效果。
2 高频超声波降解改性应用研究
在低频(如20 kHz)超声波作用过程中主要是强烈的物理效应起作用,而在高频超声波作用时,虽然物理效应仍存在,但化学效应占据主导地位,此时介质中活跃的气泡数目较高,瞬态空化较少,稳态空化成为声化学效应的主要形成因素。已有研究表明,在其他条件相同的情况下,高频率的超声波能产生更多的·OH和H2O2[28-29],由此产生空化效应会对分子的理化特性和结构特性产生较大影响。
聚合物的分子大小和结构是决定热、机械和生物降解的重要因素。通常分子的体积越大,降解程度普遍越低,降解速率也越低。在水溶液中由于超声波产生的自由基更有助于水溶性多聚物的降解[30]。不同于化学降解或热分解作用,超声波处理对物质结构特性的改变是一个非随机的过程。裂解通常发生在分子的中心。且当相对分子质量低于一定值时,物质无法通过超声波降解。这一特性也可以用来缩小相对分子质量的分布[31]。
2.1 高频超声波对多糖的影响
高频超声波处理对多糖大分子也有许多应用,尤其在降解改性方面。过去多糖降解大多采用相对传统的方法,如化学改性、酶改性等。但化学改性比较费时费力,并且消耗大量有机试剂,产生不必要的副产物;酶法相对来讲比较复杂,而且成本高,工业应用限制性大。而利用高频超声波,不但在降解改性方面有着更快速、温和、环保等特点[32],还能对物料的流变学特性产生一定的影响。
Zuo等[33]对超声波处理(211 kHz)之后的糯米淀粉糊的糊化特性进行了研究,利用快速黏度分析仪对其糊化特性进行了测量分析。超声波处理之后的淀粉糊和未经超声波处理的淀粉糊相比,其黏度显著降低。粒度测量和扫描电子显微镜的结果也说明超声处理之后的淀粉颗粒粒径变得更小、更均匀。Park等[34]利用400 kHz的超声波来处理浸泡了不同时间的糙米,并从中提取出淀粉,研究超声波处理对糙米品质及其淀粉性质的影响。其结果表明超声波处理后的糙米口感质量更好,更接近精米,但又保留了比精米更多的营养成分。同时,超声波处理提高了糙米淀粉的溶解度以及结合水的能力。经超声波处理之后的淀粉,糊化特性也有所改变,变得更容易糊化,且黏度更大。这是由于超声波处理降解了淀粉分子,使其颗粒变小,从而分子变得更加混乱、表面积更大、更容易与水结合。
Czechowska-Biskup等[35]用360 kHz超声波处理壳聚糖溶液对其进行降解改性,并模仿人体消化系统的pH值变化来研究壳聚糖与脂肪结合的能力。实验结果表明,高频超声波处理能有效降低壳聚糖的分子质量,同时会产生氧化副作用,增加了壳聚糖分子中羰基基团的含量。随着壳聚糖分子质量的降低,结合的脂肪含量也随之增加。可见,高频超声波处理还可以对一些大分子物质的功能特性产生影响。
2.2 高频超声波对蛋白质的影响
经过高频超声波处理,蛋白质分子的构象会产生改变,其亲水端被暴露在水中,亲水性增强,从而导致溶解度提高。Jambrak等[36]研究了超声波对乳清蛋白的溶解性和起泡特性的影响,发现500 kHz的超声波处理使乳清分离蛋白的溶解度明显提高,但对乳清蛋白的起泡特性和起泡稳定性没有很大影响。Matouqa等[37]的研究结果也表明高频超声波(2.4 MHz)处理能明显提高酸奶乳清和干酪乳清中乳清蛋白的溶解率。蛋白浓度越低,其溶解率提高效果越明显,在酸奶乳清中溶解率最高可增加至2 倍,干酪乳清中最高可增加至3 倍。
高频超声波对蛋白质的影响作用可以应用于一些有特定功能的酶蛋白,改变其功能特性。有研究认为高频超声中所产生的高活性自由基是导致酶失活的重要因素[38]。高活性自由基与蛋白质中的半胱氨酸残基反应,导致蛋白质分子间形成二硫键,从而产生聚集体,使酶变性。由此,可以利用高频超声波对食品中一些产生不良影响的酶进行灭活或者对一些有益酶进行改性。Basto等[39]研究了20、150、500 kHz的超声波处理对漆酶稳定性和酶活性的影响。研究证明超声波能缩短漆酶的半衰期,其中150 kHz处理下的漆酶半衰期最短,最不稳定。Basto等[39]在体系中引入聚乙烯醇作为酶的保护剂,减少了超声过程中漆酶的失活,从而使超声波辅助酶解的底物降解率较之于纯酶解和纯超声降解都有很大提高,其中150 kHz条件下的酶解效果最好。因此可以根据具体情况,采用不同的参数或引入一些添加剂来达到理想的酶的灭活或活化效果。
2.3 高频超声波对食品工业中其他物质的影响
运用高频超声波的这一性质还可以对食品工业废水或者包装中的一些残留的有害物质进行降解。双酚A作为一种非生物降解的抗氧化剂,常被用于食品包装领域,添加至塑料包装中或者金属容器的内壁涂层中。双酚A的迁移以及在废水中的残留都可能会对人体或环境产生危害。Nikfar等[40]将超声波和H2O2相结合,用于去除水溶液中的双酚A。使用130 kHz的高频超声波和H2O2联合处理可以使双酚A的降解率达98%以上,而单独使用超声波处理或H2O2处理的去除程度均不超过50%。由此,可以推断,高频超声波作为一种辅助技术可以有效加速一些反应的进程。
高频超声波作用所产生的大量活性自由基可以和易氧化的食品成分反应,在一定程度上可增强某些食品成分的功能特性。例如一些酚类化合物,可以通过这一声化学效应被羟基化[41-42]。矢车菊素-3-葡萄糖苷在经过高频超声波(358 kHz)处理之后,其抗氧化活性有所下降[43]。另有研究发现经过986 kHz超声波处理之后,红树莓酱的总酚含量增加了10%左右,而经过20 kHz和490 kHz超声波处理后,树莓酱的总抗氧化活性、总酚含量和总单体花色苷含量均发生了变化[44]。然而,高频超声波产生的活性自由基究竟能增强哪一类食品组分的抗氧化性或者其他功能特性,还有待进一步探索。
3 高频超声波对多聚物的影响机制探究
虽然高频超声波与低频超声波相比,作用效果更加温和,但近年来许多研究表明高频超声波产生的强烈的自由基效应在大分子降解改性上有着明显优势[45-46]。超声波对于特定某种物质的降解作用总是存在一个最适的频率。Mostafa等[47]研究了不同频率(0.75、1.00、1.25、1.75、2.00 MHz)的超声波对不同链长的聚苯乙烯苯溶液的降解作用。当超声波频率低于1 MHz时,降解效果逐渐增强,当频率大于1 MHz时,降解效果逐渐减弱,表明其降解的最适频率为1 MHz,在这一频率,超声波的机械效应和自由基效应的降解效果达到最佳。但Mostafa等[47]并没有对其中的自由基效应或者机械效应进行进一步的深入研究。
不同的超声波频率会对超声的氧化进程有所影响,H2O2在高频率时的产量往往比低频率时多。在较高的超声波频率下,空化气泡的体积较小,破裂时释放的能量少,破裂时间短,生成的自由基离开气泡后才发生一系列反应;而在较低的频率下,自由基停留在气泡中的时间相对较长,在高温的环境下遵循燃烧化学的反应路径,形成O2,从而抑制了H2O2的生成和氧化进程。此外,体系中的气体也会对H2O2的产量产生影响,并且在不同频率下影响不同。O2的存在增加了高频条件下H2O2的产量但减少了低频条件下H2O2的产量。高频超声波作用时分子氧会和氢原子形成·OOH(公式(1)),降低H·和·OH重组的概率,因此·OH的含量相对提高;而在低频条件下,气泡存在时间相对较长,生成的·OH又与·OOH反应,形成了水和氧气(公式(2)),从而减少了H2O2的产量[48]。可见自由基效应除了频率这一影响因素,还受其他许多因素影响。
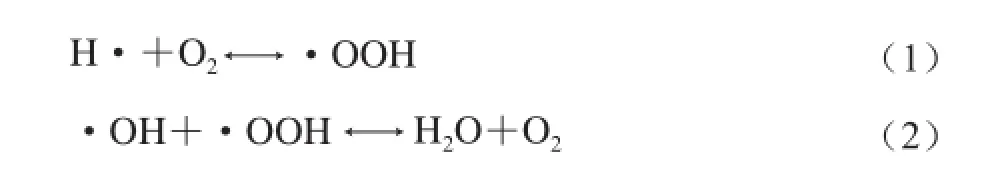
不同的溶剂对超声降解的机理和效果也有不同影响。Tran等[49]研究了一种简单经济的方法来量化的超声波产生的机械效应,发现在频率达到100 kHz之后,随着超声波频率的提高,机械效应逐渐减弱。同时对苯溶液和水溶液中的降解机理进行了研究分析。在有机溶剂中自由基无法形成,超声波对大分子的降解作用主要源于机械效应。同时较高的蒸汽压使得溶液中形成的气泡难以压缩,降低了气泡塌陷的效率,从而影响聚合物的降解。在水溶液中,自由基效应能够形成,产生的自由基会攻击聚合物,并且水的蒸汽压比苯的蒸汽压小,气泡塌陷更强,因此在水溶液中聚合物的降解速率更高。
超声降解的主要作用原理是空化产生的机械效应和自由基效应。研究人员主要通过添加自由基清除剂来研究高频超声波的自由基效应对多聚物降解的贡献。Lastre-Acosta等[50]研究了不同磺胺嘧啶水溶液pH值、初始浓度、超声波的频率和功率对磺胺嘧啶降解的影响,并通过自由基抑制剂的加入研究其降解机理。结果表明高频超声波对磺胺嘧啶有明显的降解效果,且在580 kHz频率下,较高的超声波功率比和微酸性(pH 5.5)条件的去除效率和去除速率更高。加入自由基抑制剂(叔丁醇)能明显减缓磺胺嘧啶的降解。Czechowska-Biskup等[51]分别在添加以及未添加自由基清除剂的溶剂中,对壳聚糖和淀粉在360 kHz频率超声波处理条件下的降解情况进行了研究。加入自由基清除剂后的体系的平均相对分子质量降解速率减小,产物相对分子质量增大,分子链断裂减少。Koda等[52]对超声降解甲基纤维素、普鲁兰糖、葡聚糖和环氧乙烷这4 种水溶性聚合物的降解机理进行了探讨,得出了相似的结论。利用20 kHz和500 kHz两种不同频率的超声波对水溶液中的这4 种聚合物进行处理,阐明了超声波频率和自由基清除剂对水溶液中的水溶性聚合物降解的影响。经过500 kHz超声波处理,4 种聚合物的相对分子质量均降低到5 000以下,远优于20 kHz的超声波处理。而在添加了自由基清除剂之后,500 kHz的降解效果大大降低,甚至低于20 kHz时的降解效果。
上述研究结果证明,高频超声波所产生的降解作用是由多种效应形成的。高频超声波能使大分子物质分子质量有很大程度降低,排除自由基效应之后,高频超声波的降解效果减弱了很大一部分。随着超声进程的继续,大分子物质的分子质量降低越不明显。在没有自由基作用时,只有链长较长的分子易被超声的机械力打断,在链长低于某一极限值时,降解作用便不再继续。即高频超声波对分子的降解作用主要源于其自由基效应,活性自由基与分子上的基团相互作用,引发一连串的反应,与超声的其他效应协同作用,改变分子结构,产生如分子质量降低、活性改变等作用。
4 结 语
综上所述,高频超声波对多聚物的物理化学性质都有极大的影响。将高频超声波应用于食品行业中,可以对食品中的一些物质,如多糖、蛋白质等进行物理或化学改性,改变其结构特性或物理化学性质,从而改进或开发更多的功能。尤其是在水溶液中的一些存在易氧化基团的物质,更容易被降解改性。本文就高频超声波对不同类型食品中的常见物质的降解作用与降解机理进行了综述,然而现今的研究在这一方面还有许多仍待发展的地方,仍有以下可以继续研究的方向:1)深入研究高频超声波对多聚物的降解改性机理,明确自由基效应和机械效应的构效关系。高频超声波的自由基效应强于低频超声,在对大分子物质的降解改性过程中,自由基效应和机械效应的作用机理尚未深入研究。2)高频超声波技术可以作为一种辅助手段,与其他降解改性方法联用来提高降解改性的效率。3)如果在使用高频超声波降解时加入辅助化学试剂,反应完成之后的副产物需要进行进一步研究,是否会对产物安全性、功能性产生影响,是否会对环境产生污染、是否易于分离处理等。4)高频超声波降解食品大分子组分形成的新型产品,需进一步研究其构效关系并详细评估其经济效益。5)高频超声波用于去除食品中的有害残留物,处理加工废水。
[1] CHEMAT F, HUMA Z, KHAN M K. Applications of ultrasound in food technology: processing, preservation and extraction[J]. Ultrasonics Sonochemistry, 2011, 18(4): 813-835. DOI:10.1016/ j.ultsonch.2010.11.023.
[2] HUANG C, MIAO M, JIANG B, et al. Polysaccharides modification through green technology: role of ultrasonication towards improving physicochemical properties of (1-3)(1-6)-α-D-glucans[J]. Food Hydrocolloids, 2015, 50: 166-173. DOI:10.1016/ j.foodhyd.2015.04.016.
[3] PINGRET D, FABIANO-TIXIER A S, CHEMAT F. Degradation during application of ultrasound in food processing: a review[J]. Food Control, 2013, 31(2): 593-606. DOI:10.1016/j.foodcont.2012.11.039.
[4] MCCLEMENTS D J. Advances in the application of ultrasound in food analysis and processing[J]. Trends in Food Science and Technology, 1995, 6(9): 293-299. DOI:10.1016/S0924-2244(00)89139-6.
[5] KRASULYA O, BOGUSH V, TRISHINA V, et al. Impact of acoustic cavitation on food emulsions[J]. Ultrasonics Sonochemistry, 2015, 30: 98-102. DOI:10.1016/j.ultsonch.2015.11.013.
[6] DEMIRDÖVEN A, BAYSAL T. The use of ultrasound and combined technologies in food preservation[J]. Food Reviews International, 2008, 25(1): 1-11. DOI:10.1080/87559120802306157.
[7] CHOI Y J, MCCARTHY K L, MCCARTHY M J. Tomographic techniques for measuring fluid flow properties[J]. Journal of Food Science, 2002, 67(7): 2718-2724. DOI:10.1111/j.1365-2621.2002. tb08804.x.
[8] BRAUNSTEIN D, PAGE J H, STRYBULEVYCH A, et al. Assessment of breadmaking performance of wheat flour dough by means of frequency dependent ultrasound[C]//International Symposium on Ultrasound in the Control of Industrial Processes, England: IOP Publishing, 2012, 42(1): 012040. DOI:10.1088/1757-899X/42/1/012040.
[9] LAMBERTI N, ARDIA L, ALBANESE D, et al. An ultrasound technique for monitoring the alcoholic wine fermentation[J]. Ultrasonics, 2009, 49(1): 94-97. DOI:10.1016/j.ultras.2008.06.003.
[10] SIKES A L, MAWSON R, STARK J, et al. Quality properties of preand post-rigor beef muscle after interventions with high frequency ultrasound[J]. Ultrasonics Sonochemistry, 2014, 21(6): 2138-2143. DOI:10.1016/j.ultsonch.2014.03.008.
[11] LEONG T, JULIANO P, JOHANSSON L, et al. Temperature effects on the ultrasonic separation of fat from natural whole milk[J]. Ultrasonics Sonochemistry, 2014, 21(6): 2092-2098. DOI:10.1016/ j.ultsonch.2014.02.003.
[12] CAMARA V C, LAUX D. Moisture content in honey determination with a shear ultrasonic reflectometer[J]. Journal of Food Engineering, 2010, 96(1): 93-96. DOI:10.1016/j.jfoodeng.2009.06.049.
[13] ASEEV D G, BATOEVA A A. Using high-frequency ultrasound (1.7 MHz) for oxidative processes in aqueous media[J]. Russian Journal of Physical Chemistry A, 2015, 89(9): 1585-1589. DOI:10.1134/ S0036024415090046.
[14] ROCHEBROCHARD S D L, SUPTIL J, BLAIS J F, et al. Sonochemical efficiency dependence on liquid height and frequency in an improved sonochemical reactor[J]. Ultrasonics Sonochemistry, 2012, 19(2): 280-285. DOI:10.1016/j.ultsonch.2011.07.009.
[15] ASAKURA Y, NISHIDA T, MATSUOKA T, et al. Effects of ultrasonic frequency and liquid height on sonochemical efficiency of large-scale sonochemical reactors[J]. Ultrasonics Sonochemistry, 2008, 15(3): 244-250. DOI:10.1016/j.ultsonch.2007.03.012.
[16] SORIA A C, VILLAMIEL M. Effect of ultrasound on the technological properties and bioactivity of food: a review[J]. Trends in Food Science & Technology, 2010, 21(7): 323-331. DOI:10.1016/j.tifs.2010.04.003. [17] WIJNGAARDEN L. Mechanics of collapsing cavitation bubbles[J]. Ultrasonics Sonochemistry, 2016, 29: 524-527. DOI:10.1016/ j.ultsonch.2015.04.006.
[18] MEROUANI S, HAMDAOUI O, REZGUI Y, et al. Sensitivity of free radicals production in acoustically driven bubble to the ultrasonic frequency and nature of dissolved gases[J]. Ultrasonics Sonochemistry, 2015, 22: 41-50. DOI:10.1016/j.ultsonch.2014.07.011.
[19] BECKETT M A, HUA I. Impact of ultrasonic frequency on aqueous sonoluminescence and sonochemistry[J]. Journal of Physical Chemistry A, 2001, 105(15): 3796-3802. DOI:10.1021/jp003226x.
[20] POKHREL N, VABBINA P K, PALA N. Sonochemistry: science and engineering[J]. Ultrasonics Sonochemistry, 2016, 29: 104-128. DOI:10.1016/j.ultsonch.2015.07.023.
[21] PRADHAN A A, GOGATE P R. Degradation of p-nitrophenol using acoustic cavitation and Fenton chemistry[J]. Journal of Hazardous Materials, 2010, 173(Suppl 1/3): 517-522. DOI:10.1016/ j.jhazmat.2009.08.115.
[22] BAGAL M V, GOGATE P R. Wastewater treatment using hybrid treatment schemes based on cavitation and Fenton chemistry: a review[J]. Ultrasonics Sonochemistry, 2013, 21(1): 1-14. DOI:10.1016/ j.ultsonch.2013.07.009.
[23] PANG Y L, ABDULLAH A Z, BHATIA S. Review on sonochemical methods in the presence of catalysts and chemical additives for treatment of organic pollutants in wastewater[J]. Desalination, 2011, 277(Suppl 1/3): 1-14. DOI:10.1016/j.desal.2011.04.049.
[24] ADEWUYI Y G. Sonochemistry: environmental science and engineering applications[J]. Industrial & Engineering Chemistry Research, 2001, 40(22): 4681-4715. DOI:10.1021/ie010096l.
[25] KIM E, CUI M, JANG M, et al. Investigation of sonochemical activities at a frequency of 334kHz: the effect of geometric parameters of sonoreactor[J]. Ultrasonics Sonochemistry, 2014, 21(4): 1504-1511. DOI:10.1016/j.ultsonch.2014.01.003.
[26] MEROUANI S, HAMDAOUI O. The size of active bubbles for the production of hydrogen in sonochemical reaction field[J]. Ultrasonics Sonochemistry, 2016, 32: 320-327. DOI:10.1016/ j.ultsonch.2016.03.026.
[27] SUN D W. Emerging technologies for food processing[M]. London: Elsevier, 2005: 603-626. DOI:10.1016/B978-012676757-5/50025-6.
[28] MILNE L, STEWART I, BREMNER D H. Comparison of hydroxyl radical formation in aqueous solutions at different ultrasound frequencies and powers using the salicylic acid dosimeter[J]. Ultrasonics Sonochemistry, 2013, 20(3): 984-989. DOI:10.1016/ j.ultsonch.2012.10.020.
[29] DALODIERE E, VIROT M, MOISY P, et al. Effect of ultrasonic frequency on H2O2sonochemical formation rate in aqueous nitric acid solutions in the presence of oxygen[J]. Ultrasonics Sonochemistry, 2016, 29: 198-204. DOI:10.1016/j.ultsonch.2015.09.014.
[30] GOGATE P R, PRAJAPAT A L. Depolymerization using sonochemical reactors: a critical review[J]. Ultrasonics Sonochemistry, 2015, 27: 480-494. DOI:10.1016/j.ultsonch.2015.06.019.
[31] ANTTI G, PENTTI P, HANNA K. Ultrasonic degradation of aqueous carboxymethylcellulose: effect of viscosity, molecular mass, and concentration[J]. Ultrasonics Sonochemistry, 2008, 15(4): 644-648. DOI:10.1016/j.ultsonch.2007.09.005.
[32] YAN J K, WANG Y Y, MA H L, et al. Ultrasonic effects on the degradation kinetics, preliminary characterization and antioxidant activities of polysaccharides from Phellinus linteus mycelia[J]. Ultrasonics Sonochemistry, 2016, 29: 251-257. DOI:10.1016/ j.ultsonch.2015.10.005.
[33] ZUO J Y, KNOERZER K, MAWSON R, et al. The pasting properties of sonicated waxy rice starch suspensions[J]. Ultrasonics Sonochemistry, 2009, 16(4): 462-468. DOI:10.1016/ j.ultsonch.2009.01.002.
[34] PARK D J, HAN J A. Quality controlling of brown rice by ultrasound treatment and its effect on isolated starch[J]. Carbohydrate Polymers, 2016, 137: 30-38. DOI:10.1016/j.carbpol.2015.10.045.
[35] CZECHOWSKA-BISKUP R, ROKITA B, ULAŃSKI P, et al. Radiation-induced and sonochemical degradation of chitosan as a way to increase its fat-binding capacity[J]. Nuclear Instruments & Methods in Physics Research, 2005, 236(8): 383-390. DOI:10.1016/ j.nimb.2005.04.002.
[36] JAMBRAK A R, MASON T J, LELAS V, et al. Effect of ultrasound treatment on solubility and foaming properties of whey protein suspensions[J]. Journal of Food Engineering, 2008, 86(2): 281-287. DOI:10.1016/j.jfoodeng.2007.10.004.
[37] MATOUQA M, SUSUMUB N, ANBER Z A, et al. The impact of high frequency ultrasound waves on diluted whey proteins resulted from dairy processing[J]. Research Journal of Pharmaceutical, Biological and Chemical Sciences, 2014, 5(1): 940-947.
[38] TEREFE N S, BUCKOW R, VERSTEEG C. Quality-related enzymes in plant-based products: effects of novel food-processing technologies part 3: ultrasonic processing[J]. Critical Reviews in Food Science & Nutrition, 2015, 55(2): 147-158. DOI:10.1080/10408398.2011.58613.
[39] BASTO C, SILVA C J, GÜBITZ G, et al. Stability and decolourization ability of Trametes villosa laccase in liquid ultrasonic fields[J]. Ultrasonics Sonochemistry, 2007, 14(3): 355-362. DOI:10.1016/ j.ultsonch.2006.07.005.
[40] NIKFAR E, DEHGHANI M H, MAHVI A H, et al. Removal of Bisphenol A from aqueous solutions using ultrasonic waves and hydrogen peroxide[J]. Journal of Molecular Liquids, 2016, 213: 332-338. DOI:10.1016/j.molliq.2015.08.053.
[41] CHEMAT F, GRONDIN I, SING A S C, et al. Deterioration of edible oils during food processing by ultrasound[J]. Ultrasonics Sonochemistry, 2004, 11(1): 13-15. DOI:10.1016/S1350-4177(03)00127-5.
[42] WAN J, MAWSON R, ASHOKKUMAR M, et al. Emerging processing technologies for functional foods[J]. Australian Journal of Dairy Technology, 2005, 60(2): 167-169.
[43] ASHOKKUMAR M, SUNARTIO D, KENTISH S, et al. Modification of food ingredients by ultrasound to improve functionality: a preliminary study on a model system[J]. Innovative Food Science & Emerging Technologies, 2008, 9(2): 155-160. DOI:10.1016/ j.ifset.2007.05.005.
[44] GOLMOHAMADI A, MÖLLER G, POWERS J, et al. Effect of ultrasound frequency on antioxidant activity, total phenolic and anthocyanin content of red raspberry puree[J]. Ultrasonics Sonochemistry, 2013, 20(5): 1316-1323. DOI:10.1016/ j.ultsonch.2013.01.020.
[45] MASON T J, COBLEY A J, GRAVES J E, et al. New evidence for the inverse dependence of mechanical and chemical effects on the frequency of ultrasound[J]. Ultrasonics Sonochemistry, 2011, 18(1): 226-230. DOI:10.1016/j.ultsonch.2010.05.008.
[46] KODA S, KIMURA T, KONDO T, et al. A standard method to calibrate sonochemical efficiency of an individual reaction system[J]. Ultrasonics Sonochemistry, 2003, 10(3): 149-156. DOI:10.1016/ S1350-4177(03)00084-1.
[47] MOSTAFA M A K. Degradation of addition polymers by ultrasonic waves. VI. Effect of frequency[J]. Journal of Polymer Science, 1958, 33(126): 311-321. DOI:10.1002/pol.1958.1203312630.
[48] PETRIER C, JEUNET A, LUCHE J L, et al. Unexpected frequency effects on the rate of oxidative processes induced by ultrasound[J]. Journal of the American Chemical Society, 1992, 114(8): 3148-3150. DOI:10.1021/ja00034a077.
[49] TRAN K V B, KIMURA T, KONDO T, et al. Quantification of frequency dependence of mechanical effects induced by ultrasound[J]. Ultrasonics Sonochemistry, 2014, 21(2): 716-721. DOI:10.1016/ j.ultsonch.2013.08.018.
[50] LASTRE-ACOSTA A M, CRUZ-GONZÁLEZ G, NUEVAS-PAZ L, et al. Ultrasonic degradation of sulfadiazine in aqueous solutions[J]. Environmental Science and Pollution Research, 2015, 22(2): 918-925. DOI:10.1007/s11356-014-2766-2.
[51] CZECHOWSKA-BISKUP R, ROKITA B, LOTFY S, et al. Degradation of chitosan and starch by 360 kHz ultrasound[J]. Carbohydrate Polymers, 2005, 60(2): 175-184. DOI:10.1016/ j.carbpol.2004.12.001.
[52] KODA S, TAGUCHI K, FUTAMURA K. Effects of frequency and a radical scavenger on ultrasonic degradation of water-soluble polymers[J]. Ultrasonics Sonochemistry, 2011, 18(1): 276-281. DOI:10.1016/j.ultsonch.2010.06.007.
Progress in High Frequency Ultrasound and Its Application for Degradation and Modification in Food Industry
WANG Danli1, MA Xiaobin1, WANG Wenjun1, ZOU Mingming1, DING Tian1, LIU Donghong1,2,*
(1. School of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310058, China; 2. Fuli Institute of Food Science, Zhejiang University, Hangzhou 310058, China)
Ultrasound can be divided into low frequency ultrasound and high frequency ultrasound. High frequency ultrasound, which is different from low frequency ultrasound in terms of cavitation efficiency, can produce a large amount of free radicals, and it has a good efficiency in degradation and modification and great application potential in the food industry. However, there are rarely systematic summaries of its application in this area. This article briefly illustrates the mechanism of action of ultrasound, and reviews the application of high frequency ultrasound in molecular degradation and modification. High frequency ultrasound can not only degrade macromolecules, but also can modify some of their groups and properties. Herein we also summarize the mechanism of the degradation and modification of polymer molecules in order to provide a theoretical basis for the application of high frequency ultrasound for degradation and modification of polymers.
high frequency ultrasound; degradation; modification; cavitation; free radicals
10.7506/spkx1002-6630-201621047
TS201.1
A
1002-6630(2016)21-0279-06
王丹丽, 马晓彬, 王文骏, 等. 高频超声波及其在食品工业中的降解改性研究进展[J]. 食品科学, 2016, 37(21): 279-284.
DOI:10.7506/spkx1002-6630-201621047. http://www.spkx.net.cn
WANG Danli, MA Xiaobin, WANG Wenjun, et al. Progress in high frequency ultrasound and its application for degradation and modification in food industry[J]. Food Science, 2016, 37(21): 279-284. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201621047. http://www.spkx.net.cn
2016-02-29
国家自然科学基金面上项目(31371872)
王丹丽(1993—),女,博士研究生,研究方向为超声多糖改性。E-mail:wangdl418@163.com
*通信作者:刘东红(1968—),女,教授,博士,研究方向为食品加工与工程。E-mail:dhliu@zju.edu.cn
