新型N-杂环卡宾环金属铱配合物的合成
2016-12-02周宇扬谢凯王筱梅
周宇扬,谢凯,王筱梅
(苏州科技大学化学生物与材料工程学院,江苏苏州215009)
新型N-杂环卡宾环金属铱配合物的合成
周宇扬,谢凯,王筱梅
(苏州科技大学化学生物与材料工程学院,江苏苏州215009)
以1,5-环辛二烯氯化铱二聚体([IrCl(COD)]2)为起始原料,合成了一种新型的N-杂环卡宾环金属铱配合物,其反应产率为45%。对后续催化领域应用所关注的氧化还原性质和电子云分布分别通过电化学和理论模拟计算方法进行了研究。研究工作将有助于推动新型N-杂环卡宾环金属铱配合物的设计合成及其应用的发展。
N-杂环卡宾;环金属铱配合物;循环伏安;理论计算
基于咪唑盐的氮杂环卡宾过渡金属配合物以其制备条件温和、能够在水和氧及空气等环境中稳定存在、结构形式多样等优点在近年来受到了极大的关注[1]。目前,含有不同过渡金属的氮杂环卡宾配合物,例如金(Au)、银(Ag)、钌(Ru)、铂(Pt)、铑(Rh)等被大量合成出来[2],并在有机催化、材料科学和新药研发等领域展示了巨大的应用前景[3-6]。
近年来,有机电致发光技术(OLEDs)的快速发展极大推动了环金属铱配合物的研究[7-8]。由于卡宾含有的孤对电子可以与中心过渡金属形成碳-金属共价键,卡宾作为一类强场配体在环金属铱配合物的设计研究中也逐渐引起了大家的关注[9]。但是,在这类铱配合物的合成中,通常是首先用氧化银与卡宾前体化合物咪唑盐反应生成银卡宾,然后将生成的银卡宾与三氯化铱(IrCl3)反应,通过金属置换得到含有卡宾配体的环金属铱配合物,由于此步骤的反应产率一般较低(约10%左右)[9],因此,如何更高效的合成氮杂环卡宾环金属铱配合物是该领域研究面临的重要课题。
需要指出的是,相比其他金属卡宾配合物,环金属铱卡宾配合物在催化领域的应用研究还相对较少,基于此,笔者采用一种新的起始原料作为中心金属铱的来源,合成了一种新型的N-杂环卡宾环金属铱配合物,并对催化领域中所关注的氧化还原性质和电子云分布[10]分别通过电化学和理论模拟计算的手段进行了研究。
1 实验部分
1.1 试剂与仪器
碘苯、咪唑、甲苯(AR)、二甲基亚砜(DMSO)、乙二醇乙醚购自国药集团化学试剂有限公司,碘化亚铜(CuI)、L-脯氨酸(L-proline)、碘甲烷、甲醇钠购自阿拉丁试剂(上海)有限公司,2-(1-氢-四氮唑)吡啶购自百灵威科技有限公司,1,5-环辛二烯氯化铱二聚体([IrCl(COD)]2)购自Alfa-Aesar(中国)化学试剂有限公司。电化学用的无水DMF(超干)购自安耐吉化学试剂有限公司。
Varian 400M核磁共振谱仪,安捷伦气-质连用谱仪(电子轰击离子源),普林斯顿电化学工作站,采用三电极体系进行循环伏安测试,其中工作电极为铂盘(直径1 mm),对电极为铂柱,参比电极为银丝,采用二茂铁(Fc/Fc+)作为内标进行电位校准,运用高斯09软件进行理论模拟计算,分别采用密度泛函理论(DFT)和时间依赖密度泛函理论(TD-DFT)对环金属铱配合物Ir(pmi)2taz的基态和激发态进行计算模拟,其中C、H、N原子采用6-31G基组,Ir原子采用Lanl2dz雁势基组。
1.2 N-甲基-N-苯基咪唑碘盐(Ligand 1)的合成
(1)如图1所示,在单口烧瓶中加入1 mmol的碘苯,1.2 mmol的咪唑,0.1 mmol的CuI,0.2当量的L-脯氨酸,2 mmol的碳酸钾,选用DMSO作为溶剂,氮气保护,110℃避光反应48 h后,冷却至室温,减压抽滤除去反应体系的不溶物,并用二氯甲胺进行洗涤,收集滤液,通过水洗除去DMSO溶剂,收集有机相,利用旋转蒸发仪进行浓缩,然后通过柱层析(流动相:CH2Cl2∶CH3OH(V∶V)=2∶1)进行纯化得到浅黄色油状物N-苯基咪唑。产率:86%。1H-NMR(400 MHz,CDCl3)δ:7.88(s,1 H),7.50-7.46(m,2 H),7.40-7.33(m,3 H),7.3(s,1 H),7.23(s,1 H)。13H-NMR(100 MHz,CDCl3)δ:137.35,135.59,130.42,129.86,127.45,121.43,118.30。EI-MS:144(M+)。

图1 氮杂环卡宾前体咪唑盐Ligand 1的合成路线
(2)将步骤(1)中得到的N-苯基咪唑溶于甲苯溶剂中,加入20倍摩尔当量的碘甲烷,30℃避光反应24 h,体系出现白色沉淀,过滤收集沉淀,并用冷的四氢呋喃洗涤沉淀,真空干燥沉淀即可得到N-甲基-N-苯基咪唑碘盐(Ligand 1)。产率:96%。1H-NMR(400 MHz,CDCl3)δ:10.40(s,1 H),7.76-7.73(m,3 H),7.69(t,J=2 Hz,1 H),7.53-7.56(m,3 H),4.26(s,3 H)。13H-NMR(100 MHz,CDCl3)δ:135.72,134.33,130.63,130.48,124.70,122.17,120.81,37.68。
1.3 氮杂环卡宾环金属铱配合物Ir(pmi)2taz的合成
如图2所示的反应路线,在50 mL乙二醇乙醚溶剂中,加入0.1 mmol环辛二烯氯化铱二聚体([IrCl(COD)]2),0.45 mmol甲醇钠,氮气40℃条件下搅拌反应3 h,体系变成深褐色,然后加入0.4 mmol Ligand 1配体,升温至135℃继续反应24 h后,冷却至室温,向反应体系中加入去离子水50 mL,有大量灰色沉淀生成,过滤并真空干燥沉淀,得到氯桥中间体化合物1,无需进一步纯化,直接进行后续反应。
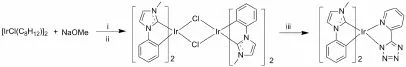
图2 氮杂环卡宾环金属铱配合物的合成路线
将得到化合物1全部溶于50 mL的乙二醇乙醚溶剂中,加入0.21 mmol的2-(1-氢-四氮唑)吡啶,4.2 mmol K2CO3,135℃下搅拌反应24 h后冷却至室温。以二氯甲烷/甲醇(V∶V)=3∶1的混合溶剂作为流动相,利用硅胶柱层析方法进行纯化,真空干燥后得到目标产物Ir(pmi)2taz(0.09 mmol),黄绿色固体,产率45%。1H-NMR(400 MHz,CD2Cl2)δ:8.27(d,J=8 Hz,1 H),7.95-7.93(m,1 H),7.81-7.76(td,J=7.6,1.6 Hz,1 H),7.36(t,J=1.6 Hz,2 H),7.08-7.00(m,3 H),6.89-6.85(td,J=8,1.6 Hz,1 H),6.82-6.76(m,3 H),6.61-6.65(td,J=7.2,1.2 Hz,1 H),6.58-6.54(td,J=7.2,1.2 Hz,1 H),6.45-6.43(dd,J=7.6,0.8 Hz,1 H),6.35-6.33(dd,J=7.6,0.8 Hz,1 H),2.91(s,3 H),2.87(s,3 H)。
2 实验结果与讨论
2.1 N-杂环卡宾前体咪唑盐Ligand 1的合成
所合成的N-杂环卡宾环金属铱配合物属于混配型结构,由N-杂环卡宾C^C双齿主配体结构和吡啶四氮唑类N^N双齿辅助配体两部分组成。首先合成了咪唑盐卡宾前体Ligand 1。对于Ligand 1,第一步先利用碘苯与咪唑在碘化亚铜的催化下通过Ullman偶联反应制备得到N-苯基咪唑。此步骤反应中K2CO3作为碱,催化剂CuI加入后应该尽快进行N2保护处理,防止催化剂失效。通过TLC板跟踪反应发现,48 h以后才能使起始原料碘苯和咪唑反应完全。反应结束后,DMSO作为高沸点溶剂很难利用旋转蒸发仪除去。选择利用水洗的方式除去DMSO溶剂,利用CH2Cl2作为有机相进行萃取有机物,并利用硅胶柱层析方法进行进一步纯化,最终得到浅黄色油状物,经核磁表征确认是目标产物N-苯基咪唑。第二步属于季胺化反应,由于CH3I易挥发,所以在投料过程中应使CH3I达20倍摩尔当量,来保证N-苯基咪唑完全转化为季铵盐。同时需要指
出的是,反应温度应该控制在40℃,不能过高,防止反应过于剧烈。随着反应的进行,体系中逐渐有沉淀析出,反应24 h后,经TLC板跟踪确认反应进行完全,冷却至室温,经过滤、洗涤得到目标产物。图3是Ligand 1的核磁氢谱,从核磁氢谱可以看出,成功合成出了N-杂环卡宾前体咪唑盐Ligand 1,核磁氢谱图3中除目标分子中氢原子的化学位移信号外,无其他杂质的信号峰,表明其有较高的纯度。
2.2 N-杂环卡宾环金属铱配合物的合成
在配合物的合成中,与传统的方法中采用IrCl3不同,笔者采用1,5-环辛二烯氯化铱二聚体作为起始原料,在碱性环境中,由于1,5-环辛二烯与Ir的配位结合力相对较小,更容易发生配体的置换,从而可以更高效的得到含有N-杂环卡宾配体的环金属铱氯桥二聚体,氯桥中间体进一步与辅助配体反应,成功制备得到目标产物N-杂环卡宾环金属铱配合物。通过图4的核磁氢谱图,可以证明成功制备得到了目标产物,由于核磁氢谱图4中除目标分子中氢原子的化学位移信号外,无其他杂质的信号峰,表明其具有较高的纯度。
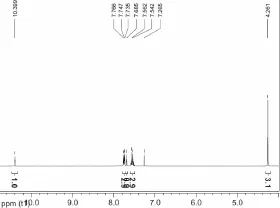
图3 Ligand 1在氘代氯仿中的核磁氢谱
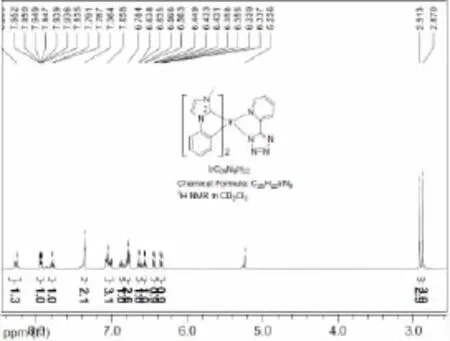
图4 Ir(pmi)2taz在氘代二氯甲烷中的核磁氢谱图
2.3 理论模拟计算
为了进一步研究这一新型N-杂环卡宾环金属铱配合物的电子云分布情况和分子前线轨道能级信息,笔者利用高斯09软件对Ir(pmi)2taz的分子结构的基态进行了理论模拟计算。如图5所示,该配合物的分子最高占有轨道(HOMO)的电子云主要分布在主配体的苯环结构单元中和中心金属铱原子d轨道,而最低空轨道(LUMO)的电子云则主要分布在辅助配体。HOMO到LUMO轨道的电子跃迁主要由金属到配体电荷转移(MLCT)和配体到配体之间电荷转移(LLCT)两部分组成。笔者还进一步计算出HOMO与LUMO轨道的能级差为3.59 eV,其数值小于传统的蓝光材料FIrpic(3.67 eV)[11]。同时,在基态分子结构优化的基础上,利用时间依赖-密度泛函理论对Ir(pmi)2taz的第一激发三重态(T1)和第一激发单重态(S1)进行了模拟计算。如表1所示,T1和S1的电子跃迁都主要发生在HOMO到LUMO轨道上,对应的最大波长分别是445 nm和431 nm。根据HOMO和LUMO轨道的电子云分布状态,第一激发三重态(T1)和第一单重态(S1)电子跃迁的特征(即表1中所示的Transition Character)主要属于金属到配体电子跃迁(MLCT)和配体到配体的电子跃迁(LLCT)。
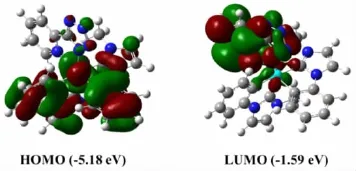
图5 基态氮杂环卡宾环金属铱配合物Ir(pmi)2taz的理论模拟计算结果

表1 时间依赖密度泛函理论(TD-DFT)对激发态Ir(pmi)2taz的理论计算结果
2.4 电化学循环伏安
电子的转移在催化反应中起着重要的作用,因此,笔者进一步对该新型N-杂环卡宾环金属铱配合物的氧化还原性质进行了研究。图6是该新型配合物在DMF溶剂中的循环伏安曲线。从图6可以看出,该配合物具有可逆的氧化峰,以二茂铁作为内标,其氧化电位为0.58 V,对应的是配合物从0价被氧化至+1价。根据公式HOMO=-(Eox+4.8)eV[11],可以推算出HOMO能级为-5.38 eV,与理论模拟计算结果-5.18 eV十分接近,从而进一步证明了理论模拟计算结果的可靠性。在0~-2.5 V的电化学窗口中,没有观察到Ir(pmi)2taz的还原峰。从而可以看出该新型环金属铱配合物比较容易被氧化(氧化电位为0.58 V vs Fc/Fc+),且+1价的氧化产物可以被可逆的还原为0价,而进一步从0价还原至更低价态则比较困难。
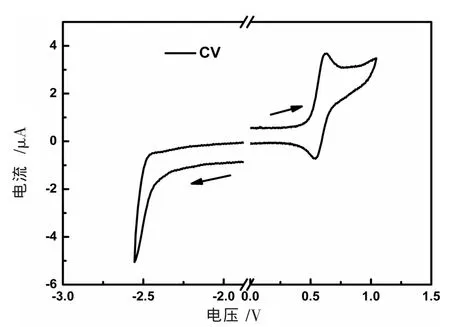
图6 氮杂环卡宾环金属铱配合物Ir(pmi)2taz的电化学循环伏安曲线
3 结语
通过以1,5-环辛二烯氯化铱二聚体([IrCl(COD)]2)为起始原料,成功制备得到了一种新型的N-杂环卡宾环金属铱配合物,其反应产率为45%。理论模拟计算结果表明该配合物HOMO轨道的电子云主要分布在中心金属铱原子和主配体的苯环结构上,而LUMO轨道的电子云则主要由辅助配体π共轭体系贡献,HOMO与LUMO之间的轨道能级差为3.59 eV。该新型N-杂环卡宾环金属铱配合物具有可逆的氧化峰,其氧化电位相对于二茂铁为0.58 V。研究结果将为新型N-杂环卡宾环金属铱配合物的设计合成及其作为新型催化剂的应用研究提供有意义的指导。
致谢:感谢中科院苏州纳米所张海禄研究员在理论模拟计算方面给予的帮助。
[1]BOURISSOU D,GUERRET O,GABBA F P,et al.Stable carbenes[J].Chem Rev,1999,100(1):39-92.
[2]HINDIK M,PANZNER M J,TESSIER C A,et al.The medicinal applications of imidazolium carbene-metal complexes[J].Chem Rev,2009,109(8):3859-3884.
[3]MERCS L,ALBRECHT M.Beyond catalysis:N-heterocyclic carbene complexes as components for medicinal,luminescent,and functional materials applications[J].Chem Soc Rev,2010,39(6):1903-1912.
[4]VISBAL R,GIMENO M C.N-heterocyclic carbene metal complexes:photoluminescence and applications[J].Chem Soc Rev,2014,43(10):3551-3574.
[5]LIX W,LIH Y,WANG,G F,et al.Blue-green luminescent rhenium(I)tricarbonyl complexes with pyridine-functionalized N-heterocyclic carbene ligands[J].Organometallics 2012,31(10):3829-3835.
[6]GIMENO M C,LAGUNA A,VISBAL R.N-heterocyclic carbene coinage metal complexes as intense blue-green emitters[J].Organometallics 2012,31(20):7146-7157.
[7]CHIY,CHOU P T.Transition-metal phosphors with cyclometalating ligands:fundamentals and applications[J].Chem Soc Rev,2010,39(2):638-655.
[8]CHOU P T,CHIY.Phosphorescent dyes for organic light-emitting diodes[J].Chem Eur J,2007,13(2):380-395.
[9]SAJOTO T,DJUROVICH PI,TAMAYO A,et al.Blue and near-UV phosphorescence from iridium complexes with cyclometalated pyrazolyl or N-heterocyclic carbene ligands[J].Inorg Chem,2005,44(22):7992-8003.
[10]CAVELL K J,MCGUINNESS D S.Redox processes involving hydrocarbylmetal(N-heterocyclic carbene)complexes and associated imidazolium salts:ramifications for catalysis[J].Coord Chem Rev,2004,248(7/8):671-681.
[11]ZHOU Y,LIW,LIU Y,et al.Substituent effect of ancillary ligands on the luminescence of bis[4,6-(di-fluorophenyl)-pyridinato-N,C2']iridium(III)complexes[J].Dalton Trans,2012,41(31):9373-9381.
Synthesis of a novel iridium(III)complex containing N-heteroleptic carbene(NHC)ligands
ZHOU Yuyang,XIE Kai,WANG Xiaomei
(School of Chemistry,Biology and Material Engineering,SUST,Suzhou 215009,China)
A novel iridium(III)complex containing N-heteroleptic carbene(NHC)based main ligands was synthesized through cyclooctadiene iridium chloride dimer([IrCl(COD)]2).The yield is 45%.Furthermore,the electron distribution and redox properties of this novel irdium(III)complex were investigated by theoretical calculations and electrochemistry.This study is important to further the design and synthesis of NHC-based iridium complexes and their application as catalysts.
NHC;cyclometalated iridium complex;cyclic voltammetry;theoretical calculation
O611.6
A
1672-0687(2016)04-0034-05
责任编辑:李文杰
2016-06-06
国家自然科学基金资助项目(21505097);江苏省高校自然科学基金面上项目(15KJB150027)
周宇扬(1986-),男,河南郑州人,讲师,博士,研究方向:过渡金属配合物的设计合成及其应用。
