光谱法研究黄曲霉毒素B1与人血清白蛋白的结合反应
2016-12-01张宇昊王佳曼
江 涛 马 良 张宇昊 王佳曼
(西南大学食品科学学院,重庆 400715)
光谱法研究黄曲霉毒素B1与人血清白蛋白的结合反应
江 涛 马 良*张宇昊 王佳曼
(西南大学食品科学学院,重庆 400715)
黄曲霉毒素B1(AFB1)是目前发现的致癌能力最强的真菌毒素,严重危害人畜健康。人血清白蛋白(Human serum albumin, HSA)在结合、运输内源性和外源性等小分子物质方面具有重要的生理功能。研究AFB1与HSA的相互作用机理和作用过程,在分子毒理学上具有重要意义。本研究模拟在人体血液pH条件(pH 7.4,离子强度 0.1 mol/L), 通过荧光淬灭、3D荧光法和圆二色谱(Circular dichroism, CD)等光谱方法研究AFB1与人血清蛋白的相互作用。结果表明, AFB1与HSA的内源荧光淬灭属于静态淬灭,AFB1-HSA在298, 303, 308和313 K 4个温度条件下,结合常数均为104数量级,结合位点都约为1。根据Van′t Hoff方程,AFB1-HSA体系是熵增焓减的自发过程,分子间主要作用力为疏水作用和氢键。基于Förster′s能量转移,得知AFB1与HSA结合距离为3.31 nm。竞争结合实验表明,AFB1结合在HSA的siteI位点上,靠近色氨酸Trp-214。通过 3D荧光分析,AFB1的结合作用导致了HSA氨基酸残基微环境和二级构象发生变化。圆二色谱的分析结果表明,二者的结合使得HSA的α-螺旋含量增加。
黄曲霉毒素B1;人血清白蛋白;结合反应;光谱法
1 引 言
霉菌毒素中黄曲霉毒素B1(Aflatoxin B1, AFB1)是目前已知的最强化学致癌物之一,能通过多种途径污染粮油等农产品、食品和饲料等,直接或间接进入人类食物链[1]。据估计,全球约有50亿人暴露于高水平的AFB1中[2]。血清白蛋白占整个血浆蛋白的52%~60%,是循环系统中主要的可溶性蛋白组分,能结合、运输许多内源性和外源性的化合物[3],且可与外源性物质在特异性结合部位形成非共价复合物。毒素分子与血清蛋白结合,不仅会延长毒素的半衰期,而且会更有利于对器官的定位和形成高剂量毒素。此外,一旦血浆中的毒素浓度比胃肠道高很多,也会形成对毒素分子的被动吸收[4]。研究人血清白蛋白与AFB1作用的毒代动力学,对黄曲霉毒素的毒理学及其安全风险评估具有极大的借鉴意义,对于寻找低毒性的潜在竞争分子及其降低在体内吸收提供理论依据。
荧光光谱是研究小分子与蛋白相互作用的重要手段[5~7],而圆二色谱技术可以从蛋白质二级结构变化的层次讨论小分子与蛋白质作用情况。目前利用荧光、CD技术研究药物与蛋白质的相互作用已有许多报道,但研究外源性毒素分子与血清白蛋白作用的报道还较少。本研究利用多种分析技术研究了模拟生理条件(pH 7.40,离子强度0.1)下AFB1与人血清白蛋白的相互作用。先对加入AFB1的各浓度AFB1-HSA的荧光值进行校正,再利用修正的双对数方程分别求出反应的结合常数和结合位点数,由Förster′s能量转移确定了AFB1与色氨酸残基的距离,并根据热力学参数确定了它们之间的主要作用力类型,以酮洛芬和布洛芬讨论了AFB1在人血清白蛋白上的结合位置,同时结合3D荧光和圆二色谱讨论了AFB1对HSA的二级结构的影响。
2 实验部分
2.1 仪器与试剂
UV-2450紫外分光光度计(日本岛津公司); F-4500荧光分光光度计(日本日立公司);MOS-450圆二色谱仪(法国Bio-logic公司)。 人血清白蛋白(Human serum albumin,HAS, Sigma 公司),使用时用缓冲液配制成0.1 mmol/L。黄曲霉毒素B1(AFB1,纯度≥98%,Sigma公司),使用前用甲醇配置成浓度为4.0 mmol/L, 4℃避光保存。酮洛芬(Ketoprofen,纯度≥99%,上海化学技术上海有限公司);布洛芬(Ibuprofen,纯度≥98%,北京百灵威科技有限公司)。上述试剂使用前都用无水乙醇配制成4.0 mmol/L,其它试剂都为分析纯。用0.1 mol/L Tris, 0.01 mol/L HCl和NaCl最终配制成含0.1 mol/L NaCl,pH为7.4的缓冲液。
2.2 实验方法
2.2.1 “内滤光效应”的校正 由于黄曲霉毒素在荧光激发波长280 nm处有吸收,随着样品中毒素浓度增加,其淬灭行为存在内滤光效应,需要按下列操作对实验数据进行校正。在1 cm比色皿中加入2.0 mL缓冲液,用微量进样器加入适量4.0 mmol/L AFB1溶液,使AFB1浓度分别为2.0, 4.0, 6.0, 8.0, 10.0, 12.0, 14.0, 16.0, 18.0和20.0 μmol/L,混匀后,扫描紫外波段190~500 nm。按公式(1)对实验荧光数据进行校正[5]:
(1)
式中,Fobs和Fcor分别为测定得到的荧光值和校正后的荧光值; Aex和Aem分别为HSA激发和发射波长下相应浓度的AFB1吸收值,实验结果的荧光数据均为校正后的荧光值。
2.2.2 荧光淬灭 和3D荧光的测定 在1 cm比色皿中加入1.0 mL 2.0 μmol/L HSA溶液,用微量进样器每次加入适量4.0 mmol/L AFB1溶液,使AFB1浓度分别为2.0, 4.0, 6.0, 8.0, 10.0, 12.0, 14.0, 16.0, 18.0和20.0 μmol/L,混匀后,在不同的温度条件下,固定激发波长λex=280 nm,狭缝宽度为5/5 nm,发射波长在220~400 nm范围内扫描HSA的荧光光谱及AFB1-HSA作用的荧光光谱。将激发波长扫描范围设置为200~450 nm,发射波长设置为220~600 nm,激发波长每递增5 nm扫描一次谱图,可得HSA及作用后AFB1-HSA的三维荧光光谱。
2.2.3 竞争实验 Site I位点标记药物酮洛芬和AFB1与HSA的竞争结合实验:在1 cm比色皿中加入1.0 mL 2.0 μmol/L HSA溶液,用微量进样器加入4.0 mmol/L AFB1溶液,使AFB1浓度为30 μmol/L,再分别加入微量4 mmol/L酮洛芬,最终酮洛芬的浓度分别为4.0, 8.0, 12.0, 16.0, 20.0, 24.0, 28.0和32.0 μmol/L,混合均匀,在荧光光谱相同的测定条件下测定荧光强度。用相同的方法测得AFB1和Site II位点标记药物-布洛芬的竞争结合实验。
2.2.4 圆二色谱扫描 配制1.0 μmol/L HSA和复合物混合液(1.0 μmol/L HSA和10 μmol/L AFB1),用光程为1 mm的比色皿,单位扫描间隔设置为1 nm, 单位扫描时间为2 s, 扫描波段为190~250 nm。
3 结果与讨论
3.1 结合常数与结合位点数的研究分析
AFB1与HSA结合时,HSA荧光强度和毒素浓度与K和n的关系满足方程式(2)[6]:
lg((F0-F)/F)=nlgK+nlg{[Q0]-n[P0](F0-F)/F0}
(2)
其中,F0和F分别是加入毒素前后的HSA荧光强度。[Q0]和[P0]分别是毒素和HSA的总浓度。通过lg[(F0-F)/F]对lg{[Q0]-[P0](F0-F)/F0}作图,得到图1。通过线性拟合得到直线的斜率和截距,可测得AFB1与HSA在不同温度下的结合位点数n和结合常数K。从表1可见,AFB1-HSA在4个温度下测定得到的结合位点数n值均约为1,表明HSA与AFB1的结合过程中只有一个结合位点,同时结合常数K值随着温度的升高而变小,说明淬灭机制是静态淬灭。因静态淬灭时,温度升高复合物稳定性下降,会导致结合率降低,而动态淬灭属于分子扩散过程,温度升高,扩散系数增大,K值相应增大。另外,AFB1-HSA在4个温度下K值的数量级均为104,比很多其它的血清蛋白-配体复合物结合常数高很多,表明AFB1与HSA存在较强的亲和力,在血浆中有很长的半衰期, 推测AFB1-HSA能够在血液中存储较长时间,能远距离运输,持续发挥毒性。
3.2 结合距离的确定
能量转移现象是一个分子发射光谱(供体)与另一个分子吸收光谱(受体)重叠,此时分子在偶极-偶极共振耦合作用下发生能量转移,最终供体荧光降低,受体荧光升高。根据Förster′s非辐射能量转移,供体和受体之间的转移效率E与临界距离R0、距离r的关系式如下[10]:

图1 不同温度下的AFB1-HSA的双对数曲线Fig.1 Double logarithmic equation of aflatoxin B-human serum albumin (AFB1-HSA) at different temperatures
表1 不同温度下AFB1-HSA结合位点数(n)和结合常数(K)
Table 1 Binding sites (n) and binding constants (K) at different temperatures

T(K)nSD1K(×104L/mol)SD22980.99960.04383.600.03173031.00500.18233.230.07323081.01460.07982.670.03643131.04400.17082.370.0379SD1代表n值的标准偏差,SD2代表K的标准偏差。SD1:Standarddeviationofn;SD2:StandarddeviationofK.
(3)
(4)
(5)
式中,F0和F分别是加入供体前后的HSA荧光值;K2为偶极空间取向因子;Φ为供体的量子产率;N是介质折射指数;J为毒素的吸收光谱与蛋白质的荧光发射光谱之间的重叠积分;F(λ)是供体在波长为λ时的荧光强度;ε(λ)是毒素在波长λ处的摩尔吸光系数。AFB1紫外光谱与HSA的荧光重叠图谱见图2。

图2 荧光发射光谱与AFB1紫外吸收光谱重叠图,HSA和毒素浓度均为4.0 μmol/L。Fig.2 Overlap of fluorescence emission spectra of HSA and absorbance spectra of AFB1, CHSA=CAFB1=4.0 μmol/L
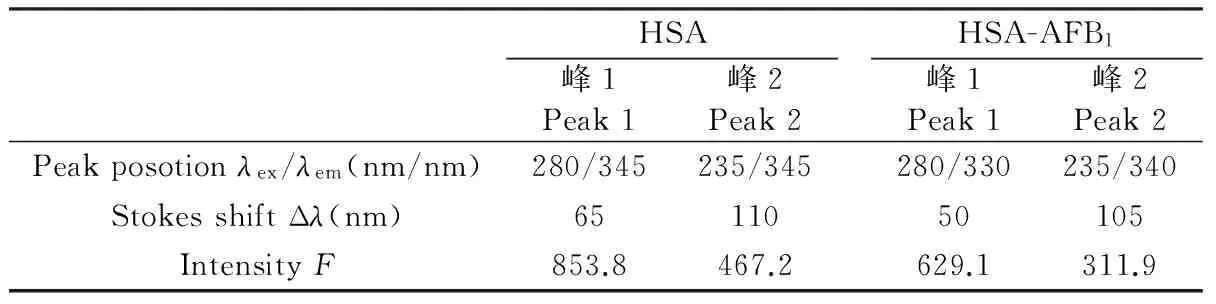
在此实验条件下,有报道K2=2/3、N=1.336,Φ=0.118[11]。通过上述公式得出,在AFB1-HSA体系中:J= 9.37161×10-15cm3L/mol,R0=2.43 nm,r=3.31 nm。结果表明AFB1与HSA反应的结合距离r<7 nm, 且符合了0.5R0 3.3 作用力类型的确定 通常,蛋白质与配体形成超分子复合物主要通过疏水作用、静电作用、范德华力及氢键等实现[12]。ΔH(焓变)、ΔS(熵变)、ΔG(自由能变化)可通过Van′t Hoff方程进行计算,再根据热力学参数判断AFB1与HSA主要作用力类型,方程如下: (6) (7) 式中,R为气体常数;K为不同温度下的结合常数。利用lnK对1/T拟合,关系如图3。在298, 303, 308和313 K条件下,HSA的结构并无很明显变化或降解,可将焓变视为一个固定数值,计算得到ΔG。通过公式,得到AFB1-HSA反应的ΔH=-22.47 kJ/mol; ΔS=11.94 J/(mol·K),4个温度下的ΔG分别为-26.02, -26.08, -26.14和-26.20 kJ/mol。 图3 AFB1与HSA相互作用的Van′t Hoff曲线Fig.3 The Van′t Hoff plots for AFB1-HSA AFB1与HSA反应的ΔG<0,说明AFB1与HSA反应过程为自发过程。通过大量实验结果,Ross等得出了通过热力学参数确定蛋白与配体作用力类型的判断依据[13]。结果表明,在4个温度条件下ΔH<0,说明反应是放热反应;ΔS>0,说明AFB1与HSA之间存在疏水作用力,推断是因AFB1与HSA在体内时,两者的极性部分状态属于水分子包围的水合状态,当两者进一步接近到一定范围内,会将本来存在于两者非极性部分附近的水分子挤开,最终使得被挤出来的水分子进一步水合而其状态由有序变为无序,这恰好符合熵增加而焓变减少,且最终使得自由能减小的过程,稳定了非极性区的相互接触[14]。由于HSA的复杂结构,在实际与配体的反应中,常同时存在几种相互作用力[15],而ΔH<0,说明反应中还存在氢键作用。通过ΔH和ΔS推断出,AFB1与HSA结合作用力主要是疏水作用力和氢键。而疏水作用主要是由疏水性小分子进入HSA的疏水腔引起的作用力,在研究AFB1的降毒过程中,增加AFB1的亲水基团,降低其进入HSA疏水腔的概率,可以降低其与HSA的亲和力,从而达到降低AFB1对人体毒性作用的效果。 3.4 AFB1与HSA结合位点的确定 HSA的高级结构可分为3个结构域,从N-端开始依次为Domain Ⅰ, Domain Ⅱ和Domain Ⅲ, 这些结构域主要由α-螺旋反向平行形成,每个域又由槽口相对的两个疏水性亚域(Sub domain A和Sub domain B)空腔形成[3],且HSA中主要有两个疏水性口袋(Site Ⅰ)和(Site Ⅱ)是配体的主要结合部位,为了确定AFB1在HSA上的结合位置,使用酮洛芬(Site Ⅰ)和布洛芬(Site Ⅱ)作为位点探针,位点探针通常发生的反应有竞争反应和非竞争反应两种[16]。 竞争反应: 非竞争反应: 根据2.2.3节实验操作,依次向AFB1-HSA体系加入不同体积的酮洛芬和布洛芬溶液,根据体系中HSA和AFB1荧光变化情况(因AFB1与HSA之间存在能量共振,使得毒素荧光强度增强),确定AFB1与HSA的结合位点。Sudlow等[17]提出了计算取代百分比的表达式: (8) 式中,F2和F1分别为存在和不存在探针时的荧光强度。 在实验中,为了确保探针产生最小的非特异性结合,控制AFB1与HSA摩尔比为15∶1。测得体系的荧光光谱,根据公式(8)求得取代百分比,以取代百分比对探针与HSA的浓度之比作图。从图4可知,加入布洛芬对AFB1-HSA体系中HSA、AFB1的荧光强度影响较小,但随着酮洛芬的加入量,AFB1与HSA的二元体系中HSA和毒素的荧光强度都发生较大降低,由此可推断出,酮洛芬取代了AFB1,与HSA发生结合。以上结果表明,AFB1与HSA的结合反应发生在Site I中,靠近Trp-214位色氨酸。OTA的动物实验表明,将OTA毒素从血清蛋白中置换出来,可以加快消除OTA在靶器官中的积累[18], 因此研究在该结合位点低毒的与AFB1存在竞争关系的小分子,可以发展AFB1中毒的体内预防措施。 3.5 AFB1诱导HSA构象发生的变化 3.5.1 三维荧光扫描 三维荧光光谱表现的是荧光强度随激发和发射波长同时变化的信息,拥有谱图特征以及丰富的信息含量,为有机小分子作为介质荧光探针的研究,以及它们与生物大分子血清白蛋白相互作用机理的研究提供了有力手段。图5是测得加入AFB1前后HSA的3D荧光等高线图,对应的一些参考数据见表2。 图5 HSA(A)、AFB1-HSA(B)系统的3D荧光等高图Fig.5 Three-dimensional contour diagrams of HSA(A) and AFB1-HSA (B)CHSA=2.0 μmol/L; CAFB1=10 μmol/L. 表2 HSA与AFB1-HSA系统的三维荧光光谱特征参数 Table 2 Three-dimensional fluorescence spectral characteristic parameters of HSA and AFB1-HSA system HSA峰1Peak1峰2Peak2HSA-AFB1峰1Peak1峰2Peak2Peakposotionλex/λem(nm/nm)280/345235/345280/330235/340StokesshiftΔλ(nm)6511050105IntensityF853.8467.2629.1311.9 3.5.2 AFB1与HSA的圆二色谱分析 在蛋白质或多肽的规则的二级结构中,肽键是高度有规律排列的,排列的方向性决定了肽键能级跃迁的分裂情况。因此,不同二级结构的蛋白质或多肽所产生的CD谱带的位置、吸收的强弱都不相同。因此CD谱带的位置、吸收相关的变化反映蛋白质的二级结构变化。蛋白质的典型的α-螺旋结构式在208 nm(肽键的π-π*跃迁)和222 nm(肽键的n-π*跃迁)处出现负的吸收峰,α-螺旋结构的含量可用下列公式求得[20]: (9) (10) 图6 AFB1与HSA的圆二色谱图Fig.6 Circular dichroism spectra of AFB1 and HSA CHSA=1.0 μmol/L; CAFB1=10 μmol/L. 式中,θobs为椭圆度(208 nm)处的椭圆度;MRE为平均残基的椭圆度;Cp为HSA的摩尔浓度,n为氨基酸残基数目(HSA中氨基酸残基数目为585);l为样品池的光径(0.1 cm)。实验中测得nHSA∶nAFB1=0∶0和1∶10时体系的CD光谱,结果见图6。 本研究采用了荧光淬灭法、同步、三维荧光光谱3种荧光光谱技术在模拟人体血液pH值条件下研究AFB1和HSA的相互作用,获得了AFB1-HSA系统的淬灭机制、结合常数、结合位点数、结合距离、结合位置、作用力类型、构象变化等相关信息。结果表明,AFB1对HSA的主要淬灭机制为形成静态复合物的静态淬灭,且结合时只有一个结合位点,二者相互作用力主要为疏水作用和氢键,结合位置为靠近Trp-214的疏水腔中,二者的结合引起了HSA的氨基酸残基微环境及其α-螺旋含量的增加。AFB1与HSA较强的结合常数说明,AFB1能够通过HSA被运输到各个靶器官中,可在血液中贮存较长的时间,存在潜在的毒性。本研究为评价黄曲霉毒素的毒性提供了有用信息,且从分子水平上研究了血液运输过程中黄曲霉毒素的毒理学效应及其对血清蛋白构效影响等。 1 Zhang D H, Li P W, Yang Y.Talanta, 2011, 85(1): 736-742 2 Vineis P, Xun W.Ann.Oncol., 2009, 20:205-212 3 He X M, Carter D C.Nature, 1993, 364: 362 4 Il′Ichev Y V, Perry J L, Rüker F.Chemico-biologicalInteractions, 2002, 141(3): 275-293 5 GONG Xia, SHI Yong-Hui, YUE Guo-Wei.SpectroscopyandSpectralAnalysis, 2005, 25(3): 420-423 宫 霞, 施用晖, 乐国伟. 光谱学与光谱分析, 2005, 25(3): 420-423 6 ZHANG Ai-Mei, SUN Kun, WANG Rong, XIE Hua, XIE Xi-Hui, SHI You-Qin.ChineseJ.Anal.Chem., 2011, 39(12): 1817-1822 张爱梅, 孙 坤,王 荣, 谢 华, 谢希晖, 施有琴. 分析化学, 2011, 39(12): 1817-1822 7 HUANG Rui, XIA Zhi-Ning, GONG Ping.SpectroscopyandSpectralAnalysis, 2008, 28(1): 161-164 黄 锐, 夏之宁, 龚 萍. 光谱学与光谱分析, 2008, 28(1): 161-164 8 Cao S N, Liu B S, Li Z Y, Chong B H.J.Lumin., 2014, 145: 94-99 9 van de Weert M.J.Fluoresc., 2010, 20(2): 625-629 10 Ge F, Jiang L X, Liu D Q, Chen C Y.Anal.Sci., 2011, 27(1): 79-84 11 Bertucci C, Domenici E.Curr.Med.Chem., 2002, 9(15): 1463-1481 12 Klotz I M. Ann N Y.Acad.Sci., 1973, 226(1): 18-35 13 Ross P D, Subramanian S.Biochem., 1981, 20(11): 3096-3102 14 Ding F, Liu W, Liu F, Li Z Y.J.Fluoresc., 2009, 19(5): 783-791 15 Lakowicz J R.InstrumentationforFluorescenceSpectroscopy.PrinciplesofFluorescenceSpectroscopy. Springer US, 1999: 25-61 16 Dufour C, Dangles O.Biochim.Biophys.Acta, 2005, 1721:164-173 17 Sudlow G, Birkett D J, Wade D N.Mol.Pharmacol., 1976, 12: 1052-1061 19 Kandagal P B, Ashoka S, Seetharamappa J.J.Pharm.Biomed.Anal., 2006, 41(2):393-399 20 Sano T, Ohno T, Otsuka-Fuchino H, Tsuchiya T.J.FoodSci., 1994, 59(5): 1002-1008 21 ZHOU Juan, JIN Gui-Yun, SUN Ting-Quan, ZHU Li, ZHONG Li-Qin.Chin.J.Anal.Lab, 2014, 33(1): 8 周 娟, 金桂云, 孙婷荃, 朱 丽, 钟立群. 分析试验室, 2014, 33(1): 8 (Received 19 August 2015; accepted 22 October 2015) This work was supported by the National Basic Research Program of China(No. 2013CB127803); the National Natural Science Foundation of China (No.31301476) and the Fundamental Research Fund for the Central Universities (No.2362014xk11) Fluorescence Spectroscopic Study of Interaction between Aflatoxin B1 and Human Serum Albumin JIANG Tao, MA Liang*, ZHANG Yu-Hao, WANG Jia-Man (CollegeofFoodScience,SouthwestUniversity,Chongqing400715,China) Aflatoxin B1 (AFB1) is the most powerful cancer-causing mycotoxins, which is serious harmful to human and animal health. Human serum albumin has important physiological functions in the binding or transporting endogenous and exogenous ligands aspects. It′s great significance in molecular toxicology of researching AFB1and human serum albumin interaction mechanism. The interaction between AFB1and human serum albumin (HSA) was investigated by fluorescence spectroscopy, circular dichroism and 3D fluorescence spectroscopy under the simulative physiological conditions (pH=7.4, Ionic strength 0.1 mol/L). Results showed that the main quenching mechanism between AFB1and HSA was a static quenching process. At four different temperatures (298, 303, 308 and 313 K), all the magnitude binding constants (K) were 104 and the number of binding sites (n) in the binary system was approximate to 1. According to Van′t Hoff equation, the negative enthalpy change (ΔHθ) and postive entropy change (ΔSθ) values indicated that hydrophobic interaction and hydrogen bonding were the mainly interaction and force in the binding process. The binding distance (r) between the AFB1and HSA was calculated to be 3.31 nm based on the theory of Förster′s non-radiation energy transfer. The site marker displacement experiments suggested the location of AFB1binding to HSA was site I, closely Trp-214. The 3D florescence revealed that the microenvironment of amino acid residues and the conformation of HSA were changed during the binding reaction. CD spectra revealed that the conformations of HSA were changed during the binding reaction with increasing inα-helix. Aflatoxin B1; Human serum albumin;Binding interaction; Spectroscopy 10.11895/j.issn.0253-3820.150657 本文系国家重点基础研究发展计划(973计划)项目(No.2013CB127803);国家自然科学基金项目(No.31301476);中央高校基本科研业务费专项资金项目(No.2362014xk11) 2015-08-19收稿;2015-10-22接受 *E -mail: zhyhml@163.com







4 结 论
