多糖提取和抗氧化活性评价方法的研究现状和进展
2016-12-01董晓芳佟建明
刘 松 董晓芳 佟建明
(中国农业科学院北京畜牧兽医研究所,北京100193)
多糖提取和抗氧化活性评价方法的研究现状和进展
刘 松 董晓芳*佟建明
(中国农业科学院北京畜牧兽医研究所,北京100193)
作为构成生命活动的四大基本物质之一,多糖与维持生命所需的多种生理功能密切相关。随着研究的进行,多糖的抗氧化活性成为众多学者关注的热点。本文综述了多糖的提取和抗氧化活性评价方法的研究现状和进展,以期为多糖的提取和抗氧化活性评价研究提供借鉴。
多糖;提取;抗氧化活性评价
多糖是广泛存在于自然界的一类天然高分子化合物,一般由10个以上单糖分子之间通过α-或β-糖苷键线性或分枝连接组成。作为构成生命活动的四大基本物质之一,多糖与维持生命所需的多种生理功能密切相关。20世纪50年代以来,多糖及其复合物在细胞识别、分化、代谢、免疫应答、癌变、凋亡、抗氧化等各项生命活动中的功能逐渐引起人们的关注。抗氧化是多糖重要的生物学活性之一。目前,关于多糖提取、抗氧化活性及其作用机理的研究日趋广泛和深入。
1 多糖的提取方法
常用的多糖提取方法主要有:水提取法、超声波辅助提取法、微波辅助提取法、酶解辅助提取法等。
1.1 水提取法
水提取法是一种常用的多糖提取方法,其是利用多糖溶于水的性质,采用热水浸煮或冷水浸提渗滤提取多糖。影响水提取法提取率的因素有:提取温度、料液比、提取时间及提取次数。研究人员对多糖水提取法的研究主要集中在对这几个提取条件的优化上,通常采用正交试验法、响应面试验法优化确定上述几个因素的最佳组合。水提取法对条件要求简单,便于使用,但在提取多糖的同时也易将蛋白质、苷类等水溶性成分提取出来,使得多糖纯度不高。此外该法耗时,提取效率不高。已报道的采用热水提取法的多糖有:虎奶菇多糖[1-2]、苹果多糖[3-4]、剑麻多糖[5]、灵芝多糖[6-7]、蜀葵种子多糖[8]、担子菌多糖[9]、淫羊藿多糖[10-11]、桑黄多糖[12]等。
1.2 超声波辅助提取法和微波辅助提取法
超声波辅助提取法主要是利用超声波产生强烈的空化效应、机械振动、扰动效应、乳化、扩散、击碎和搅拌作用等多级效应,增大物料分子的运动频率和速度,形成瞬间空化高温和局部高压,加速物料中多糖在溶媒的溶出。微波辅助提取法则主要是利用高频电磁波穿透提取介质,使物料细胞内的水分吸收微波能,导致细胞内部温度迅速上升,连续的高温使细胞膨胀破裂,加速物料细胞内多糖的自由流出。同时,微波所产生的电磁场可以加速多糖向提取溶剂界面扩散的速率,缩短多糖分子由物料内部扩散到萃取溶剂界面的时间,从而提高提取速率。
超声波辅助提取法和微波辅助提取法的优点在于能利用物理作用加速细胞壁破碎和多糖的浸出,提高多糖提取的效率,同时还可降低提取温度,最大限度保证提取的多糖质量。但是,与传统水提取法相比,超声波辅助提取法和微波辅助提取法提取过程中超声和微波功率、频率、处理时间等工艺条件都需要额外优化,而且这2种方法是由内向外快速传热,因而功率过大或时间太长可能会导致多糖的糖苷键断开[13],对多糖生物学活性产生不利影响。目前报道的采用超声波辅助提取法和微波辅助提取法提取的多糖有虎奶菇多糖[2]、古尼虫草多糖[14]、党参多糖[15]、银耳多糖[16]等。
1.3 酶解辅助提取法
酶解辅助提取法是指在多糖的提取时加入一定活性的一种或多种酶来加速细胞壁的破碎、多糖的浸出,如加入纤维素酶和果胶酶分解细胞壁、蛋白酶以除去杂蛋白等。使用酶解辅助提取法时,既可以同时使用多种酶(复合酶法)[17-18],也可单独使用一种酶(单一酶法)[19]。酶解辅助提取法的优点在于提取条件温和、效率较高。但是由于外源酶的加入可能会造成多糖的单糖组成、分子量、多糖结构和构象[18]等理化性质发生变化,从而对多糖生物学活性造成影响。同时,酶解辅助提取法中酶的成本较高,提取条件(尤其是温度和酸碱度)需要额外优化选择,而且条件要求较高,从而使得酶解辅助提取法的应用受到限制。目前已报道的使用酶解辅助提取法提取的多糖有:苜蓿多糖[20]、淫羊藿多糖[11]、黄芪多糖[21]、枸杞多糖[22]等。
1.4 多糖的其他提取方法
多糖的提取方法还有碱提取法[1,9]、高压脉冲电场辅助提取法[23]、超声波-酶协同辅助提取法[1]等。多糖的上述几种提取方法虽有零星研究报道,但实际应用尚较少。多糖提取方法的优缺点见表1。

表1 多糖提取方法的优缺点
2 多糖抗氧化活性的研究进展
2.1 体外研究
多糖抗氧化活性体外研究主要是通过使用化学、生物学方法对多糖清除自由基能力、抑制脂质过氧化和蛋白质氧化损伤能力等评价方法来进行。抗氧化活性体外评价方法简便、快捷,因此得到广泛应用。不同的抗氧化活性体外评价方法分别基于不同的反应原理,但各自存在缺陷,因此在多糖体外抗氧化活性评价过程中仅选用1种评价方法显得有些不足。因此,在进行多糖体外抗氧化能力评价的时候,众多学者一致推荐至少采用2种基于不同原理的体外评价方法。
2.1.1 体外化学方法评价
2.1.1.1 清除自由基活性评价
自由基具有极强的氧化反应能力,其能通过氧化作用来攻击所遇到的任何分子,使机体内的大分子物质产生过氧化反应,从而引起机体不可逆损伤。因此多糖的清除自由基能力是评价其抗氧化活性的一个重要方面。
常用的清除自由基活性评价方法有:清除1,1-二苯基-2-苦基肼(1,1-two phenyl-2-bitter base hydrazine,DPPH)自由基活性评价、清除2,2′-联氮-二(3-乙基苯并噻唑啉-6-磺酸)[2, 2′-azino-two (3-ethyl benzene and thiazole-6-sulfonic acid),ABTS]自由基活性评价、清除活性氧自由基(reactive oxygen species,ROS)活性评价、清除活性氮自由基(reactive nitrogen species,RNS)活性评价。其中清除ROS活性评价主要包括清除氧化自由基(oxyradical,ROO·)、超氧阴离子自由基(superoxide anion radical,O2-·)和羟基自由基(hydroxyl free radical,OH·)能力评价。清除RNS活性评价包括清除一氧化氮自由基(nitric oxide radical,NO·)和过氧化亚硝盐离子自由基(pro-oxidant peroxynitrite,ONOO-)能力评价。
Wang等[3]、Zhang等[5]分别对复合酶辅助提取的苜蓿多糖、热水提取的剑麻多糖进行清除DPPH自由基、羟自由基活性评价,发现苜蓿多糖和剑麻多糖具有清除DPPH自由基、羟基自由基活性,且具有剂量效应。Wang等[3]报道苹果多糖具有清除DPPH自由基和ABTS自由基活性,且具有剂量效应。Cheng等[10-11]发现淫羊藿多糖具有清除DPPH自由基、羟基自由基和ABTS自由基活性。据报道,蜀葵多糖[8]、灵芝多糖[24]、苹果多糖[25]具有清除超氧阴离子自由基活性。
此外,Klaus等[9]、Ma等[26]、Li等[27]、Volpi等[28]分别使用上述1种或几种方法对担子菌多糖、白桦茸多糖、玉米穗多糖、桑葚多糖清除自由基能力进行研究,并发现这几种多糖都具有一定的体外清除自由基活性。
2.1.1.2 还原能力评价
多糖同样具有良好的还原能力,因此可以通过测定多糖的还原能力来间接评价其抗氧化活性。目前,应用于多糖抗氧化能力评价的主要方法有:三价铁离子(Fe3+)还原能力评价、二价铁离子(Fe2+)结合能力评价、总还原能力评价等。
Chen等[13]、Ma等[26]分别发现淫羊藿多糖、白化茸多糖具有Fe3+还原能力。Tseng等[7]分别发现松杉树芝多糖具有Fe2+结合能力,从而具有抗氧化活性。Tseng等[7]、Liu等[8]、Dou等[25]和Li等[27]分别通过总还原能力评价发现松杉树芝多糖、蜀葵多糖、苹果多糖和金丝小枣具有一定的还原能力。
2.1.2 体外生物学评价
2.1.2.1 抑制体外脂质过氧化活性评价
研究表明,多糖可以络合产生ROS所必需的金属离子[28]。多糖环上的醇羟基可与产生羟基自由基等所必需的金属离子[如Fe2+、二价铜离子(Cu2+)等]络合,使其不能产生羟基自由基,而羟基自由基能起动脂质过氧化反应,脂质过氧化反应可产生脂质过氧化氢(H2O2)。因此多糖能够抑制脂质过氧化。
Fe2+/抗坏血酸处理小鼠离体肝脏能引起肝脏脂质过氧化反应的发生。目前研究发现,白化茸多糖[26]、海藻多糖[29]、灵芝多糖[30]、天门冬多糖[31]能抑制Fe2+/抗坏血酸引起的肝脏脂质过氧化作用。
研究还发现,淫羊藿多糖[10]、银耳多糖[16]能抑制红细胞膜的脂质过氧化,保护细胞膜结构的完整性。
2.1.2.2 抑制体外蛋白质氧化损伤活性评价
蛋白质的氧化损伤会造成一系列的生理和病理紊乱[32]。Subramanian等[33]研究发现,心叶青牛胆多糖可以抑制辐射引起的蛋白质损伤。
2.1.3 体外细胞模型评价
由于细胞更接近生物体内的环境,因此与体外化学法和生物学评价方法相比,采用细胞为载体来进行抗氧化活性的初期筛选、评价,成为多糖抗氧化活性研究一种较好的选择。
研究者可以根据抗氧化物质的应用目的来选择不同的模型细胞,以评价抗氧化活性物质对生物体内某一特定氧化应激反应的抗氧化能力[34-40]。表2列举了多糖抗氧化活性研究中常用的细胞模型及其研究应用。
2.2 体内评价
上述多糖抗氧化活性的体外评价方法简便、快捷,但是由于多糖消化、吸收、新陈代谢过程的作用增加了多糖抗氧化能力的不确定性,仅凭此研究结果不足以准确评价其抗氧化活性。目前,采用有代表性的氧化应激动物模型对多糖抗氧化活性进行评价研究已经得到了广泛认可。动物机体发生氧化应激时,体内高活性分子如ROS和RNS等产生过多,氧化程度超出机体抗氧化物的清除能力,氧化系统和抗氧化系统失衡,从而导致组织损伤的现象。在氧化应激过程中,由于受到自由基的氧化胁迫,构成细胞组织的各种物质如脂质、糖类、蛋白质、核糖核酸(DNA或RNA)等大分子物质,都会发生各种程度的氧化反应,引起变性、交联、断裂等氧化损伤[34-36],进而导致细胞结构和功能的破坏和细胞死亡,以及机体组织的损伤和器官的病变甚至癌症等[37]。
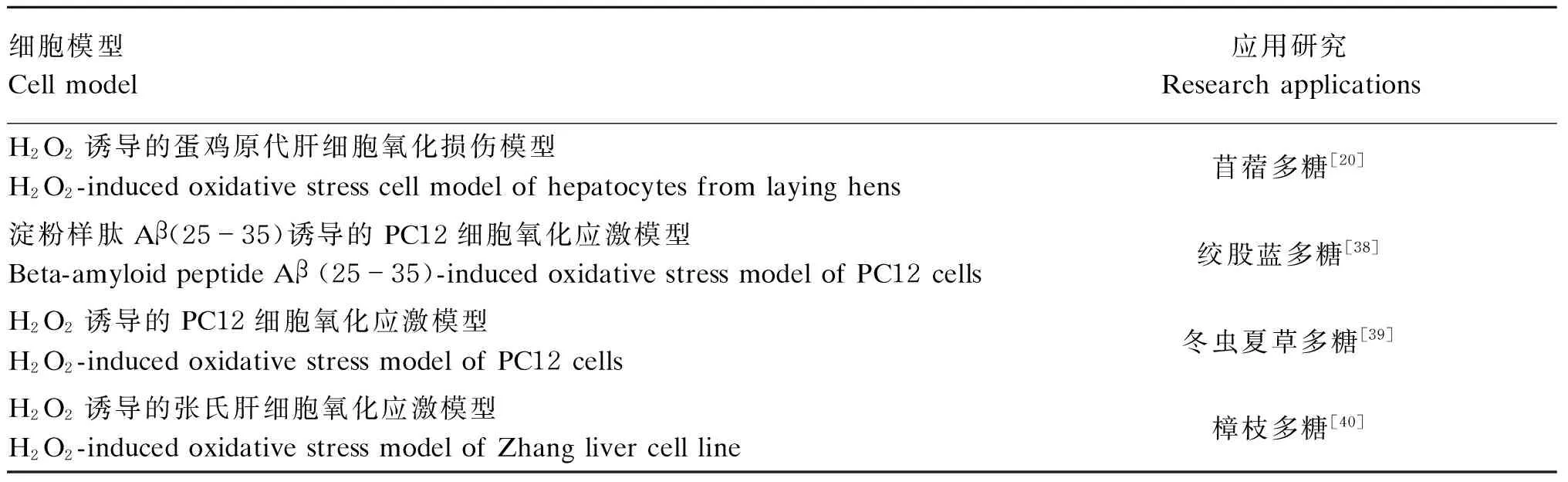
表2 多糖抗氧化活性研究中常用的细胞模型及其研究应用
研究发现,多糖抗氧化活性主要体现在对肝脏、肾脏等氧化自由基集中产生的器官蛋白质损伤、脂质过氧化、DNA或RNA氧化损伤的抑制、自由基的清除、抗氧化物(如抗氧化酶系统等)的保护、线粒体正常膜电位的维持等方面。
多糖抗氧化活性评价常用的动物模型包括D-半乳糖模型、转基因动物模型、高脂血症模型、脂肪酸氧化应激模型、辐射损伤模型等试验动物整体性地处于氧化应激状态的全身性的氧化应激模型(也称非特异性的氧化应激模型),另外还包括针对试验动物的某些特定组织器官进行氧化损伤的局部器官性的氧化应激模型(也称为特异性的氧化应激模型),如:四氯化碳(CCl4)-肝损伤模型、环孢灵-A诱导的肝或肾损伤氧化应激模型、链脲霉素诱导的糖尿病(胰腺损伤)氧化损伤模型及蛋氨酸和胆碱缺乏肝损伤模型等。表3列举了多糖抗氧化活性研究常用的动物模型及其研究应用。
2.3 细胞模型和动物模型评价常用方法和指标
多糖抗氧化活性的评价研究多集中在氧化应激标志物、抗氧化酶和抗氧化物的分析、细胞内钙、线粒体膜电位和线粒体凋亡分析等方面。根据氧化应激的物质种类,氧化应激的定量评价方法主要有蛋白质氧化损伤标志物检测、脂质过氧化标志物检测、DNA或RNA损伤检测以及活性氧消除系统酶和抗氧化物质检测等。研究证明,多糖在缓解蛋白质、脂质、核酸氧化损伤,调节机体抗氧化酶和抗氧化物水平,抑制细胞凋亡等抗氧化层面具有较好的活性。
2.3.1 蛋白质氧化损伤分析
氧化应激过程中,自由基对蛋白质的损伤作用包括蛋白质肽链断裂、蛋白质分子相互间交联聚合、蛋白质氨基酸发生氧化脱氨反应、氧自由基攻击蛋白质还原性基团、脂类氧化裂解所产生的丙二醛(MDA)与蛋白质上的氨基产生分子间的交联等。目前对于蛋白质氧化损伤的检测指标主要有2个:蛋白质羰基生成(羰基化)和二酪氨酸的生成(蛋白质中酪氨酸硝基化)[59-62]。相比之下,试验研究中以测定蛋白质羰基水平居多。
Josephine等[56]通过测定蛋白质羰基化水平,发现马尾藻多糖能降低环孢灵-A诱导的肝损伤大鼠蛋白质氨酰基化程度,降低蛋白质氧化损伤,缓解氧化应激。
2.3.2 脂质过氧化分析
脂质过氧化为ROS与生物膜的磷脂、酶和膜受体相关的多不饱和脂肪酸的侧链及核酸等大分子物质起脂质过氧化反应,形成脂质过氧化产物,如:MDA、4-羟基壬烯醛(HNE),从而使细胞膜的流动性和通透性发生改变,最终导致细胞结构和功能的改变[63-64]。HNE和MDA是2个强毒力的脂质过氧化终产物,常被作为判断脂质过氧化的指标。试验研究中以测定MDA含量较为常见。

表3 多糖抗氧化活性研究常用的动物模型及其研究应用
通过测定脂质过氧化终产物MDA含量,Jia等[38]研究发现绞股蓝多糖能降低β淀粉样肽(Aβ)诱导的CP12细胞脂质过氧化水平;Li等[48]发现刺五加多糖能降低辐射引起的氧化应激大鼠脂质过氧化水平;Yu等[50]发现甘遂多糖能降低游泳疲劳引起的氧化应激小鼠的脂质过氧化程度;Josephine等[56]发现马尾藻多糖能降低环孢灵-A诱导的肝损伤大鼠脂质过氧化程度。
2.3.3 DNA或RNA损伤分析
自由基可以直接攻击生物大分子DNA或RNA诱发DNA或RNA氧化损伤[65-66],其中以鸟嘌呤8位碳原子氧化后形成8-羟基-[脱氧]鸟嘌呤(8-OHdG/8-OHG)最为常见。另外,还有一些嘌呤或者嘧啶碱基直接脱去的反应,因此形成了核酸中无嘌呤(apurinic)和脱嘧啶(apyrimidinic)位点,统简称AP位点。除了上述氧化损伤外,DNA双链断裂(DSBs)是细胞内多种类型的DNA损伤中最危险、最严重的一种。试验研究中多采用测定8-OHdG含量的方法评价DNA损伤。另外,彗星试验(comet assay)也是应用较多的DNA损伤评价方法。彗星试验又称单细胞凝胶电泳检测技术(single cell gel electrophoresis assay,SCGE)是近年发展起来的在单细胞水平上定量检测DNA损伤的灵敏方法。其原理为:变性切离的DNA片段在电场的影响下从细胞核中移出,而完整的超螺旋DNA仍然保持在细胞核内。因而,通过凝胶电泳会形成完整的DNA的细胞染色体为“头”,松散和断裂的DNA为“尾”的“彗星拖尾”(comet tail)现象。DNA损伤越严重尾部和总彗星荧光百分比(tail DNA%)越高。
Josephine等[56]发现马尾藻多糖能降低环孢灵-A诱导的肝损伤大鼠8-OHdG含量,缓解DNA损伤。Tsai等[40]通过测定H2O2诱导的张氏肝细胞8-OHdG含量,发现樟枝多糖可以降低其DNA损伤。另外,Tsai等[40]还通过彗星试验研究证实,樟枝多糖可以降低H2O2诱导的张氏肝细胞DNA氧化损伤。
2.3.4 ROS、抗氧化酶和抗氧化物分析
需氧细胞在代谢过程中产生一系列的ROS,过多的ROS对细胞是有害的。细胞内存在的各种活性酶及抗氧化剂在机体细胞抵御氧化损伤、维持氧化和抗氧化的平衡中起了重要作用,如:氧自由基酶类将活性氧簇转化为低毒性物质[67]、抗氧化物质的解毒作用[68]等。其中,机体内多种氧自由基酶类发挥了重要的作用。主要的抗氧化酶类有:碱性磷酸酶(alkaline phosphatase,ALP)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、谷胱甘肽还原酶(glutathione reductase,GR)、超氧化物歧化酶(superoxide dismutase,SOD)。SOD是体内超氧阴离子的主要清除者,将其催化分解为H2O2,但H2O2也具有氧化损伤作用,CAT将其转化为氧气(O2)和水(H2O)。同时H2O2也可通过GSH-Px的催化和还原型谷胱甘肽(GSH)反应生成H2O,同时生成氧化型谷胱甘肽。另外,机体内GSH、维生素C、维生素E等非酶类抗氧化物质也在维持氧化和抗氧化的平衡中起了重要作用。
此外,多糖能够作为氢质子或电子的供给体,直接猝灭或抑制自由基,终止自由基的连锁反应,发挥抗氧化功能。可能途径一是多糖本身可以释放出体积小、亲合性很强的氢质子,捕捉高势能的极活泼的自由基使之转变为非活性或较为稳定的化合物,另一个途径可能是通过电子转移直接给出电子而清除自由基。
众多研究发现,樟枝多糖[40]、枸杞多糖[43]、刺五加[48]、甘遂多糖[50]、马尾藻多糖[56]、枸杞多糖[57]等具有促进机体GSH-Px、GR、SOD等抗氧化酶类生成的作用。Ma等[43]发现枸杞多糖能抵制饲喂高脂饲粮引起的氧化应激小鼠肝脏内非酶抗氧化物质GSH、维生素C和维生素E含量的下降,缓解小鼠氧化应激。此外,Jia等[38]研究发现,绞股蓝多糖能降低Aβ诱导的PC12细胞ROS含量。Tsai等[40]研究证实,樟枝多糖能降低H2O2诱导的张氏肝细胞ROS含量。
2.3.5 细胞内钙、线粒体膜电位和线粒体凋亡分析
过强的氧化应激会引起细胞内钙水平升高,导致线粒体膜电位降低,进而会激活线粒体凋亡通路。通过细胞内钙水平、线粒体膜电位测定和蛋白质免疫印迹(Western blot)等手段,Berridge等[68]发现,绞股蓝多糖能通过降低细胞内钙水平、维持线粒体正常膜电位、降低B淋巴细胞瘤基因-2(Bax/Bcl-2)表达、减少线粒体细胞色素C释放、抑制细胞凋亡蛋白酶(caspase-3,CPP3)来缓解PC12细胞由于Aβ诱导的氧化损伤[38]。
3 小 结
综上所述,多糖的不同提取方法各有优劣,在多糖提取中应根据实际情况选择合适的提取方法。同时,多糖的抗氧化机理复杂,在进行多糖抗氧化活性评价研究时应将体外评价和体内评价方法结合起来,有层次、有目的地研究才能清楚的了解多糖抗氧化活性的机制、有效的提取和利用多糖。
[1] WU G H,HU T,HUANG Z L,et al.Characterization of water and alkali-soluble polysaccharides fromPleurotustuber-regiumsclerotia[J].Carbohydrate Polymers,2013,96(1):284-290.
[2] ZHANG M,ZHANG L N,CHEUNG P C K,et al.Molecular weight and anti-tumor activity of the water-soluble polysaccharides isolated by hot water and ultrasonic treatment from the sclerotia and mycelia ofPleurotustuber-regium[J].Carbohydrate Polymers,2004,56(2):123-128.
[3] WANG X,LÜ X.Characterization of pectic polysaccharides extracted from apple pomace by hot-compressed water[J].Carbohydrate Polymers,2014,102:174-184.
[4] YANG X B,YANG S,GUO Y R,et al.Compositional characterisation of soluble apple polysaccharides,and their antioxidant and hepatoprotective effects on acute CCl4-caused liver damage in mice[J].Food Chemistry,2013,138(2/3):1256-1264.
[5] ZHANG X H,LIU L N,LIN C W.Isolation,structural characterization and antioxidant activity of a neutral polysaccharide fromSisalwaste[J].Food Hydrocolloids,2014,39:10-18.
[6] LAI L S,YANG D H.Rheological properties of the hot-water extracted polysaccharides in Ling-Zhi (Ganodermalucidum)[J].Food Hydrocolloids,2007,21(5/6):739-746.
[7] TSENG Y H,YANG J H,MAU J L.Antioxidant properties of polysaccharides fromGanodermatsugae[J].Food Chemistry,2008,107(2):732-738.
[8] LIU F,LIU W H,TIAN S G.Artificial neural network optimization ofAlthaearoseaseeds polysaccharides and its antioxidant activity[J].International Journal of Biological Macromolecules,2014,70:100-107.
[9] KLAUS A,KOZARSKI M,NIKSIC M,et al.Antioxidative activities and chemical characterization of polysaccharides extracted from the basidiomyceteSchizophyllumcommune[J].LWT-Food Science and Technology,2011,44(10):2005-2011.
[10] CHENG H R,FENG S L,SHEN S A,et al.Extraction,antioxidant and antimicrobial activities ofEpimediumacuminatumFranch.polysaccharide[J].Carbohydrate Polymers,2013,96(1):101-108.
[11] CHENG H R,FENG S L,JIA X J,et al.Structural characterization and antioxidant activities of polysaccharides extracted fromEpimediumacuminatum[J].Carbohydrate Polymers,2013,92(1):63-68.
[12] WANG Z B,PEI J J,MA H L,et al.Effect of extraction media on preliminary characterizations and antioxidant activities ofPhellinuslinteuspolysaccharides[J].Carbohydrate Polymers,2014,109:49-55.
[13] CHEN R Z,LI S Z,LIU C M,et al.Ultrasound complex enzymes assisted extraction and biochemical activities of polysaccharides fromEpimediumleaves[J].Process Biochemistry,2012,47(12):2040-2050.
[14] ZHU Z Y,PANG W,LI Y Y,et al.Effect of ultrasonic treatment on structure and antitumor activity of mycelial polysaccharides fromCordycepsgunnii[J].Carbohydrate Polymers,2014,114 :12-20.
[15] ZOU Y F,CHEN X F,YANG W Y,et al.Response surface methodology for optimization of the ultrasonic extraction of polysaccharides fromCodonopsispilosulaNannf. var.modestaL. T. Shen[J].Carbohydrate Polymers,2011,84(1):503-508.
[16] YAN Y L,YU C H,CHEN J,et al.Ultrasonic-assisted extraction optimized by response surface methodology,chemical composition and antioxidant activity of polysaccharides fromTremellamesenterica[J].Carbohydrate Polymers,2011,83(1):217-224.
[17] YIN X L,YOU Q H,JIANG Z H.Optimization of enzyme assisted extraction of polysaccharides fromTricholomamatsutakeby response surface methodology[J].Carbohydrate Polymers,2011,86(3):1358-1364.
[18] ZHU Y,LI Q,MAO G H,et al.Optimization of enzyme-assisted extraction and characterization of polysaccharides fromHericiumerinaceus[J].Carbohydrate Polymers,2014,101:606-613.
[19] LI S N,HAN D D,ROW K H,et al.Optimization of enzymatic extraction of polysaccharides from some marine algae by response surface methodology[J].Korean Journal of Chemical Engineering,2012,29(5):650-656.
[20] WANG S P,DONG X F,TONG J M.Optimization of enzyme-assisted extraction of polysaccharides from alfalfa and its antioxidant activity[J].International Journal of Biological Macromolecules,2013,62:387-396.
[21] CHEN H G,ZHOU X,ZHANG J Z.Optimization of enzyme assisted extraction of polysaccharides fromAstragalusmembranaceus[J].Carbohydrate Polymers,2014,111:567-575.
[22] ZHANG J,JIA S Y,LIU Y,et al.Optimization of enzyme-assisted extraction of theLyciumbarbarumpolysaccharides using response surface methodology[J].Carbohydrate Polymers,2011,86(2):1089-1092.
[23] ZHAO W Z,YU Z P,LIU J B,et al.Optimized extraction of polysaccharides from corn silk by pulsed electric field and response surface quadratic design[J].Journal of the Science of Food and Agriculture,2011,91(12):2201-2209.
[24] CHEN X P,CHEN Y,LI S B,et al.Free radical scavenging ofGanodermalucidumpolysaccharides and its effect on antioxidant enzymes and immunity activities in cervical carcinoma rats[J].Carbohydrate Polymers,2009,77(2):389-393.
[25] DOU J,MENG Y H,LIU L,et al.Purification,characterization and antioxidant activities of polysaccharides from thinned-young apple[J].International Journal of Biological Macromolecules,2015,72:31-40.
[26] MA L S,CHEN H X,ZHU W C,et al.Effect of different drying methods on physicochemical properties and antioxidant activities of polysaccharides extracted from mushroomInonotusobliquus[J].Food Research International,2013,50(2):633-640.
[27] LI J W,LIU Y F,FAN L P,et al.Antioxidant activities of polysaccharides from the fruiting bodies ofZizyphusJujubacv.Jinsixiaozao[J].Carbohydrate Polymers,2011,84(1):390-394.
[28] VOLPI N,TARUGI P.Influence of chondroitin sulfate charge density,sulfate group position,and molecular mass on Cu2+-mediated oxidation of human low-density lipoproteins: effect of normal human plasma-derived chondroitin sulfate[J].Journal of Biological Chemistry,1999,125(2):297-304.
[29] DE SOUZA M C R,MARQUES C T,DORE C M G,et al.Antioxidant activities of sulfated polysaccharides from brown and red seaweeds[J].Journal of Applied Phycology,2007,19(2):153-160.
[30] LEE J M,KWON H,JEONG H,et al.Inhibition of lipid peroxidation and oxidative DNA damage byGanodermalucidum[J].Phytotherapy Research,2001,15(3):245-249.
[31] 李志孝,黄成钢,蔡育军,等.天门冬多糖的化学结构及体外抗氧化活性[J].药学学报,2000,35(5):358-362.
[32] STADTMAN E R,BERLETT B S.Reactive oxygen-mediated protein oxidation in aging and disease[J].Chemical Research in Toxicology,1997,10(5):485-494.
[33] SUBRAMANIAN M,CHINTALWAR G J,CHATTOPADHYAY S.Antioxidant properties of aTinosporacordifoliapolysaccharide against iron-mediated lipid damage and γ-ray induced protein damage[J].Redox Report,2002,7(3):137-143.
[34] HALLIWELL B,GUTTERIDGE J M C.Free radicals in biology and medicine[M].New York:Oxford University Press,1998:105-107.
[35] DEAN R T,GIESEG S,DAVIES M J.Reactive species and their accumulation on radical damaged proteins[J].Trends in Biochemical Science,1993,18(11):437-441.
[36] ARUOMA O I.Free radicals,oxidative stress,and antioxidants in human health and disease[J].Journal of the American Oil Chemists’ Society,1998,75(2):199-212.
[37] VALKO M,IZAKOVIC M,MAZUR M,et al.Role of oxygen radicals in DNA damage and cancer incidence[J].Molecular and Cellular Biochemistry,2004,266(1/2):37-56.
[38] JIA D,RAO C G,XUE S X,et al.Purification,characterization and neuroprotective effects of a polysaccharide fromGynostemmapentaphyllum[J].Carbohydrate Polymers,2015,122:93-100.
[39] LI S P,ZHAO K J,JI Z N,et al.A polysaccharide isolated fromCordycepssinensis,a traditional Chinese medicine,protects PC12 cells against hydrogen peroxide-induced injury[J].Life Sciences,2003,73(19):2503-2513.
[40] TSAI M C,SONG T Y,SHIH P H,et al.Antioxidant properties of water-soluble polysaccharides fromAntrodiacinnamomeain submerged culture[J].Food Chemistry,2007,104(3):1115-1122.
[41] HASSAN S,EL-TWAB S A,HETTA M,et al.Improvement of lipid profile and antioxidant of hypercholesterolemic albino rats by polysaccharides extracted from the green algaUlvalactucaLinnaeus[J].Saudi Journal of Biological Sciences,2011,18(4):333-340.
[42] ZHAO S,RONG C B,LIU Y,et al.Extraction of a soluble polysaccharide fromAuriculariapolytricha and evaluation of its anti-hypercholesterolemic effect in rats[J].Carbohydrate Polymers,2015,122:39-45.
[43] MA M,LIU G H,YU Z H,et al.Effect of theLyciumbarbarumpolysaccharides administration on blood lipid metabolism and oxidative stress of mice fed high-fat diet in vivo[J].Food Chemistry,2009,113(4):872-877.
[44] 葛霞,陈婷婷,蔡教英,等.青钱柳多糖抗氧化活性的研究[J].中国食品学报,2011,11(5):59-64.
[45] QIAO D L,KE C L,HU B,et al.Antioxidant activities of polysaccharides fromHyriopsiscumingii[J].Carbohydrate Polymers,2009,78(2):199-204.
[46] KE C L,QIAO D L,GAN D,et al.Antioxidant acitivityinvitroandinvivoof the capsule polysaccharides fromStreptococcusequisubsp.zooepidemicus[J].Carbohydrate Polymers,2009,75(4):677-682.
[47] 党月兰.红毛五加多糖对实验性肝损伤的保护作用[J].中国中药杂志,1997,22(3):176-178.
[48] LI X L,ZHOU A G.Preparation of polysaccharides fromAcanthopanaxsenticosusand its inhibition against irradiation-induced injury of rat[J].Carbohydrate Polymers,2007,67(2):219-226.
[49] WEI W S,TAN J Q,GUO F,et al.Effects ofCoriolusversicolorpolysaccharides on superoxide dismutase activities in mice[J].Acta Pharmacologica Sinica,1996,17(2):174-178.
[50] YU F R,LU S Q,YU F H,et al.Protective effects of polysaccharide from Euphorbia kansui (Euphorbiaceae) on the swimming exercise-induced oxidative stress in mice[J].Canadian Journal of Physiology and Pharmacology,2006,84(10):1071-1079.
[51] CHI A P,KANG C Z,ZHANG Y,et al.Immunomodulating and antioxidant effects of polysaccharide conjugates from the fruits ofZiziphusJujubeon Chronic Fatigue Syndrome rats[J].Carbohydrate Polymers,2015,122:189-196.
[52] JIANG C X,XIONG Q P,GAN D,et al.Antioxidant activity and potential hepatoprotective effect of polysaccharides fromCyclinasinensis[J].Carbohydrate Polymers,2013,91(1):262-268.
[53] 陈春英,丁玉强,ELMAHADI E A,等.箬叶多糖对小鼠实验性四氯化碳致肝损伤的作用[J].中国药理学与毒理学杂志,1996,10(3):237-238.
[54] 杨云,胡筱希,周凌凌,等.龙葵多糖对CCl4致急性肝损伤小鼠的保护作用研究[J].中成药,2014,36(12):2602-2605.
[55] JOSEPHINE A,VEENA C K,AMUDHA G,et al.Evaluating the effect of sulphated polysaccharides on cyclosporine a induced oxidative renal injury[J].Molecular and Cellular Biochemistry,2006,287(1/2):101-108.
[56] JOSEPHINE A,NITHYA K,AMUDHA G,et al.Role of sulphated polysaccharides fromSargassumWightiiin Cyclosporine A-induced oxidative liver injury in rats[J].BMC Pharmacology,2008,8(1):4.
[57] LI X M.Protective effect ofLyciumbarbarumpolysaccharides on streptozotocin-induced oxidative stress in rats[J].International Journal of Biological Macromolecules,2007,40(5):461-465.
[58] JIA J,ZHANG X,HU Y S,et al.Evaluation of in vivo antioxidant activities ofGanodermalucidumpolysaccharides in STZ-diabetic rats[J].Food Chemistry,2009,115(1):32-36.
[59] DAVIES K J.Protein damage and degradation by oxygen radicals.Ⅰ.General aspects[J].The Journal of Biological Chemistry,1987,262(20):9895-9901.
[60] DAVIES K J,DELSIGNORE M E,LIN S W.Protein damage and degradation by oxygen radicals.Ⅱ.Modification of amino acids[J].The Journal of Biological Chemistry,1987,262(20):9902-9907.
[61] DAVIES K J,DELSIGNORE M E.Protein damage and degradation by oxygen radicals.Ⅲ.Modification of secondary and tertiary structure[J].The Journal of Biological Chemistry,1987,262(20):9908-9913.
[62] DAVIES K J,LIN S W,PACIFICI R E.Protein damage and degradation by oxygen radicals.Ⅳ.Degradation of denatured protein[J].The Journal of Biological Chemistry,1987,262(20):9914-9920.
[63] RICE-EVANS C,BURDON R.Free radical-lipid interactions and their pathological consequences[J].Progress in Lipid Research,1993,32(1):71-110.
[64] HALLIWELL B,GUTTERRIDGE J M C.Lipid peroxidation,oxygen radicals,cell damage,and antioxidant therapy[J].The Lancet,1984,323(8391):1396-1397.
[65] IMLAY J A,LINN S.DNA damage and oxygen radical toxicity[J].Science,1988,240(4857):1302-1309.
[66] COTGREAVE I A,MOLDEUS P,ORRENIUS S.Host biochemical defense mechanisms against prooxidants[J].Annual Review of Pharmacology and Toxicology,1988,28(1):189-212.
[67] ARUOMA O I.Characterization of drugs as antioxidant prophylactics[J].Free Radical Biology and Medicine,1996,20(5):675-705.
[68] BERRIDGE M J,LIPP P,BOOTMAN M D.Signal transduction.The calcium entry pas de deux[J].Science,2000,287(5458):1604-1605.
*Corresponding author, associate professor, E-mail: xiaofangd1124@sina.com
(责任编辑 武海龙)
Research Status and Progress of Extraction and Antioxidant Activity Evaluation Methods of Polysaccharides
LIU Song DONG Xiaofang*TONG Jianming
(Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
As one of the four essential substances that constitute the life activity, polysaccharides is closely related to the various physiological functions needed to maintain life. With the development of its research, the antioxidant activity of polysaccharides has become a research hotspot. In this paper, the research status and progress of extraction and antioxidant activity evaluation methods of polysaccharides were summarized which could be referenced in the extraction and antioxidant activities research of polysaccharides.[ChineseJournalofAnimalNutrition, 2016, 28(11):3391-3399]
polysaccharides; extraction; antioxidant activity evaluation
2016-04-20
“十二五”国家科技支撑计划课题(2013BAD10B04);国家蛋鸡产业技术体系建设专项经费(CARS-41-K16);中国农业科学院科技创新工程(ASTIP-IAS08)
刘 松(1991—),男,山东日照人,硕士研究生,从事蛋鸡营养与饲料添加剂研究。E-mail: liusong7@yeah.net
*通信作者:董晓芳,副研究员,硕士生导师,E-mail: xiaofangd1124@sina.com
10.3969/j.issn.1006-267x.2016.11.004
S852.2
A
1006-267X(2016)11-3391-09
