生物膜处理高含油废水及膜表面微生物群落特性研究
2016-12-01林莹莹聂麦茜贺美丽西安建筑科技大学环境与市政工程学院陕西西安710055
林莹莹,聂麦茜,王 琰,贺美丽,李 虹 (西安建筑科技大学环境与市政工程学院,陕西 西安 710055)
生物膜处理高含油废水及膜表面微生物群落特性研究
林莹莹,聂麦茜*,王 琰,贺美丽,李 虹 (西安建筑科技大学环境与市政工程学院,陕西 西安 710055)
利用单一铜绿假单胞菌NY3生物膜在敞开体系中(非无菌条件下)处理石油废水,结果发现,生物膜可高效率去除高浓度含油废水中的油类物质.在2g/L含油水样中,连续运行25d,石油烃去除率可持续保持约91.1%.停止进水后,曝气可使生物膜活性恢复.自然环境中,配伍于NY3菌生物膜中的微生物主要有芽孢杆菌、假单胞菌和红球菌属,其中在实验室能够培养出来的微生物经16SrRNA鉴定分别属于红球菌属和芽孢杆菌属,经检测,2株菌均有高的石油烃降解效率.
铜绿假单胞菌NY3;固定化生物膜;高浓度含油废水;微生物群落
固定化生物膜处理技术的研究起步较早,但一直无法处理高浓度含油废水.从文献报道
[1-4]看,利用混合优势菌株固定化生物膜可处理低浓度含油废水中油类物质;也可经过长期的培养驯化,得到固定化生物膜,用此来降解含油废水,一般该生物膜培养、驯化、挂膜时间较长,且仅可处理低于 100mg/L的含油废水[5];近年来报道了一种新型的微生物固定化产品[6-7],它是通过将微生物固定在一定数量的载体上,做成生物膜成品,这些成品大多数都是通过一些混合菌株进行固定化而形成的,对中低浓度的含油废水处理效率较高,目前这类固定化生物膜处理技术应用于处理高浓度含油废水的报道相对较少.所以,开发一种单一高效的耐温度、耐酸碱性的石油降解菌株,通过固定化的方法形成生物膜,然后用其处理高浓度含油废水的生物处理技术非常紧迫.
课题组前期从陕北某油田受石油污染的土壤中筛选得到一株铜绿假单胞菌,命名为NY3[8],具有高效降解石油烃的功能.前期研究发现单一NY3菌可固定在聚氨酯泡沫表面,形成固定化生物膜,且可处理含油废水.本文在此基础上,研究在敞开体系中,NY3菌生物膜处理高浓度含油废水前后表面特征,处理前后及其恢复过程中自然从环境中配伍在生物膜上的微生物种群关系,并对其中可培养微生物的降油性能进行研究,研究结果为NY3菌生物膜处理实际高浓度含油废水奠定基础.
1 材料与方法
1.1 实验材料
1.1.1 菌种来源 铜绿假单胞菌NY3,由实验室分离并鉴定[8].
1.1.2 原油来源及其特性 试验中所用原油均来自长庆油田,其含蜡量为 10.48%,胶质含量6.5%,沥青质含量 0.93%,20℃密度为 0.845t/m3,汽油比为45m3/t,50℃粘度为5.2mps.s,初馏点为55.6℃.
1.1.3 聚氨酯泡沫载体 参照文献[9-10]中的方法,先将载体制作成5mm的立方体小块,再用5% HCl溶液浸泡24h,用蒸馏水洗至中性;然后用5% NaOH溶液浸泡24h,用蒸馏水洗至中性,烘干备用.
1.1.4 培培培 制备种子液的培养基:牛肉膏3.0g/L,蛋白胨 10.0g/L,NaCl 5.0g/L,蒸馏水1000mL,调节pH值为7.3~7.5,121℃灭菌30min.
NY3菌固定化培养液:同制备种子液的培养基.
无机盐培养基:5g NH4NO3,1mL微量元素,0.1mL 1M MgSO4·7H2O溶液,0.05mL 1M CaCl2·2H2O溶液,100mL磷酸盐缓冲液,用蒸馏水定容1000mL,调节pH为7.5;121℃高压水蒸气灭菌30min.
原油-无机盐降解体系(2g/L):用移液管吸取1mL溶有原油的石油醚(4%),置于50mL锥形瓶中,再用吹风机将石油醚吹至挥发完,向瓶中加入20mL上述无机盐培养基,121℃高压水蒸气灭菌30min.
1.2 实验方法
1.2.1 NY3固定化生物膜挂膜方法 基于前期研究结果[11-12],本实验在最佳优化条件下,进行NY3菌生物膜的固定化,其固定化步骤为[13]:
(1)用电子天平分别准确称取已预处理过的、于60℃干燥后的聚氨酯泡沫载体1.0g,将相同重量的 4份聚氨酯泡沫在使用之前于紫外灯下灭菌30min,杀死载体上的杂菌.
(2)在无菌条件下操作,将灭菌后的4份载体分别放入100mL固定化培养液(pH=7.5)中,分别接种等量的菌悬液,接种量为10%.
(3)将4份制备好的固定化培养液置于30℃,200r/min的恒温摇床上生长固定 51h(前期已优化的最佳固定化时间),51h后,将固定化生物膜载体用0.85%的NaCl溶液洗涤3次,洗掉残留在载体上的菌悬液以及粘附在载体表面上的固定化液.收获固定化菌剂.
(4)取上述2份样品检测聚氨酯泡沫表面生物量,采用细胞干重法测定载体上的生物量,将已知重量的聚氨酯泡沫载体和吸附在其上的菌体于 60℃烘干至恒重,减去载体重量,所得值为细胞干重,以mg/g聚氨酯泡沫表示.
1.2.2 NY3固定化生物膜的运行 取10个装有20mL原油-无机盐降解体系(2g/L)的50mL锥形瓶,向每瓶加入 20个上述固定化菌剂(即1.0g生物膜/100mL反应体系[11-12]),敞开体系,置于30
℃、151r/min的恒温摇床内降解原油,每隔 24h更换一次原油-无机盐培养液,运行60d.
1.2.3 NY3固定化生物膜生物活性的恢复 取上述运行60d后的膜测定其恢复结果.取6份相同量的运行60d后的生物膜载体,分别投入到装有20mL无机盐培养液(加入200uL 50%的甘油)的锥形瓶中,敞开体系,置于 30℃、151r/min的恒温摇床内振荡培养,每隔 3d取出一份样品萃取生物膜上残留的油类物质,萃取液经气相检测器分析.
1.2.4 NY3菌固定化生物膜表面菌群多样性分析 分别取挂膜初始、运行过程中,恢复过程中的样品做 PCR-DGGE分析.用细菌通用引物968F(AACGCGAAGAACCTTAC)和1401R (CGGTGTGTACAAGACCC)进行16SrRNA V3区扩增[14].
PCR反应体系(50µL)如下:10xbuffer 5µL,dNTP 4µL, ExTaq酶 6µL,引物各 0.2µL,模板DNA 5µL,补ddH2O至50µL.
反应条件[15]:95℃预变性 5min;94℃变性30s,59℃退火 45s,72℃延伸 45s,30个循环;72℃延伸7min.
DGGE变性梯度为 35%~55%,电泳温度60℃,电压130V预跑10min,然后70V跑13h[16],电泳完毕后用 gelred染色 30min,超纯水脱色10min,通过凝胶成像系统分析结果,割胶.经回收的胶再次扩增后跑琼脂糖凝胶电泳,割胶回收,然后连接到PMD19-T载体上,并转入DH5ɑ感受态细胞中,挑选阳性克隆送上海生工测序.
1.2.5 天然复配菌种分离与鉴定 在上述恢复过程中,每隔 3d取出的样品经石油醚萃后,放入10mL无菌水中,置于超声波中超声以制备菌悬液[17],再将菌悬液稀释倒平板,37℃培养24h.从平板上挑出不同形态的菌落培养,然后通过划线分离法得到各个单株菌菌落.
利用基因组DNA提取试剂盒分别提取各个分离菌株的基因组DNA,用通用引物27F(AGAGTTTGATCCTGGCTCAG)和1492R (AAGGAGGTGATCCAGCCGCA)[18]进行菌株 16SrRNA序列扩增.PCR反应体系同上.
PCR扩增条件为[19]:95℃预变性 5min;95℃变性 40s,58℃退火 40s,72℃延伸 90s,32个循环;72℃延伸10min.克隆转化方法同上.
1.2.6 天然复配菌降解原油 无菌条件下,向50mL锥形瓶中加入已灭菌的原油-无机盐降解体系10mL,接种量为10mL,30℃、175r/min恒温培养5d,用60~90℃石油醚萃取剩余原油3次,合并萃取液,挥发石油醚,2mL正己烷定容后,做气相分析.
1.3 分析测试方法
1.3.1 NY3固定化生物膜表面结构的观察 分别取刚制备的和恢复期间(萃油后)的NY3固定化生物膜,用2%~4%的戊二醛溶液固定4h,再用0.2M pH 7.0的磷酸盐缓冲液漂洗 3次,每次15min,然后,用浓度梯度不同的乙醇水溶液(50%、70%、80%、90%、95%、100%)按从稀到浓的次序,进行脱水处理,每种浓度处理15min,再将样品浸泡于醋酸异戊二酯中[20],4℃过夜,最后把样品放入临界点干燥仪(HCP-2型)样品室中,干燥后,借助扫描电子显微镜(SEM)观察其表观结构.
1.3.2 气相色谱测定原油组分的方法和色谱条件 用安捷伦6890N单检测器气相色谱仪分离原油组分,用戊烷、己烷、辛烷、十二烷、十四烷、正十六烷、十八烷等标准物质及烷烃气相色谱分离规律,确定原油中烃的组分.以正十一烷为内标物,与未投加菌对照组相应色谱图对比,计算降解效率.色谱条件[21]:5% phenyl Methyl Siloxane HP-5 毛细管气相色谱柱(30m×320µm× 0.25µm),载气:99.99%高纯氮气,进样口温度300℃,分流比 30:1.检测器温度:300℃,氢气流量40mL/min,空气流量 450mL/min.程序升温,初始50℃,保留7min,再以20 /min℃ 升温至100℃,保留1min,最后以5 /min℃ 升温至290℃保留5min.
1.3.3 测序结果分析及进化树构建 将16SrRNA序列测序结果进行序列拼接和去除多余碱基后,在 NCBI(http://blast.ncbi.nlm.nih.gov/ Blast.cgi)中进行blast分析,采用clustalX1.81和mega4.0软件进行序列比对和进化树构建.
2 结果与讨论
2.1 NY3菌固定化生物膜及其处理高浓度含油水样的特性
按照1.2.1中实验方法,预处理聚氨酯泡沫表面,处理好的表面如图1a所示.将NY3菌接种于含预处理过的聚氨酯泡沫的培养基中,51h后,按照1.3.1中方法利用扫描电镜(SEM)观察NY3菌固定化生物膜的表面特征如图1b所示.图1b结果表明,聚氨酯泡沫表面 NY3菌分布均匀,生物量大,利用重量法测得聚氨酯泡沫表面生物量为430~460mg干菌/g聚氨酯.利用该生物膜以序批式处理含油2g/L的实验室配制的水样,水力停留时间保持在24h,运行60d后,生物膜特征如图1c所示.生物膜运行过程中石油烃去除效率如图 2所示.从运行效果看,在敞开反应体系中,NY3菌生物膜至少在25d内一直保持降解活性,石油烃净去除率83%~95%之间.在前25d的运行过程中出水一直清澈,透明,但运行约 30d时,明显看出,出水浑浊度大,OD600nm可达到约0.7,这是因为生物膜脱落造成的,这直接导致石油烃净去除率降低 15%~20%.随运行时间延长,生物膜活性逐渐恢复,当运行至45d时,石油烃净去除率可恢复到80%左右.随后生物膜活性逐渐降低,这是由于生物膜表面油量负荷过高,且包含异构烷烃、烯烃、炔烃、芳香烃及其它难降解物质[22].

图1 聚氨酯泡沫表面及其NY3菌固定化生物膜的SEM图Fig.1 SEM photos of the surface of carrier with and without immobilized NY3 strain (a) surface of the carrier without NY3 strain (b) surface of the carrier with NY3strain (c) surface of the carrier with NY3strain after sixty recycles in treated oil-bearing wastewater
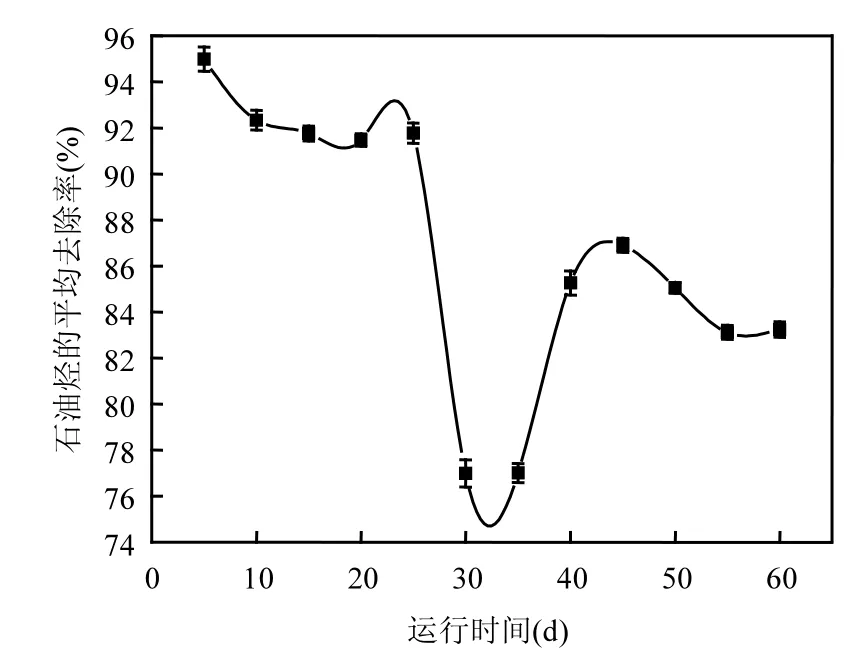
图2 NY3菌固定化生物膜序批式降解高浓度含油水样运行图Fig.2 The removal efficiency of immobilized bio-film of NY3 strainin treated high concentration oil-bearing wastewater
2.2 NY3固定化生物膜运行后自行恢复可行性
上述运行过程生物膜对油的吸附和降解同时进行,从气相色谱图看,降解量远大于吸附量.按照 1.2.3中实验方法,停止进水,恢复生物膜活性.将运行60d后生物膜取出,平均分为6组,其中一组生物膜用于在扫描电镜上观察生物膜特征,如图1c所示.5组各放入含500mg/L甘油的无机盐培养基中,与运行过程相同,曝气,分别在0、5、10、12、15d取出一组,用石油醚萃取,定容后测定石油醚层紫外光谱,如图3所示.石油醚挥发后,用正己烷定容做气相分析,结果如图4所示.结合图3和图4结果看,膜上的石油烃逐渐被降解,恢复12d后,生物膜上的石油烃基本降解完全,但仍残留一些难降解油类物质.从恢复后生物膜表面颜色逐渐变浅也说明生物膜活性逐渐恢复.
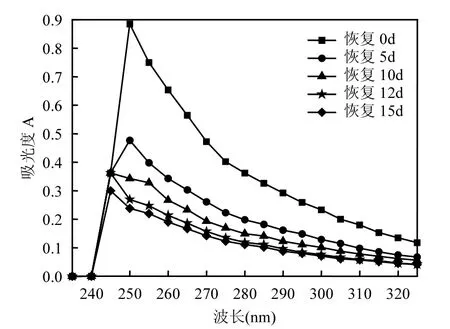
图3 恢复过程中从生物膜表面所萃取油类的紫外光谱图变化趋势Fig.3 UV spectra of oil from the surface of immobilized bio-film of NY3 strain in the process of recovery
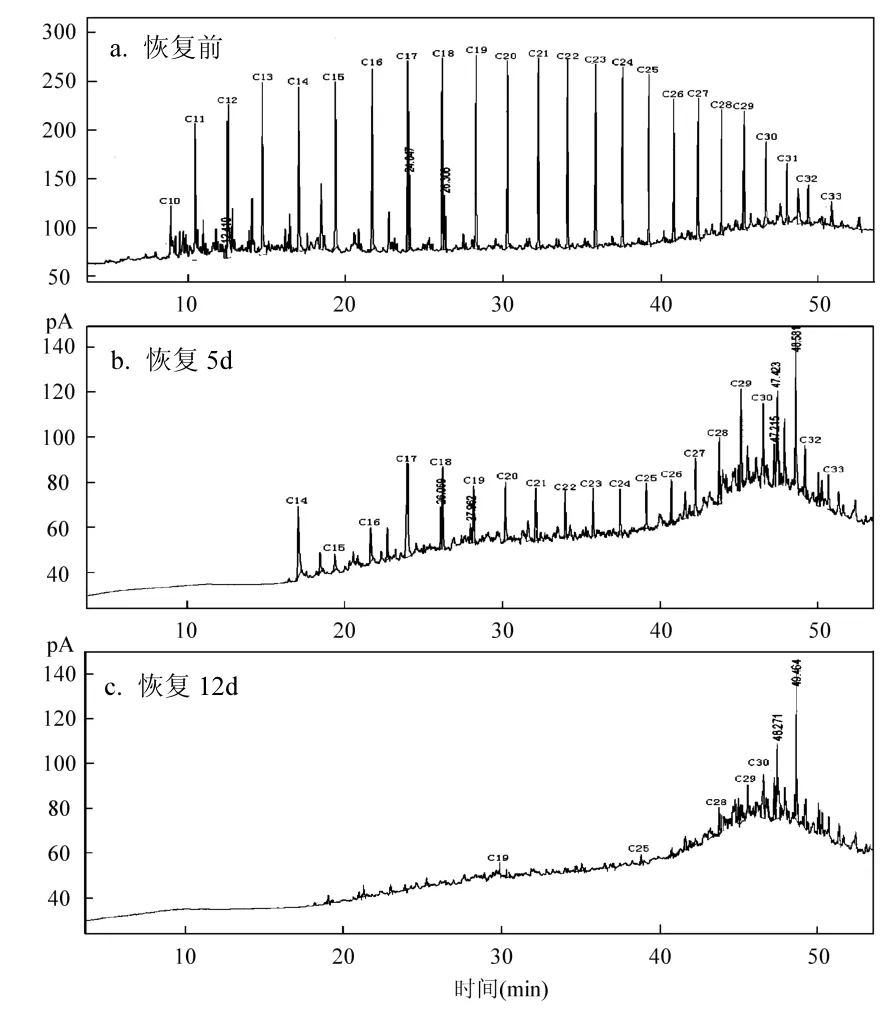
图4 恢复过程中从生物膜表面所萃取油类的气相色谱图Fig.4 Gas Chromatogram of oil from the surface of immobilized bio-film of NY3 strain in the process of recovery
2.3 NY3固定化生物膜表面微生物菌群DGGE分析结果
尽管初期仅用NY3菌获得固定化生物膜,然而运行是在敞开体系中,为掌握运行过程中微生物多样性的变化特性,按照 1.3.3中实验方法,收集运行前、运行过程及其恢复过程中生物膜表面细胞,提取DNA,然后进行PCR扩增,DGGE分析和目标条带的克隆转化.微生物多样性如图 5所示.从图5结果看,运行前,生物膜上主要是NY3菌株,在运行5d和10d时,微生物多样性逐渐增加,当运行达到60d时,生物膜上NY3菌细胞所占比例已非常少,因此,出现图 2中石油烃降解效率无法恢复到新鲜生物膜的活性的现象.按照2.2中方法恢复生物膜的活性,明显看出在恢复6d和12d后,生物膜上NY3菌细胞量逐渐增加.结合图3、图4和图5结果,说明停止进水,在含甘油的无机盐培养基中曝气生物膜的活性可逐渐恢复.
运行过程中自然与NY3菌配伍于生物膜表面的微生物,经16SrRNAV3区序列测序鉴定,结果如表1所示,细菌菌群结构之间的相似性如图6所示.从表1结果看,能自动配伍于NY3菌生物膜、并共同作用于石油烃降解的微生物种类主要有铜绿假单胞菌(Pseudomonas)、红球菌(Rhodococcus)、芽孢杆菌(Bacillus)、污泥溶杆菌(Lysobacter)、酸酐菌(Pelosinus),黄单胞菌(Stenotrophomonas)等,其中芽孢杆菌、假单胞菌和红球菌为优势菌群.
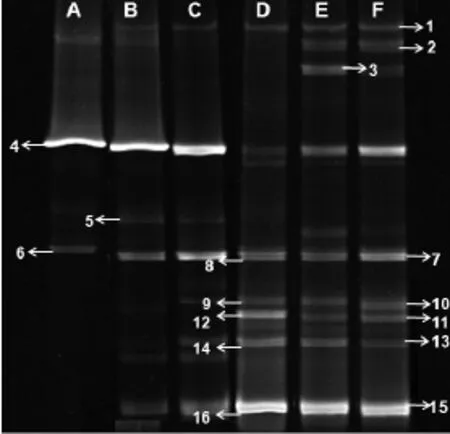
图5 不同时期生物膜上微生物DGGE图谱Fig.5 DGGE map of bacteria from biofilm at different periods

表1 DGGE优势条带的序列与NCBI数据库比对结果Table 1 Tentative identification of dominant DGGE bangs by sequencing the excised and NCBI analysis

续表1
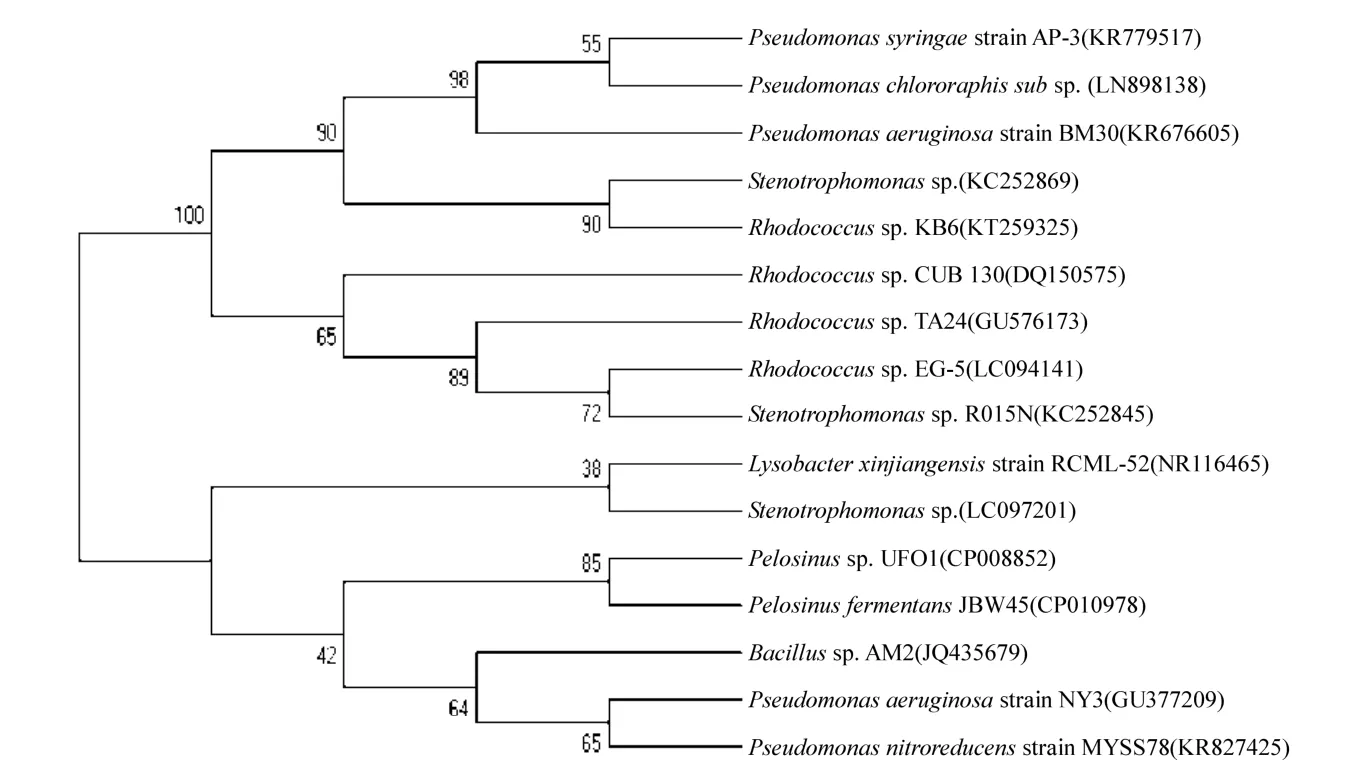
图6 聚类分析DGGE图谱中细菌菌群结构之间的相似性Fig.6 Analysis of the similarity among bacterial communites in DGGE map
2.4 NY3固定化生物膜上天然复配菌的分离与鉴定以及降解原油特性研究
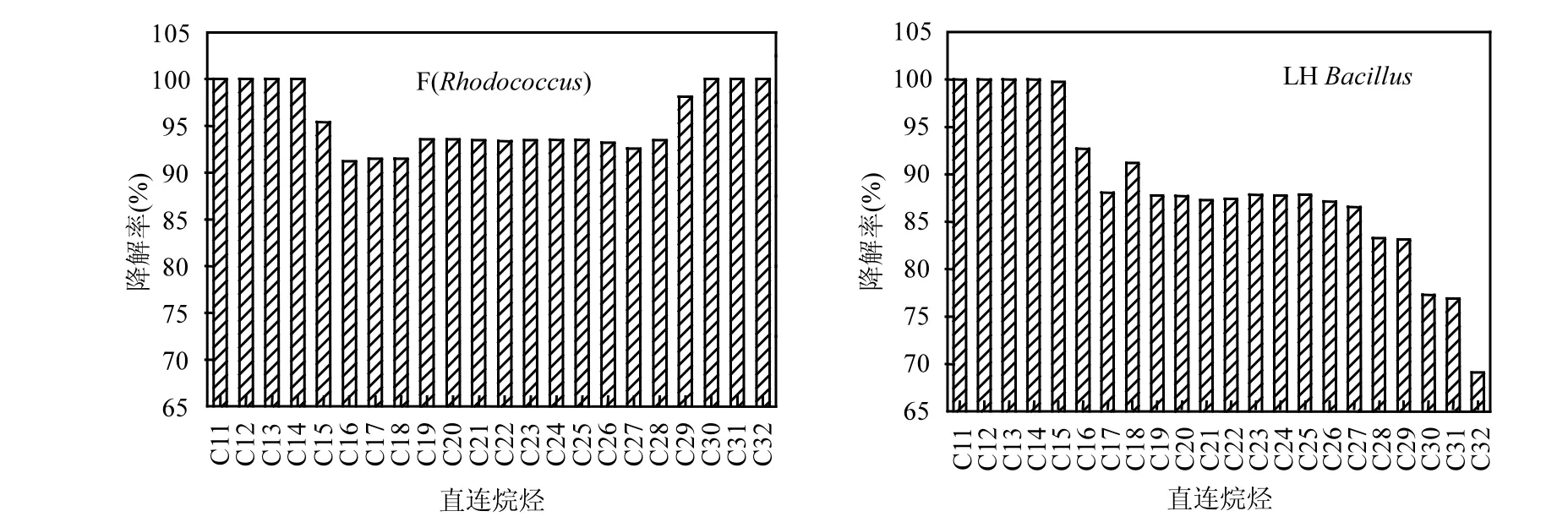
图7 芽孢杆菌LH和红球菌F对原油中各直链烷烃的降解特性Fig.7 The removal rate of petroleum hydrocarbons by LH(Bacillus) and F(Rhodobacterales)
由方法1.2.6可知,其中可分离、培养的菌株有2株,分别命名为LH和F,经16SrRNA鉴定细菌LH和F分别属于芽孢杆菌属(Bacillus)和红球菌属(Rhodococcus),并且分别与Bacillus sp. AM2(芽孢杆菌 AM2)和 Rhodococcus erythropolis R138(红串红球菌R138)菌株最为接近.2株可培养菌株经检测均能降解石油烃,结果如图7所示,尤其是红球菌属菌株 F对高浓度石油烃的平均降解率可达95%.
3 结论
3.1 在固定化培养基中,51h铜绿假单胞菌NY3能在聚氨酯泡沫表面挂膜,最大膜生物量为430~460mg干菌/g聚氨酯泡沫;HRT为24h时,在含油量为2g/L水样中,该膜连续运行约25d保持高达约91.1%的油去除率.
3.2 运行60d的 NY3固定化生物膜恢复12d,吸附在膜表面的石油烃基本降解完全,微生物活性恢复,使生物膜可重复利用.
3.3 运行初期,NY3固定化生物膜表面菌群仅为NY3菌,随运行时间延长微生物多样性增加,60d时,膜上 NY3菌细胞所占比例已非常少,天然复配了芽孢杆菌、假单胞菌和红球菌等.但随着恢复时间的延长膜表面NY3菌的细胞量又逐渐增多,恢复至12d时,NY3菌的细胞量已占较大比重.
3.4 自然配伍于NY3菌生物膜中的红球菌F和芽孢杆菌 LH分别单独降油时均具有高效的石油烃降解效率.
[1] Zhao X, Wang Y, Ye Z, et al. Oil field wastewater treatment in biological aerated filter by immobilized microorganisms [J]. Process Biochemistry, 2006,41(7):1475-1483.
[2] 沈齐英.含油废水处理概况 [J]. 北京石油化工學院學報, 2006,14(3):34-38.
[3] 湛 美,陈 丹.固定化菌剂处理含油废水的试验研究 [J]. 环境保护科学, 2011,37(5):23-47.
[4] Abalos A, Vinas M, Sabate J, et al. Enhanced biodegradation of Casablanca crude oil by a microbial consortium in presence of a rhamnolipid produced by Pseudomonas aeruginosa AT10 [J]. Biodegradation, 2004,15(4):249-260.
[5] 张文林,李春利,侯凯湖.含油废水处理技术研究进展 [J]. 化工进展, 2005,24(11):1239-1243.
[6] 张秀霞,秦丽姣,黄聪聪,等.微生物固定化载体的选择及其性能[J]. 化工进展, 2011,30(12):2781-2786.
[7] PIEKARSKA K.Preliminary studies on application of immobilized microorganisms to petroleum hydrocarbons biodegradation[C]//EuropeanSymposium on environmental biotechnology, 2004.
[8] Nie M, Yin X, Ren C, et al. Novel rhamnolipid biosurfactants produced by a polycyclic aromatic hydrocarbon-degrading bacterium Pseudomonas aeruginosa strain NY3 [J]. Biotechnology advances, 2010,28(5):635-643.
[9] Manohar S, Kim C, Karegoudar T. Enhanced degradation of naphthalene by immobilization of Pseudomonas sp. strain NGK1in polyurethane foam [J]. Applied Microbiology and Biotechnology, 2001,55(3):311-316.
[10] 刘献玲.固定化热带假丝酵母降解苯酚的实验与理论研究 [D].天津:天津大学, 2006.
[11] 刘 虹,张兰英,吴宇航.泥炭对石油降解菌最佳固定化条件的研究 [J]. 吉林化工学院学报, 2011,28(1):26-28.
[12] 贺美丽.嗜油菌固定化生物膜对高浓度含油废水的处理技术研究 [D]. 西安建筑科技大学, 2014:35-49.
[13] Li P, Wang X, Stagnitti F, et al. Degradation of phenanthrene and pyrene in soil slurry reactors with immobilized bacteria Zoogloea sp [J]. Environmental engineering science, 2005,22(3):390-399.
[14] Theron J, Cloete T E. Molecular techniques for determining microbial diversity and community structure in natural environments [J]. Critical reviews in microbiology, 2000,26(1):37-57.
[15] Ferris M J, Muyzer G, Ward D M. Denaturing gradient gel electrophoresis profiles of 16S rRNA-defined populations inhabiting a hot spring microbial mat community [J]. Applied and Environmental Microbiology, 1996,62(2):340-346.
[16] 赵兴青,杨柳燕,陈 灿,等.PCR-DGGE技术用于湖泊沉积物中微生物群落结构多样性研究 [J]. 生态学报, 2006,26(11):3610-3616.
[17] 周林成,李彦锋.大孔载体固定化微生物处理污水研究 [J]. 离子交换与吸附, 2007,23(6):531-539.
[18] Araya R, Tani K, Takagi T, et al. Bacterial activity and community composition in stream water and biofilm from an urban river determined by fluorescent in situ hybridization and DGGE analysis[J]. FEMS Microbiology Ecology, 2003,43(1):111-119.
[19] Tiedje J M. Microbial diversity: of value to whom [J]. ASM News, 1994,60(10):524-525.
[20] 周林成,李彦锋.大孔载体固定化微生物处理污水研究 [J]. 离子交换与吸附, 2007,23(6):531-539.
[21] 常 虹,聂麦茜,葛碧洲,等.铜绿假单胞菌NY3所产表面活性剂对原油降解的影响 [J]. 环境工程学报, 2013,7(2):771-776.
[22] 湛 美,陈 丹.固定化菌剂处理含油废水的试验研究 [J]. 环境保护科学, 2011,37(5):23-47.
Study on the high concentration oil-containing wastewater by biofilm treatment of P.aeruginosa strain NY3 and the characteristics of microbial community in biofilm.
LIN Ying-ying, NIE Mai-qian*, WANG Yan, HE Mei-li, LI Hong (School of Environmental and Municipal Engineering, Xi’an University of Architecture and Technology, Xi’an 710055, China). China Environmental Science, 2016,36(9):2800~2807
Single P. aeruginosa NY3 can grow and be immobilized on the surface of polyurethane foam carrier, the biofilm was used in an open system (non sterile conditions) to treat the oil-containing wastewater. The results showed that the biofilm can efficiently removeoil material of high concentrationoily wastewater. After continuously running for 25 d in the oil-bearing wastewater of 2g/L, the removal rate of petroleum hydrocarbons can be maintained at 91.1%. When the entrance of water was stopped, the bioactivityof the biofilm can be recovered by aeration. Under the natural environment,the bacterial accompanied and survived with NY3 in bacteria biofilmmainly includedBacillus, Pseudomonas and Rhodococcus strain. Two cultured strains were isolated and identified through the 16SrRNAsequence, which showed they belonged toRhodococcusand Bacillus separately, and they were also proved to have the capabilty to efficiently remove petroleum hydrocarbon.
Pseudomonas aeruginosa NY3;immobilized biological membrane;high concentration of oily wastewater;microbial community
X172,X703
A
1000-6923(2016)09-2800-07
2016-02-01
国家自然科学基金(51278405);陕西省国际科技合作重点项目(2012KW-25);榆林市2011年产学研合作项目
* 责任作者, 教授, niemaiqian@xauat.edu.cn
林莹莹(1990-),女,陕西人,硕士,从事微生物降解石油烃研究.发表论文 篇.
