高效液相色谱紫外检测法测定饲料中N-氨甲酰谷氨酸的含量
2016-12-01李裕
李 裕
(湖南省兽药饲料监察所,湖南长沙410006)
高效液相色谱紫外检测法测定饲料中N-氨甲酰谷氨酸的含量
李 裕
(湖南省兽药饲料监察所,湖南长沙410006)
本实验建立了高效液相色谱紫外检测法测定饲料中N-氨甲酰谷氨酸含量的方法。配合饲料样品用水提取后经混合型阴离子固相萃取柱净化富集。以甲醇-0.05%磷酸水溶液(V/V,5∶95)为流动相,C18色谱柱分离,检测波长215 nm。结果表明,在1.5~500 μg/mL浓度范围线性关系良好,R2=1,样品回收率为88.6%~101.2%,相对标准偏差为0.69%~2.31%(n=5),定量限为0.075 mg/g。可见本方法适用于饲料中N-氨甲酰谷氨酸的含量测定。
饲料;N-氨甲酰谷氨酸;高效液相色谱
N-氨甲酰谷氨酸是N-乙酰谷氨酸的稳定结构类似物,能激活动物体内氨甲酰磷酸合成酶-Ⅰ和二氢吡咯-5-羧酸合成酶,从而促进精氨酸的生成。精氨酸在调控动物机体营养代谢和免疫反应方面有重要作用,可提高多胎动物窝产仔数和初生重、促进幼龄动物生长和发育(Wu等,2004)。N-氨甲酰谷氨酸的成本仅为精氨酸的1/10(冯涛等,2012)。目前含有N-氨甲酰谷氨酸的饲料产品主要有饲料添加剂和配合饲料两大类。
目前报道的检测饲料中N-氨甲酰谷氨酸的方法有高效液相色谱电喷雾串联质谱法(梁婧等,2015;唐圣芸等,2014)。相比常见的高效液相色谱紫外检测法,串联质谱法对色谱条件、样品净化容忍度较高,而且灵敏度高、定性更准确,常用于复杂基质中极痕量物质的检测。但串联质谱仪器昂贵,运行和维护成本也较高,大部分饲料企业尚未配备。而且对于含量较高样品的检测,由于串联质谱上机的稀释倍数大、离子源的离子化效率及稳定性等因素,定量可能不如高效液相色谱紫外检测法准确。因此,本实验旨在建立一种适用于大多数饲料企业实验室使用,能准确测定饲料中N-氨甲酰谷氨酸含量的方法。
1 材料与方法
1.1 仪器Waters 2695高效液相色谱仪配2489型紫外检测器、2998型二极管阵列检测器(美国Waters公司);Delta 320型pH计(梅特勒-托利多公司);OASIS MAX固相萃取柱(150 mg,6cc,美国Waters公司)。
1.2 试剂N-氨甲酰谷氨酸(纯度≥98%,Sigma公司);甲醇(色谱纯,德国Merck公司);磷酸(优级纯,国药集团化学试剂有限公司)。
N-氨甲酰谷氨酸标准储备液:准确称取N-氨甲酰谷氨酸对照品102 mg置于100 mL容量瓶中,用水溶解,定容至刻度,摇匀。该溶液浓度为1.0 mg/mL。
N-氨甲酰谷氨酸标准工作液:移取不同体积标准储液,用流动相配制成不同浓度标准工作液:1.5、5.0、10.0、25.0、50.0、100.0、250.0、500.0 μg/mL。
1.3 样品前处理
1.3.1 饲料添加剂样品前处理准确称取饲料添加剂样品0.2 g置于100 mL容量瓶中,加入约70 mL水,摇匀,置超声清洗仪中超声约10 min,取出恢复至室温后,加水定容至刻度,摇匀。用去离子水稀释至合适的上机浓度,过0.22 μm针头式滤器,供高效液相色谱测定。
1.3.2 配合饲料样品前处理准确称取配合饲料1 g置于100 mL容量瓶中,加入70 mL水,摇匀,置超声清洗仪中超声约10 min,取出恢复至室温后,加水定容至刻度,摇匀。滤纸过滤后,用5%氨水溶液微调至pH≥6.5(如果样液pH本身大于6.5则不用调)。
1.3.3 过柱净化OASIS MAX固相萃取柱中加入5 mL甲醇进行柱活化,加入5mL水进行柱平衡,准确移取2mL样液加入柱中,使流速小于1 mL/min缓慢过柱;加入3 mL 5%氨水清洗,抽干;加入3 mL甲醇清洗,抽干;6 mL 2%甲酸甲醇溶液洗脱入10 mL小烧杯。通风橱内65℃水浴。待液体挥发至干,准确移取1mL水加入小烧杯中,充分溶解后过0.22 μm针头式滤器,供高效液相色谱测定。
1.4 色谱条件色谱柱:菲罗门lunaC18柱(5μm,250 mm×4.6 mm);流动相:甲醇-0.05%磷酸水溶液(V/V,5∶95)。流速:0.7 mL/min;进样量:20 μL;柱温:30℃;检测波长:215 nm。
1.5 标准曲线的绘制将1.5、5.0、10.0、25.0、50.0、100.0、250.0、500.0 μg/mL的对照品工作液,依次注入色谱仪,测定各浓度工作液的峰面积,以浓度为横坐标,峰面积为纵坐标绘制标准曲线。
1.6 灵敏度的测定分别称取3份1.00 g空白配合饲料,按样品处理方法测定,测得基线噪音值,按10倍信噪比计算,得到方法的定量限。
1.7 回收率的测定
1.7.1 饲料添加剂回收率的测定自制N-氨甲酰谷氨酸含量分别为5%、10%、20%的混合型添加剂样品。每个含量的样品设置5个重复,按1.3.1方法进行处理后上机测定。采用外标法计算含量、回收率和相对标准偏差(RSD)。
1.7.2 配合饲料回收率的测定称取空白配合饲料,加入标准储备液,使添加浓度分别为0.05%、0.1%、0.2%。每个含量的样品设置5个重复,按1.3.2方法进行处理后上机测定。采用外标法计算含量、回收率和相对标准偏差(RSD)。
2 结果
2.1 色谱图色谱图见图1~5。N-氨甲酰谷氨酸峰形完好,无杂峰干扰。

图1 N-氨甲酰谷氨酸标准溶液色谱图
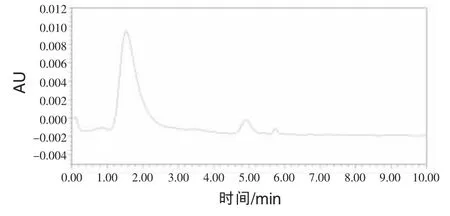
图2 空白饲料添加剂色谱图
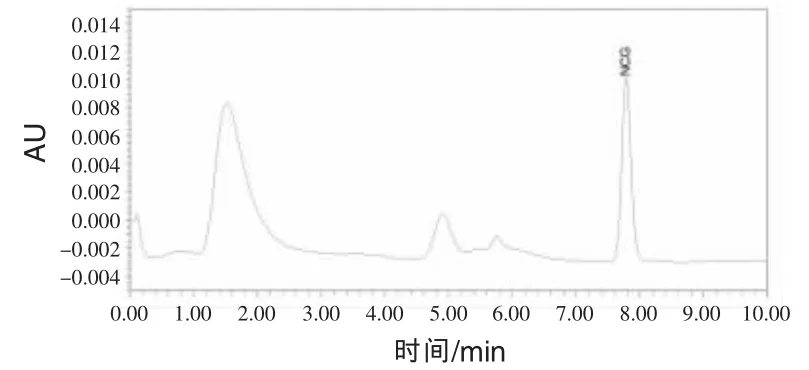
图3 饲料添加剂中添加N-氨甲酰谷氨酸色谱图
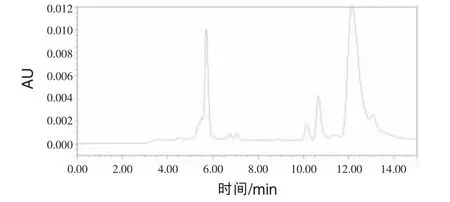
图4 空白配合饲料色谱图
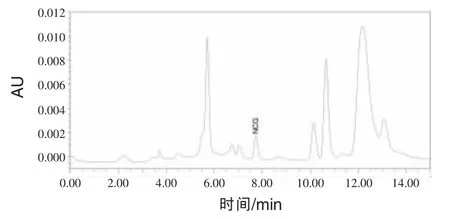
图5 配合饲料中添加N-氨甲酰谷氨酸色谱图
2.2 线性范围与定量限检测线性方程为y= 0.0005x-0.6556,R2=1。在1.5~500 μg/mL浓度范围线性关系良好。本方法测定饲料中N-氨甲酰谷氨酸的定量限为0.075 mg/g(相当于含量0.0075%)。
2.3 准确度与精密度当饲料添加剂N-氨甲酰谷氨酸含量为5%、10%、20%时,平均回收率分别为101.2%(RSD=0.81%)、100.5%(RSD=0.76%)、99.7%(RSD=0.69%)。配合饲料中N-氨甲酰谷氨酸含量为0.05%、0.1%、0.2%时,平均回收率分别为88.6%(RSD=2.31%)、90.4%(RSD=1.96%)、92.3%(RSD=1.89%)。
3 讨论
3.1 流动相的选择N-氨甲酰谷氨酸有两个羧酸基团和一个N-氨甲酰基团。极性强的离子型化合物在C18色谱柱上几乎是不保留的。水相中含有一定量的磷酸,可抑制羧酸基团的离子化,增加保留时间。同时还可以抑制C18色谱柱上硅羟基的离子化,削弱COO-与Si-Oδ-Hδ+的相互作用,减小拖尾。本实验中磷酸加入量为0.001%~0.1%能满足检测要求。从保护色谱柱、缓冲能力两方面考虑,磷酸的加入量定为0.05%。乙腈的洗脱能力强,且目标化合物不溶于乙腈,所以不适合选用。本试验选择甲醇为有机相。甲醇比例降到色谱柱允许的5%时,随柱温变化,保留时间在7~12 min,可满足色谱分离的要求。
3.2 检测波长的选择N-氨甲酰谷氨酸在紫外检测器范围仅有末端吸收,在205~190 nm范围吸收值突跃很大。235~210 nm范围吸收值增加平稳,但吸收值不高。考虑到水、甲醇的紫外截止波长分别为200、205 nm。本试验不使用梯度洗脱,选择215 nm作为检测波长。
3.3 提取N-氨甲酰谷氨酸溶于水、甲醇,不溶于乙腈。用水、甲醇提取都能满足实验要求。用甲醇提取并未表现出提取液杂质较少的优势,原因可能是提取液中盐类等离子型化合物变少,但油脂、脂溶性维生素等干扰物质增加。因此,本实验选择水为提取溶剂。
3.4 净化有机酸类化合物适合使用阴离子柱进行纯化。离子交换时,样液的pH值很关键。由于柱容量的限制和色谱分离的需要,在保证N-氨甲酰谷氨酸完全阴离子化的同时,需尽量避免其他阴离子数量的增加,所以调节pH值的氨水不宜过量。样液中N-氨甲酰谷氨酸浓度较高时(如200 μg/mL),pH值5.2可保证N-氨甲酰谷氨酸阴离子化完全。样液中N-氨甲酰谷氨酸浓度较低时(如10 μg/mL),pH值6.5可保证N-氨甲酰谷氨酸阴离子化完全。
3.5 空白样品的选择含有N-氨甲酰谷氨酸的饲料产品目前仅有饲料添加剂和配合饲料两大类。饲料添加剂产品、混合型饲料添加剂产品的配物料通常有淀粉、谷氨酸钠、中草药提取物等。所以制备空白饲料添加剂样品时,按淀粉65%、谷氨酸钠25%、杜仲叶提取物5%、淫羊藿提取物5%的比例制成饲料添加剂空白样品。以验证这些物料对本方法是否有干扰。空白配合饲料使用某饲料厂家提供的不含N-氨甲酰谷氨酸的仔猪配合饲料。
3.6 添加浓度的选择饲料添加剂产品、混合型饲料添加剂产品中N-氨甲酰谷氨酸的含量一般为40%~80%。含量越高,就越容易测定。饲料添加剂选择5%、10%、20%三种含量做添加回收试验。N-氨甲酰谷氨酸在配合饲料中的加入量大多在0.09%~0.2%(冯涛等,2012;彭瑛等,2011)。所以配合饲料选择的添加浓度分别为0.05%、0.1%、0.2%。
4 结论
建立了测定饲料添加剂、配合饲料中N-氨甲酰谷氨酸含量的高效液相色谱方法。本方法准确度、精密度、定量限均符合饲料中N-氨甲酰谷氨酸含量的检测要求,而且操作相对简单,对仪器设备要求不高,适合大多数饲料企业质检实验室使用。
[1]冯涛,白佳桦,闫学军,等.N-氨甲酰谷氨酸在养猪生产中的应用[J].中国畜牧兽医,2012,39(10):137~139.
[2]梁婧,徐懿,宋亮,等.HPLC-ESI-MS/MS法检测N-氨甲酰谷氨酸的含量[J].畜牧与饲料科学,2015,36(5):22~23.
[3]彭瑛,蔡力创.精氨酸和精氨酸生素对断奶仔猪生长性能、器官重及生化指标的影响[J].中国畜牧兽医.2011,38(8):23~26.
[4]唐圣芸,王远兴,温平威,等.高效液相色谱—电喷雾串联质谱法测定饲料中的N-氨基甲酰-L-谷氨酸[J].色谱,2014,32(2):184~188.
[5]Wu G,Knabe D A,Kim S W.Arginine nutrition in neonatal pigs[J].The Journal of Nutrition,2004,134(10):2783~2790.
A high performance liquid chromatography(HPLC)method was developed for the quantitation of N-carbamylglutamate in feed.Sample was extracted with water,and purified by anion exchange SPE cartridge.The HPLC separation was achieved on a C18 column using a mobile phase of methanol and 0.05%phosphoric acid aqueous solution(V∶V= 5∶95).The UV detector was operated at 215 nm.The method provided good linearity from 1.5 μg/mL to 500 μg/mL(R2=1). The recoveries were in the range of 88.6%~101.2%and the relative standard deviations(RSDs)were in the range of 0.69%~2.31%(n=5).The quantification limit was 0.075 mg/g.It was a simple,rapid and reliable method for the determination of N-carbamylglutamate in feed.
feed;N-carbamylglutamate;high performance liquid chromatography
10.15906/j.cnki.cn11-2975/s.20161711
S816.17
A
1004-3314(2016)17-0041-03
