克里雅绿洲旱生芦苇根茎叶C、N、P化学计量特征的季节变化
2016-11-29李红林
李红林,贡 璐,*,洪 毅
1 新疆大学资源与环境科学学院, 乌鲁木齐 830046 2 绿洲生态教育部重点实验室, 乌鲁木齐 830046
克里雅绿洲旱生芦苇根茎叶C、N、P化学计量特征的季节变化
李红林1,2,贡 璐1,2,*,洪 毅1,2
1 新疆大学资源与环境科学学院, 乌鲁木齐 830046 2 绿洲生态教育部重点实验室, 乌鲁木齐 830046
旱生芦苇在水分限制、元素匮乏的环境条件下,经长期进化适应形成了自身独特的生理生态特征,研究其C、N、P化学计量特征随生长季节的变化规律有助于深入了解该植物生存和适应策略。系统分析了克里雅绿洲旱生芦苇根、茎、叶的C、N、P化学计量特征及其季节动态,深入探讨了不同生长季、不同器官以及两因素的交互作用对以上特征的影响。结果表明:旱生芦苇C、N、P含量均值分别为393.36、12.43、1.25 mg/g,C∶N、N∶P、C∶P均值分别为54.55、9.96、441.27。整个生长季内芦苇各器官间C、N、P平均含量的变化规律一致,为叶>茎>根,C、N、P化学计量比的变化规律不一致;芦苇C含量随生长季节的变化不断增加,N、P随季节的变化逐渐减少,C、N、P化学计量比随季节的变化规律也不尽相同。对芦苇C、N、P含量及其化学计量比整体变异来源分析显示,生长季节的变化对芦苇C、P、C∶N、C∶P变化的贡献大于器官间差异,器官间差异对芦苇N、N∶P变化的贡献大于生长季节的变化;说明芦苇生长发育过程中各生长季各器官对元素的吸收利用具有特异性。结合N、P元素含量及N∶P值的大小可知,研究区芦苇生长受到N、P共同限制,且更易受N元素的限制。
旱生芦苇;生态化学计量学;器官;季节;克里雅绿洲
植物碳(C)、氮(N)、磷(P)元素及其平衡稳定关系在植物生长和生理机能调节中发挥着重要作用[1]。生态化学计量学通过分析生物系统多重化学元素和能量的交互作用,为探索C、N、P 等元素的生态学过程和生物地球化学循环提供了一种新思路,是当前生态学研究的热点[2-4]。相关学者将其率先应用于水生生态系统,之后扩展到陆地生态系统,集中于森林、草地和湿地植物[5-11],取得了一系列重要进展;而干旱区植物相关的研究相对不足,且主要以不同生境和不同生活型植物叶片为研究对象[12-14]。旱区植物在水分限制、元素匮乏的条件下,形成其独特的生理生态特征,研究不同器官元素的分配特点及其季节动态变化规律,对揭示严酷生境下植物的生存策略具有重要意义。
克里雅绿洲地处塔里木盆地南缘极端干旱区,生态环境十分脆弱,水资源短缺、土壤盐渍化问题突出[15]。极其恶劣的环境条件导致该区生物多样性低,植被稀疏、结构简单。旱生芦苇(Phragmitesaustralis)为多年生禾本科植物,分布于干旱区绿洲农田外围、盐碱地以及一些沙漠地区,是该区优势物种。前人对旱生芦苇的研究集中在形态、生理生态特征等方面[16-17],而有关其各器官元素化学计量特征随植物生长变化规律的研究鲜有报道。本研究以旱生芦苇为研究对象,系统分析旱生芦苇各器官C、N、P生态化学计量特征的季节变化规律,旨在解析旱生芦苇在各生长季对环境变化的响应,补充旱生植物在生态化学计量学领域中的研究成果,促进荒漠生态系统的保护与重建。
1 研究方法
1.1 研究区概况
克里雅绿洲地处塔克拉玛干沙漠南缘、昆仑山中段北麓,跨81°08′59″—82°00′03″E, 36°44′59″—37°12′04″N。该区南高北低,最高海拔5 460m,最低海拔1 180m。属暖温带大陆性干旱荒漠气候,昼夜温差大,年均气温12.4℃,多年有效积温4 340 ℃;降水稀少,年均降水量44.7mm;蒸发强烈,年均蒸发量2 498mm;热量与光照十分丰富,年光辐射量598.672kJ;春夏多风沙和浮尘等灾害天气。土壤母质以棕漠土为主,原生土壤偏碱性,含盐量高,土壤贫瘠。该区土壤表层(0—20cm)的基本理化性质:pH值为8.72,土壤水分为15.46%,有机质、全氮、有效磷、速效钾含量分别为2.97g/kg、0.15g/kg、1.86mg/kg、305.20mg/kg;平均地下水埋深为2.92m,北部荒漠区超过7 m。芦苇、柽柳(Tamarixspp.)、胡杨(Populuseuphratica)、骆驼刺(Alhagisparisifolia)是绿洲主要的天然植物。该区经济发展主要依靠农业,且仍处于传统农业经济状态。
1.2 样品采集与分析
在研究区选择立地条件相对一致的5个芦苇群落为样地,分别于2013年4月(生长初期)、7月(生长旺季)和10月(生长末期)在每个样地随机选取3个1m×1m的样方,按对角线法选取样方内10株芦苇,齐地面剪下得到地上部分(包括地上茎和叶片)样品,在剪过的样方内先将土壤表面的残落物和杂质清除干净,挖取0—30cm地下部分根系(包括根茎和须根)。所有样品带回实验室经清洗后,于烘箱中105℃下杀青0.5 h,然后80℃烘干至恒重,粉碎后过100目筛,测定全C、全N和全P含量;其中全C含量采用重铬酸钾氧化外加热法,全N含量采用凯氏定氮法,全P含量采用钼锑抗比色法。每个样品重复测定3次,测定结果以单位质量的元素含量(mg/g) 表示。
1.3 数据处理
数据前期处理、绘图及统计分析分别在Microsoft Excel 2 007和SPSS 19.0软件中完成。利用单因素方差分析(One-way ANOVA)中LSD(Least-significant different)多重比较分别分析不同器官间和生长季节间芦苇C、N、P含量及其化学计量比的差异。对不同生长季芦苇各器官C、N、P含量及其化学计量比进行重复测量方差分析(Repeated-Measure ANOVA)。
2 结果分析
2.1 芦苇C、N、P含量及其化学计量比的经典统计学特征
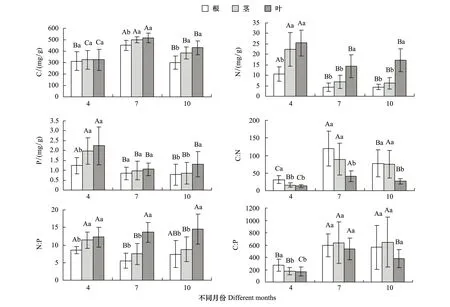
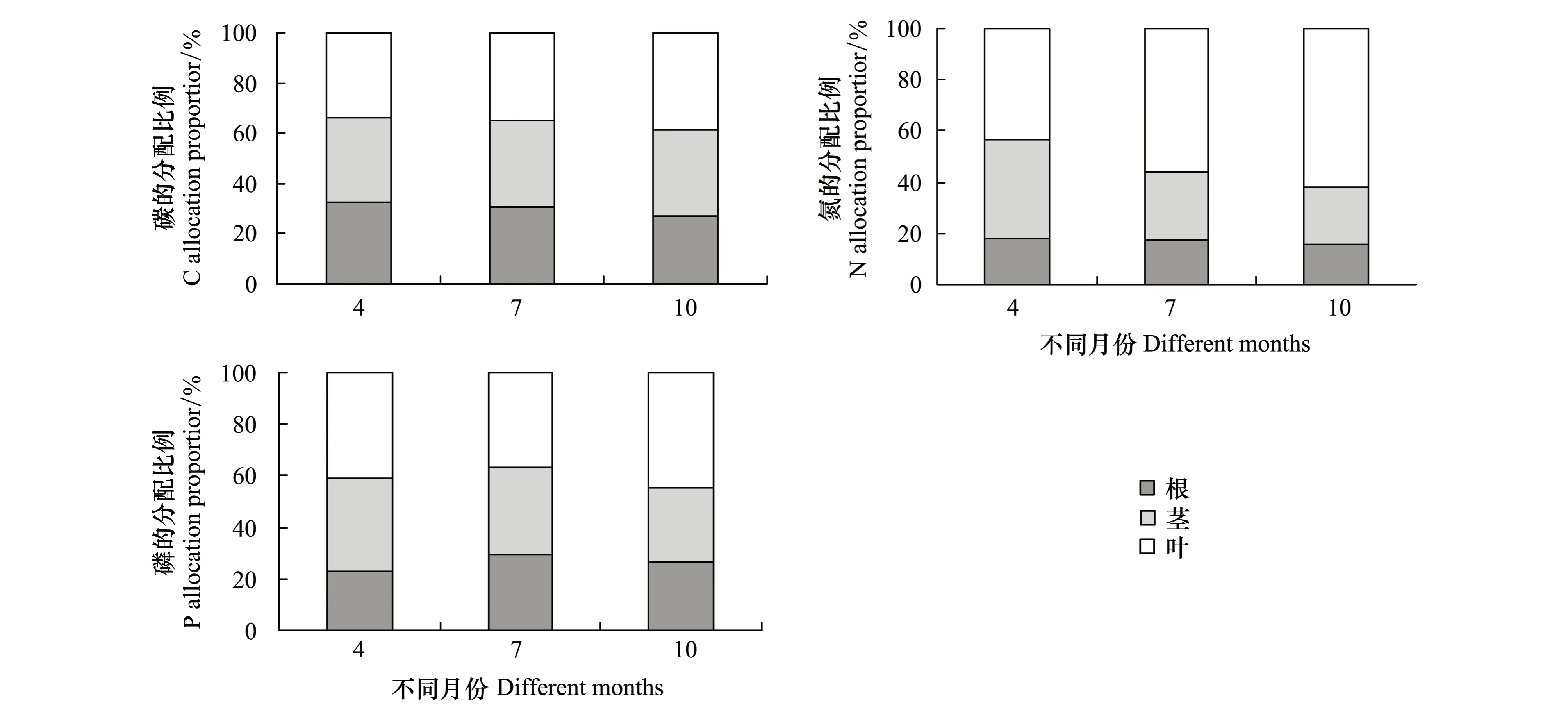
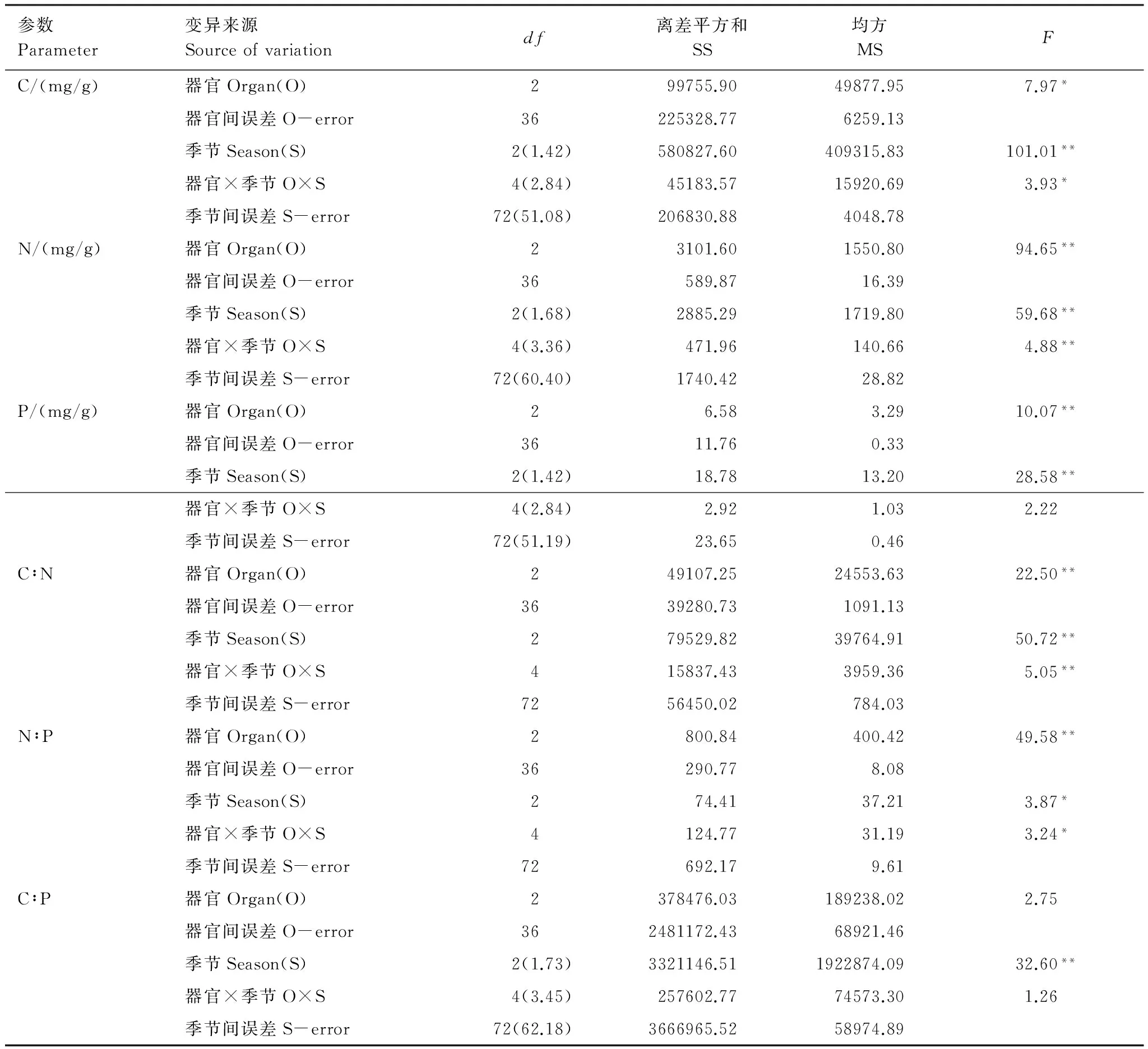
对研究区芦苇C、N、P含量及其化学计量比进行经典统计学分析,结果如表1所示。C、N、P含量均值分别为393.36、12.43、1.25 mg/g。由于采样涉及不同季节和器官,所以极差较大,分别为424.7、32.29、4.16 mg/g。进一步分析C、N、P化学计量比可知,C∶N、N∶P、C∶P均值分别为54.55、9.96、441.27,其中,N∶P比值小于14,研究区植物生长受N元素限制更为明显。变异系数(CV)是反映随机变量离散程度的主要指标:CV≤0.1为弱变异,0.1 表1 芦苇C、N、P含量及其化学计量比的统计学参数 2.2 芦苇各器官C、N、P含量及其化学计量比的季节动态特征 不同生长季芦苇各器官C、N、P含量往往表现出较大的差异(图1)。各生长季芦苇C、N、P含量的变化规律均为叶>茎>根,但随季节的动态特征各不相同。生长初期各器官间C含量无显著差异,生长旺季和末期茎和叶C含量显著高于根(P<0.05);不同生长季节间C含量呈现先升高后降低的趋势,其中茎和叶C含量在不同生长季节间的差异性显著(P<0.05),根C含量表现为生长旺季显著高于生长初期和生长末期(P<0.05)。生长初期茎和叶N含量显著高于根(P<0.05),生长旺季和末期仅叶片N含量显著较高(P<0.05);生长初期和生长末期叶片P含量显著高于根和茎(P<0.05),生长旺季各器官间P含量变化不显著(P>0.05)。不同生长季节间芦苇各器官N、P元素含量变化一致,根和茎N、P含量为生长初期>生长旺季>生长末期,叶片N、P含量为生长初期>生长末期>生长旺季;其中生长初期N、P元素含量显著高于生长旺季和生长末期(P<0.05),生长旺季和末期间N、P含量的差异未达到显著性水平(P>0.05)。 图1 芦苇各器官C、N、P含量及其化学计量比的季节动态Fig.1 Seasonal dynamics of C, N and P contents and their ratios in different organs of Phragmites australis 不同大写字母表示同一器官不同季节间差异显著;不同小写字母表示同一季节不同器官间差异显著(P<0.05) 不同生长季芦苇各器官C∶N、N∶P、C∶P也呈现出一定的变化规律(图1)。不同生长季芦苇各器官C∶N的变化趋势均为根>茎>叶,生长初期根C∶N显著高于地上部分(P<0.05),生长旺季和末期叶片C∶N显著低于根和茎(P<0.05);随生长季节的变化芦苇C∶N先升高后降低,根和叶片C∶N在不同生长季节间呈现出显著性差异(P<0.05),茎C∶N仅在生长旺季和末期显著高于初期(P<0.05)。芦苇N∶P的变化趋势与N、P含量变化一致,生长初期地上部分N∶P显著高于根(P<0.05),生长旺季和末期N∶P在根和茎间无显著差异(P>0.05);不同生长季芦苇根和茎N∶P表现为先降低后升高,根N∶P在生长初期与旺季间表现出显著性差异(P<0.05),茎N∶P在生长初期显著低于生长旺季和末期的值(P<0.05);不同生长季节间叶片N∶P差异不显著(P>0.05)。生长初期根C∶P显著高于地上部分(P<0.05),生长旺季和末期各器官间C∶P差异不显著(P>0.05);不同生长季叶片C∶P 差异显著(P<0.05),根和茎C∶P从生长初期到生长旺季显著增长(P<0.05),而后无显著变化(P>0.05)。 2.3 芦苇各器官 C、N、P含量的季节分配特征 在植物生活史过程中植物为了适应不断变化的外界环境以及满足自身的生长,其体内结构性物质、功能性物质以及储藏性物质在分配比例上随季节变化会产生较大的差别[14]。不同生长季芦苇体内C、N、P含量的分配格局如图2所示。生长初期芦苇C含量在根、茎和叶的分配比例较为均衡,分别为32.42%、33.73%和33.85%;生长旺季芦苇C含量在各器官的分配比例未出现较大波动,与生长初期相比,根的分配比例降低至30.74%,茎和叶片C含量的分配比例分别增加到34.06%和35.20%;生长末期根C含量的分配比例进一步下降至26.89%,茎和叶片C含量的分配比例增加到34.51%和38.60%。整个生长季内N含量在根和茎的分配比例随生长季的变化持续降低,在生长末期分别为15.66%和22.42%;叶片N含量的分配比例则不断增加,到生长末期高达61.92%。P含量在生长初期根、茎和叶的分配比例分别为22.57%、36.33%和41.10%;到生长旺季,根P含量的分配比例增加了6.70%,茎和叶片P含量的分配比例则下降至34.15%和36.59%;到了生长末期根和茎P含量的分配比例下降,叶片P含量的分配比例有所增加,分别为26.53%、28.91%和44.56%。 图2 芦苇各器官C、N、P分配特征Fig.2 C, N and P distribution characteristics of each organ of Phragmites australis 2.4 芦苇C、N、P含量及其化学计量比的整体变异分析 芦苇C、N、P含量及其化学计量比受不同生长季和不同器官单因素及其两因素的交互影响程度各不相同(表2)。芦苇C含量受生长季节极显著影响(P<0.01),其离差平方和最大,为580827.60,其次是不同器官(P<0.05),两因素的交互作用对C含量的影响也达到显著水平(P<0.05)。N含量的变异主要受不同器官的影响,其离差平方和为3101.60,不同生长季节以及两因素的交互作用对芦苇N含量的影响达到极显著水平(P<0.01)。P含量的变化主要受到生长季节的限制,不同器官对芦苇P含量的影响达到极显著水平(P<0.01)。 表2 旱生芦苇C、N、P含量及其计量的整体来源变异来源分析 Table 2 Summary about the effect of variation from different organs, months and both interactions on C, N and P contents and their ratios ofPhragmitesaustralis 参数Parameter变异来源Sourceofvariationdf离差平方和SS均方MSFC/(mg/g)器官Organ(O)299755.9049877.957.97*器官间误差O-error36225328.776259.13季节Season(S)2(1.42)580827.60409315.83101.01**器官×季节O×S4(2.84)45183.5715920.693.93*季节间误差S-error72(51.08)206830.884048.78N/(mg/g)器官Organ(O)23101.601550.8094.65**器官间误差O-error36589.8716.39季节Season(S)2(1.68)2885.291719.8059.68**器官×季节O×S4(3.36)471.96140.664.88**季节间误差S-error72(60.40)1740.4228.82P/(mg/g)器官Organ(O)26.583.2910.07**器官间误差O-error3611.760.33季节Season(S)2(1.42)18.7813.2028.58**器官×季节O×S4(2.84)2.921.032.22季节间误差S-error72(51.19)23.650.46C∶N器官Organ(O)249107.2524553.6322.50**器官间误差O-error3639280.731091.13季节Season(S)279529.8239764.9150.72**器官×季节O×S415837.433959.365.05**季节间误差S-error7256450.02784.03N∶P器官Organ(O)2800.84400.4249.58**器官间误差O-error36290.778.08季节Season(S)274.4137.213.87*器官×季节O×S4124.7731.193.24*季节间误差S-error72692.179.61C∶P器官Organ(O)2378476.03189238.022.75器官间误差O-error362481172.4368921.46季节Season(S)2(1.73)3321146.511922874.0932.60**器官×季节O×S4(3.45)257602.7774573.301.26季节间误差S-error72(62.18)3666965.5258974.89 自由度后括号内数字为按Greenhouse-Geisser方法校正后的自由度结果;**P<0.01,*P<0.05 芦苇C∶N的变异主要受生长季节的影响,其次为不同器官,最后是两因素的交互作用,三者对芦苇C∶N比值的影响均达到极显著水平(P<0.01)。不同器官对N∶P变异的影响达到极显著水平(P<0.01),其离差平方和最大,两因素的交互作用以及不同器官对芦苇N∶P的影响达到显著性水平(P<0.05)。C∶P主要受到生长季节的限制,其离差平方和最大,为3321146.51,不同器官及两因素的交互作用对芦苇C∶P比值的影响未达到显著水平(P>0.05)。 总之,对比器官和季节因素F值发现,生长季节变化对芦苇C、P、C∶N、C∶P变化的贡献大于器官间差异,器官间差异对芦苇N、N∶P贡献大于生长季节的变化,由此可见生长季节内N含量的变异性对N∶P的动态变化起主导作用。 3.1 芦苇C、N、P化学计量特征分析 芦苇是隐域性植物,可生存于各种生态环境,本文研究对象旱生芦苇在适应干旱环境的过程中体内C、N、P含量不断变化,从而形成了自身独特的生理生态特征。其在不同生长季的平均C含量为(393.36±99.91)mg/g,低于全球492种陆地植物研究所得的C含量((464 ± 32.1)mg/g)[18]。芦苇在不同生长季的平均N含量为(12.43±8.70)mg/g,显著低于全球植物N含量的平均水平20.1 mg/g[19]。与全球P含量水平(1.99 mg/g)[18]相比,研究区芦苇不同生长季的P含量(1.25±0.74)mg/g较低。旱生芦苇根的C∶N∶P的质量比为373∶7∶1(折合成原子比为983∶15∶1),茎的C∶N∶P的质量比为317∶9∶1(折合成原子比为839∶21∶1),叶片C∶N∶P的质量比为277∶12∶1(折合成原子比为706∶27∶1),均低于全球平均水平[20]。 3.2 芦苇各器官C、N、P含量的季节变异规律 C是植物各种生理生化过程的底物和能量来源,N和P是各种蛋白质和遗传物质的重要组成元素[21];因此,C同化和N、P吸收的途径不同,在自然条件下,一般认为C不会限制植物的生长,N和P的变化则是生态系统生产力的主要限制因素[22-23]。在本研究中生长初期芦苇生物量小,C含量较低;各器官输导组织、支持组织发育均不完善,细胞大多具有分裂能力,需要大量的蛋白质和核酸来满足植物逐渐增加的生长速率,从而对N、P元素的选择性吸收较多。生长旺季温度升高,光合作用增强,叶片作为植物获取能源和合成光合产物的同化器官,此时其新陈代谢和生产活动最为旺盛,糖类物质得到有效的积累,生物量迅速增加,C含量达到峰值,而芦苇根对营养元素的吸收赶不上细胞膨胀的速率,使得芦苇各器官N、P元素受到稀释效应[24]。传导器官茎在这个时期将叶片光合作用所固定的C输送至根,致使其本身的C含量达到整个生长季的峰值。生长末期为植物吸收根快速生长期,根的吸收能力得到加强,叶片C含量小幅度降低,营养元素N、P却略有增加,用以提高植物的代谢强度,这与平川等[25]对兴安落叶松元素含量变化的研究结果一致。 在生活史过程中,植物为适应不同阶段的生存环境将有限的资源按一定的比例分配给不同功能的器官,形成一定的生长特性与元素分配规律[26-27]。本研究芦苇C、N、P含量的季节变化充分反映了其体内物质转移的实际格局,所得结果与罗先香等[28]对辽河口湿地芦苇C、N、P平均含量在不同器官的分布情况以及曾从盛等[29]对闽江河口短叶茳芏氮、磷含量的季节变化规律基本一致;而南方芦苇全年常青,冬天需贮存较多营养物质,即林小涛等[30]研究澳门路氹湿地芦苇元素含量的变化规律为N、P含量在秋冬达到最大值,春夏达到最低值,与本研究结果不一致。 3.3 芦苇各器官C、N、P化学计量比的季节变异规律 植物能够主动地调整养分需求,从而调整体内各元素的相对丰度,灵活地适应外界生长环境的变化,这些过程将导致植物自身组织的C∶N∶P化学计量比发生变化。荒漠植物在不同的生长时期,如何调整元素含量在各器官间的分配比例以适应不利环境,是研究荒漠植物生存策略的重要内容[15]。作为重要的生理指标,C∶N和C∶P预示着植物在吸收营养过程中对C的同化能力,在一定程度上反映了植物的养分利用效率,具有重要的生态适应意义[24]。芦苇各器官C含量在生长旺季较高,N、P含量较低,而到生长末期芦苇C含量降低,N、P含量增加,表明芦苇采取防御性的生活史策略[31]。在植物蒸腾作用和水分消耗最为剧烈的旺季,植物为了增强对外界干旱环境的抵抗能力,增加了对叶片的C分配,叶片C∶P 增加,植物生长速率减缓,水分消耗降低;而到了末期,随着蒸腾作用的减弱,植物受水分胁迫作用降低,减少了对叶片C元素的分配,叶片C∶P有所降低,茎C∶P比有所增加,植物生长速率略有增加。较高的C∶N和C∶P同时代表植物对 N、P 的利用率较高,以往研究也证实了植物在营养元素供应缺乏的情况下往往具有较高的养分利用效率,是植物适应贫瘠养分状态的一种生存策略[32]。芦苇C、N、P化学计量比的季节变化规律与吴统贵等[33]对杭州湾滨海湿地芦苇C、N、P化学计量比的季节变化规律以及牛得草等[34]对阿拉善荒漠区6种主要灌木植物元素化学计量比的季节变化结果基本相似。 3.4 芦苇C、N、P含量及其化学计量比的整体变异分析 植物体C、N、P化学计量特征受到多种不同尺度因素(如温度、纬度、降水、群落演替、干扰、土壤肥力及土壤水分等)的影响[35],而生长季节是诸多环境因子的综合体现。本文对不同生长季节和不同器官对旱生芦苇C、N、P含量及其化学计量比影响的交叉分析显示,芦苇C、P、C∶N和C∶P的变异主要受不同生长季的影响,N、N∶P的变异主要受不同器官的影响,N含量的变异性对N∶P的动态变化起主导作用。不同生长季节对旱生芦苇元素化学计量特征造成的差异一方面是由于不同物候期植物自身的生物学特征引起,另一方面,各生长季环境要素的不同也可能是引起差异的主要原因。本研究芦苇样品均取自相同生长环境条件下,生境的异质性可以忽略不计,这进一步突出了器官和生长季节对芦苇C、N、P化学计量特征的影响。虽然,芦苇C、N、P化学计量特征主要受生长季节的影响,但由于芦苇自身结构特性也导致了该特征在不同生长季节间出现一定波动。生长季节对C、N、P含量及其化学计量比的影响并没有抹杀芦苇自身结构的效应,除C∶P外,器官对C、N、P、C∶N、N∶P的影响均达到了显著性水平,这进一步说明了芦苇器官分化过程中各器官对元素的吸收利用具有特异性。 在漫长的进化过程中,植物为适应环境的变化形成了多种多样的生活史策略,对于物种,尤其是广布种,由于外界环境的差异或群落种间、种内的复杂关系,不同外界环境的繁殖速率或策略也将发生变化,一年内的季节变化只能说明其在一个生长季内的调节规律。因此,进一步持续多年观测芦苇C、N、P化学计量特征的季节变化规律,探讨其长期的生存适应策略是今年研究的重点。 [1] Sardans J, Rivas-Ubach A, Peuelas J. The elemental stoichiometry of aquatic and terrestrial ecosystems and its relationships with organismic lifestyle and ecosystem structure and function: a review and perspectives. Biogeochemistry, 2012, 111(1/3): 1-39. [2] 李月芬, 王冬艳, Lasoukanh V, 杨小琳, 李文博, 赵一嬴, 孙超. 基于土壤化学性质与神经网络的羊草碳氮磷含量预测. 农业工程学报, 2014, 30(3): 104-111. [3] Ågren G I, Weih M. Plant stoichiometry at different scales: element concentration patterns reflect environment more than genotype. New Phytologist, 2012, 194(4): 944-952. [4] 曾冬萍, 蒋利玲, 曾从盛, 王维奇, 王纯. 生态化学计量学特征及其应用研究进展. 生态学报, 2013, 33(18): 5484-5492. [5] Sardans J, Peuelas J. Climate and taxonomy underlie different elemental concentrations and stoichiometries of forest species: the optimum “biogeochemical niche”. Plant Ecology, 2014, 2015(4): 441-455. [6] 宋彦涛, 周道玮, 李强, 王平, 黄迎新. 松嫩草地80种草本植物叶片氮磷化学计量特征. 植物生态学报, 2012, 36(3): 222-230. [7] Abbas M, Ebeling A, Oelmann Y, Ptacnik R, Roscher C, Weigelt A, Weisser W W, Wilcke W, Hillebrand H. Biodiversity effects on plant stoichiometry. PLoS One, 2013, 8(3): e58179. [8] Fujita Y, de Ruiter P C, Wassen M J, Heil G W. Time-dependent, species-specific effects of N∶P stoichiometry on grassland plant growth. Plant and Soil, 2010, 334(1/2): 99-112. [9] 郑艳明, 尧波, 吴琴, 胡斌华, 胡启武. 鄱阳湖湿地两种优势植物叶片C、N、P动态特征. 生态学报, 2013, 33(20): 6488-6496. [10] Cuassolo F, Balseiro E, Modenutti B. Alien vs. native plants in a Patagonian wetland: elemental ratios and ecosystem stoichiometric impacts. Biological Invasions, 2012, 14(1): 179-189. [11] Qu F Z, Yu J B, Du S Y, Li Y Z, Lv X F, Ning K, Wu H F, Meng L. Influences of anthropogenic cultivation on C, N and P stoichiometry of reed-dominated coastal wetlands in the Yellow River Delta. Geoderma, 2014, 235-236: 227-232. [12] 李从娟, 徐新文, 孙永强, 邱永志, 李生宇, 高培, 钟显彬, 闫健, 王桂芬. 不同生境下三种荒漠植物叶片及土壤C、N、P的化学计量特征. 干旱区地理, 2014, 37(5): 996-1004. [13] 肖遥, 陶冶, 张元明. 古尔班通古特沙漠4种荒漠草本植物不同生长期的生物量分配与叶片化学计量特征. 植物生态学报, 2014, 38(9): 929-940. [14] 阿布里孜·阿不都热合曼, 吕光辉, 张雪妮, 公延明. 新疆艾比湖流域植物光合器官碳、氮、磷生态化学计量特征. 生态学杂志, 2015, 34(8): 2123-2130. [15] 哈学萍, 丁建丽, 塔西甫拉提·特依拜, 罗江燕, 张飞. 基于SI-Albedo特征空间的干旱区盐渍化土壤信息提取研究——以克里雅河流域绿洲为例. 土壤学报, 2009, 46(3): 381-390. [16] 付爱红, 陈亚宁, 李卫红. 极端干旱区旱生芦苇叶水势变化及其影响因子研究. 草业学报, 2012, 21(3): 163-170. [17] 贡璐, 朱美玲, 塔西甫拉提·特依拜, 张雪妮, 韩丽, 解丽娜. 塔里木盆地南缘旱生芦苇生态特征与水盐因子关系. 生态学报, 2014, 34(10): 2509-2518. [18] Baldwin D S, Rees G N, Mitchell A M, Watson G, Williams J. The short-term effects of salinization on anaerobic nutrient cycling and microbial community structure in sediment from a freshwater wetland. Wetlands, 2006, 26(2): 455-464. [19] Elser J J, Fagan W F, Denno R F, Dobberfuhl D R, Folarin A, Huberty A, Interlandi S, Kilham S S, McCauley E, Schulz K L, Siemann E H, Sterner R W. Nutritional constraints in terrestrial and freshwater food webs. Nature, 2000, 408(6812): 578-580. [20] Reich P B, Oleksyn J. Global patterns of plant leaf N and P in relation to temperature and latitude. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(30): 11001-11006. [21] 赵亚芳, 徐福利, 王渭玲, 王玲玲, 王国兴, 孙鹏跃, 白小芳. 华北落叶松根茎叶碳氮磷含量及其化学计量学特征的季节变化. 植物学报, 2014, 49(5): 560-568. [22] 李征, 韩琳, 刘玉虹, 安树青, 冷欣. 滨海盐地碱蓬不同生长阶段叶片C、N、P化学计量特征. 植物生态学报, 2012, 36(10): 1054-1061. [23] Elser J J, Fagan W F, Kerkhoff A J, Swenson N G, Enquist B J. Biological stoichiometry of plant production: metabolism, scaling and ecological response to global change. New Phytologist, 2010, 186(3): 593-608. [24] 刘万德, 苏建荣, 李帅锋, 郎学东, 张志钧, 黄小波. 云南普洱季风常绿阔叶林优势物种不同生长阶段叶片碳、氮、磷化学计量特征. 植物生态学报, 2015, 39(1): 52-62. [25] Townsend A R, Cleveland C C, Asner G P, Bustamante M M C. Controls over foliar N∶P ratios in tropical rain forests. Ecology, 2007, 88(1): 107-118. [26] 平川, 王传宽, 全先奎. 环境变化对兴安落叶松氮磷化学计量特征的影响. 生态学报, 2014, 34(8): 1965-1974. [27] Han W X, Fang J Y, Guo D L, Zhang Y. Leaf nitrogen and phosphorus stoichiometry across 753 terrestrial plant species in China. New Phytologist, 2005, 168(2): 377-385. [28] Vanni M J, Flecker A S, Hood J M, Headworth J L. Stoichiometry of nutrient recycling by vertebrates in a tropical stream: linking species identity and ecosystem processes. Ecology Letters, 2002, 5(2): 285-293. [29] 罗先香, 张珊珊, 敦萌. 辽河口湿地碳、氮、磷空间分布及季节动态特征. 中国海洋大学学报, 2010, 40(12): 97-104. [20] 曾从盛, 张林海, 仝川. 闽江河口湿地短叶茳芏氮、磷含量与积累量季节变化. 生态学杂志, 2009, 28(5): 788-794. [31] 林小涛, 梁海含, 梁华, 许忠能. 澳门路氹湿地芦苇氮磷含量的季节变化. 生态学杂志, 2007, 26(1): 5-8. [32] Wright I J, Reich P B, Westoby M, Ackerly D D, Baruch Z, Bongers F, Cavender-Bares J, Chapin T, Cornelissen J H C, Diemer M, Flexas J, Garnier E, Groom P K, Gulias J, Hikosaka K, Lamont B B, Lee T, Lee W, Lusk C, Midgley J J, Navas M L, Niinemets Ü, Oleksyn J, Osada N, Poorter H, Poot P, Prior L, Pyankov V I, Roumet C, Thomas S C, Tjoelker M G, Veneklaas E J, Villar R. The worldwide leaf economics spectrum. Nature, 2004, 428(6985): 821-827. [33] 张珂, 何明珠, 李新荣, 谭会娟, 高艳红, 李刚, 韩国君, 吴杨杨. 阿拉善荒漠典型植物叶片碳、氮、磷化学计量特征. 生态学报, 2014, 34(22): 6538-6547. [34] 吴统贵, 吴明, 刘丽, 萧江华. 杭州湾滨海湿地3种草本植物叶片N、P化学计量学的季节变化. 植物生态学报, 2010, 34(1): 23-28. [35] Sterner R W, Elser J J. Ecological Stoichiometry: the Biology of Elements from Molecules to the Biosphere. Princeton: Princeton University Press, 2002. Seasonal variations in C, N, and P stoichiometry of roots, stems, and leaves ofPhragmitesaustralisin the Keriya Oasis, Xinjiang, China LI Honglin1,2, GONG Lu1,2,*, HONG Yi1,2 1.CollegeofResourcesandEnvironmentScience,XinjiangUniversity,Urumqi830046,China2.KeyLaboratoryofOasisEcology,MinistryofEducation,Urumqi830046,China C, N, and P are the basic chemical elements required for plant growth and regulation, and their balance and stability play an important role in many physiological functions. Ecological stoichiometry combines the first law of thermodynamics, the theory of evolution by natural selection, and the central dogma of molecular biology, and has organically integrated biological studies at the scales of molecules, cells, species groups, communities, and ecosystems. Plants adjust their growth rate to adapt to environmental changes throughout their lives. The growth rate can be regulated by C∶N∶P ratios; therefore, these ratios reflect the adaptability of plants to the external environment. Seasonal variations in C∶N∶P ratios reflect the seasonal variations in plant growth rate. Consequently, research on the seasonal variations in C∶N∶P ratios can increase our understanding of plant adaptation strategies. There has been limited research on the change in C, N, and P during the xerophyte growing season. In this study,Phragmitesaustralis, the common reed, was used to examine the contents of C, N, and P and their ratios in roots, stems, and leaves in different seasons in the Keriya Oasis, China. The contents of C, N, and P in the plants ranged from 140.4 to 565.1 (average 393.36 ± 99.92) mg/g for C, 2.19 to 34.48 (average 12.43 ± 8.70) mg/g for N and 0.26 to 4.42 (average 1.25 ± 0.74) mg/g for P. The means of the C∶N, N∶P, and C∶P ratios were 54.55, 9.96, and 441.27, respectively. The order of the mean contents of C, N, and P in all organs was leaves > stems > roots during the growing seasons. The content of C in roots, stems, and leaves increased first, and then decreased again. The contents of N and P in roots and stems decreased gradually during the growing season. The contents of N and P in leaves decreased first, and then increased again. The changes in C∶N and C∶P ratios were opposite to those in corresponding N and P contents in roots, stems, and leaves. The ratio of N∶P was highest in leaves and was lowest in roots. The C, N, and P contents and their ratios had moderate variability in all organs throughout the growing season. Factorial analysis of variation for each parameter, with sampling season and organs as independent variables, showed that the contents of C and P and C∶N and C∶P mass ratios mainly depended on the season. The content of N and the N∶P mass ratio were mainly determined by the organs. Furthermore, N is a restrictive factor forPhragmitesaustralisin the Keriya Oasis during its growth and development. Phragmitesaustralis; ecological stoichiometry;organs; seasons; Keriya Oasis 国家自然科学基金-新疆联合基金重点项目(U1138303);国家自然科学基金项目(41461105) 2015- 07- 08; 2015- 11- 27 10.5846/stxb201507081451 *通讯作者Corresponding author.E-mail: gonglu721@163.com 李红林,贡璐,洪毅.克里雅绿洲旱生芦苇根茎叶C、N、P化学计量特征的季节变化.生态学报,2016,36(20):6547- 6555. Li H L, Gong L, Hong Y.Seasonal variations in C, N, and P stoichiometry of roots, stems, and leaves ofPhragmitesaustralisin the Keriya Oasis, Xinjiang, China.Acta Ecologica Sinica,2016,36(20):6547- 6555.
3 结论与讨论
